锂离子电池负极材料Li4Ti5O12合成与改性的研究进展*
2020-04-03黄俊涛任亚航程丽丽
王 鸣,黄俊涛,任亚航,梁 萌,程丽丽,沈 丁
(辽宁工程技术大学 材料科学与工程学院,辽宁 阜新 123000)
0 引 言
锂离子电池由于其能量密度高、循环寿命长、自放电率小、无记忆效应等优点而被公认为是便携电器以及电动汽车的理想动力能源。目前商业化的锂离子电池通常以磷酸铁锂、镍钴锰酸锂、尖晶石锰酸锂等为正极,而负极材料大多是含碳化合物,可以在较大的范围内允许Li+嵌脱[1]。然而大多数嵌锂碳材料具有明显的缺点:与电解液发生反应形成钝化膜,导致电解液中Li+的损耗以及Li+在进行反复脱嵌过程中破坏碳材料的结构,造成很大的容量损失;析出锂枝晶,使电池发生短路,在大功率脉冲充电时存在类似电池爆炸这样严重的安全隐患等。因此,有必要寻找嵌锂的电极电位稍正于碳、寿命长、安全可靠的新型负极材料[2-3]。
近年来尖晶石型的Li4Ti5O12日益受到重视,它的理论比容量为175 mAh/g,与碳负极材料相比在Li+的脱嵌过程中晶格常数变化非常小,是一“零应变”材料;嵌锂电位高(1.55 V vs.Li/Li+),不易引起金属锂的析出;安全性高、循环性能、库伦效率高;锂离子扩散系数(2×10-8cm2/s)远远高于碳负极材料[4-7]。但Li4Ti5O12材料也存在一定的缺点如导电性能差,其中电子导电率(大约10-13~10-8S/cm)比较低,这也导致其在大电流放电条件下极化比较严重、倍率性能差、容量衰减快等,这些都限制了Li4Ti5O12的广泛应用[8]。
1 Li4Ti5O12的结构特征
Li4Ti5O12是一种由金属锂和过渡族金属钛复合而成的金属氧化物,属于AB2X4系列。在Li4Ti5O12中只含有正4价的Ti4+。这些Ti4+占据着16d的位置。它的结构类似于一个反尖晶石,属于Fd3m空间群。在一个晶胞中,32个氧离子O2-按照立方密堆进行排列,总锂离子Li+数里有3/4个被4个氧离子O2-近邻作正四面体配体嵌入间隙,其余的锂离子和所有的钛离子被6个氧离子近邻作正八面体配体嵌入间隙。因此它的结构又可以表示为Li[Li1/3Ti5/3]O4[9]。
2 Li4Ti5O12的制备方法
Li4Ti5O12的制备方法有很多种,主要包括固相法、溶胶-凝胶法、水热法、微波法、静电纺丝法、熔盐法等[10-16]。采用不同的制备方法得到的Li4Ti5O12材料其结构和形貌有很大的差异;同一材料采用不同的制备工艺得到的Li4Ti5O12材料其电化学性能、粒度、结构以及形貌等也不尽相同;同一种制备工艺条件下得到的Li4Ti5O12的性能又受锂源与钛源的摩尔比、反应时间、反应温度等的影响。
2.1 固相法
固相法通常是将Li2CO3或LiOH·H2O与TiO2按照一定的化学计量比均匀混合,通过高温(800~1 000 ℃)烧结处理一段时间(4~12 h),得到Li4Ti5O12材料[17]。原料中钛源与锂源的种类、混合比例、高温煅烧的温度和时间对Li4Ti5O12的形貌、结构和电化学性能有较大影响[18]。Li等[19]则用LiOH·H2O和TiO2为原料,在800 ℃下先预烧2 h,得到中间产物经研磨过筛之后,继续在600 ℃下反应2、8和12 h,都得到了纯相的钛酸锂。其中,烧结时间选择为8 h的产物显示出了最佳的高倍率特性和最佳的Li+电导性和电子电导性。杨应昌等[20]利用固相法电化学合成了Li4Ti5O12纳米颗粒,在充放电速率为0.5C、5C、10C的条件下,其首次可逆容量分别为170.1、139.3、120.7 mAh/g。10C下经过400次循环后容量保持率为90%。
固相法中锂源的选取基本都为LiOH或Li2CO3,但Li2CO3作为反应原料相对于LiOH而言,产物中的杂质会更少。随着学者们研究的深入,对于固相法制备Li4Ti5O12的具体参数也越来越合理和精确。如果在工厂大规模生产的情况下,Li等[19]选用的二次煅烧的方法更为合理,因为经过预煅烧之后再进行二次煅烧不仅缩短了煅烧的时间,还大大降低了煅烧的温度,而产物的性能却没有降低,降低了生产成本,带来更加丰厚的经济效益。
2.2 溶胶-凝胶法
溶胶-凝胶法也是一种常见的合成Li4Ti5O12的方法,它是将金属醇盐或无机盐利用水解和聚合反应得到均匀溶胶,然后再经过溶剂、催化剂等的作用得到透明的凝胶,再将其干燥、焙烧除去有机成分,最后得到纳米尺寸的材料[21-23]。相比于固相法其合成温度较低,产物纯度高,粒径小且分布均匀,这些都有利于提高材料的循环性能和倍率性能[24]。Chen等[25]利用溶胶凝胶法合成了平均粒径为100 nm的Li4Ti5O12颗粒。该材料在0.3 mA/cm2首次放电比容量高达272 mAh/g,并且拥有很好的循环性能。Hao等人[26]以草酸和金属盐离子为原料,制得亚微米级的Li4Ti5O12颗粒。0.5 mA/cm2时的首次放点比容量为171 mAh/g,经过35次循环后其放电比容量为150 mAh/g。
溶胶-凝胶法的钛源多为金属醇盐,另外,采用有机酸(柠檬酸、草酸、丙烯酸等)作为螯合剂成本过高,且不同的螯合剂对于材料性能的改善各不相同。随着研究的进一步深入,低价格,高提高材料性能的螯合剂还有待学者们进行更深层次的研究和探索。
2.3 水热法
水热法是指以水或乙醇等为分散剂,在反应釜中利用高温高压条件使原料发生化学反应,并经过后续的洗涤、干燥、热处理来获得目标产物的方法。该法制得的产物粒径小,纯度高,但成本较高,做不到大规模化的生产。
Shen等[27]利用水热法合成了Li4Ti5O12纳米颗粒,如图1( a~d)所示。制备过程中若煅烧温度过高,或者煅烧时间过长会导致严重团聚,颗粒粒径较大。其中,700 ℃煅烧2 h的样品具有最高的库伦效率和充放电倍率性能。5 C和20 C首次放电的比容量分别为130和100 mAh/g。Tang等[28]通过水热法制得直径约为400 nm的纳米片自组装的空心Li4Ti5O12微球。球壳厚度大约为2~5 nm,如图1(e~f)所示。其具有较大的比表面积和孔介结构,可以使材料与电解液充分接触,缩短Li+的扩散路径。10 C下经过50次循环,其容量保持在151 mAh/g,50 C时放电容量仍然有131 mAh/g。
制备钛酸锂的方法还有微波法、熔盐浸渍法、静电纺丝法等。以上几种制备钛酸锂的方法,其各自的特点以及今后研究的重点如表1所示。
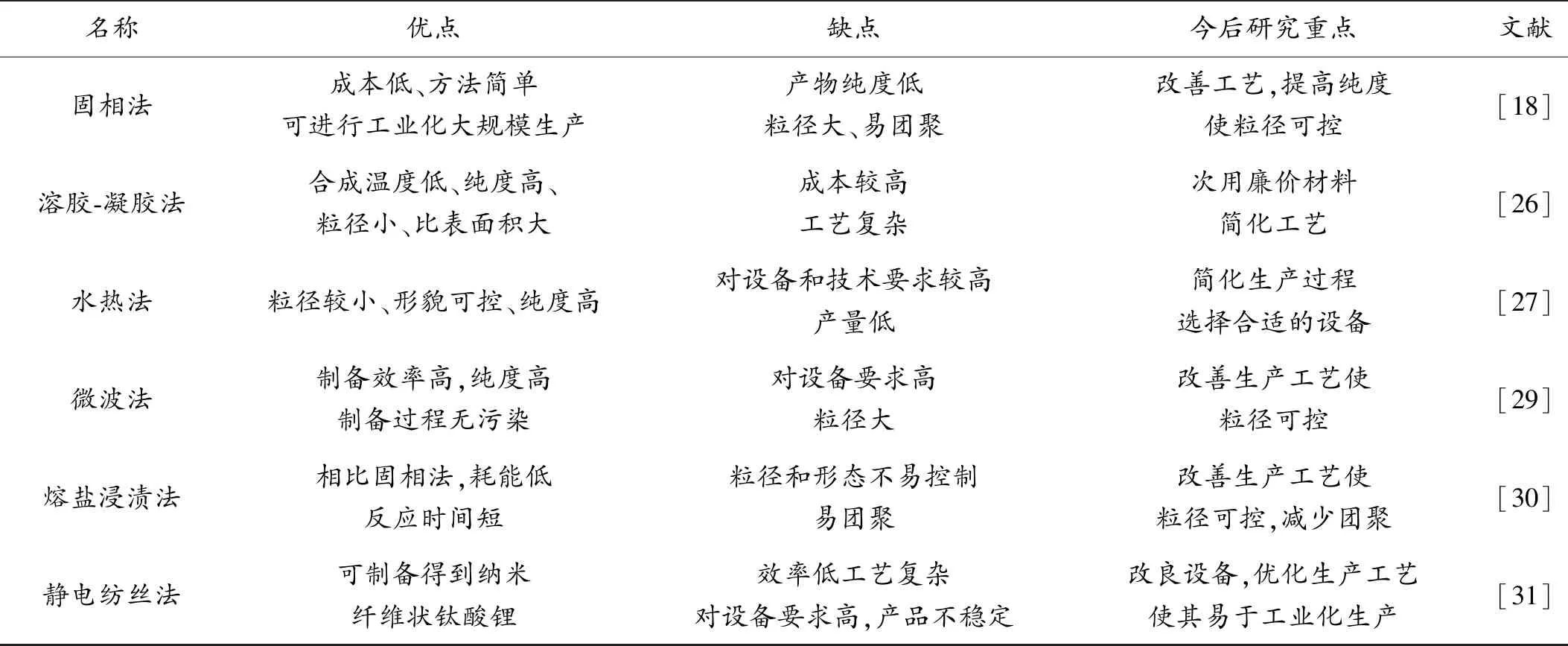
表1 钛酸锂的制备方法及其特点Table 1 Preparation method and characteristics of Li4Ti5O12
3 Li4Ti5O12的性能改性研究
由于Li4Ti5O12具有较低的电子电导率和离子电导率,因此Li4Ti5O12在大电流充放电的过程中,材料的比容量相对于其它负极材料来说比较低,衰减较快。目前人们研究的Li4Ti5O12材料的改性方法大致为形貌尺寸改进(颗粒纳米化、球化、多孔化)、离子掺杂改性、表面复合改性等[32-36]。
3.1 形貌尺寸改进 (颗粒纳米化、球化、多孔化)
为了提高钛酸锂的的各种电化学性能,研究者们从形貌尺寸改进入手,通过制备纳米结构的的Li4Ti5O12材料,如设计合成微纳米球、纳米颗粒、多孔结构、纳米片、纳米化等结构的钛酸锂,这些结果的钛酸锂纳米材料可以有效缩短Li+的扩散路径,并且较大的比表面积可以使负极材料与电解液充分的接触,有利于电子的传输,这些可以大大提高钛酸锂的电化学性能。
3.1.1 纳米化改性
纳米化可以缩短离子在纳米材料中的迁移路径,并且纳米材料与电解液接触时的表面积更大,因此材料纳米化的过程可以应用到不同材料的电池反应中,纳米化过程也因此成为了近期科学研究的热点之一。
Jiang等[37]将粒径为纳米级的锐钛矿与LiOH溶液进行充分的混合,通过水合键的作用,锂化的锐钛矿晶体颗粒发生了定向的连接。形成了具有八面体结构的Li-Ti-O中间体,通过煅烧,得到了结构仍旧为八面体的Li4Ti5O12。产物的平均粒径仅有30 nm左右,并且纯度高、结晶度好,如图2所示。其在1和3 A/g电流密度下的放电比容量分别为119和85 mAh/g。
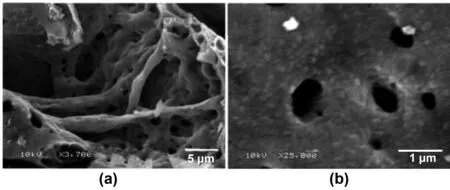
图2 燃烧法合成的Li4Ti5O12SEM图谱[37]Fig 2 SEM images of Li4Ti5O12 synthesized by combustion method[37]
虽然纳米化过程对材料性能的提高具有如此优越的表现,但是纳米化过程具有一定弊端的。更短的路径虽然有利于Li+的嵌脱过程,但是比表面积的提高也就意味着材料表面活性的提高,这样材料就容易与电解液发生反应,如形成SEI膜,包覆了颗粒造成材料的绝缘,使得高倍率下材料容量的衰减非常严重。
3.1.2 球化改性
球型材料有利于颗粒与颗粒之间进行相互接触,实现产物堆积紧密的特点,因而拥有了较高的振实密度。通常制备球型Li4Ti5O12常用的方法为热喷雾法。
Ju等[38]将LiNO3和Ti(OCH4H9)4加入到稀硝酸溶液中,等混合均匀后利用热喷雾干燥器进行前驱体的制备。并且其通过实验得出当反应温度为800℃、Li和Ti的总浓度高于0.05 mol/L时,制得的产物直径为500~1 000 nm,其在0.1 C倍率下首次放电比容量为172 mAh/g,图3为球化Li4Ti5O12的XRD(a)、SEM(b)、Li4Ti5O12样品的紫外可见吸收光谱(c)、第一个5个周期的Li4Ti5O12球体的电化学性能(d)。
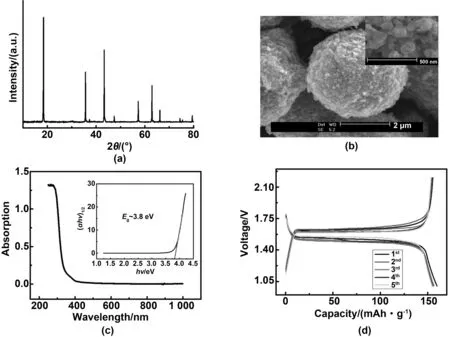
图3 球化Li4Ti5O12的各项测试表征[38]Fig 3 The test characterization of the spherical Li4Ti5O12[38]
3.1.3 多孔化改性
多孔结构的Li4Ti5O12具有较高的比表面积,并且与电解液接触的面积比较大,从而提高材料的导电性。E.M.Sorensen等[39]用聚甲基丙烯酸甲醛胶状晶体作为模板,制得了三维多孔结构的Li4Ti5O12,孔径为15 和100 nm,纳米尺寸的孔壁相互连接形成了网状结构,又由于孔壁的结构较为粗糙,这就为Li+的进出提供了路径,同时又增大了材料的表面积。1 C倍率下和5 C倍率下材料的首次放电比容量分别为149和143 mAh/g。
仅仅减小材料的粒径来提高Li4Ti5O12材料放电比容量是远远不够的,材料的粒径分布、结晶度以及特殊形貌的特点也是影响材料倍率性能的重要因素。以上对Li4Ti5O12的几种改性方法不仅增大了材料的比表面积和材料与电解液的接触面积,而且缩短了Li+的迁移路径,这些都有利于提高材料的电化学性能。3种方法都是材料本身的改性,其中多孔化改性材料的性能更优。
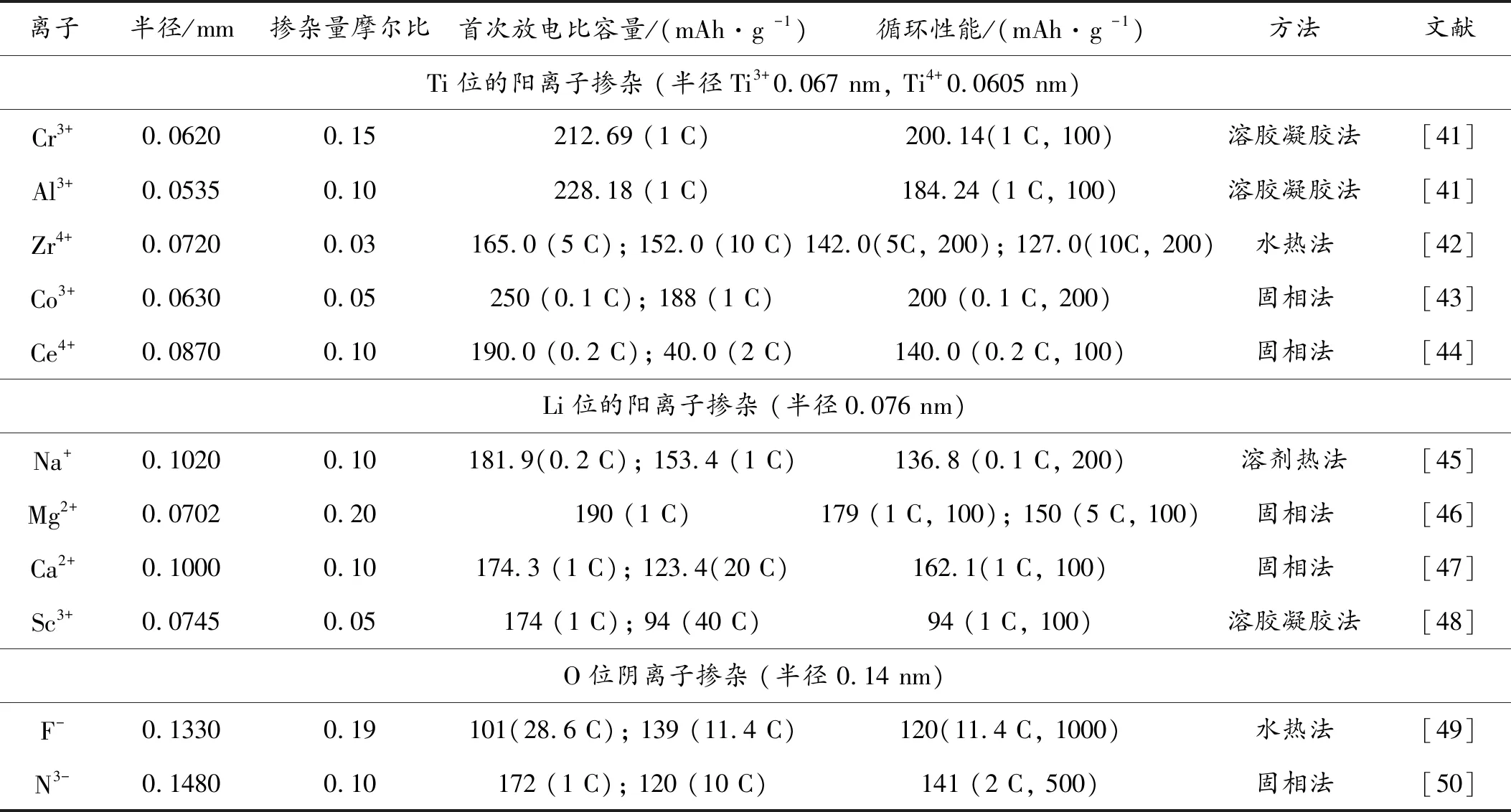
表2 代表性阴阳离子掺杂 Li4Ti5O12的Li,Ti,O 各位点对性能的影响Table 2 Summary of representative LTO doped with various cations/anions in the Li,Ti and O sites
3.2 离子掺杂改性
对Li4Ti5O12进行离子掺杂的主要目的是提高材料的导电性、降低电极电位以及提高电池比容量等。离子掺杂又按照取代Li4Ti5O12中Li+、Ti4+和O2-的位置可以分成Li位掺杂、Ti位掺杂和O位掺杂。钛酸锂的离子掺杂通常是将低价阴离子引入O2-的32e位置,而Ti4+的16d位置或者Li+的8a位置则引入高价的阳离子,进而可以提高钛酸锂的电子电导率,其掺杂机理为高价态的掺杂离子取代了低价态的离子,使得材料中的部分Ti4+转化成Ti3+,产生一个多余的自由电子作为电荷补偿,增加了电子浓度,提高了电导率。另外,掺杂也会使得材料的晶格结构发生变化,在材料的晶格中产生新的空隙以及缺陷,这将使得离子的传递阻力和锂离子的扩散系数发生变化。
早期时候,人们研究最多的离子掺杂为Fe3+、Ni3+、Cr3+、V3+、Mn2+等。这些元素都降低了Li4Ti5O12的工作电压,使导电性得到了提高,但是材料的容量衰减比较快,循环性能也相对较差。随即人们又进行了新元素的掺杂改性,例如Mg2+、Al3+、Sr2+、Ba2+、Ag+、Zr4+、F-、Mo6+、V5+等,以及他们之间进行的复合掺杂[40]。表2总结了一些代表性阴阳离子掺杂改性Li4Ti5O12材料的性能。
研究发现,不同的离子种类、掺杂量、制备方法都会影响Li4Ti5O12的电化学性能,掺杂也有可能会提高钛酸锂的某一性能而降低另一性能,如提高材料的首次放电比容量而循环性能却不太理想等。因此对于掺杂改性今后学者们研究的重点应该是寻找合适的离子种类、适当的掺杂量以及最佳的制备方法,以此来提高掺杂改性后钛酸锂的各项电化学性能。
3.3 Li4Ti5O12表面改性
Li4Ti5O12的表面改性目前应用最多的即为碳包覆改性技术。碳包覆不仅可以提高材料的电子电导率,提高材料的比容量,还会对材料的循环稳定性有一个非常大的促进作用。
Chen等[25]通过模板法(图4所示)合成了具有介孔结构的Li4Ti5O12/C纳米复合材料,如图5所示,从图5(a)、(b)中我们可以看到明显的三维介孔结构,这些介孔结构使材料具有较高的比表面积,能使Li4Ti5O12/C纳米复合材料与电解液接触充分,而且可以有效缩短Li+的传输途径,进而可以提高材料的电化学性能。在0.2 C条件下,Li4Ti5O12的初始放电比容量为142.3 mAh/g,Li4Ti5O12/C纳米复合材料也表现出了良好的倍率性能和循环稳定性。

图5 (a,b)中孔Li4Ti5O12/C纳米复合材料的TEM图像,显示Li4Ti5O12纳米颗粒嵌入中孔中和周围[25]Fig 5 (a,b) TEM images of a mesoporous Li4Ti5O12/C nanocomposite,showing Li4Ti5O12 and surrounding hole nanoparticles embedding[25]
Yang等[51]通过一步法合成了球形Li4Ti5O12/石墨烯复合材料。通过溶胶化方法把Li和Ti前体混合的氧化石墨烯(GO)悬浮液的球形Li4Ti5O12/石墨烯复合材料的一步连续合成 (图6)。得到的石墨烯球支撑的Li4Ti5O12纳米晶体具有三维结构(图7),具有高导电性,高表面积和良好的电解质稳定性。具有优异的倍率性能(如在5 A/g电流密度下,它提供了在12.5 mA/g下获得的60%的容量)和出色的循环性能(在1 250 mA/g的5000次循环后容量保持率为88%)。Li4Ti5O12/石墨烯复合材料的一步连续合成与传统的多步骤制备相比具有高生产效率,通常可用于合成锂离子电池的锂金属氧化物/石墨烯材料。
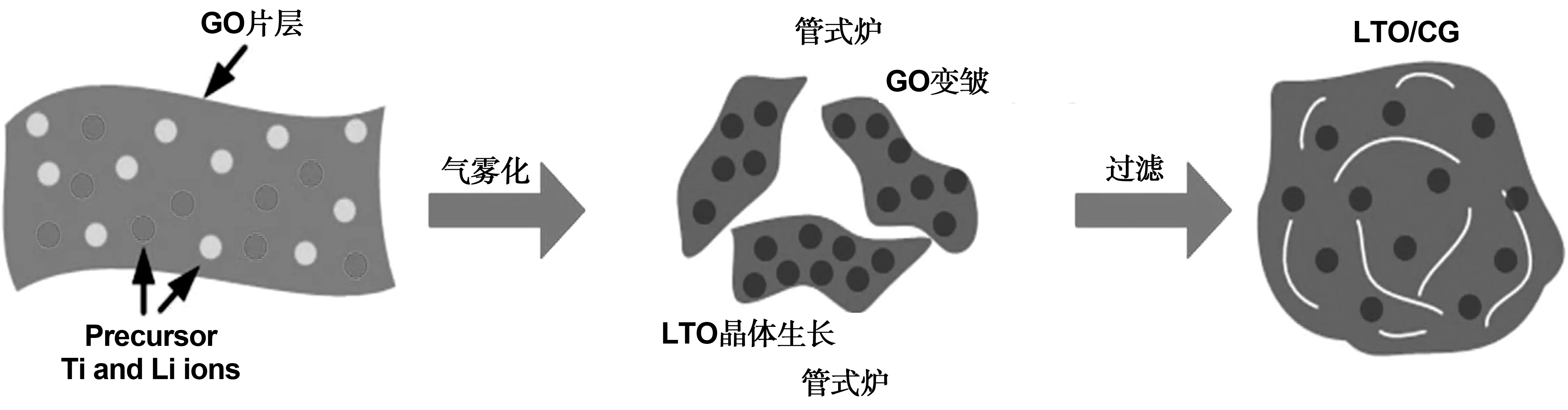
图6 一步法合成球形Li4Ti5O12/石墨烯复合材料过程[51]Fig 6 Synthesis of spherical Li4Ti5O12/graphene composites by one-step process[60]

图7 (a)和(b)LTO/CG复合材料的SEM图像,(d)Li4Ti5O12/CG复合材料的TEM图像,(e)和(c)LTO/CG复合材料的HRTEM图和SAED图[51]Fig 7 (a,b) SEM images of the Li4Ti5O12/CG hybrids,(d) TEM images of Li4Ti5O12/CG composites,(e,c) HRTEM and SAED maps of Li4Ti5O12/CG hybrids
碳包覆可以很明显的提高材料的电子电导率,但是由于材料外部包了一层碳,所以锂离子在嵌脱过程会受到一定的阻碍作用;金属掺杂后的改性材料其倍率性能有所提高,但是其比容量和循环稳定性会降低。Li4Ti5O12材料的复合改性可以提高各项性能,但是会造成其振实密度的下降。改善材料尺寸形貌可以明显提高材料的比容量,缩短锂离子进出的路径,但是容易造成材料与电解液发生反应,形成SEI膜。
4 结 语
目前通过多种方法制备Li4Ti5O12材料性能改善的方法也越来越多样化,在高性能Li4Ti5O12的设计和制造方面取得了很大进步。水热法可以制备出介孔结构、纳米片、花瓣状等尖晶石结构的Li4Ti5O12,且具有纯度高、不易团聚等优点,但对设备要求和生产成本比较高,且效率低下等。溶胶凝胶法虽然也能制备出结构和性能比较好的Li4Ti5O12,但过程繁琐生产成本较高,以上两种方法皆不适宜工业化的大规模生产。固相法制备的Li4Ti5O12没有以上两种方法制备的纯度高,颗粒粒径稍大一点,但固相法是目前制备Li4Ti5O12最简单的方法,生产成本不高,最适宜目前工业化的大规模生产。随着研究的进一步深入,其它几种制备Li4Ti5O12的新方法还有待学者们进行更深层次的探索和研究。
在Li4Ti5O12的改性研究方面,针对Li4Ti5O12电导率低、倍率性能差、容量衰减快、等一系列问题,通过离子掺杂,我们需要寻找合适的离子、最佳的合成工艺、适当的掺杂比例及几种离子共掺杂等来改善钛酸锂。在对Li4Ti5O12的纳米化和复合改性方面,应将二者结合起来,即通过制备纳米级别尖晶石的Li4Ti5O12材料与其他材料进行复合改性,同时进一步优化合成工艺,应当是研究者们研究的重点。通过对钛酸锂改性来进一步提高钛酸锂的性能,使其在倍率性能的提高方面有一个更大的突破和进展。另外,在钛酸锂的应用方面,由于其大的电极电位,可以在超级电容器方面有一个更深层次的应用,可以满足电动汽车或者混合动力汽车等对于电源的一些特殊需求,具有巨大的商业应用前景。
