粉末床电子束3D打印医用金属材料的研究进展*
2020-04-03汤慧萍李元元
杨 坤,汤慧萍,李元元
(1.吉林大学 材料科学与工程学院,长春 130022;2.西北有色金属研究院 金属多孔材料国家重点实验室,西安 710016)
0 引 言
近年来,随着“精确诊疗”概念的普及,临床对骨科植入材料个性化的需求越发迫切。3D打印技术拥有极高的加工自由度,对于骨科材料的3D打印,其可以利用CT、MRI等医学影像,通过计算机重建患者失效骨模型,制造出生物学性能与力学性能更与骨匹配的植入物产品,更可以针对每位患者制定独特的治疗方案,实现为骨植入患者“量体裁衣”的产品定制[1-2]。
近10年来,3D打印技术在骨科植入材料的制备粉末取得了飞速的发展,技术发展逐渐成熟。粉末床电子束3D打印,即电子束选区熔化(selective electron beam melting,SEBM)技术,是20世纪90年代中后期发展起来的一种粉末床熔融型3D打印技术。该技术在真空环境下成形,具有能量利用率高、扫描速度快、成形应力低等突出优点,特别适合高活性、高熔点、脆性难加工金属材料的直接成形,在生物医疗、航空航天等领域具有广阔的应用前景[3]。
2007年,意大利外科医生Guido Grappiolo完成了全球首例SEBM打印的髋关节置换术,这一事件拉开了3D打印技术在骨科植入领域的应用[4]。SEBM技术制备的Ti-6Al-4V髋臼杯垫块在2007和2009年分别获得了欧盟CE和美国FDA的认证,我们国家的国家食品药品监督管理总局也在2015年为增材制造技术制备的Ti-6Al-4V髋臼杯垫块颁发了准入许可。目前,仅SEBM技术打印的髋臼杯在临床的应用数量就已经超过了10万例,已经有超过100种3D打印的骨科植入物获得了美国FDA认证[3]。因此,SEBM技术在医用领域存在巨大的应用潜力。本文将主要介绍SEBM技术及其近年来在医用材料研究上的研究与应用进展。
1 SEBM技术与装备的发展现状
SEBM技术的原理如图1所示。首先将所设计零件的三维图形按一定的厚度切片分层,得到三维零件的所有二维信息;在真空环境下以电子束为能量源,电子束在电磁偏转线圈的作用下由计算机控制,根据零件各层截面的CAD数据有选择地对预先铺好在工作台上的粉末层进行扫描熔化,未被熔化的粉末仍呈松散状,可作为支撑。一层加工完成后,工作台下降一个层厚的高度,再进行下一层铺粉和熔化,同时新熔化层与前一层熔合为一体。重复上述过程直到零件加工完后从真空箱中取出,用高压空气吹出松散粉末,得到三维零件[5]。

图1 粉末床电子束3D打印技术的工艺流程Fig 1 Process of powder bed electron beam 3D printing technology
瑞典Arcam公司是全球最早开展SEBM成形装备研究和商业化开发的机构,2001年Arcam公司在申请了如图1所示原理的国际专利WO01/81031,并在2002年制备出SEBM技术的原型机Beta机器,2003年推出了全球第一台真正意义上的商业化SEBM装备EBM-S12,随后又陆续推出了A1、A2、A2X、A2XX、Q10、Q20等不同型号的SEBM成形装备。表1列出了Arcam公司历代SEBM装备的主要性能参数。
2016年,Arcam公司被国际工业巨头GE公司收购,并于2019年Arcam公司推出了最新一代的SEBM Spectra H型电子束3D打印装备,其最大功率为6kW,电子束直径为140 μm,可成形最大尺寸为250 mm×250 mm×430 mm,可将原有的3~4 h的校准过程减少到15 min,成形效率更高。由表1可以看出,S系列及A系列的电子是由钨电极发出,而Q系列及Spectra H系列的电子是由直径0.75 mm的单晶LaB6电极发出。相比于钨电极,单晶LaB6电极的稳定性更高。SEBM成形样品过程中,当功率超过1 kW时,由钨电极产生的电子束的直径随着功率的增加而增大。而对于LaB6电极,由于硼原子与镧原子形成的是一个三度结构,并且硼晶格的稳定性很好,因此当功率达到3 kW时,由LaB6电极产生的电子束直径仍比较稳定,有利于聚焦,从而成形更高质量样品。

表1 瑞典Arcam公司开发的电子束选区熔化装备性能参数Table 1 Main parameters and properties of the SEBM system by Arcam
清华大学和西北有色金属研究院金属多孔材料国家重点实验室最早在国内开展了SEBM设备的研发和成形工艺的探索。2013年,西北有色金属研究院成果转化成立的西安赛隆金属材料有限责任公司,并与2015年在国内首次推出了满足科研的S型和满足医疗产品的Y型国产商业化SEBM设备。
2 SEBM打印骨科植入材料的研究进展
骨科植入材料是指能够植入人体,治疗骨骼疾患、替换骨组织,恢复骨骼的正常生理功能的金属材料[6]。目前,应用于临床的生物医用金属材料主要包括不锈钢、钴基合金、钛合金、医用形状记忆合金等。本部分内容主要对SEBM技术成形钛合金、CoCr合金和多孔钽的研究和应用现状进行了阐述。
2.1 钛及钛合金
钛及钛合金密度低,比强度高,耐蚀性能好,生物相容性好等特点,被广泛应用于航空航天、石油化工和医疗健康领域。对于钛及钛合金在医疗植入上的应用,早在1940年,就有学者报道了钛植入物与小鼠股骨之间的惰性表现[7]。在现有医用钛合金中,Ti-6Al-4V合金是使用最优广泛(超过医用钛合金总量的50%),主要用于人工关节、接骨板、螺钉以及牙齿等部位。
2.1.1 SEBM制备Ti-6Al-4V合金的微观组织
SEBM技术成形Ti-6Al-4V合金的典型组织为沿竖直方向贯穿多个粉层厚度的柱状原始β晶粒形貌,成形时无扩散的马氏体相变、短程扩散的块状相变和长程扩散型相变均可发生。沉积态中微观组织的演变过程为L(液态)→β→α′+α+β→β→α′+αm+α+β[3]。当熔化成形当前粉层时,马氏体相变首先发生。在随后的层层沉积过程中,马氏体组织受循环热处理而重新进入β相区,而后可经长程扩散型相变(包括马氏体分解)转变为α+β组成的经典网篮组织或魏氏组织,或短程扩散相变转变为块状组织,如图2所示。

图2 SEBM成形Ti-6Al-4V的典型微观组织(a)样品上部的显微组织;(b)区域1的SEM图,虚线区域即为块状相;(c) 图(a)区域2的SEM图Fig 2 Microstructure of Ti-6Al-4V alloy fabricated by SEBM technology
2.1.2 SEBM制备Ti-6Al-4V合金的力学性能
图3统计了现有公开报道的SEBM技术成形Ti-6Al-4V合金的室温拉伸性能,并与传统锻造退火态数值进行了比较。可以看出,SEBM技术成形Ti-6Al-4V合金的拉伸性能达到了锻件标准,但性能数据分散性较大,这主要是受内部缺陷、氧含量、组织的不均匀性、成形工艺参数不同等因素影响。热等静压处理(一般推荐920 ℃,2 h,100 MPa)处理可消除气孔等缺陷,使延伸率提高,分散性降低,且减少各向异性的影响,但会造成材料强度降低[8]。

表2 SEBM成形Ti-6Al-4V合金的静态力学性能Table 2 Mechanical properties of the Ti-6Al-4V alloys fabricated by SEBM technology
2.1.3 SEBM制备多孔Ti-6Al-4V合金
借助于3D打印技术自由设计的特点,可以对人体骨的真实结构进行仿生,将孔结构引入材料设计,达到降低Ti-6Al-4V植入体弹性模量的目的,消除“应力屏蔽”效应带来的骨吸收等问题。因此,多孔钛合金也一直是3D打印领域研究的热点之一。与传统无序多孔结构不同,3D打印技术更关注有序化的孔结构,这种多孔材料通常被称为点阵材料(Lattice structure)。表2给出了SEBM技术制备的典型Ti-6Al-4V多孔材料的结构特点和力学性能。

图3 SEBM成形Ti-6Al-4V点阵多孔材料的力学性能[13,21-33]Fig 3 Mechanical properties of Ti-6Al-4V lattice structure fabricated by SEBM technology[13,21-33]
从以上数据可以看出,通过调节Ti-6Al-4V点阵材料的孔结构和密度,实现其强度和弹性模量在0.8~196 MPa和0.03~14.9 GPa范围内的任意调控,基本达到了人体松质骨的力学性能要求,但同等密度条件下,SEBM成形Ti-6Al-4V点阵材料的强度和刚度还无法达到人体密质骨的水平。另一方面,由于逐层沉积过程中的台阶效应,Ti-6Al-4V点阵材料的孔棱表面比较粗糙,应力集中严重,导致现有报道的SEBM成形Ti-6Al-4V点阵材料的韧性较差,压缩应变均在10%以内就会发生不可以的脆性断裂,热等静压或热处理虽然可以在一定程度上改善Ti-6Al-4V点阵材料的韧性,但难以消除其脆性断裂的本质。笔者针对这一问题,从结构设计和微观组织调控两方面入手,获得了一种具有高韧性的Ti-6Al-4V点阵材料,压缩过程变形均匀,应变超过50%时仍为发生脆性断裂[34]。
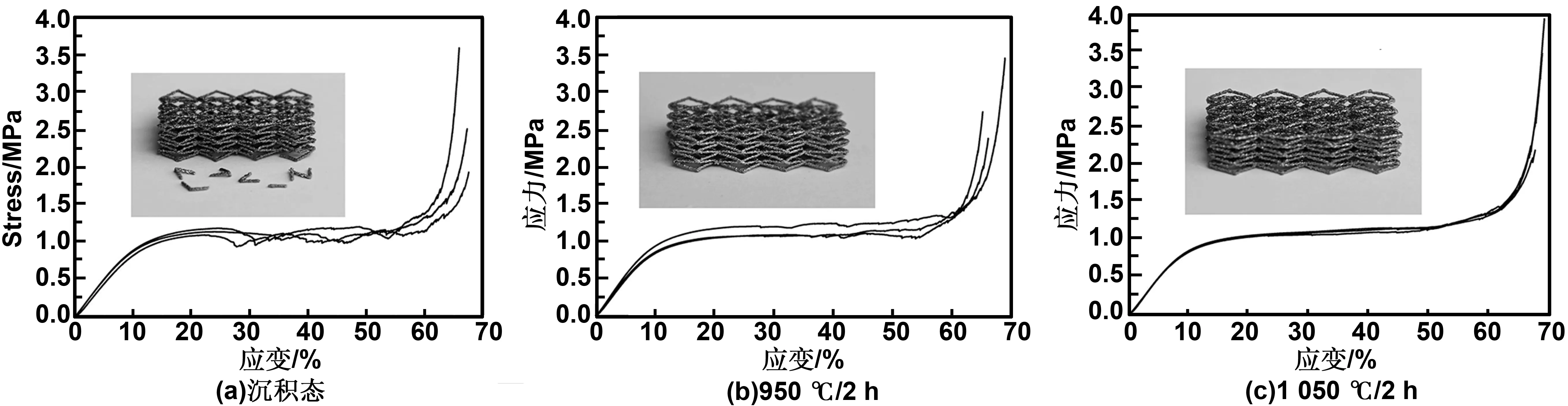
图4 高韧性的Ti-6Al-4V点阵材料的压缩应力-应变曲线(插图为压缩后样品的实物图)Fig 4 Compressive strain-stress curves of Ti-6Al-4V lattice with high ductility
2.1.4 SEBM技术成形Ti-6Al-4V合金的应用
我国在SEBM技术成形Ti-6Al-4V合金的应用方面与国外基本保持在同一水平。2015年7月22日,北京爱康医疗采用SEBM技术研发的我国首个3D打印人体植入物——人工髋关节获得国家食品药品监督管理总局(CFDA)注册批准[2]。截止目前,总共有4款SEBM技术成形的标准化植入体获得CFDA认证,并已经在临床得到了规模化应用(如表3所示)。
2.2 CoCr合金
与钛合金相比,CoCr合金硬度高、耐磨性优异,并且成本低。因此,CoCr合金是一种重要的生物医用金属材料,主要用于制作人工膝关节、种植牙和表面涂层材料。常规的铸造方法制备的CoCr合金虽然性能优异,但无法实现复杂结构的植入体制备,离心铸造等方法制备的成形精度和性能稳定性难以满足临床要求。
与钛合金相比,有关SEBM技术成形CoCr的研究较少。现有研究结果表明,SEBM成形CoCr合金微观组织在高度方向上存在差异,其底部为hcp结构的ε相,逐渐过渡到顶部的fcc结构的γ相[35]。组织的各向异性导致SEBM成形的CoCr合金力学性能在各个方向上存在一定的差异,尽管通过800 ℃热处理时的fcc→hcp转变可以一定程度减弱组织的各向异性。但热处理后ε相的晶粒尺寸和形态在高度方向上还是存在一定的不同,即顶部为细小等轴组织,底部为粗大的柱状晶[36],如图5所示。

表3 获CFDA认证的SEBM成形Ti-6Al-4V植入件Table 3 Properties of SEBM-ed Ti-6Al-4V implants certified by CFDA
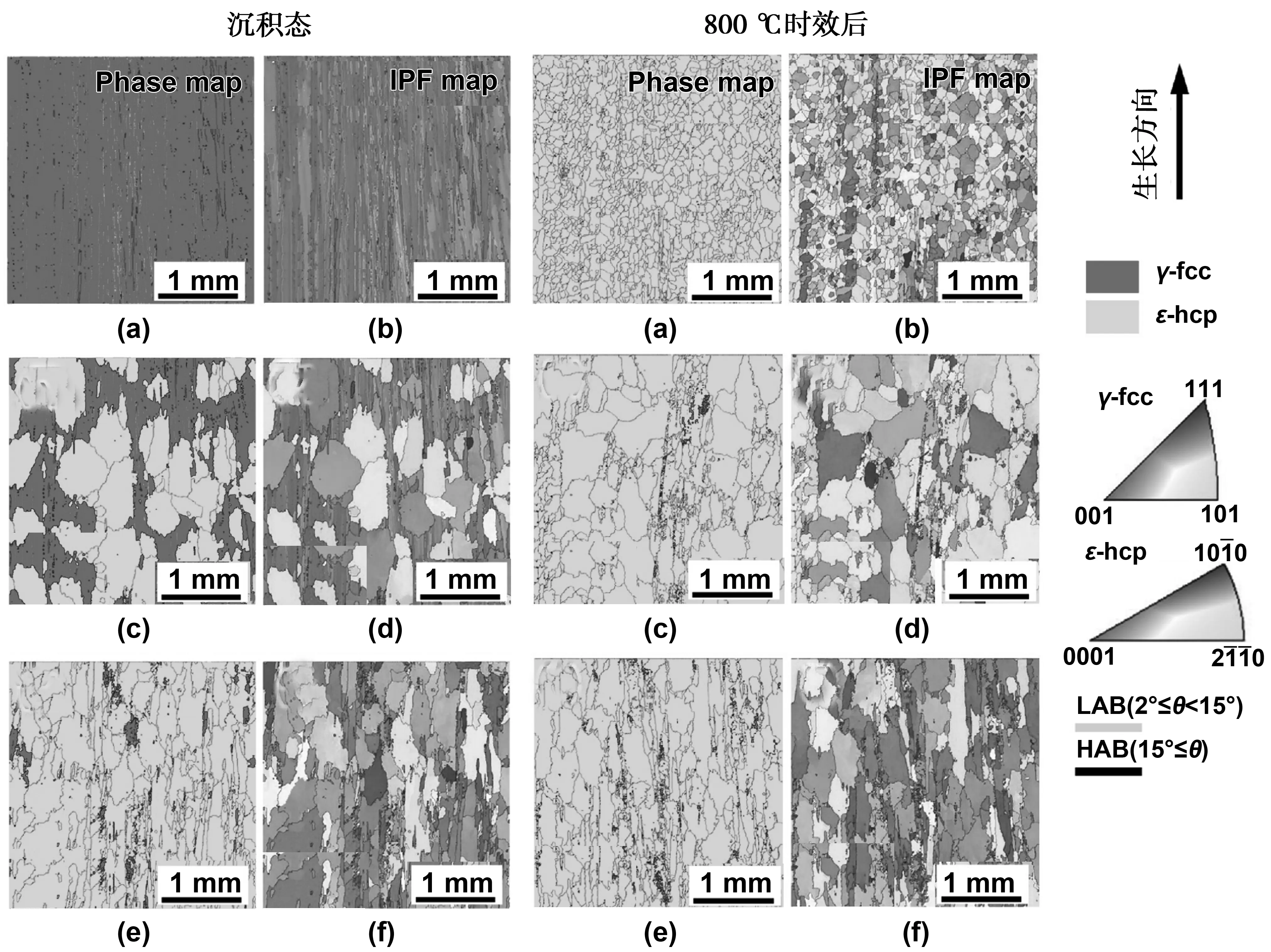
图5 SEBM成形Co-28Cr-6Mo-0.23C-0.17N合金的微观组织各项异性Fig 5 DBSD phase maps of Co-28Cr-6Mo-0.23C-0.17N alloys fabricated by SEBM
2016年,Arcam公司在Q10 plus设备中推出了CoCr合金的成形工艺包,并给出了经过热等静压和均匀化处理前后的材料性能。可以看到,SEBM成形沉积态的CoCr合金沿高度方向为粗大的柱状晶,并且内部析出了大量的碳化物颗粒,经过热等静压(1 200 ℃/100 MPa/240 min)和均匀化退火处理(1 200 ℃/240 min,快冷至760 ℃)后,组织中的碳化物完全融入基体,并且没有发现任何的孔洞缺陷。Arcam公司制备的CoCr合金的力学性能全面超过了铸造态,并且疲劳性能优异,如图6和表2所示。

图6 Arcam公司制备的Co-28Cr-6Mo-0.23C-0.17N合金微观组织Fig 6 Optical microstructure of Co-28Cr-6Mo-0.23C-0.17N alloys before and after heat treatment

表4 SEBM成形CoCr合金的力学性能Table 4 Mechanical properties of CoCr alloys fabricated by SEBM technology
目前,还没有关于SEBM成形CoCr合金临床应用的相关报道,基于上述力学性能数据,可以预见,SEBM技术成形的CoCr合金植入体(图7)必将很快进入临床应用阶段。

图7 SEBM技术成形的CoCr合金膝关节植入体Fig 7 CoCr alloy keen implant fabricated by SEBM technology
2.3 SEBM成形多孔钽
金属钽具有优异的韧性和耐腐蚀性能以及优异的生物相容性,被认为是最为理想的骨科植入材料。钽的密度较高,临床上常以多孔钽作为骨科植入体。同时,钽的熔点为2 996 ℃,是钛合金的2.8倍,常规的加工方法难以实现多孔结构的制备。1997年,美国Zimmer公司采用化学气象沉积技术制备的多孔钽Trabecular MetalTM获得美国FDA批准被应用于临床,但该方法无法满足个性化诊疗的需求[37]。
随着3D打印技术在医用钛合金领域的成功和技术装备的不断成熟,3D打印多孔钽逐渐成为医用材料领域的研究热点[38]。我国西北有色金属研究院在科技部重点研发计划项目的支持下,采用西安赛隆公司等离子旋转电极雾化的医疗级球形钽粉,获得了致密度99.9%以上的金属钽材料,并且实现了多孔钽孔隙率在65%~95%以内的任意调控,化学成分满足医疗行业植入标准YYT0966—2014《外科植入物金属材料纯钽》的要求,如图8所示。
2018年,第三军医大学西南医院采用西北有色金属研究院制备的多孔钽材料,成功完成了全球第一例个性化多孔钽植入体的临床手术,如图9所示。截止目前,该院已经完成了27例SEBM技术成形的个性化3D打印多孔钽金属假体植入的临床应用[37]。

图9 个性化3D 打印多孔钽金属假体植入加右膝关节翻修术Fig 9 A case of customized porous tantalum implant fabricated by SEBM technology
3 3D打印骨科制造材料存在的主要问题
随着技术和装备的不断进步与发展,SEBM技术成形的医用骨科产品逐步被医患所认知与接受。其技术优势对医疗领域的革命创新是显而易见的。然而,SEBM技术在医用金属材料领域仍存在许多问题有待完善。
3.1 制造成本
从工艺角度分析,SEBM技术要求粉末原料具有优良的流动性和批次稳定性,一般是采用一定粒度级配的球形粉末为原料,原料成本较高;从临床应用来看,医用骨科植入产品对材料成分的要求十分严格,例如:YY/T0966—2014 《外科植入物金属材料纯钽》中规定钽的氧含量要小于150×10-6,而市售的钽粉氧含量一般在1 000×10-6以上,成形工艺控制的难度较大。以上因素均导致现有SEBM成形医用植入材料的生产成本显著高于传统的铸造和锻造工艺。
3.2 性能评价方法和行业法规空白
现有的材料性能评价方法需要标准样品进行性能检测,而3D打印技术制备的医用植入材料(器械)大多是由致密、多孔以及薄壁结构组成而成,难以满足传统检测方法的要求。同时,针对3D打印技术的工艺特点、复杂结构以及个性化植入体的相关质量在线监控技术和性能测试方法仍处于空白,导致部分临床医生和患者对3D打印骨科植入材料的性能还存在疑惑。
3.3 个性化植入体的认证困难
现阶段获得医疗准入许可的均是标准化的骨科植入体,很多的研究和产品都只是用增材制造代替了传统的制造方法,缺乏针对性的设计和分析,产品实质还是传统产品,并非个性化产品,并没有充分发挥3D打印在个性化诊疗上的巨大优势。然而,对于针对患者定制的个性化产品,由于FDA与CFDA对于3D打印产品并无单独的评价体系,导致此类产品很难获得市场准入认证,仅能停留在临床试验阶段。因此,急需加快制定3D打印个性化骨科植入材料的国家标准以及临床应用的评价方法,开通绿色通道,加速推进3D打印个性化骨科植入体的取证工作,早日造福患者。
4 结 语
随着装备与技术的不断成熟,SEBM技术制备的钛合金植入体已经在医用骨科植入材料领域取得了成功,多孔钽和CoCr合金也在临床得到了试用,未来的市场将会呈现出爆发式的增长。但现阶段由于性能评价体系的欠缺和准入门槛的限制,个性化的植入体距离规模应用还需在生产成本、行业标准与评价体系建立等方面进行大量的工作。3D打印技术的新突破和新成就还需先进的技术团队、医疗器械公司、临床医生及政府监管部门的共同协作和努力,从而共同推动3D打印技术在骨科植入材料领域的发展,使得该项技术早日造福于民。
