苯扎贝特减轻小鼠糖尿病肝损伤*
2020-04-03蒋青松任凯强邱红梅
吴 堃, 蒋青松, 任凯强, 黄 波, 邱红梅, 韩 萍
(1重庆市人民医院肝胆外科, 重庆 400013; 2重庆医科大学药理教研室, 重庆市生物化学与分子药理学重点实验室, 重庆 400016; 3重庆市永川区人民医院 药剂科, 重庆 402160; 4遵义医科大学基础药理教育部重点实验室 暨特色民族药教育部国际合作联合实验室, 贵州 遵义 563003; 5重庆市人民医院肿瘤科, 重庆 400013)
糖尿病是由于胰岛素分泌绝对或相对不足,以体内血糖水平持续升高为特征的代谢性疾病。长期高血糖损伤全身大血管和微血管,出现糖尿病心肌病、糖尿病肾病、糖尿病性视网膜病变和糖尿病神经病变等并发症。据世界卫生组织统计,糖尿病并发症高达100多种,是目前已知并发症最多的一种疾病,其中,糖尿病肝病的临床症状较少且表现不典型,故常被忽视。近年,糖尿病患者肝损伤的发生率越来越高,终末期肝病的死亡率也逐渐增加,糖尿病肝病引起了人们的重视[1]。目前,虽然对糖尿病肝病进行了一些研究,但其病理生理机制尚未阐明,仍然缺乏有效的治疗手段和针对性药物。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)属于核受体家族成员,是配体依赖的转录因子,其3种不同亚型(α、β和γ)均参与体内糖脂代谢、炎症反应、细胞增殖与分化等重要生物调节过程,其调控异常与糖尿病等代谢紊乱性疾病密切相关[2]。已有研究发现,PPARs受体参与了糖尿病肝病的病理生理过程[3-4]。临床上,PPARα和PPARγ激动剂贝特类和噻唑烷酮类药物已分别用于高脂血症和胰岛素抵抗的治疗。虽然没有PPARβ激动剂上市,但动物实验证实,PPARβ激动在糖尿病及其并发症的防治中也有重要意义[5]。苯扎贝特(bezafibrate,BEZ)是上市药物中唯一能够同时激动PPAR受体3种亚型的药物,与其它贝特类药物一样,BEZ也主要用于高脂血症的治疗。临床及基础实验均显示[6-7],BEZ对于糖尿病及其并发症的防治是有益的,尤其在降低心血管疾病风险方面[8]。但目前对BEZ在糖尿病肝病中的治疗作用研究较少,国内未见报道。因此,本研究拟利用小鼠糖尿病肝损伤模型,观察BEZ的作用及其可能机制。
材 料 和 方 法
1 动物
SPF级雄性昆明小鼠,6~8周龄,体重16~20 g,由重庆医科大学实验动物中心提供 [许可证号为SYXK(渝)2012-0001]。
2 主要试剂
BEZ购自Sigma,用0.5% 羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)制成混悬液;链脲菌素(streptozotocin,STZ)购自Sigma,溶于pH 4.2~4.4枸橼酸盐缓冲液,现配现用;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、胰岛素和糖化血红蛋白(HbA1c)检测试剂盒购自南京建成生物技术公司;BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术公司;TRIzol、逆转录试剂盒、SYBR Green Supermix和PCR引物购自TaKaRa;鼠抗PPARα、PPARβ、PPARγ和β-actin多克隆抗体均购自博奥森生物科技公司;ECL化学发光试剂盒购自Thermo;其余试剂均为国产分析纯。
3 主要方法
3.1糖尿病肝损伤模型的建立 小鼠适应性喂养1周后,随机分为正常对照(normal control,NC)组(n=10)组、高脂饮食对照(high-fat, HF)组(n=10)和模型(model)组(n=26)。模型组小鼠予高糖高脂饲料(成分为10%蔗糖、10%蛋黄、10%猪油、1.5%胆固醇、0.5%胆盐和68%基础饲料)喂养4 周后,连续5 d予STZ(40 mg·kg-1·d-1)腹腔注射。7 d后(即STZ 7 d),用血糖仪(ONETOUCH Ultra)检测小鼠空腹血糖水平(fasting blood glucose,FBG),高于11.1 mmol/L的小鼠即为糖尿病小鼠。4周后,随机取6只糖尿病小鼠检测肝脏组织病理学和肝功能变化,确定糖尿病肝病形成[9-11]。将剩余的糖尿病小鼠,即糖尿病肝病小鼠随机分为2组(n=10),分别灌胃给予相应药物,持续4 周:(1)糖尿病肝损伤模型(model)组:与BEZ混悬液等剂量的CMC-Na;(2)BEZ给药治疗(BEZ)组:BEZ采用与临床相当的剂量,即75 mg·kg-1·d-1。此外,NC组小鼠给予常规饲料,HF组予高糖高脂饲料,喂养4 周后,连续5 d腹腔注射等量的枸橼酸缓冲液,7 d后检测FBG,继续给予相应饲料喂养,并予等剂量CMC-Na灌胃,每日1次,持续4 周。每周监测小鼠的FBG。
3.2生化指标检测 实验结束时,小鼠眼眶取血,于4 ℃、3 000 r/min离心15 min,取上清液分装冻存于-20 ℃冰箱备用。按照各试剂盒说明书操作,用酶标仪(ELx800,BioTek)分别检测不同波长吸光度值(AST和ALT:510 nm;TC和TG:490 nm;HbA1c:530 nm), 根据标准曲线计算各相应指标的浓度。另外, 用放射免疫法在γ计数仪上检测胰岛素(insulin,INS)含量,以mU/L表示, 并计算胰岛素抵抗指数: HOMA-IR=FBG×INS/22.5。
3.3肝脏组织病理学观测 分离肝脏组织,4%的多聚甲醛溶液固定6 h,用不同浓度的乙醇和二甲苯逐级脱水,石蜡包埋,作3~5 μm冠状切片,HE染色,于200倍显微镜下观察肝脏组织形态学变化。
3.4RT-qPCR检测PPARs的mRNA表达 参照GenBank中小鼠的基因序列合成引物(引物序列见表1)。用TRIzol提取组织总RNA,测定RNA浓度,按照1 μg/20 μg反应体系进行逆转录合成cDNA,利用SYBR Green荧光技术,在定量PCR仪器上按如下条件进行扩增:95 ℃ 30 s;95 ℃ 30 s、60 ℃ 30 s,循环40次。以β-actin作为内参照,对Ct值进行统计,根据相对定量公式分析结果。
3.5Western blot法检测PPARs蛋白表达 肝脏组织液氮冷冻后匀浆提取总蛋白,用BCA蛋白浓度检测试剂盒检测蛋白浓度。取30 μg总蛋白进行SDS-PAGE,转移至PVDF膜上,5% BSA封闭2 h,加入 I 抗[anti-PPARα (1∶1 000)、anti-PPARβ(1∶1 000)、anti-PPARγ(1∶1 000)和anti-β-actin(1∶2 000)],4 ℃摇床过夜,加入辣根过氧化物酶标记的 II 抗 (1∶2 000)。用发光液显色凝胶成像仪成像后用Image Lab软件分析结果。
4 统计学处理
采用SPSS 20.0进行统计学分析。数据用均数±标准差(mean±SD)表示,用Excel和GraphPad Prism 5.01等软件作图。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 BEZ对小鼠糖尿病相关指标的影响
给予STZ 7天后,小鼠FBG水平显著升高(P<0.01),且模型小鼠FBG一直维持较高水平直至实验结束,INS、HbA1c和HOMA-IR的水平亦明显增加(P<0.01);BEZ显著降低糖尿病小鼠FBG(P<0.01),但仍维持在较高水平,亦使INS、HbA1c和HOMA-IR明显降低(P<0.01);与NC组比较,HF对照组FBG的水平无明显变化,INS、HbA1c和HOMA-IR有增加趋势,但差异无统计学显著性(P>0.05),见图1、表2。
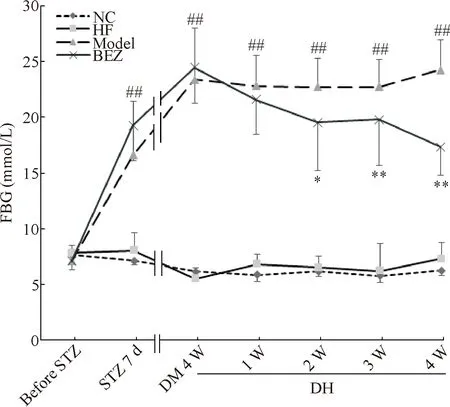
Figure 1.The effect of bezafibrate (BEZ) on fast blood glucose (FBG) level of the mice. DM: diabetes mellitus; DH: diabetic hepatopathy.Mean±SD.n=10.##P<0.01vsNC group;*P<0.05,**P<0.01vsmodel group.
图1 苯扎贝特对小鼠空腹血糖的影响
表2 苯扎贝特对糖尿病小鼠胰岛素、HbA1c和HOMA-IR的影响
Table 2.The effect of bezafibrate (BEZ) on the levels of insulin, HbA1c and HOMA-IR in the diabetic mice (Mean±SD.n=10)
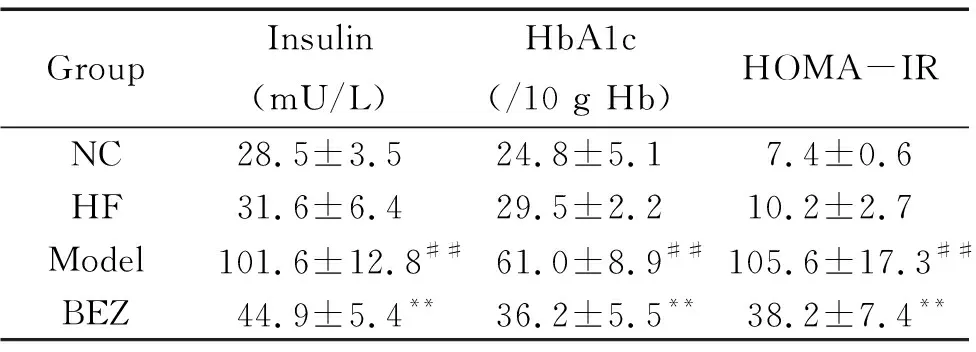
GroupInsulin(mU/L)HbA1c(/10 g Hb)HOMA-IRNC28.5±3.524.8±5.17.4±0.6HF31.6±6.429.5±2.210.2±2.7Model101.6±12.8##61.0±8.9##105.6±17.3##BEZ44.9±5.4**36.2±5.5**38.2±7.4**
##P<0.01vsNC group;**P<0.01vsmodel group.
2 BEZ对糖尿病小鼠肝脏结构和功能及血脂的影响
实验结束时,模型小鼠肝功能指标AST和ALT水平较正常组显著升高(P<0.01);HE染色显示肝细胞肿胀,排列紊乱,肝小叶结构消失,细胞内出现大量脂肪空泡,胞浆内可见大小不一脂滴,局部伴有炎症细胞浸润,出现了明显的肝损伤;同时,TC和TG也明显升高(P<0.01)。HF组的AST和ALT有增加趋势,但差异无统计学显著性(P>0.05);肝脏结构基本正常,细胞内有少量脂肪空泡及脂滴,未见炎症细胞浸润;TC和TG也增加(P<0.05),但分别只有模型组水平的25.5%和38.5%。BEZ明显减轻模型小鼠肝脏功能和结构的改变,使糖尿病肝损伤小鼠的AST和ALT均降低(P<0.01);病理损伤明显减轻,但仍可见少量脂滴;TC和TG水平也下降(P<0.01),见表3、图2。
表3 苯扎贝特对糖尿病小鼠血脂和肝功能的影响
Table 3.The effect of bezafibrate (BEZ) on the levels of TC, TG, ALT and AST in the diabetic mice (Mean±SD.n=10)

GroupTC(mg/dL)TG(mg/dL)AST(U/L)ALT(U/L)NC34±315±341±642±5HF40±4*25±8*44±750±10Mod-el157±19##65±7##99±8##97±6##BEZ44±9**29±4**74±6**72±10**
##P<0.01vsNC group;*P<0.05,**P<0.01vsmodel group.
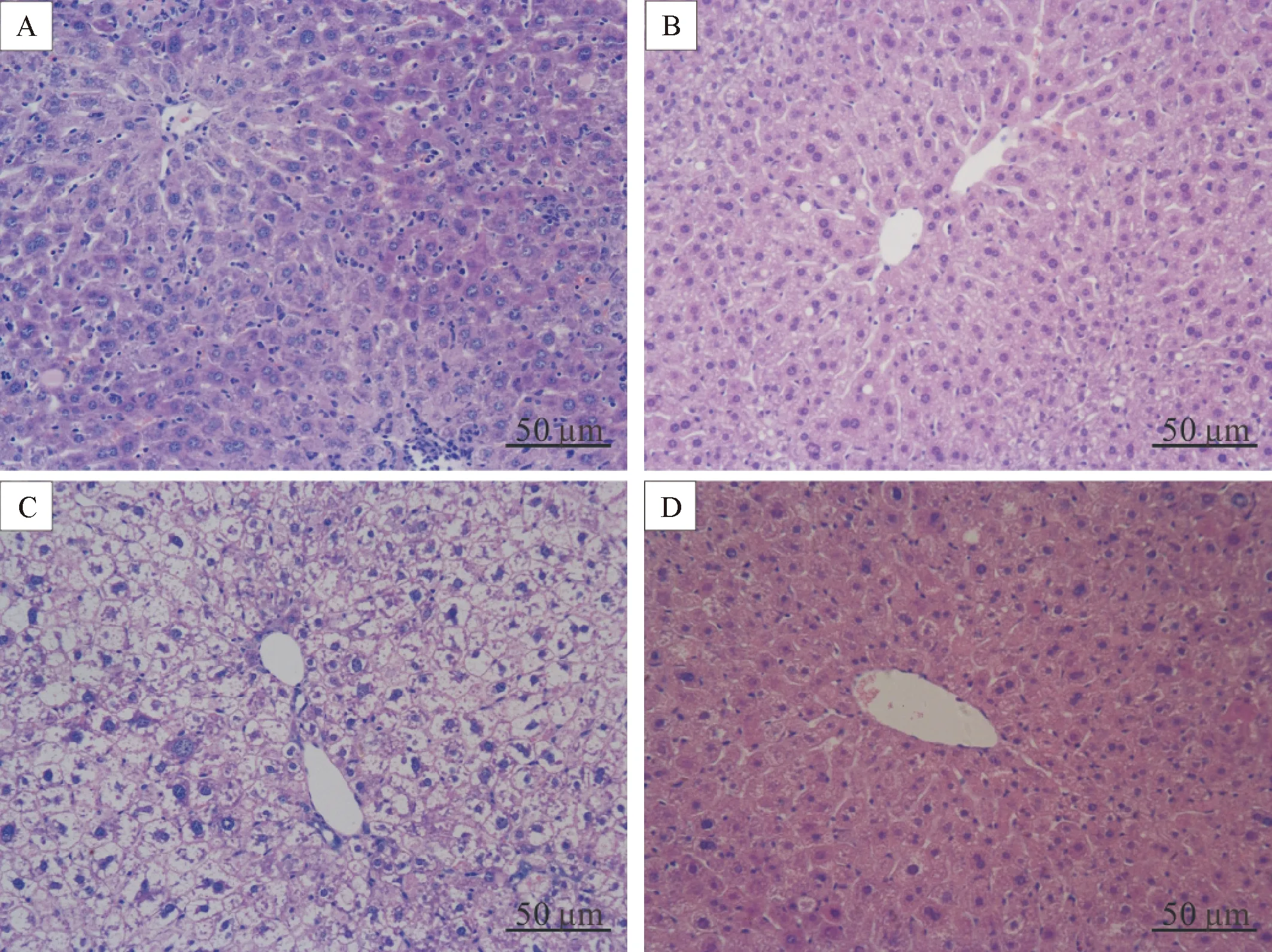
Figure 2.The effect of bezafibrate (BEZ) on the histopathological changes of liver tissues in the diabetic mice (HE staining, ×200). A: NC group; B: HF group; C: model group; D: BEZ group.
图2 苯扎贝特对糖尿病小鼠肝脏组织病理形态的影响
3 BEZ对肝脏PPARs的mRNA和蛋白表达的影响
模型组小鼠肝脏PPARs的mRNA明显下降(P<0.01),蛋白表达也明显下调(P<0.01);BEZ使模型组PPARα、PPARβ和PPARγ的mRNA和蛋白表达均上调(P<0.05);值得注意的是,与NC组比较,除了PPARβ的蛋白表达外,高脂饮食对照组小鼠肝脏PPARs的mRNA和蛋白的表达也下调(P<0.05),但其下调程度不如模型组,见图3、4。
讨 论
糖尿病是肝脏疾病发生发展的独立危险因素,约超过70%的糖尿病患者出现肝脏损伤[12];同时,肝脏病变引起的胰岛素敏感性降低及糖脂代谢异常反过来也可导致或加快糖尿病的进展[13]。因此,糖尿病并发的肝损害也被称为糖尿病性肝病(diabetic hepatopathy),包括以肝细胞内脂质的过度累积为特征的非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD),而后炎症因子产生,成为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),再进一步恶化,肝脏出现纤维化,甚至肝硬化,最终出现肝功能衰竭[14]。

Figure 3.The effect of bezafibrate (BEZ) on the mRNA expression of PPARs in the liver tissues of diabetic mice. Mean±SD.n=3.##P<0.01vsNC group;*P<0.05,**P<0.01vsmodel group.
图3 苯扎贝特对糖尿病小鼠肝脏PPARs mRNA表达的影响
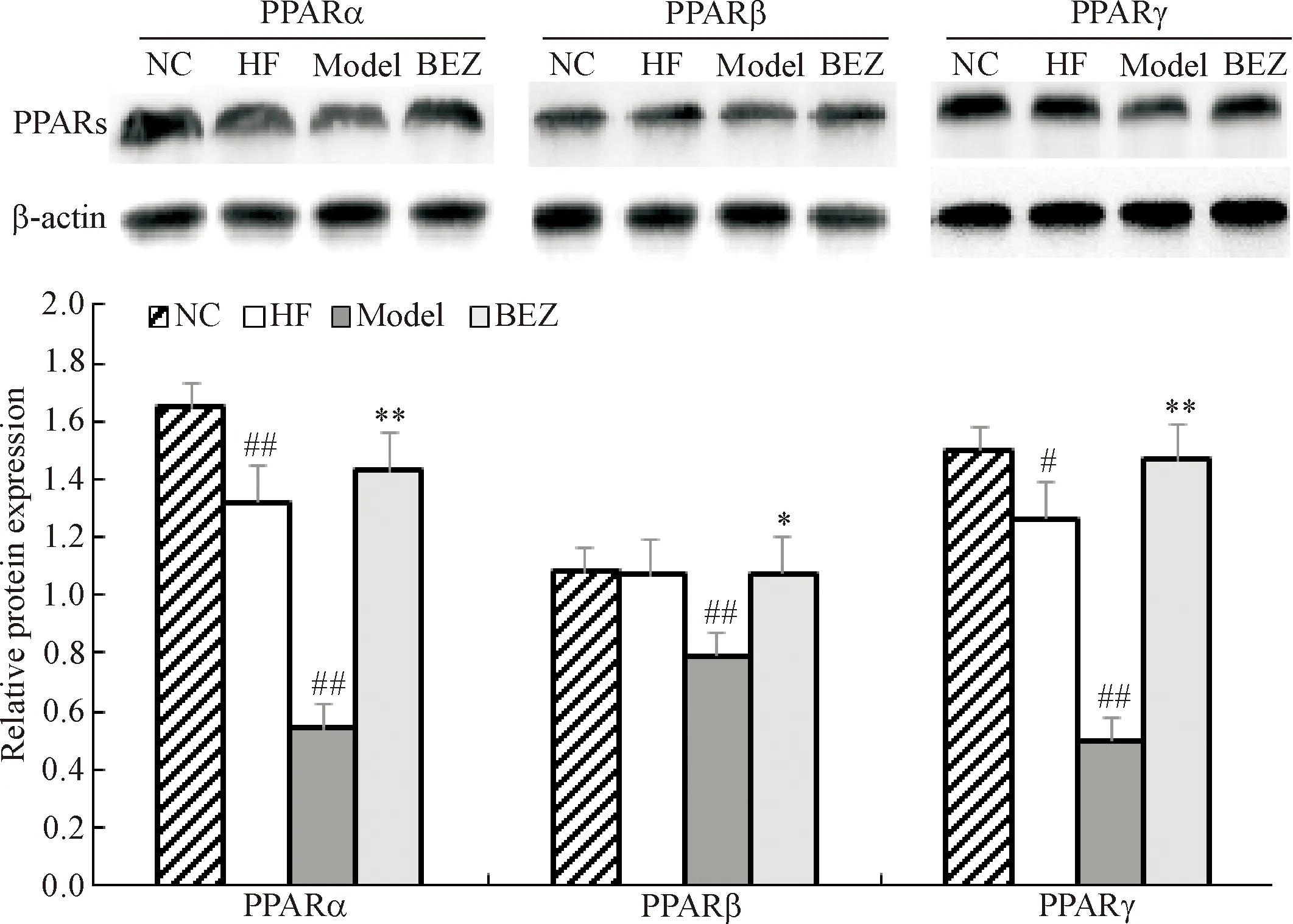
Figure 4.The effect of bezafibrate (BEZ) on the protein expression of PPARs in the liver tissues of diabetic mice. Mean±SD.n=3.##P<0.01vsNC group;*P<0.05,**P<0.01vsmodel group.
图4 苯扎贝特对糖尿病小鼠肝脏PPARs蛋白表达的影响
我们前期研究已经证实,长期高脂饮食联合STZ多次小剂量给予形成糖尿病4周后可建立糖尿病肝病模型[9-11]。本研究中,模型小鼠FBG水平持续高于11.1 mmol/L,提示糖尿病形成且稳定。实验结束时,INS、HbA1c及HOME-IR均明显增加,TCH和TG也明显上升,提示模型小鼠出现胰岛素抵抗,并伴发血脂紊乱。组织形态学检查发现,模型小鼠肝细胞内脂肪变性并伴有炎症细胞浸润,提示其肝损伤已进展至NASH阶段。模型小鼠血清的AST和ALT水平亦显著升高,提示其肝脏功能也出现损害。需要注意的是,高脂饲料对照组小鼠的TC和TG增加,但其AST和ALT基本正常,同时肝细胞内有少量脂肪空泡及脂滴,提示长期高脂饮食引起血脂紊乱,导致轻度脂肪肝形成。临床研究证实,高脂饮食可导致脂肪肝发生[15]。但在本实验时间内,肝功能尚未出现异常。由于HF组小鼠的FBG和INS等糖尿病相关指标仍处于正常范围,故在本实验条件下和观察时间内,单独高脂饮食不能导致糖尿病肝病形成。
目前对BEZ的研究主要集中于其降血脂作用。在糖尿病患者,BEZ除了有效改善其糖脂紊乱外,也能减少心血管疾病风险,降低患者死亡率[7]。在小鼠糖尿病心肌肥厚和糖尿病肾病模型,BEZ也有保护作用[16-17]。本实验中,给予BEZ治疗后,模型小鼠AST和ALT水平降低,肝损伤病理状态改善,提示BEZ对糖尿病肝脏结构和功能的损伤均有改善作用。虽然BEZ在一定程度上降低了糖尿病小鼠FBG水平,但仍远高于11.1 mmol/L糖尿病的诊断标准,提示对血糖的调节可能不是BEZ保护糖尿病肝损伤作用的主要机制。与Franko等[6]的研究结果一致,BEZ也使TCH和TG水平也下降,INS、HbA1c和HOMA-IR明显降低,提示在糖尿病肝病小鼠模型,除了降血脂作用外,BEZ对胰岛素抵抗也有一定的改善作用。
我们前期研究已经发现,PPARs相关信号通路参与了糖尿病肝损伤的发生发展过程[11],PPAR各受体亚型可能是糖尿病肝损伤防治的重要靶点。在高脂饲料对照组,小鼠肝脏PPARs的mRNA和蛋白表达也减少,提示长期高能量饮食对PPARs信号通路可能也有损伤作用。BEZ是PPAR泛激动剂,可同时激动PPARα、PPARβ和PPARγ受体,但目前对BEZ糖尿病肝损伤与PPARs之间的研究较少。本研究结果显示,BEZ在减轻糖尿病肝损伤的同时,对PPARα、PPARβ和PPARγ 的mRNA和蛋白表达表现出明显的上调作用。这些结果证实,BEZ减轻糖尿病肝损伤的作用可能与其激活PPARs受体,从而调控相关因子的生成有关。
综上所述,本研究结果提示,BEZ具有减轻糖尿病肝损伤的作用,其机制可能与BEZ对PPARα、PPARβ及PPARγ的激活有关。除了PPARs相关因素,BEZ的作用是否还有其它机制参与,还需要进行更多深入研究。
