衢枳壳提取物改善2 型糖尿病db/db 模型小鼠肾脏氧化损伤的作用研究
2020-04-03王思为钟松阳楼丽君
郑 慧 王思为 钟松阳 楼丽君
糖尿病肾病(diabetic nephropathy,DN)是2 型糖尿病最严重的并发症之一,发病率20%~40%[1]。研究表明,DN 已成为导致终末期肾脏病的重要因素,并会引起多器官衰竭和死亡[2]。DN 的发病机制复杂,目前尚缺乏有效的治疗方法。衢枳壳,即常山胡柚片,是芸香科植物常山胡柚Citrus changshan huyou Y.B.Chang 的干燥未成熟果实的加工品[3]。本研究组前期研究表明,衢枳壳的主要成分为柚皮苷、新橙皮苷等黄酮类化合物,具有抗炎、降糖等多种药理学活性[3-4]。本研究拟通过2 型糖尿病db/db 模型小鼠观察衢枳壳提取物对其肾脏的保护作用并探讨可能的机制,报道如下。
1 材料与方法
1.1 动物 雄性自发性2 型糖尿病C57BLKS/J db/db 模型小鼠,Stock No:000642,7~8 周龄,体质量30~40g;同遗传背景C57BLKS/J db 野生型小鼠(db/m),7~8 周龄,体质量18~22g,以上动物购自南京大学—南京生物医药研究院,动物生产许可证号:SYXK(苏)2015-0001。饲养于浙江中医药大学实验动物中心,自由摄食及饮水。动物实验经浙江省衢州市人民医院医学伦理委员会审核批准。
1.2 药物及制备 衢枳壳饮片购自衢州南孔中药有限公司。衢枳壳提取物(Quzhou Fructus Aurantii extract,QFAE)制备:称取衢枳壳饮片1kg 净制,粉碎,加15 倍量的80%乙醇(15000mL),浸泡1h,加热回流提取3 次,每次2h,合并提取液,冷却过滤,滤液回收溶剂,冷冻干燥,即得QFAE。所得QFAE 中黄酮类化合物的含量≥50%。
1.3 主要试剂及仪器 血糖试纸,购自美国强生,批号Lot4 525469;肌酐(Cr)检测试剂盒(批号20181207)、尿素氮(BUN)检测试剂盒(批号20181207)、超氧化物歧化酶(SOD)检测试剂盒(批号20190428)、过氧化氢酶(CAT)检测试剂盒(批号20190428)和还原型谷胱甘肽(GSH)检测试剂盒(批号20190428),均购自南京建成生物工程研究所;Trizol 试剂(美国Invitrogen,批号Lot△S7130);cDNA逆转录试剂盒(美国Thermo Fisher,批号Lot:00742498);SYBR Green 试剂盒(上海生工,批号F708KA2311)。7020 全自动生化分析仪,日本日立;高速冷冻离心机,美国Thermo;LC480 荧光定量PCR仪,美国罗氏。
1.4 动物分组及给药 24 只C57BLKS/J db/db 雄性小鼠适应性饲养1 周后,采用随机数字表法分为模型组,QFAE 低、高剂量组,每组8 只。另取8 只C57BLKS/J db 野生型小鼠作为对照组。对照组和模型组小鼠每天以蒸馏水灌胃,QFAE 低、高剂量组小鼠每天按QFAE 100、300mg/kg 剂量灌胃,连续喂养7 周,每周记录小鼠体质量和血糖情况。末次给药24h 后处死小鼠,收集血清、肾脏。
1.5 检测指标
1.5.1 生化指标测定 全自动生化仪上测定各组小鼠血清Cr 和BUN 水平;取小鼠肾脏匀浆,根据试剂盒操作要求,检测肾组织匀浆氧化应激指标SOD、CAT 和GSH 的活性。
1.5.2 肾组织病理学观察 取各组小鼠一部分肾脏组织,用10%福尔马林固定,常规石蜡包埋切片,HE染色,400 倍显微镜下观察。
1.5.3 RT-PCR 检测 采用Trizol 法提取各组小鼠肾脏RNA,并逆转录为cDNA。按照SYBR Green 荧光染料法进行定量PCR 测定,引物由苏州金唯智生物科技有限公司合成,引物序列如下:Gclm 上游序列5'-CTTCGCCTCCGATTGAAGATG-3',下游序列5'-AAAGGCAGTCAAATCTGGTGG-3';Nqo1 上游序列5'-AGGATGGGAGGTACTCGAATC-3',下游序列5'-TGCTAGAGATGACTCGGAAGG-3';Gclc 上游序列5'-CTACCACGCAGTCAAGGACC-3',下游序列5'-CCTCCATTCAGTAACAACTGGAC-3';GAPDH 上游序列5'-TGAGGCCGGTGCTGAGTATGT-3',下游序列5'-CAGTCTTCTGGGTGGCAGTGAT-3'。PCR 反应条件:95℃30s 1 循环,95℃5s 40 循环,60℃31s 40 循环,采用2-ΔΔCt 法进行半定量分析。
1.6 统计学方法 所有数据均用SPSS 17.0 统计软件进行处理,数据以均值±标准差()表示,组间差异按方差分析进行检验,并用最小显著差法检验作两两比较,以P<0.05 表示差异有统计学意义。
2 结果
2.1 QFAE 对db/db 模型小鼠血糖、体质量和肾质量的影响 与对照组比较,模型组小鼠血糖、体质量和肾质量显著增高(P 均<0.05);与模型组比较,QFAE低、高剂量组小鼠血糖、体质量无明显变化(P>0.05),但肾质量显著低于模型组(P 均<0.01),见表1。
表1 各组小鼠血糖、体质量和肾质量比较()
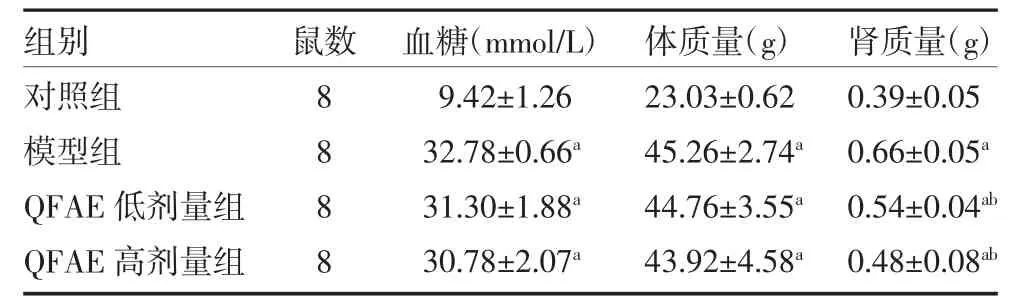
表1 各组小鼠血糖、体质量和肾质量比较()
注:对照组予蒸馏水灌胃;模型组予蒸馏水灌胃;QFAE 低剂量组予100mg/kg 剂量QFAE 灌胃;QFAE 高剂量组予300mg/kg 剂量QFAE灌胃;QFAE 为衢枳壳提取物;与对照组比较,aP<0.05;与模型组比较,bP<0.01
2.2 QFAE 对db/db 模型小鼠血清Cr 和BUN 水平的影响 与对照组比较,模型组小鼠血清Cr 和BUN水平显著升高(P 均<0.05);与模型组比较,QFAE低、高剂量组小鼠血清Cr 和BUN 水平显著降低(P<0.05,P<0.01),见表2。
2.3 QFAE 对db/db 模型小鼠肾组织病理学的影响对照组小鼠肾组织结构完整,无明显组织病理学改变;模型组小鼠肾小球出现萎缩和碎裂,肾小管变性和坏死;QFAE 喂养能一定程度改善以上病理学变化,尤其高剂量效果显著。见图1。
表2 各组小鼠血清Cr 和BUN 水平比较()

表2 各组小鼠血清Cr 和BUN 水平比较()
注:对照组予蒸馏水灌胃;模型组予蒸馏水灌胃;QFAE 低剂量组予100mg/kg 剂量QFAE 灌胃;QFAE 高剂量组予300mg/kg 剂量QFAE灌胃;Cr 为肌酐;BUN 为血清尿素氮;QFAE 为衢枳壳提取物;与对照组比较,aP<0.05;与模型组比较,bP<0.05,bbP<0.01

图1 各组小鼠肾组织病理学改变(HE 染色×400)
2.4 QFAE 对db/db 模型小鼠肾组织SOD、GSH 和CAT 活性的影响 与对照组比较,模型组小鼠肾组织SOD、GSH 和CAT 活性显著降低(P 均<0.05);与模型组比较,QFAE 低、高剂量组小鼠肾组织SOD、GSH 和CAT 活性显著增加(P<0.05 或P<0.01)。见表3。
表3 各组小鼠肾组织SOD、GSH 和CAT 活性比较()
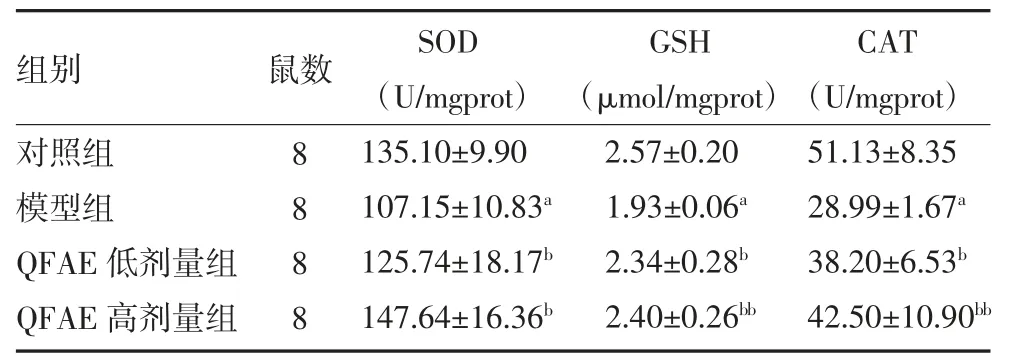
表3 各组小鼠肾组织SOD、GSH 和CAT 活性比较()
注:对照组予蒸馏水灌胃;模型组予蒸馏水灌胃;QFAE 低剂量组予100mg/kg 剂量QFAE 灌胃;QFAE 高剂量组予300mg/kg 剂量QFAE灌胃;QFAE 为衢枳壳提取物;SOD 为超氧化物歧化酶;CAT 为过氧化氢酶;GSH 为还原型谷胱甘肽;与对照组比较,aP<0.05;与模型组比较,bP<0.05,bbP<0.01
2.5 QFAE 对db/db 模型小鼠肾组织抗氧化基因Gclm、Nqo1 和Gclc 表达的影响 RT-PCR 结果显示,与对照组比较,模型组小鼠肾脏抗氧化基因Gclm、Nqo1 和Gclc mRNA 表达降低,但差异无统计学意义(P>0.05);与模型组比较,QFAE 低、高剂量组小鼠肾组织Gclm、Nqo1 和Gclc mRNA 表达显著升高(P<0.05,P<0.01),见表4。
3 讨论
DN 特征主要包括细胞外基质(ECM)蛋白的积累和不可逆转的肾功能下降[5]。血清Cr 和BUN 水平反应肾小球滤过率,DN 会引起血清Cr 和BUN 水平升高。本研究结果显示,与db/m 模型小鼠比较,db/db小鼠血Cr 和BUN 水平显著升高,且小鼠肾脏出现一定程度的病理学改变。然而,给予不同剂量QFAE后,db/db 模型小鼠SCr 和BUN 水平降低,且肾脏组织的病理损伤缓解,提示QFAE 对db/db 模型小鼠肾损伤具有一定改善作用。
表4 各组小鼠肾组织抗氧化基因Gclm、Nqo1和Gclc mRNA 表达量比较()

表4 各组小鼠肾组织抗氧化基因Gclm、Nqo1和Gclc mRNA 表达量比较()
注:对照组予蒸馏水灌胃;模型组予蒸馏水灌胃;QFAE 低剂量组予100mg/kg 剂量QFAE 灌胃;QFAE 高剂量组予300mg/kg 剂量QFAE灌胃;Gclm 为谷氨酸-半胱氨酸修饰亚基;Nqo1 为醌氧化还原酶1;Gclc 为谷氨酸-半胱氨酸连接酶催化亚基;QFAE 为衢枳壳提取物;与模型组比较,aP<0.05,aaP<0.01
氧化应激被认为是DN 发生与发展的重要机制之一。有研究认为,2 型糖尿病肾病与机体氧化损伤及抗氧化防御系统失衡有关[6-7]。正常生理条件下,机体内自由基、过氧化脂质和抗氧化酶之间保持动态平衡。然而,当组织和细胞受到外界环境不利因素刺激(例如高糖高脂环境),会导致机体氧化-还原体系平衡被打破,引起一些抗氧化酶(如SOD、CAT 和GSH 等)活性降低,从而导致组织和细胞氧化损伤[6-7]。药理研究表明,QFAE 的主要成分柚皮苷、新橙皮苷等均具有较强的抗氧化作用[8]。因此,我们认为QFAE可能具有提高db/db 模型小鼠肾脏抗氧化能力的作用。结果显示,与对照组比较,db/db 模型小鼠肾组织抗氧化酶SOD、CAT 和GSH 活性显著降低,而QFAE能够显著提高db/db 小鼠肾组织抗氧化酶SOD、CAT和GSH 活性,减轻肾脏氧化损伤。
Nqo1、Gclc、Gclm 等是参与维持组织、细胞氧化-还原平衡体系的重要基因[9]。研究显示,Nqo1、Gclc、Gclm 能够通过提高SOD、CAT 和GSH 等酶活性,加速自由基的清除,从而抑制细胞氧化应激反应,缓解细胞氧化损伤[10]。本研究结果显示,QFAE 能够显著提高小鼠肾组织抗氧化基因Gclm、Nqo1、Gclc mRNA 表达,提示促进肾组织抗氧化基因表达可能是QFAE 改善db/db 模型小鼠肾脏氧化损伤的主要机制之一。
综上所述,本研究结果表明,QFAE 具有改善2型糖尿病db/db 模型小鼠肾功能,缓解肾损伤的作用,其机制主要与促进抗氧化基因表达,提高肾组织抗氧化能力有关。
