宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 的表达变化及临床指导意义
2020-04-03陈小霞
陈小霞,谢 环
(三峡大学宜昌市第二人民医院妇科,湖北宜昌 443000)
宫颈癌发生与患者的宫颈上皮细胞癌变有关,宫颈癌的,死亡率和发生率分别排在女性恶性肿瘤的第9 位和第8 位,严重威胁女性健康[1]。宫颈癌的治疗主要以手术治疗和放化疗为主,随着近年来靶向治疗以及免疫治疗技术的发展,宫颈癌患者的预后得到较大改善,但是死亡率和发生率依然呈现上升趋势[2],因此迫切需要对宫颈癌的发病机制进行深入探究。宫颈癌发病的分子机制较为复杂,涉及到众多蛋白质和基因表达的变化,其中微小RNA(micro-RNA,miRNA)在基因表达调控中起到重要作用[3]。miRNA 是一类长度为18-24nt 的短片段RNA,在细胞当中广泛存在,并且调节细胞的一系列生理和代谢活动[4]。研究报道显示miRNA 在肿瘤发生发展过程中起到重要作用,在肿瘤的增殖、转移、细胞周期以及肿瘤干细胞维持等过程中均显示具有一定调节作用[5-6]。miRNA-21 在正常组织中表达量较低,研究报道显示在乳腺癌、结肠致癌和胃癌等肿瘤当中miRNA-21表达量上调,并且与肿瘤细胞的转移和增殖密切相关[7]。miRNA-127 在正常组织当中表达量较高,而在肺癌和乳腺癌等肿瘤当中表达量下调,并且与肿瘤的侵袭转移密切相关[8]。miRNA-125a 在结肠致癌和乳腺癌等肿瘤中表达量下调,并且与肿瘤细胞的远端转移密切相关[9]。本研究对95 例宫颈癌患者宫颈癌组织中miRNA-21、miRNA-127和miRNA-125a 的表达水平进行检测,以此探究其临床意义。
1 资料与方法
1.1 一般资料
选择2014 年1 月至2017 年12 月在三峡大学宜昌市第二人民医院接受治疗的95 例宫颈癌患者的临床资料进行回顾性分析。患者年龄39~74 岁,平均(57.83±12.56)岁。按照TNM分期将宫颈癌患者分为Ⅰ期18 例,Ⅱ期14 例,Ⅲ期39 例,Ⅳ期24 例。39 例未发生肌层浸润,56 例发生肌层浸润。低分化宫颈癌39 例,中分化32 例,高分化24 例。发生淋巴结转移30 例,未发生淋巴结转移65 例。
1.2 方法
1.2.1 仪器与试剂Trizol 试剂(美国英潍捷基有限公司),逆转录试剂盒(美国赛默飞世尔生物科技有限公司,货号:18090050),实时荧光定量PCR 试剂盒(美国赛默飞世尔生物科技有限公司,货号:4444556),荧光定量PCR 仪(美国安捷伦科技有限公司,型号Mx3000PS),所需引物均从苏州金唯智生物科技有限公司合成。
1.2.2 检测方法手术切除宫颈癌组织以及距离宫颈癌组织3 cm 以上的癌旁组织后立即将其置于2 mL 冻存管当中,立即放入液氮中进行速冻处理,液氮速冻之后置于-80℃冰箱保存。待需要检测时,将组织从-80℃冰箱取出并置于液氮速冻,用镊子将组织从冻存管中取出后,使用研钵将肿瘤组织研磨成粉末,根据肿瘤组织的大小加入适量的Trizol 提取液,使用移液枪充分吹打混匀,冰上裂解30 min 后加入苯酚-氯仿-异戊醇抽提液对肿瘤组织中的RNA 进行抽提,抽提结束后用酒精将RNA 沉淀下来,3 000 g 离心10 min 后弃去上清液,待酒精蒸发完全后加入无菌水进行溶解,获得RNA 溶液。随后使用逆转录试剂盒将RNA 逆转录为cDNA,实验操作严格按照试剂盒说明书进行。获得cDNA 文库后使用实时荧光定量PCR 试剂盒对miRNA-21、miRNA-127 和miRNA-125a 的表达量进行检测,配套使用荧光定量PCR 仪进行检测,操作方法严格按照试剂盒说明书和仪器说明书进行操作。在检测miRNA-21、miRNA-127 和miRNA-125a 的表达量的同时,以甘油醛-3-磷酸脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,并检测其表达量。通过相对△Ct值法对miRNA-21、miRNA-127 和miRNA-125a 相对表达量进行计算,目的基因miRNA-21、miRNA-127 和miRNA-125a 的表达量相对于GAPDH 基因的比值为2-△Ct,计算miRNA-21、miRNA-127 和miRNA-125a 的相对表达量,其中△CtmiRNA-21=CtmiRNA-21-CtGAPD H、△CtmiRNA-127=Ct miRNA-127-CtGAPDH 和△CtmiRNA-125a=CtmiRNA-125a-CtGAPDH。miR NA-21 的PCR 引物序列包括正向引物:5'-CTGCAGGGAAAACACATACCAGA-3',反向引物:5'-TGGTTCAGGATGCGCTGCTC-3'。miRNA-127的 PCR 引物序列包括正向引物:5'-GGCAGAATGGAAGCAGTCCC-3',反向引物:5'-CTCAGCTCGCTCAGAAGGGC-3'。miRNA-125a 的PCR引物序列包括正向引物 :5'-TGGTAGTCCTGTTGGCAGGAGA-3',反向引物:5'-GTCGCTTGTTACCTAGCATCTGCA-3'。GAPDH的 PCR引物序列包括正向引物 :5'-TCTCTCAGATGTAACTGAGCTG-3',反向引物:5'-TAGCTCATCAACCGATCT-3'。
1.3 统计学处理
2 结果
2.1 宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 的表达水平比较
宫颈癌组织中miRNA-21 表达量为(25.63±6.85),明显高于癌旁组织的(1.33±0.62)t=34.435,P<0.001。宫颈癌组织中miRNA-127 和miRNA-125a 表达量分别为(5.64±1.29)和(8.47±1.58),而癌旁组织中miRNA-127 和miRNA-125a 表达量分别为(16.47 ±4.62)和(23.49±5.57),宫颈癌组织中表达量明显低于癌旁组织(t=22.007 和25.285,P<0.001)。宫颈癌组织及其癌旁组织miRNA-21、miRNA-127 和miRNA-125a 的表达量见图1。
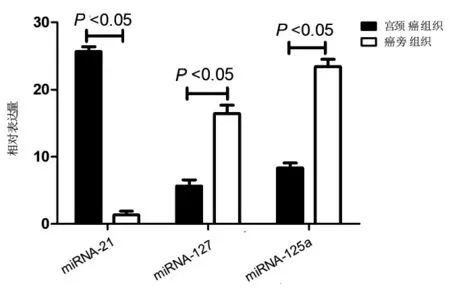
图1 宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 的表达水平Fig.1 Expression levels of miRNA-21,miRNA-127 and miRNA-125a in cervical cancer tissues
2.2 宫颈癌组织miRNA-21、miRNA-127 和miRNA-125a 表达水平与患者临床病理参数的关系
宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 均与宫颈肌层浸润、组织学分化、淋巴结转移和TNM 分期密切相关(P<0.05),而与患者的年龄和肿瘤大小无关(P>0.05),见表1。
2.3 宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 表达与患者预后的关系分析
在宫颈癌中,miRNA-21 高表达宫颈癌患者的生存率明显低于miRNA-21 低表达患者(X2=16.214,P<0.001),而miRNA-127 高表达和miRNA-125a 高表达宫颈癌患者的生存率分别高于miRNA-127 低表达和miRNA-125a 低表达患者(X2=10.612 和9.526,所有P<0.001)。宫颈癌患者的生存曲线见图2。
3 讨论
HPV 感染是宫颈癌的一大致病因素,约60%的患者存在HPV 感染,并且HPV 疫苗显示对宫颈癌具有很好的预防效果[10]。但是对于部分HPV 阴性的宫颈癌患者,HPV 疫苗对这类患者的疗效欠佳,其宫颈癌的发病机制更为复杂[11]。目前对宫颈癌的发病机制仍然缺乏了解,研究报道通过高通量测序的方法对宫颈癌组织中基因的表达情况进行综合分析,发现一系列基因在宫颈癌发病过程中表达出现异常[12]。研究报道对宫颈癌中的miRNA 表达及调控方式进行系统研究,发现宫颈癌中存在复杂的miRNA 调控网络,一种miRNA 能够同时对多种基因的表达进行调控,并且miRNA 自身的表达也可能受到另外的miRNA 调控[13]。研究报道显示miRNA 可以作为肿瘤的分子标记,用于肿瘤的诊断和治疗[14],提示miRNA 在宫颈癌的诊断和治疗中具有重要的临床价值。
表1 宫颈癌组织miRNA-21、miRNA-127 和miRNA-125a 表达与患者临床病理参数的关系()Tab.1 Relationship between expressions of miRNA-21,miRNA-127 and miRNA-125a in cervical cancer tissue and clinical pathological parameters of the patients()
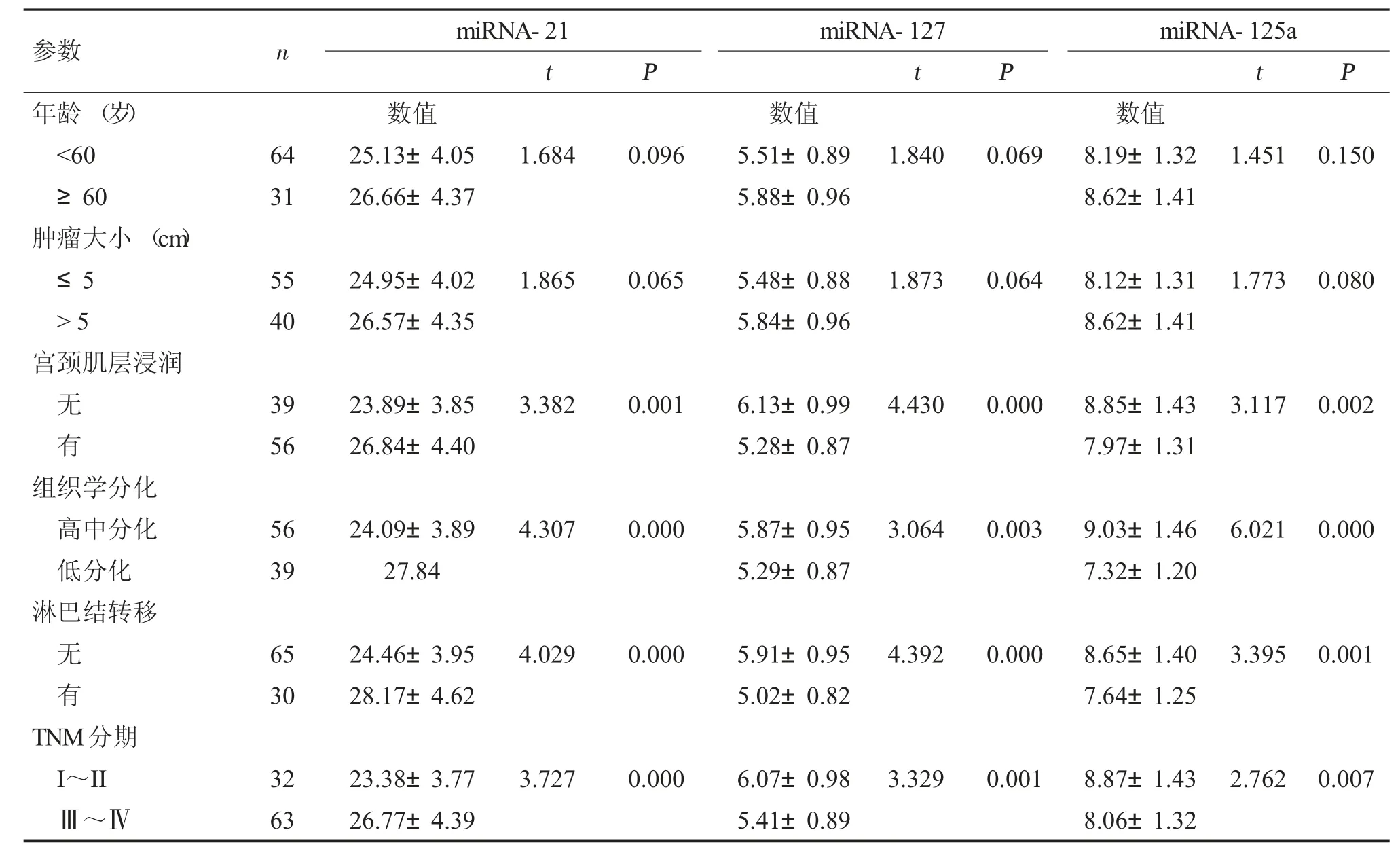
表1 宫颈癌组织miRNA-21、miRNA-127 和miRNA-125a 表达与患者临床病理参数的关系()Tab.1 Relationship between expressions of miRNA-21,miRNA-127 and miRNA-125a in cervical cancer tissue and clinical pathological parameters of the patients()
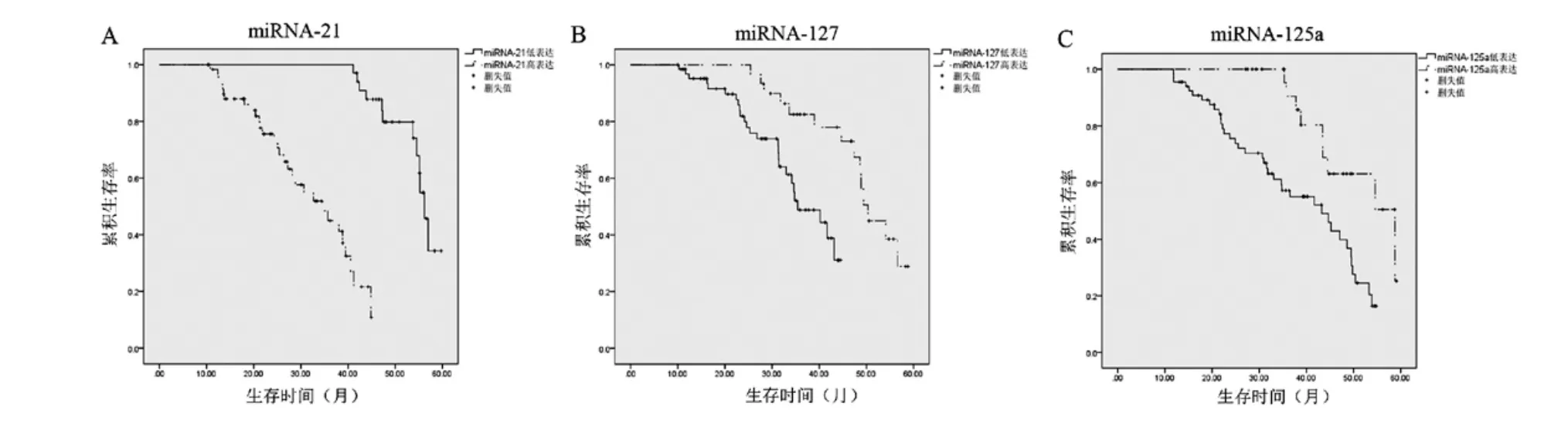
图2 宫颈癌组织中miRNA-21、miRNA-127 和miRNA-125a 表达与患者预后的关系分析Fig.2 An analysis of the relationship between the expressions of miRNA-21,miRNA-127 and miRNA-125a in cervical cancer tissues and the patients'prognosis
miRNA-21 主要分布于细胞质中,研究报道显示随着肿瘤细胞发生凋亡,miRNA-21 会从肿瘤细胞中释放进入到患者的血液当中,因此miRNA-21可以作为多种肿瘤的血清标记物分子[15]。miRNA-127 在细胞质和细胞核中均有分布,研究报道显示在细胞核中miRNA-127 能够与多种转录因子结合调控基因转录,而细胞质中miRNA-127能够与基因mRNA 相互结合,促进基因mRNA 降解,从而抑制基因表达[16]。miRNA-125a 主要分布于细胞质中,研究报道显示miRNA-125a 通过调节一系列信号通路的活性来调节肿瘤细胞的增殖、转移和侵袭[17]。本研究发现宫颈癌组织中miRNA-21 表达上调,而miRNA-127 和miRNA-125a表达下调。研究报道显示在乳腺癌等多种肿瘤当中miRNA-21 主要作为癌基因起作用,而miRNA-127 和miRNA-125a 主要作为抑癌基因起作用[18]。本研究在宫颈癌中进一步对此进行证实,表明在宫颈癌中miRNA-21 也作为癌基因起作用,而miRNA-127 和miRNA-125a 也作为抑癌基因起作用。研究进一步发现miRNA-21、miRNA-127 和miRNA-125a 表达均与宫颈肌层浸润、组织学分化、淋巴结转移和TNM 分期密切相关,表S 明miRNA-21、miRNA-127 和miRNA-125a 表达与肿瘤的侵袭转移存在密切联系。研究报道显示miRNA-21 能够激活有丝分裂原激活的蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路,进而促进肿瘤细胞的转移[19]。miRNA-127 则能够激活核因子-κB(nuclear factor κB,NF-κB)信号通路,进而促进乳腺癌和胃癌的侵袭转移[20]。miRNA-125a 则能够直接抑制黏蛋白1(mucprotein 1,MUC1)和上皮钙黏着蛋白(E-cadherin)等细胞黏附相关蛋白的表达,从而抑制细胞转移[21]。因此在宫颈癌中miRNA-21、miRNA-127 和miRNA-125a 可能通过调节细胞黏附相关信号通路或者是相关蛋白的表达来调节细胞的侵袭和转移。研究结果发现miRNA-21 高表达、miRNA-127 低表达和miRNA-125a 低表达的宫颈癌患者生存率明显下降。宫颈癌患者的生存率与肿瘤是否发生转移之间联系密切,研究报道显示非转移宫颈癌患者生存率是发生转移患者的2~3 倍,并且发生转移的宫颈癌患者放化疗和手术治疗难度加大,对患者的生存也会造成影响[22]。因此miRNA-21、miRNA-127 和miRNA-125a 可能通过影响肿瘤转移进而影响宫颈癌患者的生存。
综上所述,宫颈癌组织中miRNA-21 表达上调,而miRNA-127 和miRNA-125a 表达下调。miRNA-21、miRNA-127 和miRNA-125a 表达均与宫颈肌层浸润、组织学分化、淋巴结转移和TNM分期密切相关,并且miRNA-21 高表达、miRNA-127 低表达和miRNA-125a 低表达的宫颈癌患者生存率明显下降。
