滇池湖滨湿地不同挺水植物区沉积物细菌群落结构特征
2020-04-03寄博华常军军司光正陈金全
寄博华,李 玮,常军军①,李 璇,司光正,何 芳,陈金全②
(1.云南大学生态学与环境学院,高原湖泊生态与治理研究院,云南 昆明 650091;2.云南大学国际河流与生态安全研究院,云南 昆明 650091;3.云南省高原山地生态与退化环境修复重点实验室,云南 昆明 650091)
位于云南省昆明市的滇池属于高原城市湖泊,是我国第6大淡水湖。湖泊及湖滨带的各类生物与周围环境构成了极其复杂多样的生态系统,具有重要的生态系统服务功能。但随着工农业和生活废水的大量排入,滇池发生了严重的富营养化,生态系统功能严重退化,引发了国内外学者的广泛关注[1]。人工湿地是一种可有效去除污水中有机物、氮、磷等污染物的生态型技术,对于低浓度污水或污水处理厂尾水也有相对较好的去除效果[2]。研究及工程实践表明,在入湖河口建设湖滨型人工湿地可截留或降解有机物和无机盐,起到湖泊污染防治中最后一道屏障的作用[3]。为了保护滇池水环境,近几年来滇池周边已建成数个人工湿地公园,其除了具有提高生物多样性、恢复滇池湖滨生态系统、为市民提供休闲娱乐场地等功能外,另一项重要功能便是削减进入滇池的面源污染[4]。
人工湿地中的微生物参与碳、氮、硫等物质的循环,是湿地的关键要素之一。微生物中细菌占比最高,作用最为显著。细菌可通过好氧/厌氧分解、硝化-反硝化、硫酸盐还原等作用去除或转化污水中有机物、氮、硫等污染物,在湿地净化污水过程中起着十分关键的作用。不同种类细菌在环境中的占比不同,构成了特有的群落结构,显著影响着湿地的污水处理效能。湿地沉积物中细菌数量比水体高数个数量级[5],群落结构也更加稳定,因此可以充分反映湿地细菌的特征。不同湿地植物因根系形态、泌氧量、分泌物以及凋落残体生物量及成分等的不同,将对其周围环境理化性质造成不同影响,进而直接或间接影响细菌的生长和分布[6]。因此,不同植物作用下的湿地沉积物微生物群落特征值得关注。
分析细菌群落结构的方法包括分离培养法、醌指纹技术、荧光原位杂交技术、聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术、末端限制性片段长度多态性(T-RFLP)技术等。但这些技术存在操作复杂、耗时长、成本高等缺点。而近年来兴起的高通量测序技术不仅免去了微生物培养步骤,能更全面地反映微生物群落结构,还具有速度快、灵敏度高、分析结果准确等优点,因此已被广泛应用于各种复杂环境中微生物群落结构分析[7]。
目前,已有研究考察分析了滇池水体及沉积物的微生物群落结构特征[8],但鲜有对滇池湖滨人工湿地典型植物群丛根系细菌群落结构的比较研究。笔者采用高通量测序技术分析了滇池典型湖滨湿地——斗南湿地中菖蒲(Acoruscalamus)、芦苇(Phragmitescommunis)和美人蕉(Cannaindica)3种典型挺水植物根区沉积物中细菌群落结构,结合沉积物化学性质,探讨不同植物和环境因子对沉积物细菌群落结构的影响及其环境意义,为滇池湖滨型湿地管理和湖泊污染防治提供科学参考。
1 材料与方法
1.1 样品采集
斗南湿地(24°53′51.87″ N,102°46′4.84″ E)位于滇池东岸,库容达13万m3,是在滇池湖滨建设的主要功能型湿地之一,其地理位置及地形见图1。该湖滨湿地的主要功能是处理昆明市洛龙河污水处理厂排放的尾水[9]。同时该湿地也具有较强的生态和社会服务价值。选择湿地中分布最多的美人蕉、菖蒲和芦苇3种挺水植物群丛生长区域并沿水流方向不同功能区采集沉积物样品。其中,进水口处(分别记为MR0、CP0、LW0)、湿地中部(分别记为MR1、CP1、LW1)和出水口处(分别记为MR2、CP2、LW2)各设定1个采样区域(图1)。
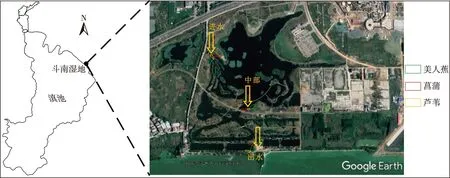
图1 斗南湿地位置、遥感地形图及采样点
2018年6月2日下午于各植物群丛区域的陆地与湿地水体交界处采集植物根系表层沉积物的混合样品。该时段植物生长茂盛,湿地状况良好。将样品置于灭菌聚乙烯袋中密封,使用便携式冰箱将其带回实验室,去除其中碎石等杂物,一部分样品置于-20 ℃条件下保存用于微生物群落结构分析。
1.2 沉积物理化性质的测定
另一部分沉积物样品风干后,按NY/T 395—2012《农田土壤环境质量监测技术规范》要求对样品进行研磨、过筛。铵态氮(NH4+-N)、硝态氮(NO3--N)和速效磷含量采用CleverChem 380自动化学分析仪测定;有机质含量采用重铬酸钾容量法测定。
1.3 细菌群落结构分析
1.3.1微生物总DNA提取与PCR扩增
沉积物中总DNA采用PowerSoil DNA提取试剂盒(MoBio,USA)进行提取,使用w=0.8%琼脂糖凝胶电泳检验DNA样品质量。采用细菌16S rRNA基因V3-V4可变区通用引物对PCR进行扩增。引物序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)(引物含有标签序列)。扩增反应条件参见文献[10]。PCR扩增产物通过琼脂糖凝胶电泳进行检测,并采用PCR 产物纯化试剂盒纯化(Qiagen,Germany)。
1.3.2MiSeq 高通量测序
使用Illumina MiSeq 2000测序平台对扩增后的PCR产物进行测序,测序由派森诺(上海)生物科技有限公司完成。对序列进行质量控制,运用QIIME v1.8.0软件去除短序列、模糊序列和嵌合序列。
1.3.3测序数据分析
按≥97%序列相似度对有效序列进行归并和分类操作单元(OTU)划分,将OTU代表序列与Greengenes数据库进行比对。根据OTU值计算物种丰富度指数(Chao 1指数、ACE指数)和多样性指数(Shannon指数);根据物种和OTU丰度矩阵,使用R软件,绘制物种热图和Venn图;根据获得的各样本在门和属分类水平上的组成和丰度分布表,使用OriginPro 2018软件绘制各分类水平及功能细菌的相对丰度柱状图;根据环境因子和属水平物种组成,使用R软件做冗余分析。
1.4 统计分析
使用SPSS 25软件做Pearson相关性分析,由Pearson相关系数分析采样点沉积物化学性质与微生物α多样性指数的相关性。
2 结果与分析
2.1 沉积物化学性质
不同采样点3种植物区域沉积物化学指标见表1。美人蕉区从进水口至出水口沉积物中铵态氮、速效磷和有机质含量呈下降趋势,芦苇区进水口处速效磷含量高于中部和出水口处,菖蒲区沉积物铵态氮、速效磷和有机质含量则以中部区域为高。美人蕉区硝态氮含量低于其他2种植物相应点位的值。美人蕉区对应点位有机质含量明显较高,芦苇区次之,菖蒲区则最低,这表明3种植物生长区域有机肥力条件不同,这与不同植物的生物量、根系生长和凋落物分解有关。美人蕉生物量较大,根系密集交错分布于沉积物表层,凋落物分解快速,这可能是其区域有机质含量较高的原因[11]。3种植物区沉积物多项化学指标值以中部为最高,这可能与尾水通过路径有关。尾水路径在中部有明显弯曲,且采样点位于凸岸一侧,水流速度减慢,污水中吸附的氮、磷、有机物小颗粒易在此处沉降,导致大部分中部沉积物样品中有机质、氮、磷含量高于进水和出水口。
表1 沉积物化学指标
Table 1 Sediment chemical properties
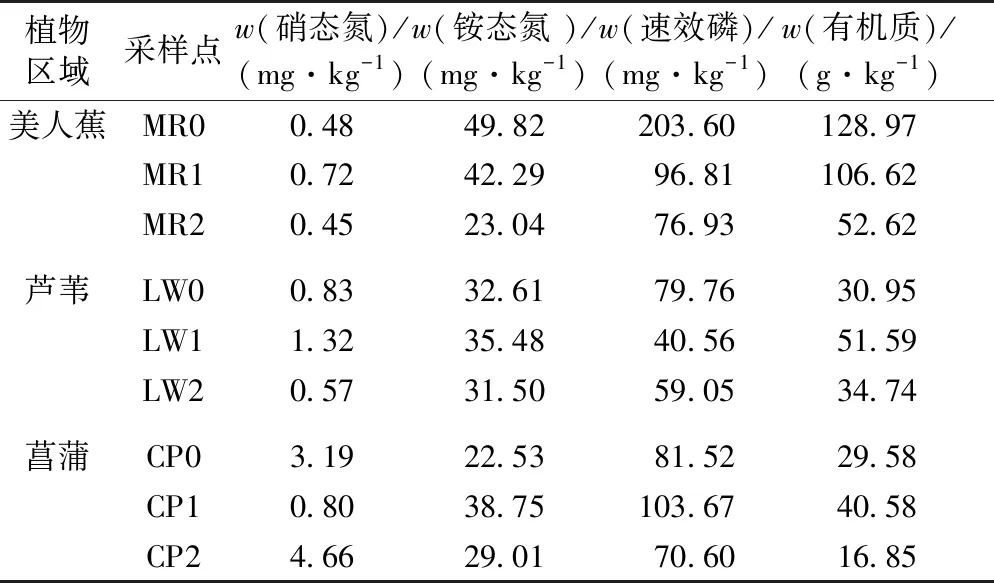
植物区域采样点w(硝态氮)/(mg·kg-1)w(铵态氮 )/(mg·kg-1)w(速效磷)/(mg·kg-1)w(有机质)/ (g·kg-1)美人蕉MR00.4849.82203.60128.97MR10.7242.2996.81106.62MR20.4523.0476.9352.62芦苇LW00.8332.6179.7630.95LW11.3235.4840.5651.59LW20.5731.5059.0534.74菖蒲CP03.1922.5381.5229.58CP10.8038.75103.6740.58CP24.6629.0170.6016.85
2.2 沉积物细菌α多样性
α多样性指数可用于反映群落多样性。根据OTU计算出表征细菌α多样性的Chao 1、ACE和Shannon指数,各指数大小见图2。Chao 1和ACE指数表征群落丰富度,指数越大,群落丰富度就越高;Shannon指数表征群落多样性,指数越大,群落多样性就越高。
分析可知,3种湿地植物区沉积物细菌群落丰富度以湿地中部为最高,在进水处最小,这可能与进水区存在较为复杂的污染物质有关。美人蕉和菖蒲区沉积物细菌群落多样性以出水区为最高。菖蒲区Chao 1、ACE和Shannon指数平均值分别为3 658.37、3 953.88和10.38,都大于芦苇区和美人蕉区,表明菖蒲区沉积物细菌群落的丰富度和多样性均最大。芦苇区Chao 1和ACE指数平均值次之,分别为3 252.94和3 472.94。但芦苇区Shannon指数为9.96,略小于美人蕉区(10.17)。这说明芦苇区沉积物细菌群落丰富度大于美人蕉区,但多样性稍小于美人蕉区。
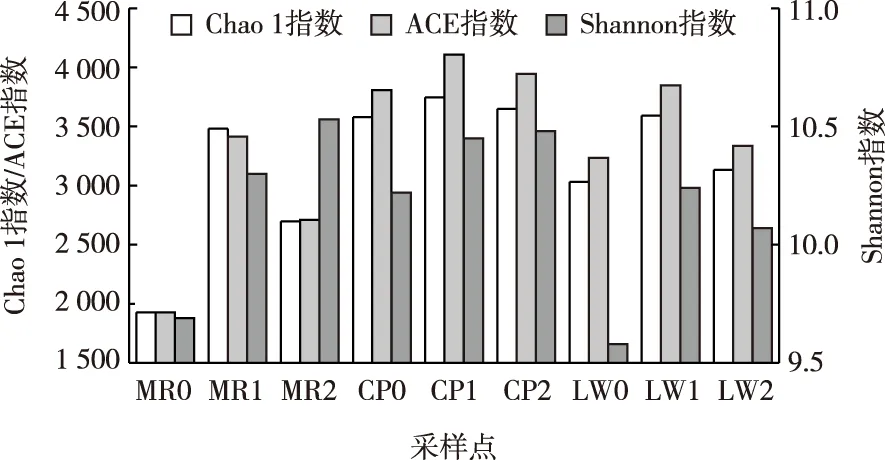
图2 沉积物细菌群落多样性和丰富度
2.3 沉积物细菌群落结构及功能
在门水平上,所得的OTU分属42个门类。由图3可知,9个样点优势菌均为变形菌门(Proteobacteria),平均相对丰度为40.0%。这与WU等[12]对佛山市一处复合人工湿地的研究结果类似。其次为绿弯菌门(Chloroflexi),平均相对丰度为20.8%。相对丰度平均值超过1%的门类还有酸杆菌门(Acidobacteria,9.3%)、放线菌门(Actinobacteria,6.8%)、拟杆菌门(Bacteroidetes,5.0%)、硝化螺旋菌门(Nitrospirae,2.7%)、厚壁菌门(Firmicutes,2.7%)、芽单胞菌门(Gemmatimonadetes,2.7%)、浮霉菌门(Planctomycetes,1.4%)和蓝细菌门(Cyanobacteria,1.0%)。变形菌门下包括α-Proteobacteria(6.36%~15.81%)、β-Proteobacteria(6.0%~14.8%)、γ-Proteobacteria(3.74%~20.4%)、δ-Proteobacteria(5.1%~12.3%)。α-Proteobacteria、β-Proteobacteria和γ-Proteobacteria中含有许多反硝化细菌,可进行自养或异养反硝化[13]。变形菌门丰度在芦苇、菖蒲区较高。
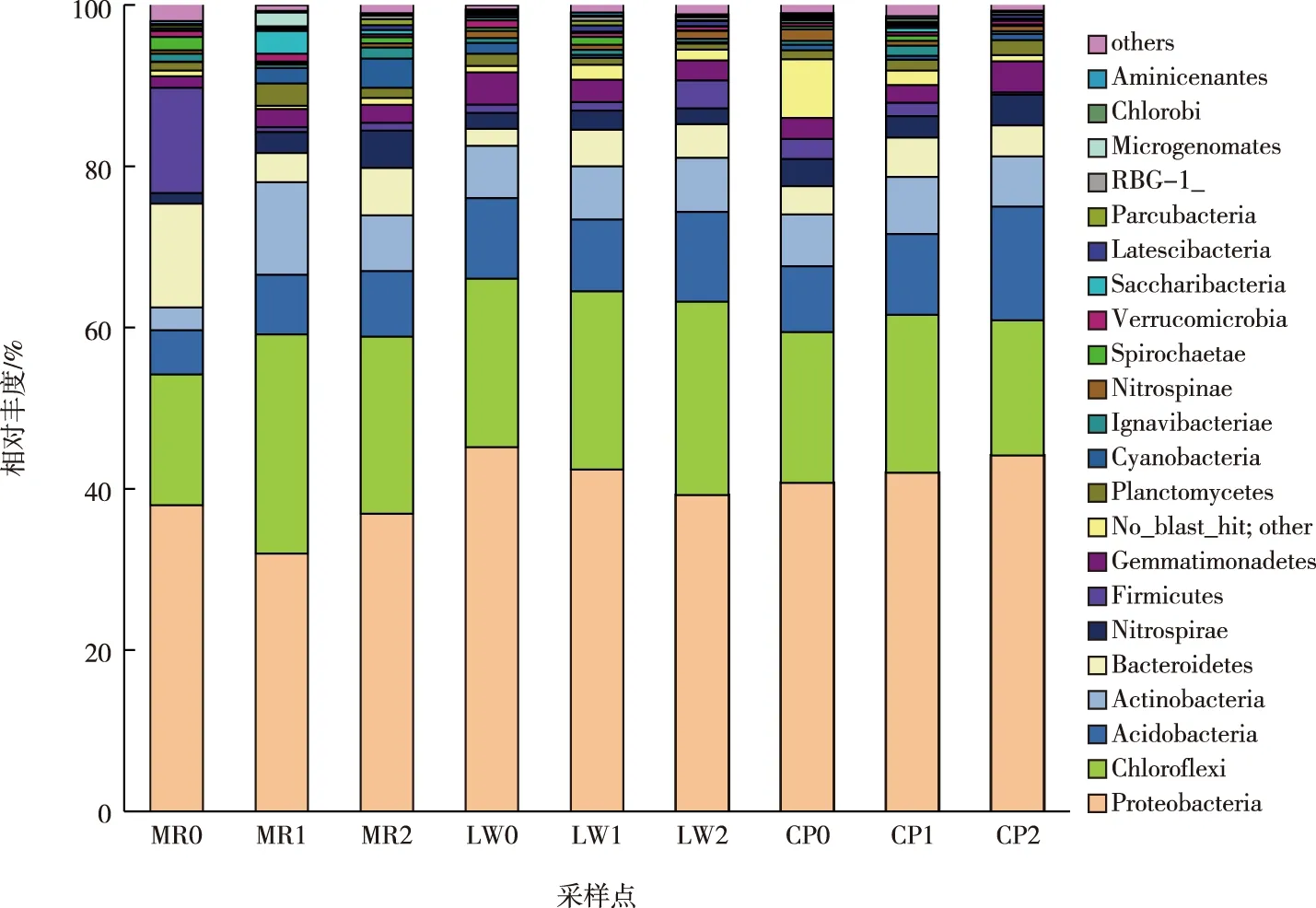
图3 沉积物细菌门水平群落结构
放线菌门和酸杆菌门是重要的根际细菌[14],对土壤生态和植物生长有影响。两者的相对丰度之和均在出水口处达到最大,也许能最大程度地促进该处植物的生长。绿弯菌门与沉积物碳循环有关,具有发酵、固定CO2和乙酸化作用[15]。美人蕉区和芦苇区绿弯菌门丰度沿采样点依次增加,美人蕉区由16.20%增至27.20%,芦苇区由20.90%增至24.00%。菖蒲区绿弯菌门丰度则以中部区域为最大,为19.60%。拟杆菌门和厚壁菌门在各样点的占比差异性较大。在美人蕉区,拟杆菌门和厚壁菌门在进水口处占比较高,分别达12.8%和13.1%,而湿地中部和出水口处2个门类占比下降,分别为3.6%和0.6%以及5.9%和1.0%。其余样点拟杆菌门和厚壁菌门相对丰度均偏低,为0.3%~4.9%。
在属水平上,各沉积物样品中共有344个属。由图4可知,平均相对丰度最高的为厌氧绳菌科(Anaerolineaceae)下的未知属(10.7%),其次为假单胞菌属(Pseudomonas,6.8%),平均相对丰度超过1%的属还有芽单胞菌科(Gemmatimonadaceae)下的未知属(2.1%)、Xanthomonadales_Incertae_Sedis科下的未知属(1.6%)、亚硝化单胞菌科(Nitrosomonadaceae)下的未知属(1.5%)、硝化螺旋菌属(Nitrospira,1.5%)、酸杆菌门(Acidobacteria)下的未知属(1.4%)、脱氯单胞菌属(Dechloromonas,1.3%)、KD4-96纲下的未知属(1.3%)和Bryobacter(1.1%)。

图4 沉积物细菌属水平群落结构
厌氧绳菌科是绿弯菌门下的厌氧细菌且在该门中占主导[16],具有发酵作用,可利用糖类和蛋白质进行代谢生长[17]。厌氧绳菌科下的未知属在美人蕉区占比最高,达7.8%~19.3%,在其他植物区占比则为6.3%~11.5%。大多数假单胞菌为反硝化细菌[18],其中,一部分还存在新型脱氮途径——异养硝化-好氧反硝化,这是一种与硝化-反硝化同时进行的方式[19]。假单胞菌在美人蕉区占比很低,不足1%,但在芦苇和菖蒲区占比较高,最高可达17.4%(芦苇区进水口处),表明芦苇和菖蒲根区可能更有利于脱氮细菌的富集。
微生物去除水中含氮污染物的途径包括氨化、硝化、反硝化和厌氧氨氧化等。硝化细菌可将NH4+/NO2-转变为NO3-。9个样品中平均丰度较高的硝化细菌包含硝化螺旋菌属(Nitrospira)、亚硝化单胞菌科下的未知属(Nitrosomonadaceae_uncultured,亚硝化单胞菌科包含的属均为硝化细菌[20])和硝化杆菌属(Nitrobacter)。反硝化细菌则通过异养或自养反硝化将NO3-最终转化为N2。沉积物样品中丰度较高的反硝化细菌包含假单胞菌属(Pseudomonas)、脱氯单胞菌属(Dechloromonas)、硫杆菌属(Thiobacillus)和红杆菌属(Rhodobacter)等。如图5可知,硝化细菌在美人蕉和菖蒲区分布较多,在MR1和CP2样点丰度均较高(6.48%,6.97%)。
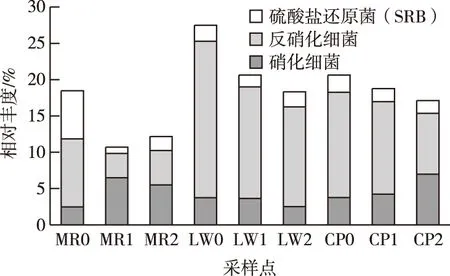
图5 沉积物部分功能细菌相对丰度
反硝化细菌丰度以每个植物区进水口处为最大,可能与进水中含有较多NO3-有关,其丰度在芦苇区进水口处高达21.53%,推测此处反硝化过程最为强烈。值得注意的是,美人蕉区反硝化细菌占比明显低于其他2个植物区,这可能与该区域NO3-含量以及植物生长特征有关。9个样点还检出相当比例的硫酸盐还原菌(SRB,0.86%~6.64%),其是厌氧细菌,可将SO42-还原为H2S,在S和重金属的地球化学循环中起着重要作用。水体中SO42-来源于生活废水、化肥溶解、矿山废水和酸沉降等[21]。过量的SO42-会导致水体酸化,也会对人体健康产生危害[22]。9个沉积物样品中丰度较高的SRB为脱硫杆菌科(Desulfobacteraceae)下的Sva0081_sediment_group(脱硫杆菌科下的菌属均为SRB[23])、脱硫叶菌属(Desulfobulbus)、Desulfobacterium_catecholicum_group和脱硫微菌属(Desulfomicrobium)。SRB在MR0样点占比最高(6.64%),是其他样点的2.8~7.7倍。这同样与水体和沉积物理化特征以及植物的生长特征有关。SRB丰度在每个区域进水口处最大,这可能与进水中SO42-等含量较高有关。
2.4 细菌群落结构相似性分析
选取属水平上相对丰度大于0.5%的细菌制作物种热图,对9个样点细菌群落进行聚类分析,结果见图6。
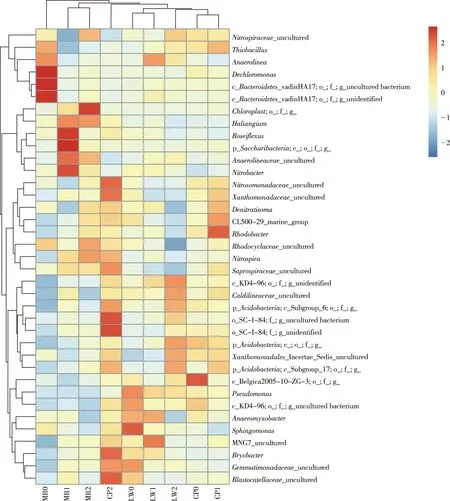
图6 沉积物细菌群落属水平聚类热图
分别用“c_”“o_”“f_”“g_”表示纲、目、科、属水平上的未知细菌。总体来说,可分为MR1、MR2,CP0、CP1和LW0、LW1 共3个分支。可见,相同植物区中沉积物细菌群落结构较为相似,表明植物种类对沉积物细菌群落结构存在显著影响。MR0样点细菌群落与其他样点差异最大,主要原因是此样点分布了较多的脱氯单胞菌属(Dechloromonas,6.44%)、Sporacetigenium(1.88%)、Romboutsia(1.67%)、脱硫盒菌属(Desulfocapsa,1.58%)和脱硫化李子菌属(Desulfoprunum,1.48%)等。脱氯单胞菌属(Dechloromonas)可降解氯酸盐和高氯酸盐,将其还原为氯化物[24]。
由Venn图(图7)可得到3种植物分布区特有和独有的OTU。芦苇和美人蕉区共有759个OTU,芦苇和菖蒲区共有1 447个OTU,美人蕉和菖蒲区共有746个OTU。3种植物区共有2 417个OTU,占OTU总个数的20.38%。独有OTU个数最多的是美人蕉区,达到1 127个。
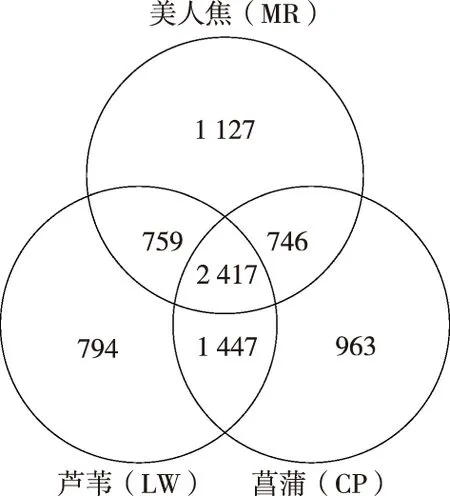
图7 沉积物OTU分布的Venn分析
2.5 细菌群落与沉积物化学指标的关系
对α多样性指数与沉积物化学性质做Pearson相关性分析,结果见表2。
表2 沉积物化学性质与沉积物细菌群落α多样性指数相关性分析
Table 2 Correlation analysis between sediment chemical properties andαdiversity index of bacterial community

α多样性指数硝态氮含量铵态氮含量速效磷含量有机质含量Chao 10.487-0.366-0.713∗-0.611ACE0.515-0.380-0.704∗-0.688∗Shannon0.339-0.420-0.439-0.301
*表示相关显著(P<0.05)。
速效磷含量与Chao 1指数呈显著负相关(P=0.031),速效磷含量和有机质含量与ACE指数也呈显著负相关(P=0.034,P=0.040),说明速效磷含量对细菌群落丰富度具有显著影响,有机质含量对丰富度也有一定影响。但硝态氮、铵态氮含量则与α多样性指数相关性较小。Shannon指数与4个指标无显著相关性,即沉积物这4个化学性质对细菌群落多样性无显著影响。
β多样性用于反映不同样品间细菌群落的差异性,冗余分析则可解释这种差异在多大程度上是由环境因子造成的。对各样点沉积物细菌属水平群落与化学性质做冗余分析,结果见图8。2个轴累积贡献率为35.85%,表明沉积物4个化学指标对细菌群落结构有一定影响。铵态氮含量、速效磷含量和有机质含量与第1主轴呈负相关,硝态氮含量与第1主轴呈正相关。第1主轴的主要影响因子为有机质含量和速效磷含量(P=0.004,P=0.001),相关系数分别为-0.96和-0.83。
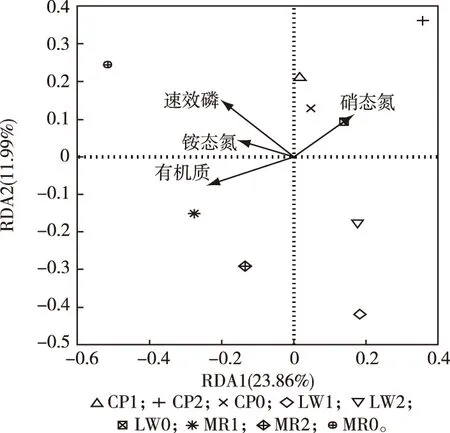
图8 属水平细菌群落与沉积物化学性质的冗余分析
3 讨论
3.1 湿地水生植物类型对细菌群落结构的影响
植物根系是微生物富集和发挥作用的集中场所。不同湿地植物因根的形态与分布、凋落物生物量及其化学性质、泌氧量和根际分泌物等的不同,导致植物根系基质中细菌群落存在差异,进而影响污染物的去除效果并间接影响湿地生态功能[25]。美人蕉、芦苇和菖蒲的根系属于须根系,对沉积物水力特征有较大影响。植物根系通过影响流速、沉降特性、水力传导率等为细菌附着生长提供有利条件[26]。植物凋落物进入水体后,有机质和营养物质等在微生物作用下被分解或矿化,可促进微生物生长。美人蕉、芦苇和菖蒲均为挺水植物,与沉水植物和漂浮植物相比,其凋落物分解较慢[27]。此外,湿地植物通过径向泌氧向水体补充溶解氧,菖蒲和美人蕉的径向泌氧(ROL)速率普遍高于芦苇[28],因此菖蒲和美人蕉浅层根系可能有利于好氧微生物的生长,使得好氧的硝化细菌丰度更高(图5)。湿地植物的根系分泌物为根系微生物提供代谢底物。根系分泌物的产生和累积可使植物形成根际效应,使得根际区细菌数量明显增多,特定功能细菌也会在根系周围聚集[29]。另一方面,水生植物根系分泌的部分化学物质存在化感效应,可抑制藻类和某些微生物的生长[30];一些分泌物还存在杀菌作用,对大肠杆菌(Escherichiacoli)等致病菌去除效果好[31]。湿地中3种不同类型植物产生的根系分泌物的种类和数量不同,从而促进或抑制了不同种类微生物的生长繁殖。微生物又可能通过其次生代谢产物影响根系生长[32]。植物根系的上述作用直接或间接地影响了微生物群落结构。
3.2 湿地沉积物理化因子对细菌群落的影响
环境因子可影响细菌群落特征。3个湿地植物区硝态氮平均值大小与细菌群落α多样性Chao 1和ACE指数大小顺序一致(表1,图2),可能是因为随着硝态氮含量的增加,细菌可利用氮源也增加,促进了细菌的生长,使其群落丰富度提高。沉积物速效磷含量和有机质含量与Chao 1指数或ACE指数呈显著相关。磷和碳源是细菌的重要物质能量来源,在一定程度上可影响细菌群落丰富度。
斗南湿地主要接纳污水处理厂尾水,尾水具有有机物浓度低、硝态氮浓度较高和C/N比值低的特点[33],不利于异养反硝化细菌的生长和脱氮作用的发挥。但斗南湿地底部较厚的沉积物可能向低C/N比值水体释放一定量有机碳,部分补充反硝化细菌所需碳源。因此,湿地中反硝化细菌相对丰度仍较高(图5)。笔者研究考察的硝态氮、铵态氮、速效磷和有机质含量4个指标中,速效磷和有机质含量与β多样性相关(图8),可能是因为硝态氮和铵态氮含量在各植物区间差异较小,对细菌分布影响有限;而速效磷和有机质含量在各植物区间差异较大,且有机质中的糖类作为碳源,是细菌重要的能量物质。尽管如此,笔者研究中冗余分析的前2个主轴解释率较低,合计仅有35.85%,其原因主要是影响沉积物细菌群落的环境因素很多,而滇池湖滨湿地是较为开放的休闲型湿地,微生物群落结构可能受到除上述因素外的其他诸多因素的影响。
4 结论
(1)滇池典型湖滨湿地——斗南湿地中菖蒲区表层沉积物细菌群落多样性和丰富度都大于芦苇区和美人蕉区。各样点优势菌门均为变形菌门和绿弯菌门,平均丰度分别为40.0%和20.8%;属水平上,厌氧绳菌科下的未知属丰度以美人蕉区为最高,而假单胞菌属丰度以菖蒲区和芦苇区为较高。
(2)硝化细菌、反硝化细菌和硫酸盐还原菌3种功能细菌在3种植物区占有显著比例。硝化细菌在美人蕉和菖蒲区的占比高于芦苇区,反硝化细菌在进水口处占比很高,尤其在芦苇区进水口处达21.53%。硫酸盐还原菌在美人蕉进水口处占比高于其他8个样点,相对丰度为6.64%。
(3)聚类分析表明湿地不同点位相同植物群丛作用下沉积物中细菌群落结构较为相似,不同湿地植物对沉积物细菌群落结构存在显著影响。相比于硝态氮和铵态氮含量,速效磷与有机质含量对沉积物细菌群落α多样性指数和群落结构的影响更大。
