脂肪间充质干细胞来源外泌体对缺氧/复氧诱导的心肌细胞凋亡的影响
2020-04-02梁政钟剑锋吴源聪温文陈灿李波
梁政 钟剑锋 吴源聪 温文 陈灿 李波
[摘要] 目的 研究小鼠脂肪間充质干细胞(mASCs)来源外泌体(Exo)对新生小鼠心肌细胞缺氧/复氧(H/R)诱导的心肌细胞凋亡的影响。 方法 采用超高速离心法分离提取mASCs来源Exo(mASCs-Exo),透射电子显微镜(TEM)、纳米颗粒示踪分析技术(NTA)和蛋白质免疫印迹法(WB)观察并鉴定Exo;差速贴壁法提取C57BL/6乳鼠心肌细胞,免疫荧光检测心肌标志蛋白CTnI和conexin43表达;PKH-26标记Exo示心肌细胞摄取能力;实验分为3组:正常对照组(control组)、缺氧/复氧组(H/R组)和缺氧/复氧+mASCs-Exo组(H/R+mASCs-Exo组);TUNEL染色检测心肌细胞凋亡;WB检测凋亡相关蛋白表达水平。 结果 与control组比较,H/R组心肌细胞凋亡率升高(P < 0.01),与H/R组比较,H/R+mASCs-Exo组心肌细胞凋亡率降低(P < 0.05);与control组比较,H/R组p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax比值降低(P < 0.01),而cleaved caspase-9/caspase-9比值升高(P < 0.001);与H/R组比较,H/R+mASCs-Exo组p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax比值升高(P < 0.05或P < 0.01),cleaved caspase-9/caspase-9的比值降低(P < 0.01)。 结论 mASCs-Exo可抑制H/R诱导心肌细胞凋亡,这可能通过激活PI3K/Akt信号通路介导的。
[关键词] 脂肪间充质干细胞;外泌体;C57BL/6乳鼠心肌细胞;缺氧/复氧;PI3K/Akt信号通路
[中图分类号] R541.4 [文献标识码] A [文章编号] 1673-7210(2020)02(b)-0004-05
Effect of the exosomes extracted from adipose-derived mesenchymal stem cells on hypoxia/reoxygenation-induced cardiomyocyte apoptosis
LIANG Zheng ZHONG Jianfeng WU Yancong WEN Wen CHEN Can LI Bo
Department of Cardiology, Affiliated Hospital of Guangdong Medical University, Guangdong Province, Zhanjiang 524000, China
[Abstract] Objective To investigate the effect of mouse adipose-derived mesenchymal stem cells (mASCs) derived exosomes (Exo) on hypoxia/reoxygenation (H/R) induced apopotosis of cardiomyocytes neonatal mouse cardiomyocytes. Methods The mascs-derived Exo (mascs-exo) was isolated and extracted by ultra-high speed centrifugation. The Exo was observed and identified by transmission electron microscopy (TEM), nanoparticle tracer analysis (NTA) and Western blot (WB). C57BL/6 suckled rat cardiomyocytes were extracted by differential adherent method. Expression of CTnI and conexin43 was detected by immunofluorescence. Pkh-26 was labeled Exo to indicate the uptake capacity of cardiomyocytes. The experiment was divided into three groups: normal control group (control group), hypoxia/reoxygenation group (H/R group) and hypoxia/reoxygenation + mascs-exo group (H/R+ mascs-exo group). Apoptosis of was detected by TUNEL staining. The expression level of apoptosis-related protein was detected by WB. Results compared with the control group, the apoptosis rate of cardiomyocytes in the H/R group was increased (P < 0.01), and the apoptosis rate of cardiomyocytes in the H/R+ mascs-exo group was decreased (P < 0.05). Compared with the control group, p-PI3K /PI3K, p-Akt /Akt, and Bcl-2 /Bax were decreased in the H/R group (P < 0.01), while the cleaved caspase-9/caspase-9 ratio was increased (P < 0.01). Compared with H/R group, the ratio of p-PI3K/PI3K, p-Akt /Akt and Bcl-2 /Bax in H/R+ mascs-exo group was increased (P < 0.05 or P < 0.01), and the ratio of cleaved caspase-9/caspase-9 was decreased (P < 0.01). Conclusion mASCs-Exo can inhibit H/R induction of cardiomyocytes apoptosis, which may be mediated by activation of the PI3K/Akt signaling pathway.
[Key words] Adipose-derived mesenchymal stem cells; Exosomes; Primary cardiomyocytes; Hypoxia/reoxygenation; PI3K/Akt signaling pathway
心肌梗死在全世界发病率和死亡率仍居高不下,对个人和社会造成巨大负担[1]。针对心肌梗死目前公认最有效的治疗方法是快速恢复血液灌注降低心肌损伤[2]。虽然及时恢复血液灌注能够挽救濒死心肌,但可引起心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)[3]。尽管已经报道许多干预措施可减轻动物模型MIRI,但临床上尚无有效治疗方法[4]。
近年来再生医学在心肌梗死治疗中表现出巨大的潜力,Wernly等[5]研究显示动物实验中移植干细胞可降低心肌梗死面积,改善心脏功能。研究显示,干细胞主要通过旁分泌起治疗作用。来源外泌体(exosomes,Exo)是细胞旁分泌的一种物质,直径为30~150 nm,内含丰富的蛋白质、脂类、核酸等。大量研究显示[6-8]其在细胞通讯中充当重要的作用,并且可以充当疾病的标志物及治疗剂。已有研究[9]显示间充质干细胞(mesenchyma stem cell,MSC)来源的Exo对MIRI具有治疗作用,但其作用机制如何仍需进一步研究探索。本研究利用原代心肌细胞在体外模拟MIRI,研究mASCs-Exo对H/R诱导的心肌细胞凋亡的影响,并进一步探究其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞株 SPF级C57BL/6小鼠,购自济南朋悦实验动物繁殖有限公司,许可证号:SCXK(鲁)20190003。动物饲养于广东医科大学动物中心,生产许可证号:SCXK(粤)2018-0008。本研究方案在广东医科大学动物伦理委员会审批后实施。小鼠脂肪间充质干细胞株(mASCs)购自广州赛业生物科技有限公司。
1.1.2 实验主要试剂 TUNEL细胞凋亡检测试剂盒(绿色荧光)购自Roche Life Science公司(批号:3900 6700);抗荧光淬灭封片液购自上海碧云天生物技术公司(批号:032819190412);小鼠脂肪干细胞完全培养基购自苏州赛业生物科技有限公司(批号:RASMD-90011);4′,6-二脒基-2-苯基吲哚(DAPI)(批号:D9542-1MG);Akt rAbbit mAb、Phospho-Akt Rabbit mAb、Bcl-2 Mouse mAb、Bax Rabbit mAb、Anti-mouse IgG,HRP-linked antibody、Anti-rabbit IgG,HRP-linked antibody均购自美国 Cell Signaling Technology公司;Anti-CD9 antibody(批号:ab92726)、Recombinant Anti-CD63 antibody(批号:ab217345)购自美国Abcam公司。
1.2 实验方法
1.2.1 mASCs细胞培养及外泌体提取 复苏mASCs细胞,细胞融合至80%~90%用无血清培养基处理48 h,收集上清,4℃、300 g/min离心10 min,2000 g/min离心10 min和10 000 g/min离心30 min。吸取上清120 000 g/min離心90 min得沉淀,PBS洗涤,100 μL PBS重悬,-80℃保存。
1.2.2 C57BL/6原代心肌细胞提取及鉴定 健康3 d内出生C57BL/6乳鼠6只,无菌操作剪取乳鼠心脏置于冰浴PBS溶液中并剪碎。1∶5比例0.25%胰酶吹打混匀,加入混合酶(0.125%胰酶+2%胶原酶Ⅱ)充分吹打,37℃孵育5 min,重复加入混合酶至心肌细胞全部消化,收集上清加入终止液。1000 r/min离心5 min,取沉淀重悬后100目筛网过滤,T75超贴壁培养瓶37℃培养90 min,吸取上清至新的超贴壁培养瓶。第3天观察细胞贴壁和生长搏动情况,并检测conexin43/cTnⅠ心肌标志蛋白表达。
1.2.3蛋白质免疫印迹法(Western blot,WB) 实验分为3组:正常对照组(control组)、缺氧/复氧(H/R)组和缺氧/复氧+mASCs-Exo组(H/R+mASCs-Exo组)收集蛋白样品100℃加热10 min变性,凝胶电泳(SDS-PAGE)使蛋白分离。90 V 120 min恒压转膜,5%脱脂牛奶封闭1 h;根据分子量大小剪切目的条带;4℃一抗孵育过夜;第2天室温复温1 h,TBST缓冲液洗膜,加入抗兔或小鼠的IgG,室温孵育1 h;洗膜后加入发光液曝光拍片。
1.2.4 TUNEL染色 共聚焦皿接种细胞,生长融合至70%~80%处理细胞,免疫染色固定液固定30 min,0.2% Triton-X100通透液孵育30 min;TdT与dUTP按1∶9比例避光配置,100 μL/孔,暗湿盒孵育1 h;DAPI(1∶2000)孵育40 min;抗荧光猝灭封片液封片避光保存,荧光拍摄。
1.2.5 PKH-26标记Exo PKH-26红色荧光标记试剂盒(Sigma-Aldrich)标记mASCs-Exo,与心肌细胞共孵育。4%多聚甲醛固定15 min,DAPI染核,抗荧光猝灭封片液封闭保存,荧光拍摄。
1.3 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用均值±标准差(x±s)表示,3次重复独立实验,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 mASCs-Exo分离和鉴定
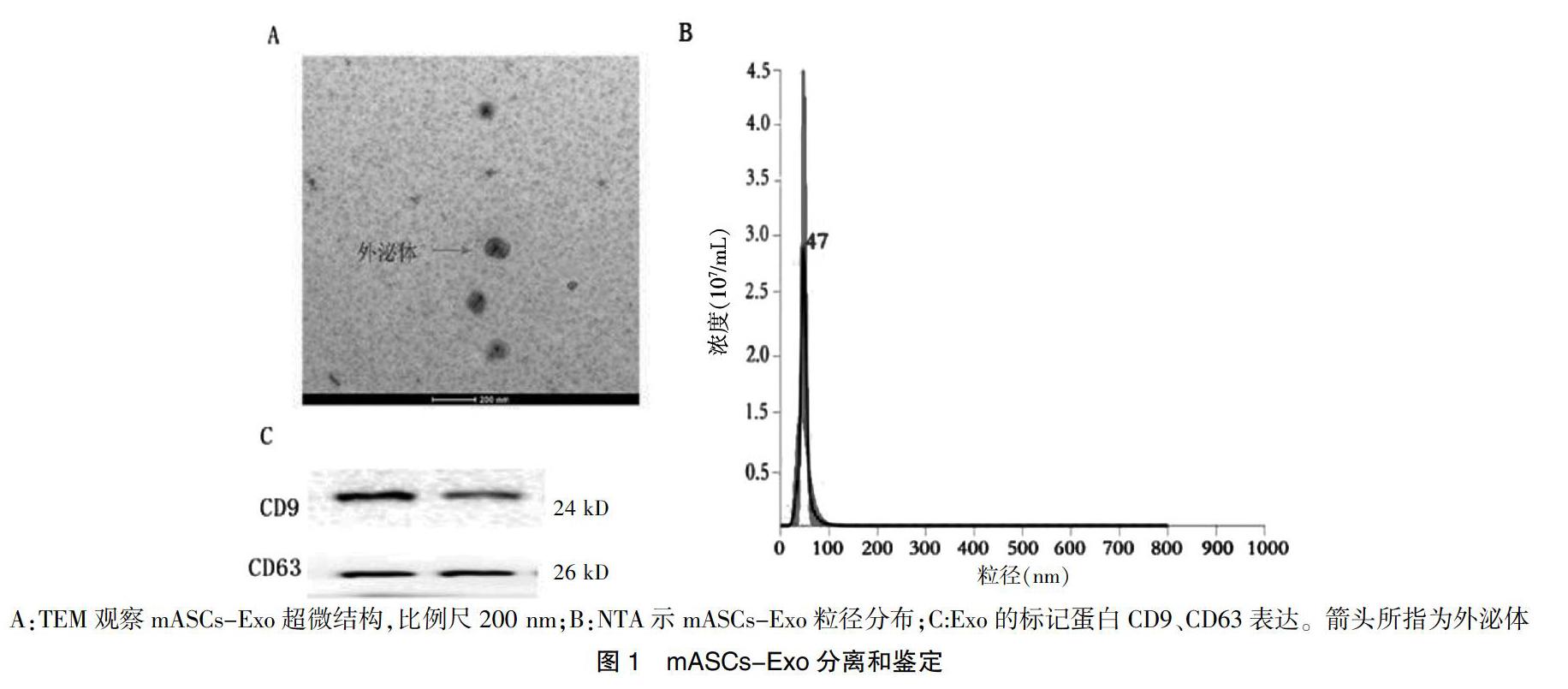
透射电子显微镜(TEM)下观察mASCs-Exo呈圆形囊泡状,质膜边缘清晰,中间颜色较边缘深(图1A)。纳米颗粒示踪分析技术(NTA)结果显示粒子大小在30~120 nm范围,平均(47.5±0.5)nm,与Exo特征一致(图1B)。WB显示Exo特异性标志蛋白CD9/CD63阳性表达(图1C)。分离获得的囊泡即为Exo。
2.2 小鼠原代心肌细胞提取和鉴定
2.2.1 小鼠原代心肌细胞形态观察与鉴定 光镜下观察心肌细见刚分离单个未贴壁心肌细胞结构完整,呈圆形,恒温培养2 d后大部分心肌细胞贴壁,细胞分散,呈椭圆形或菱形,中央高亮,出现自主搏动,频率缓慢(4~15次/min)。4 d后细胞融成集落,搏动频率一致且呈放射状(30~50次/min)。7 d后观察细胞搏动频率减弱,体积缩小并逐渐脱落(图2A,封三)。三色免疫荧光鉴定心肌细胞纯度。红色荧光标记conexin43,绿色荧光标记CTnI,蓝色荧光为DAPI染细胞核。心肌细胞阳性率为(94.3±4.2)%(n = 5)(图2B,封三)。
2.3 mASCs-Exo对H/R诱导心肌细胞凋亡的影响
2.3.1 Exo标记和心肌细胞摄取 PKH-26标记mASCs-Exo,与心肌细胞共孵育0、12、24 h,DAPI复染细胞核。在12 h出现心肌细胞摄取PKH-26标记mASCs-Exo,且红色荧光信号随着时间增强,24 h时绝大部分心肌细胞显示红色荧光(图3,封三)。
2.3.2 TUNEL法检测mASCs-Exo对H/R诱导心肌细胞凋亡影响 与control组比较,H/R组和H/R+mASCs-Exo组凋亡率明显升高(P < 0.01);与H/R组比较,H/R+mASCs-Exo组细胞凋亡率降低(P < 0.05)(图4,封三)。
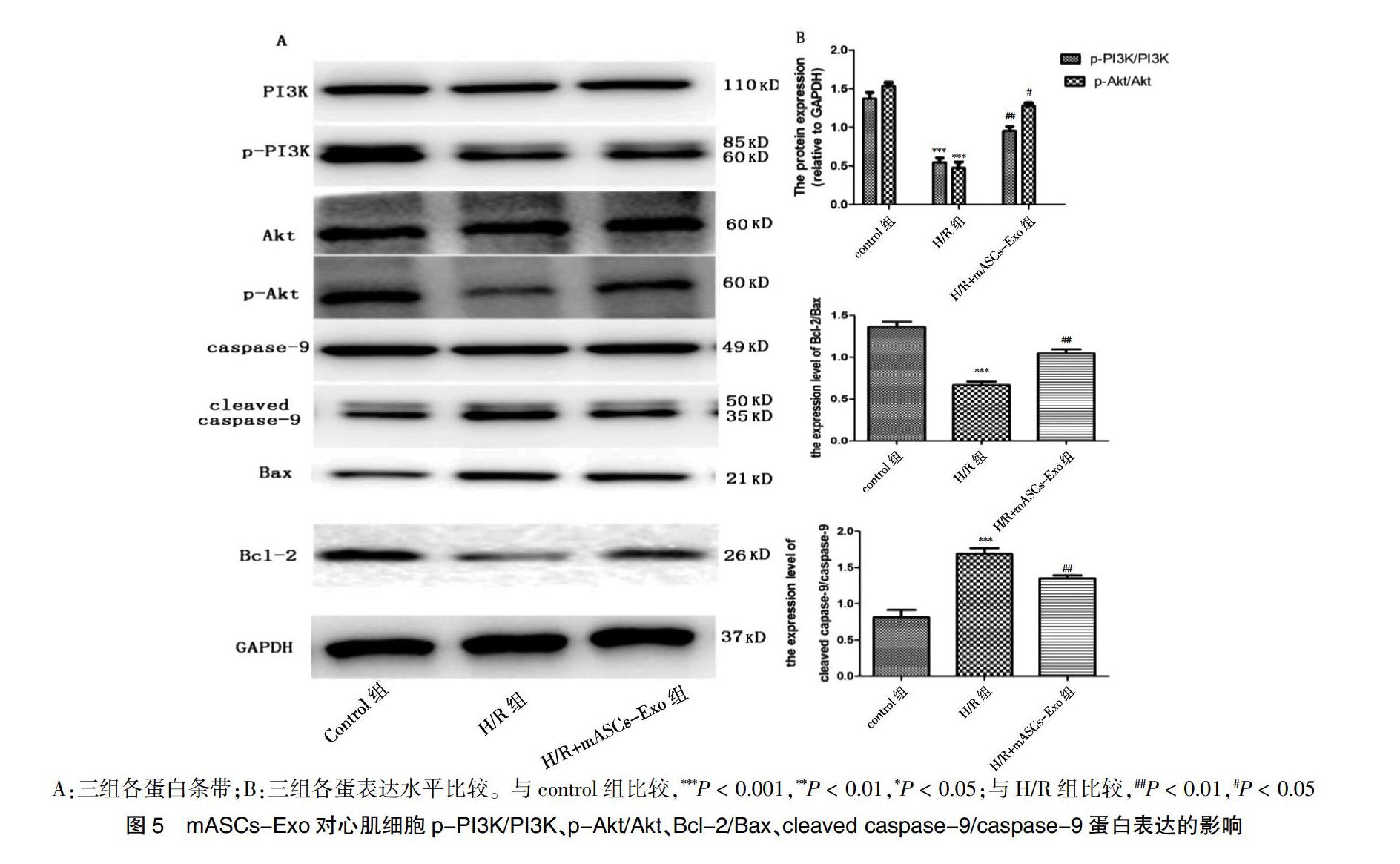
2.3.3 mASCs-Exo对心肌细胞p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax、cleaved caspase-9/caspase-9蛋白表达的影响 与control组比较,H/R组p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax比值显著下降(P < 0.01),而cleaved caspase-9/caspase-9比值增加(P < 0.01);H/R+mASCs-Exo组p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax比值下降(P < 0.01或P < 0.05),cleaved caspase-9/caspase-9比值增加(P < 0.01);与H/R组比较,H/R+mASCs-Exo组p-PI3K/PI3K、p-Akt/Akt、Bcl-2/Bax比值升高(P < 0.01或P < 0.05),cleaved caspase-9/caspase-9的比值降低(P < 0.01)。见图5。
3 讨论
MIRI损伤过程复杂,涉及线粒体功能障碍,氧化应激和炎症等分子机制,这些机制导致心脏结构和功能损伤[10]。但针对这些机制进行干预尚未证明可有效预防 MIRI[11]。近年来,基于干细胞疗法在心血管疾病中受到了极大的关注,并且已应用到临床试验中[12]。MSCs因其具有多向分化潜能、免疫调节特性及容易在体外分离和扩增的特性,可能成为最具临床前景的干细胞[13]。多项研究显示,应用MSC植入能减轻MIRI[14-15]。然而,研究提示MSC治疗MIRI仅1%干细胞有效发挥作用[16]。進一步研究发现,干细胞降低MIRI损伤是通过旁分泌介导的[17]。使用干细胞来源的Exo可能比单纯使用活细胞具有更加可观的优势[18]。本研究采用mASCs-Exo预处理对H/R诱导损伤的心肌细胞,发现H/R处理心肌细胞凋亡显著增加,而mASCs-Exo后心肌细胞的凋亡明显减少,提示mASCs-Exo可以通过抑制心肌细胞凋亡从而减轻MIRI损伤。
MIRI过程中,不同时期可能激活了不同的病理信号,从而通过多种机制导致心脏损伤[19]。PI3K/Akt途径是体内重要的信号转导途径,在细胞存活、增殖和凋亡中起着重要作用。PI3K激活催化了磷脂酰肌醇(3,4,5)-三磷酸的产生,其在膜上积累并激活磷酸化Akt。磷酸化Akt则增加了抗凋亡蛋白表达,抑制促凋亡蛋白表达[20]。mASCs-Exo预处理H/R损伤心肌细胞,发现PI3K/Akt激活,抗凋亡蛋白Bcl-2水平显著增加,而促凋亡蛋白Bax及caspase-9(cleaved caspase-9是其激活形式)表达减少。因此,结果提示mASCs-Exo抑制H/R后心肌细胞的凋亡可能是通过激活PI3K/Akt途径介导的。
本研究仍然存在一些局限性,虽然研究采用乳鼠原代心肌细胞作为体外实验细胞,对比使用稳定细胞系H9C2实验结果更加可靠。但是H/R损伤模型只是在体外模拟MIRI损伤,与实际体内复杂环境仍然存在差异,需要进一步补充体内实验。在机制研究上,通过WB验证了PI3K/Akt及凋亡相关蛋白水平的表达情况,如果再使用PI3K/Akt抑制剂进行反向验证,会使实验结果更加可靠。
总之,本研究提示,使用mASCs-Exo处理H/R损伤的心肌细胞可以激活PI3K/Akt信号,上调Bcl-2蛋白,下调caspase-9和Bax蛋白的表达,从而抑制心肌细胞凋亡达到保护心脏作用。本研究将为临床治疗MI/R损伤提供新方法和理论基础。
[参考文献]
[1] Benjamin EJ,Blaha MJ,Chiuve SE,et al. Heart Disease and Stroke Statistics-2017 Update:A Report From the American Heart Association [J]. Circulation,2017,135(10):e146-e603.
[2] Anderson JL,Morrow DA. Acute Myocardial Infarction [J]. N Engl J Med,2017,376(21):2053-2064.
[3] Patil KD,Halperin HR,Becker LB. Cardiac arrest:resuscitation and reperfusion [J]. Circ Res,2015,116(12):2041-2049.
[4] Chin KY,Qin C,May L.,et al. New Pharmacological Approaches to the Prevention of Myocardial Ischemia-Reperfusion Injury [J]. Curr Drug Targets,2017,18(15):1689-1711.
[5] Wernly B,Mirna M,Rezar M,et al. Regenerative Cardiovascular Therapies:Stem Cells and Beyond [J]. Int J Mol Sci,2019,20(6):1420.
[6] Wei Z,Qiao S,Zhao J,et al. miRNA-181a over-expression in mesenchymal stem cell-derived exosomes influenced inflammatory response after myocardial ischemia-reperfusion injury [J]. Life Sci,2019,232:116632.
[7] Pegtel DM,Gould SJ. Exosomes [J]. Annu Rev Biochem,2019,88:487-514.
[8] Davidson SM,Takov K,Yellon DM. Exosomes and Cardiovascular Protection. Cardiovasc [J]. Drugs Ther,2017, 31:77-86.
[9] Zhang H,Xiang M,Meng D,et al. Inhibition of Myocardial Ischemia/Reperfusion Injury by Exosomes Secreted from Mesenchymal Stem Cells [J]. Stem Cells Int,2016,2016:4328362.
[10] Huang S,Frangogiannis NG. Anti-inflammatory therapies in myocardial infarction:failures,hopes and challenges [J]. Br J Pharmacol,2018,175(9):1377-1400.
[11] Li Y,Chen B,Yang X,et al. S100a8/a9 Signaling Causes Mitochondrial Dysfunction and Cardiomyocyte Death in Response to Ischemic/Reperfusion Injury [J]. Circulation,2019,140(9):751-764.
[12] Goradel NH,Hour FG,Negahdari B,et al. Stem Cell Therapy:A New Therapeutic Option for Cardiovascular Diseases [J]. J Cell Biochem,2018,119(1):95-104.
[13] Golpanian S,Wolf A,Hatzistergos KE,et al. Rebuilding the damaged heart: mesenchymal stem cells,cell-based therapy,and engineered heart tissue [J]. Physiol Rev,2016,96:1127-1168.
[14] Hong HS,Kim S,Lee S,et al. Substance-P Prevents Cardiac Ischemia-Reperfusion Injury by Modulating Stem Cell Mobilization and Causing Early Suppression of Injury-Mediated Inflammation [J]. Cell Physiol Biochem,2019,52(1):40-56.
[15] Takamura M,Usui S,Inoue O,et al. Adipose-derived regenerative cells exert beneficial effects on systemic responses following myocardial ischemia/reperfusion [J]. Cardiol J,2016,23(6):685-693.
[16] Vizoso FJ,Eiro N,Cid S,et al. Mesenchymal Stem Cell Secretome:Toward Cell-Free Therapeutic Strategies in Regenerative Medicine [J]. Int J Mol Sci,2017,18(9)Pii:E1852.
[17] Zhao J,Li X,Hu J,et al. Mesenchymal stromal cell-derived exosomes attenuate myocardial ischaemia-reperfusion injurythrough miR-182-regulated macrophage polarization [J]. Cardiovasc Res,2019,115(7):1205-1216.
[18] Mendt M,Rezvani K,Shpall E. Mesenchymal stem cell-derived exosomes for clinical use [J]. Bone Marrow Transplant,2019,54(Suppl 2):789-792.
[19] Jovanovi A. Cardioprotective signalling: Past,present and future [J]. Eur J Pharmacol,2018,833:314-319.
[20] Shu Z,Yang Y,Yang L,et al. Cardioprotective effects of dihydroquercetin against ischemia reperfusion injury by inhibiting oxidative stress and endoplasmic reticulum stress-induced apoptosis via the PI3K/Akt pathway [J]. Food Funct,2019,10(1):203-215.
(收稿日期:2019-09-26 本文編辑:刘永巧)
