不同HbA1c水平2型糖尿病患者的胰岛细胞功能比较
2020-04-02王春华苏建彬王雪琴
王春华,苏建彬,王雪琴
0 引 言
糖尿病是一组由多种病因导致以慢性高血糖为特征的终身性代谢性疾病,很多因素参与糖尿病的发生发展,如饮食习惯、血脂异常、激素水平紊乱等,发病率在世界范围内呈上升趋势[1-3]。糖尿病的急慢性并发症不仅可影响患者的生活质量甚至可危及患者生命。目前中国成年人糖尿病患病率为11.6%,而约有一半的中国人处于糖尿病边缘[4]。糖尿病是一种“双激素”疾病,其发病不仅与胰岛素分泌及作用有关,同时与胰高血糖素(glucagon,GLA)密切相关,两者在血糖调节及能量代谢等方面的作用日益受到重视[5]。2016年美国糖尿病协会(ADA)指南糖尿病诊断主要基于空腹血糖(FPG)、口服75 g葡萄糖耐量试验(75 g OGTT)、2小时血糖(2hPG)以及糖化血红蛋白(hemoglobin Alc,HbA1c),由于国内有关HbA1c水平在种族差异、不同人群、不同年龄段的诊断切点及有效性等方面仍存在较多争议,限制了HbA1c在国内的广泛应用[6]。但HbA1c反映既往3个月左右血糖波动水平,与糖尿病的慢性并发症关系密切相关[7]。而HbA1c水平与糖尿病患者的血浆C肽、GLA水平的关系报道却较少。本研究主要目的在于了解2型糖尿病患者不同水平的HbA1c与血浆C肽、GLA变化的关系,探讨血糖控制与2型糖尿病患者胰岛α、β细胞功能的关系。
1 资料与方法
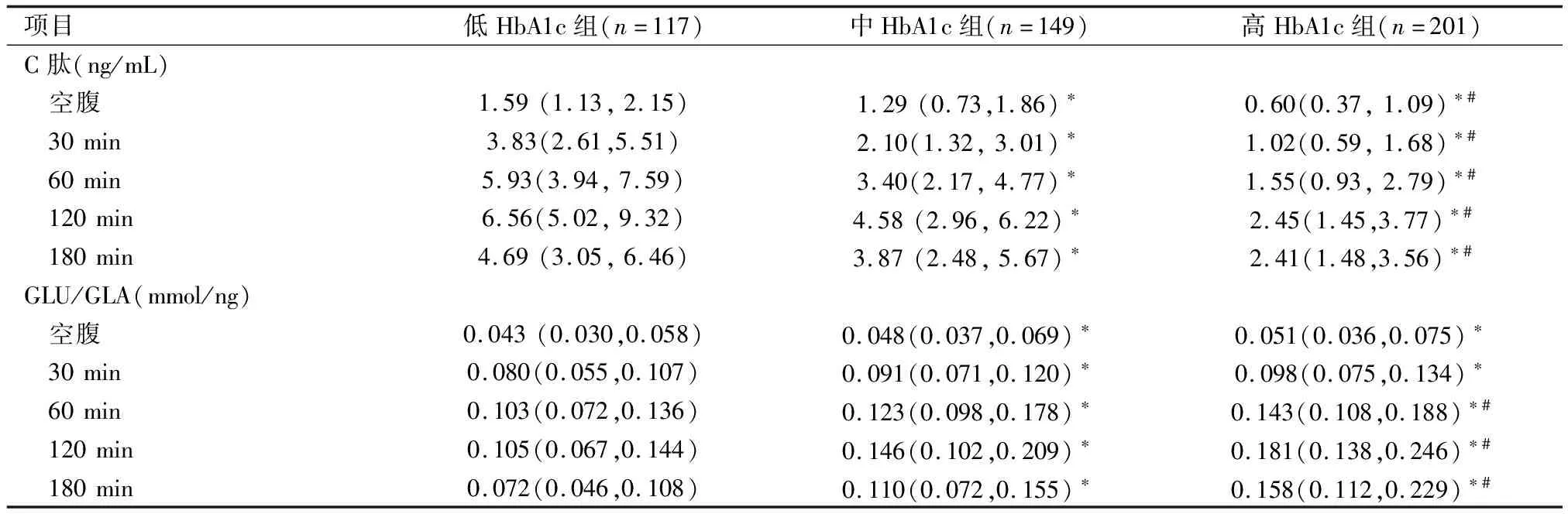
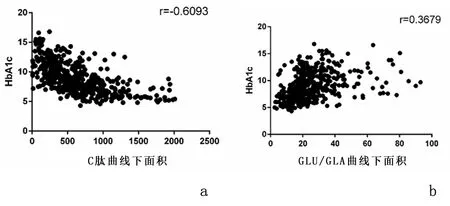
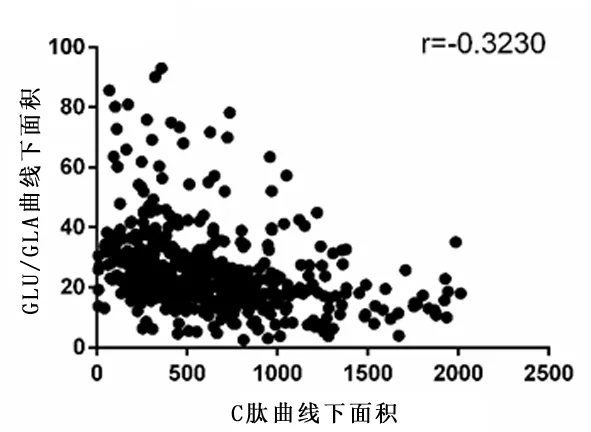
1.1 研究对象回顾性分析2016年1月至2017年7月在南通市第一人民医院内分泌科住院就诊的467例2型糖尿病患者临床资料。纳入标准:符合2007年中国2型糖尿病防治指南诊断标准:糖尿病症状+空腹血糖≥7 mmol/L(或随机血糖≥11.1 mmol/L,或葡萄糖负荷后2 h血糖≥11.1 mmol/L)。排除标准:1型糖尿病;糖尿病急性并发症如糖尿病酮症酸中毒、糖尿病高渗性昏迷;合并有严重感染性疾病;合并恶性肿瘤、结核活动期等消耗性疾病;有严重肝肾功能损害、贫血、急性心脑血管事件;近期使用糖皮质激素等影响血糖波动。根据HbA1c水平分为3组,即HbA1c≤7%组(低HbA1c组)117例、7.0% 1.2研究方法统计受试者的身高、体重、收缩压、舒张压。空腹12 h后取静脉血,全自动生化分析仪(日立7600)测量肝肾功能、血脂、尿酸、血糖。糖化血红蛋白分析仪(美国BIO-RAD10)检测HbA1c(HPLC法)。放免计数器(SN-697γ)检测GLA。使用APVIA Centanv xp检测C肽(直接化学发光法)。行75 g OGTT前1天停用胰岛素及胰岛素促泌剂并禁食12 h,分别检测空腹及口服75 g葡萄糖后30、60、120、180 min后的血糖(GLU)、C肽和GLA。采用同一时点GLU与GLA的比值(GLU/GLA)矫正高血糖对GLA的抑制作用。比较各组各时间点C肽曲线下面积(AUCC肽)、GLU/GLA曲线下面积(AUCGLU/GLA)的变化。曲线下面积(area under the curve,AUC)计算公式: AUC=15×空腹值+30×(30 min值+180 min值)+45×60 min值+60×120 min值 2.1 一般资料的比较3组性别构成、年龄、三酰甘油、血红蛋白比较差异无统计学意义(P>0.05),3组随HbA1c的逐步升高,低密度脂蛋白胆固醇(LDL-C)逐步升高,糖尿病病程时间逐步延长,差异有统计学意义(P<0.05)。随着HbA1c的逐步升高,高密度脂蛋白胆固醇(HDL-C)、尿酸逐步下降,差异有统计学意义(P<0.05)。中HbA1c组的收缩压、舒张压、BMI均高于低HbA1c组及高HbA1c组,差异有统计学意义(P<0.05)。见表1。 2.2空腹及OGTT后各时间点C肽及GLU/GLA比较随着HbA1c的逐步升高,空腹及OGTT后各时间点的C肽呈现逐步下降趋势,差异有统计学意义(P<0.05),各组均于口服75 g葡萄糖后120 min达高峰。随着HbA1c的逐步升高,中HbA1c组与高HbA1c组空腹及OGTT后30 min的GLU/GLA虽逐步上升,但差异无统计学意义(P>0.05),其余各组各时间点的GLU/GLA呈逐步上升趋势,差异亦有统计学差异(P<0.05),各组均于口服75 g葡萄糖后120 min达高峰。见表2。 2.3AUCC肽及AUCGLU/GLA的比较3组AUCC肽及AUCGLU/GLA变化与各时间点C肽及GLU/GLA变化的趋势相一致,随着HbA1c的逐步升高,AUCC肽呈现逐步下降趋势,而AUCGLU/GLA呈现逐步升高趋势,差异均有统计学意义(P均<0.05)。见表3。 表1 不同HbA1c水平2型糖尿病患者一般资料比较 项目低HbA1c组(n=117)中HbA1c组(n=149)高HbA1c组(n=201)P值男/女(n)53/6483/66112/890.1480年龄(岁)51.74±15.9453.85±13.1955.23±15.080.1272体重指数(kg/m2)25.0±3.8026.01±3.9324.53±3.160.0085收缩压(mmHg)130.50±16.65135.91±18.18132.65±15.490.0284舒张压(mmHg)75.97±9.9779.44±10.5778.95±10.770.0167三酰甘油(mmol/L)1.59(1.02,2.61)1.84(1.18,2.97)1.71(1.05,2.66)0.0705总胆固醇(mmol/L)4.28(3.81,5.03)4.68(4.06,5.47)4.64(3.73,5.20)0.0099LDL-C(mmol/L)2.22(1.94,2.78)2.54(1.96,3.21)2.56(1.91,2.99)0.0296HDL-C(mmol/L)1.14(0.91,1.35)1.05(0.89,1.25)0.98(0.82,1.17)0.0022尿酸(mmol/L)313.50(235.50,395.00)297.00(251.00,351.00)276.50(220.50,328.50)0.0019血红蛋白(g/L)141.1±13.2139.6±15.2143.7±14.50.7531病程(年)4.01±5.874.81±5.726.22±6.580.0096 1 mmHg=0.133 kPa 表2 不同HbA1c水平2型糖尿病患者空腹及OGTT后各时间点C肽、GLU/GLA的比较[M(QL,Qu)] 项目低HbA1c组(n=117)中HbA1c组(n=149)高HbA1c组(n=201)C肽(ng/mL) 空腹1.59(1.13,2.15)1.29(0.73,1.86)∗0.60(0.37,1.09)∗# 30min3.83(2.61,5.51)2.10(1.32,3.01)∗1.02(0.59,1.68)∗# 60min5.93(3.94,7.59)3.40(2.17,4.77)∗1.55(0.93,2.79)∗# 120min6.56(5.02,9.32)4.58(2.96,6.22)∗2.45(1.45,3.77)∗# 180min4.69(3.05,6.46)3.87(2.48,5.67)∗2.41(1.48,3.56)∗#GLU/GLA(mmol/ng) 空腹0.043(0.030,0.058)0.048(0.037,0.069)∗0.051(0.036,0.075)∗ 30min0.080(0.055,0.107)0.091(0.071,0.120)∗0.098(0.075,0.134)∗ 60min0.103(0.072,0.136)0.123(0.098,0.178)∗0.143(0.108,0.188)∗# 120min0.105(0.067,0.144)0.146(0.102,0.209)∗0.181(0.138,0.246)∗# 180min0.072(0.046,0.108)0.110(0.072,0.155)∗0.158(0.112,0.229)∗# 与低HbA1c组比较,*P<0.05;与中HbA1c组比较,#P<0.05 表3 不同HbA1c水平2型糖尿病患者AUCC肽及AUCGLU/GLA的比较[M(QL,Qu)] 项目低HbA1c组(n=117)中HbA1c组(n=149)高HbA1c组(n=201)AUCC肽960.30(726.75,1259.85)636.90(437.55,860.70)∗332.10(214.65,524.10)∗#AUCGLU/GLA16.61(12.47,22.14)20.99(16.51,29.32)∗25.61(20.29,35.87)∗# AUCC肽:C肽曲线下面积;AUCGLU/GLA:GLU/GLA曲线下面积 与低HbA1c组比较,*P<0.05;与中HbA1c组比较,#P<0.05 2.4HbA1c与AUCC肽、AUCGLU/GLA的相关性分析Pearson相关分析结果显示,HbA1c与AUCC肽呈负相关(r=-0.6093,P<0.05),HbA1c与AUCGLU/GLA呈正相关(r=0.3679,P<0.05),见图1。以AUCC肽、AUCGLU/GLA、BMI、血压、总胆固醇、LDL-C、HDL-C、尿酸、病程作为自变量,以HbA1c为因变量进行多元逐步回归分析,结果提示HbA1c与AUCC肽呈负相关[β(SE)=-0.0031(0.0002),P<0.05],HbA1c与AUCGLU/GLA呈正相关[β(SE)=0.0359(0.0057),P<0.05]。 a: C肽曲线下面积;b: GLU/GLA曲线下面积 图1 2型糖尿病患者HbA1c与C肽曲线下面积、GLU/GLA曲线下面积的相关性 2.5AUCC肽与AUCGLU/GLA的相关性分析进一步将AUCC肽及AUCGLU/GLA行Pearson相关分析结果显示,AUCC肽与AUCGLU/GLA呈负相关(r=-0.3230,P<0.05),见图2。以AUCC肽、HbA1c、BMI、血压、总胆固醇、LDL-C、HDL-C、尿酸、病程作为自变量,以AUCGLU/GLA为因变量进行多元逐步回归分析,结果提示AUCC肽与AUCGLU/GLA呈负相关[β(SE)=-0.0133(0.0023),P<0.05]。进一步将AUCC肽10等分,作为等级变量入模型,结果示[β(SE)=-2.0558(0.3315),P<0.05],提示随着AUCC肽每下降10%,AUCGLU/GLA上升2.0558(数值),由于AUCGLU/GLA平均值为26.5,即AUCC肽每下降10%,AUCGLU/GLA上升7.8%。 图2 2型糖尿病患者C肽曲线下面积与GLU/GLA曲线下面积的相关性 HbA1c是血红蛋白与糖类结合发生不可逆的非酶促反应的产物。其浓度主要取决于血红蛋白与葡萄糖,可反映过去3~4个月的平均血糖水平,不受饮食、运动及降糖药物等因素的影响[8-10]。早在2002年美国糖尿病学会(ADA)就将HbA1c作为控制血糖的“金指标”。从2010年起,ADA将HbA1c≥6.5%作为糖尿病的诊断标准之一。本研究发现3组在性别构成、年龄、三酰甘油、血红蛋白等均无明显统计学差异,但HbA1c与HDL-C、LDL-C密切相关,随HbA1c逐步升高,HDL-C呈现逐步下降,LDL-C逐步升高,3组之间存在统计学差异(P<0.05),与英国前瞻性糖尿病研究(UKPDS)研究发现HbA1c、HDL-C、LDL-C均与糖尿病大血管并发症密切相关相符合。本研究还观察到随HbA1c水平逐步升高,尿酸呈现逐步下降趋势,3组间差异有统计学意义(P<0.05),其可能的机制为,虽2型糖尿病患者,因为胰岛素抵抗及糖酵解中间产物向5-磷酸核糖转移,使得血尿酸产生增多,但高血糖导致的血渗透压升高使肾血流量增加,尿酸通过肾脏排泄增多,同时近端肾小管对尿酸的重吸收因为尿糖的增多而降低,使得血尿酸降低。 胰岛细胞主要由胰岛α细胞和β细胞组成,α细胞分泌GLA,具有升糖的作用,β细胞分泌胰岛素,具有降糖作用,机体的葡萄糖代谢调节由两者共同参与完成,即为目前研究较热的“双激素”模式[11]。而血糖升高是因为“双激素”模式改变而引起的,由于胰岛α细胞和胰岛β细胞功能改变,使血糖赖以稳定的GLA与胰岛素的比值改变从而导致高血糖。 GLA是“双激素”学说中糖代谢调控的主要升糖激素,健康人GLA在餐后30 min略升高,而后逐渐下降,至180 min稍低于空腹水平[12]。GLA最为有效的调节因素为葡萄糖,但严重的高血糖状态对胰岛α细胞有糖毒性,使α细胞产生近似于对血糖无反应的状态,葡萄糖丧失抑制GLA分泌的能力,本研究使用GLU/GLA矫正高血糖对GLA的抑制作用用来评价胰岛α细胞功能。 “双激素”学说中主要的降糖激素为胰岛素,胰岛素和C肽水平测定均是评价胰岛β细胞胰岛素分泌功能的重要方法。胰岛素是由胰岛β细胞合成其前体,经加工分泌的降糖激素。C肽亦是胰岛β细胞的分泌产物,它和胰岛素有一个共同的前体-胰岛素原。一个分子的胰岛素原在特殊的作用下,裂解成一个分子的胰岛素和一个分子的C肽,理论上C肽和胰岛素是等同分泌的,但C肽不被肝脏摄取,半衰期较胰岛素长,且不受体内产生的胰岛素抗体和外源性胰岛素的干扰[13],本研究使用血浆C肽水平代替胰岛素反映胰岛β细胞功能,3 h内 C肽曲线下面积反应总体胰岛素分泌指标[14]。 本研究观察到随HbA1c逐步升高,3组各时间点C肽及C肽曲线下面积均有统计学差异(P<0.05),且HbA1c与AUCC肽呈负相关(r=-0.6093,P<0.05),3组HbA1c与GLU/GLA及AUCGLU/GLA亦均有统计学差异(P<0.05),呈正相关(r=0.3679,P<0.05),且多元回归分析亦呈现相同结果,其机制可能为HbA1c随血糖浓度的升高而升高,对于糖尿病患者来讲,空腹血糖及餐后血糖对HbA1c均有影响。有研究[15]认为GLA/胰岛素是调节空腹血糖水平的主要因素,随着胰岛素的分泌减少和GLA的异常高分泌,空腹血糖可明显升高,同时对于正常人进餐后30 min时胰岛素水平迅速升高5~10倍,此时无论GLA是否受抑制均可导致肝脏门静脉中GLA/胰岛素明显下降,可维持正常血糖。而对于2型糖尿病患者由于胰岛素第一时相分泌减弱,胰岛素仅升高2~3倍,无法抑制GLA的分泌,导致GLA异常高分泌,GLA/胰岛素升高,从而使餐后血糖明显升高。空腹及餐后血糖的升高导致全天血糖浓度明显升高进而导致HbA1c升高。 本研究发现AUCGLU/GLA的上升与AUCC肽的下降具有相关性(r=-0.3230,P<0.05),且具体阐述了随AUCC肽(即胰岛β细胞功能)每下降10%,AUCGLU/GLA(即胰岛α细胞功能)升高7.8%。其可能的机制为2型糖尿病患者绝大部分均存在胰岛素抵抗和胰岛素分泌的绝对或相对不足,α细胞表面亦存在胰岛素抵抗,葡萄糖需要在胰岛素的作用下进入α细胞代谢产生能量,从而抑制GLA的分泌,但存在胰岛素抵抗时,进入α细胞的葡萄糖不能产生足够的能量,不能有效抑制α细胞分泌GLA;而GLA水平的升高,进一步刺激β细胞分泌胰岛素,长此以往,β细胞数量逐步减少及功能逐步衰竭。 本研究的不足之处:首先,进入此研究样本量较少,没有采用多种、大样本的研究,且为回顾性分析,研究数据存在一定的局限性;其次,本研究患者均为住院患者,用药情况不均一,针对初发糖尿病未使用药物治疗患者进一步研究可弥补可这一局限。 综上所述,胰岛α细胞和β细胞分泌的胰岛素和GLA共同影响着体内葡萄糖的代谢,与HbA1c密切相关,调节双激素稳态平衡将更有利于血糖控制平稳,减少糖尿病慢性并发症的发生和发展。
2 结 果

3 讨 论
