基于血糖生成指数的最新应用研究进展
2020-04-01钟雪婷康建平华苗苗张星灿
钟雪婷,康建平,华苗苗,张星灿
基于血糖生成指数的最新应用研究进展
钟雪婷1,康建平2,华苗苗1,张星灿2
(1. 四川东方主食产业技术研究院,四川 成都 611130;2. 四川食品发酵工业研究设计院,四川 成都 611130)
血糖生成指数(glycemic index,GI)由加拿大的Dr.Jekins提出,是一个衡量食物升血糖能力的参数。近年来研究表明血糖生成指数对Ⅱ型糖尿病人的治疗和体重控制方面有积极作用。通过介绍血糖生成指数的概念、根据GI分级的各类食材原料、GI与食物营养组分的关系、人体分别摄入高GI和低GI食物后的生理反应、GI在Ⅱ型糖尿病防治中的应用,为现代医学中的糖尿病治疗与糖尿病病人的营养配餐提供科学依据。
血糖生成指数;Ⅱ型糖尿病防治;应用研究进展
随着社会经济飞速发展,人民生活节奏越来越快,饮食习惯也随之改变,社会老龄化现象加剧[1],慢性病高发,如糖尿病、心血管疾病、肥胖症、高血压等比例不断上升,已成为目前全球性重大公共卫生问题[2]。在这些疾病中,糖尿病发病率的逐年增长尤为显著,据估计,全球糖尿病患者约有3.47亿,其中,我国就有1.14亿,并且潜在或隐性糖尿病患者的数量更多[3]。预防和控制上述疾病发生的关键在于科学合理的膳食结构。1981年,加拿大科学家Dr.Jenkins等[4]提出了血糖生成指数(GI)的概念,用于描述人体对食物的消化吸收速率和由此引起的血糖应答。GI是对碳水化合物质(CHO)的评价,低GI膳食模式在预防和改善糖尿病、心脏病、肥胖等慢性病中具有很大的应用价值和很强的可操作性。
近年来,国外有关GI的研究层出不穷,澳大利亚和新西兰已经将GI作为生产食品的营养指标之一。研究表明GI的应用对糖尿病的预防和控制起到积极作用,为糖尿病病人的膳食干预提供指导性的思路。
1 GI的概念
1981年,加拿大科学家Dr.Jenkins提出了食物血糖生成指数的概念,即glycemic index,用来衡量食物升血糖的能力[5],并可从生理指标区分CHO,至此CHO有一个更加适合人体生理需求的划分。GI表示含50 g碳水化合物的食物与葡萄糖或白面包相比,人体摄入一定时间后引起血糖应答的相对能力[6]。餐后血糖应答一般用曲线下的面积(area under the curve, AUC)表示(见图1),用公式表示为:

由图1可知,人体在摄入食物后,体内的血糖浓度先迅速上升,之后会逐渐下降[7]。食物消化一段时间后,血糖浓度会形成一条曲线,在第一点之上的曲线面积即为餐后血糖应答曲线下面积。
由图2[8]可知,人体在分别摄入葡萄糖、面包和豆类后,血糖浓度都会上升,但是面包和豆类的血糖反应较弱,其中豆类的血糖涨速最慢,曲线最平缓。面包、豆类餐后血糖曲线下面积与葡萄糖血糖曲线下面积之比即为它们的GI值。
2 根据GI进行的食物分级
不同于传统方法,GI能够确切地反映食物摄入一段时间后人体血糖的波动状态,是衡量食物引起人体餐后血糖反应的一项有效指标。GI能从“质”的角度重新区分CHO,是对以往单靠测量膳食能量和碳水化合物摄入量进行饮食控制一个极好的补充和提升[9]。
根据GI值,科学家将食物分为三个等级(见表1)。以葡萄糖为参考物(定GI值为100),目前将GI>70的食物作为高GI食物,GI在55~70的食物为中GI食物,GI≤55的食物为低GI食物[10]。
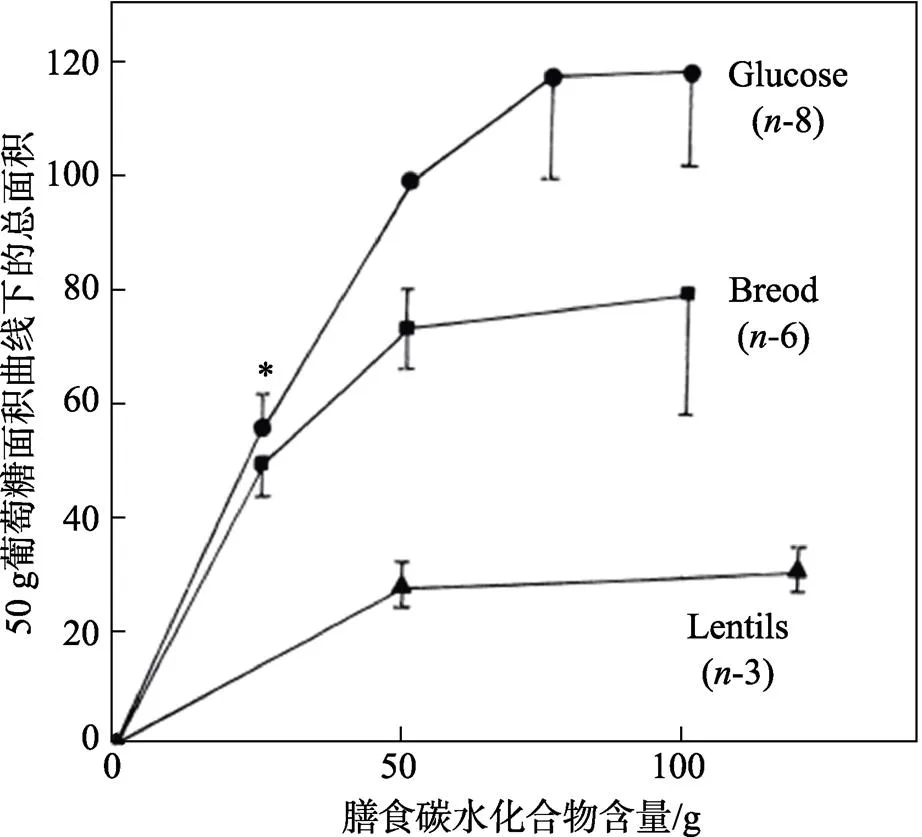
图2 健康人摄入葡萄糖、全麦面包,豆类后的剂量反应曲线
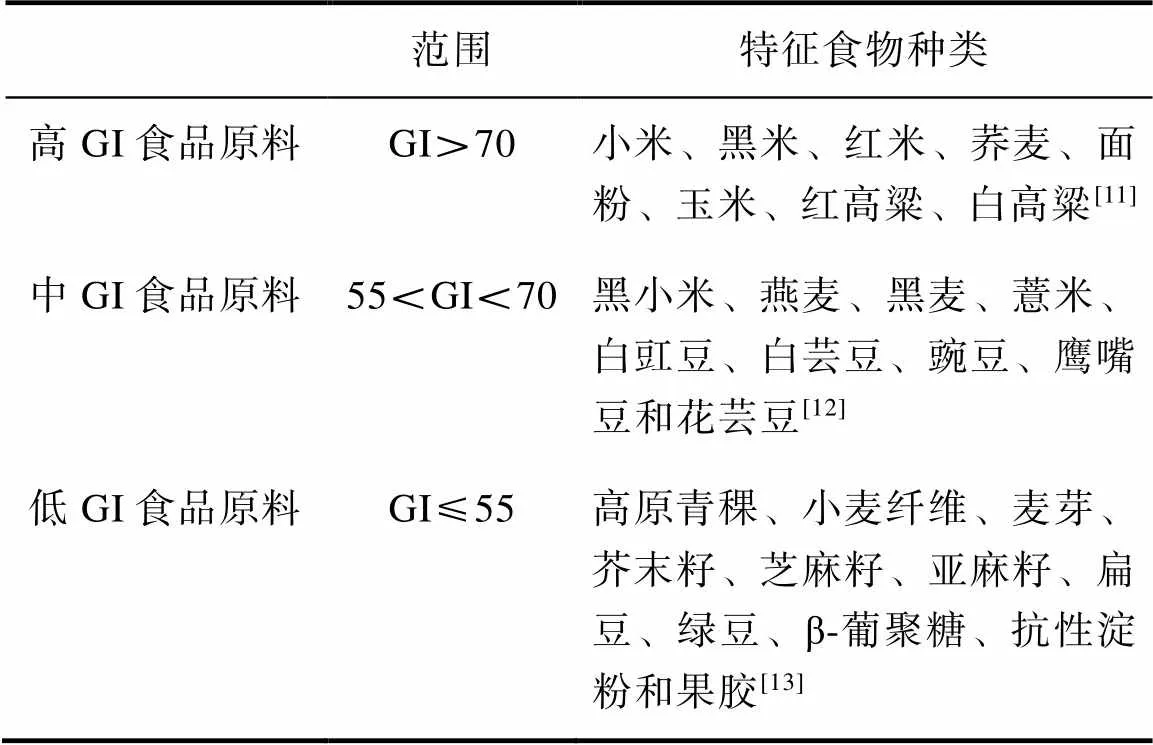
表1 GI食品原料分级
高GI的食物进入人体后,迅速被消化系统吸收,并进入血液产生血糖峰值,促使胰岛素分泌增加,导致血糖下降速度快,血糖变化剧烈;相比之下,低GI食物消化速度慢,吸收率低,对血糖影响小,胰岛素需求量也相应较少,从而避免血糖的剧烈波动,更有利于血糖保持稳定[14]。研究表明,低GI食物具有预防糖尿病、控制肥胖、抗高血压等诸多益处,对保持身体健康具有重要作用[20,27]。
3 GI与食物营养成分的关系
影响食物GI值的因素有很多,主要包括食物本身的营养成分及测定方法两个方面,本文主要讨论食物营养成分的影响,暂不考虑测定方法所带来的影响。
3.1 碳水化合物
碳水化合物由碳、氢和氧三种元素构成,它是主要为人体提供热量的产能营养素之一。食物中的碳水化合物包括单糖、双糖、寡糖、多糖和纤维。单糖主要是葡萄糖、果糖和半乳糖,双糖主要是蔗糖,乳糖和麦芽糖。研究表明,餐后血糖应答与碳水化合物食物“量”的影响密切相关,Salmeron提出血糖负荷的概念,综合考虑CHO的种类和数量对血糖应答的影响[15]。
3.1.1 单糖
摄入不同糖类会对人体内环境造成不同影响。糖的摄入量也是影响胰岛素分泌的关键因素。Bae等[16]研究发现,木糖可抑制蔗糖酶的反应,在食物中添加木糖,能够降低血糖浓度。Yun Ju[17]观察到受试者摄入含木糖的饮料15和30 min后,餐后葡萄糖,胰岛素和C肽水平受到明显的影响。从而发现木糖补充剂可对正常血糖水平和糖尿病前期的受试者餐后血糖反应产生有益效果。
3.1.2 双糖
Johnson研究发现[18],当实验大鼠摄入能量的35%来自于蔗糖时,他们更容易患上脂肪肝这类代谢型疾病。这与Lutig及其同事的研究一致,结果显示上升的糖尿病发病率和糖摄入量的增加存在着流行病学的关系[19]。另一项动物实验表明,每天给小鼠喂食时,其中38.5%的热量是由蔗糖提供,在口服葡萄糖耐量测试早期阶段可观察到血浆血糖升高,这可能是胰岛素抵抗或胰岛素释放受损的迹象[20]。
3.1.3 寡糖
壳寡糖来源于自然界中广泛存在的甲壳素,是经过物理、化学以及酶处理等过程使壳聚糖的主链发生断裂而生成的降解产物[21]。实验表明,壳寡糖可以显著降低糖尿病小鼠的空腹血糖,空腹胰岛素,增加胰岛素敏感性指数,以及改进大鼠口服葡萄糖的耐受性[22]。通过对降血糖机制的研究发现,壳寡糖是通过促进胰腺β细胞(INS-1)增殖,来提高胰岛素释放,同时有效提高糖尿病机体的抗氧化能力以及免疫能力[23],改善胰岛素抵抗,以达到降低血糖的目的。
3.1.4 常见功能性多糖
葡甘露聚糖是由葡萄糖和甘露糖通过β-1,4糖苷键聚合而成的一种天然植物中性多糖,研究发现[24],这种可溶性膳食纤维既能增加食物的运输时间,又能延长胃排空食物的时间,这样可以增加饱腹感,减少体重,减少摄入会增加胆固醇和葡萄糖浓度的食物,并能抑制餐后血糖上升,抑制肝胆固醇合成,以及增加粪便对胆汁酸的胆固醇清除率。
3.1.5 膳食纤维
膳食纤维是一种复杂的物质,包括不能被肠道上部消化的碳水化合物和木质素。根据水溶性可分为可溶性膳食纤维和不可溶膳食纤维两种类型。前者包括果胶、β-葡聚糖和低聚果糖等,后者包括纤维素、半纤维素和木质素等[25]。不可溶膳食纤维可以通过吸附肠腔内的胆汁酸,阻断胆固醇的肠循环[26]来达到降低胆固醇的作用。同时,膳食纤维还能阻碍胆固醇与肠黏膜的接触,降低胆固醇的吸收[27]。研究发现,摄入不可溶的谷物类膳食纤维和全谷物食品能够降低餐后血糖反应,同时降低总胆固醇和LDL胆固醇水平[28]。膳食纤维可在结肠内被肠道细菌分解和发酵,通过其多种亲水基团及强大的吸水性,在肠内体积增大15~25倍,可明显增强食物的粘性,延缓胃排空,阻止食物与消化道内的酶接触,降低消化吸收率。实验表明,可溶性膳食纤维粘度大,可以形成凝胶,从而延缓胃的排空速度,降低餐后血糖反应[29]。
3.1.6 抗性淀粉
抗性淀粉属于膳食纤维的一种,又称抗酶解淀粉。研究发现,抗性淀粉在进入人体后,不能被小肠消化和吸收,而是直接到达结肠,并能够与挥发性脂肪酸起发酵反应[30]。自然农作物如马铃薯、香蕉、玉米等都含有抗性淀粉,这种淀粉在体内较其他淀粉难降解,对血糖影响较小。
Abby等发现[31],抗性淀粉和普鲁兰糖能够降低餐后血糖反应和胰岛素水平,但是不会对人体饱腹感起任何作用。Mindy等研究发现[32],健康超重成人每天消耗30 g高直链玉米抗性淀粉Ⅱ型持续6周,可在不影响身体成分的情况下,改善葡萄糖稳态,降低瘦素浓度和增加空腹PYY,并可有助于预防慢性病。
3.2 脂肪
实验表明,脂肪与碳水化合物一起摄入后,可以维持餐后胰岛素浓度基本不变而血糖浓度降低45%左右[33]。另外,游离脂肪酸的疏水端可以与直链淀粉螺旋链内部通过疏水作用结合形成复合物,降低淀粉的体外消化速率。Crowe的实验结果显示[34],月桂酸与直链淀粉结合后,淀粉的体外消化率降低了26%。研究发现[35],脂肪主要通过延缓胃排空,降低早期的血糖反应,但是会造成餐后后期的高血糖反应。每摄入35 g的脂肪会使血糖升高2.3 mmol/L。
王竹研究表明,在高能量摄入和肥胖状况下,由于体内脂肪增多(包括脂肪组织和内脏脂肪)、脂肪细胞代谢障碍、线粒体脂肪酸氧化异常,使输送到肌肉和肝脏的脂肪增加,结果造成肝脏对脂蛋白代谢物的摄取以及脂肪酸合成增强、降解减少,极低密度胆固醇(VLDL)增多;肌肉细胞对葡萄糖转运和糖原合成能力下降,其代价是循环中的能量物质(脂肪和葡萄糖)增多[36]。
综上所述,在肥胖或高脂肪摄入条件下,由于组织内脂肪酸氧化降低、葡萄糖氧化升高,使得肝内糖原大量堆积而肌肉对葡萄糖摄取能力下降,并使胰岛素敏感性下降,从而引起餐后高血糖反应。
3.3 蛋白质
蛋白质和碳水化合物一起被摄入时和蛋白质单独被摄入时对血糖有不同作用[37]。在高蛋白食物中,蛋白质分子间形成致密网络将淀粉分子包裹其中,使淀粉消化速度降低。如面粉中谷蛋白之间交联形成能够包裹淀粉分子的网络,阻止酶与淀粉颗粒接触,进而抑制淀粉在小肠内水解速度[38]。蛋白质可以促进体内胰岛素分泌,进一步清除血液中的葡萄糖,具有降低血糖应答水平的作用。Brent等实验发现[39],将乳清蛋白加入高碳水化合物食品中,可显著降低50 g葡萄糖引起的血糖反应。Wolever研究表明[40],只有30 g以上的蛋白质才可能有降低血糖应答的作用,其机制可能是通过促进胰岛素分泌来实现的。
最新研究发现[41],将米饭和鸡蛋进行模拟消化实验,米饭在加入胰液30 min左右开始糊化,但相比单独的米饭,其结构更完整。在接下来的消化过程中也可看出,同样时间30~120 min时,与鸡蛋组合的米饭其结构会更完整,说明蛋白质对米饭的消化有保护作用,能够减缓淀粉食物消化速度即葡萄糖的释放速率,一定程度上抑制米饭中碳水化合物的消化过程。
4 人体分别摄入高GI食物与低GI食物后的生理反应
4.1 人体摄入高GI食物后的生理反应
当人体摄入高GI食物后,血糖的快速吸收会干扰人体内部稳态,餐后血糖被吸收的过程因此而变得复杂化[42]。人体在摄入高GI膳食2 h后,总血糖浓度的增加值是摄入等量营养素和能量低GI膳食的两倍以上。这种相对高血糖症,与胰高血糖素样肽-1和促胰岛素多肽浓度升高产生的协同作用,既能有效促使胰岛素释放,又能抑制α细胞释放胰高血糖素。由此产生的胰岛素与胰高血糖素的高比率倾向于夸大对进食的正常合成代谢反应,包括干涉胰岛素响应组织对营养物质的摄取,进一步刺激糖原生成和脂肪生成,并更加抑制糖异生和脂解反应[42]。
科学家开展16项单项人体试验,研究表明[43],与摄入低GI膳食相比,有15项试验发现人体在摄入高GI膳食后,饱腹感降低,饥饿感增加,从而自愿摄取更多食物;Ludwig等开展一项针对GI肥胖人群能量代谢和摄取食物影响的试验,肥胖儿童在早餐和午餐时被给予含等量能量和常量营养素的高GI即食燕麦片或低GI燕麦,并在整个下午监测他们的能量消耗。与低GI膳食相比,高GI膳食摄入后能量增加53%[44]。
人体所需热量的主要来源之一,游离脂肪酸,在人体摄入高GI膳食后,相比低GI膳食,更受抑制。在摄入高GI膳食后的4~6 h,低浓度循环的代谢燃料会引发反调节激素反应,通过刺激糖原分解和糖异生使血糖恢复正常,使游离脂肪酸浓度远高于低GI膳食餐后观察到的水平。这种升高的反调节激素和游离脂肪酸水平的组合类似于持续数小时的禁食状态。相较而言,人体摄入低GI膳食后,由于胃肠道营养物质的持续吸收和肝脏葡萄糖输出的增加,餐后期间不会发生低血糖及其激素后遗症。
尽管基因可能会影响个体反应,人体摄入高GI膳食后导致餐后低血糖已经是普遍现象。实验发现,在做过口服葡萄糖耐量试验的650名非糖尿病个体中,平均血浆葡萄糖最低点低于禁食水平,并且有10%的个体血浆葡萄糖最低点小于2.6 mmol/L[45]。科学家在人体食用含有高GI食物的混合膳食后也观察到类似的现象[41]。进一步来讲,餐后低血糖在肥胖人群中表现更明显[46]。
4.2 人体摄入低GI食物后的生理反应
动物实验和人体试验都表明,低GI食物中碳水化合物的吸收速度慢,能够减少餐后肠道激素和胰岛素分泌,持续抑制血液游离脂肪酸水平,从而使餐后血糖高峰值和胰岛素水平降低,外周组织对葡萄糖的摄取利用率增加,有效地改善胰岛素抵抗和血糖控制,并减少慢性并发症的发生和发展[47]。此外,有研究发现进食低GI食物[48],可使升高的纤溶酶原激活物抑制剂-1的活性恢复正常,具有改善纤溶的功能,并能减少因餐后高血糖引起血浆C反应蛋白浓度和组织的氧化损伤,有助于预防心血管疾病。
5 GI在Ⅱ型糖尿病防治中的作用
糖尿病由遗传、自身免疫、病毒感染、氧化应激等不同的因素导致胰岛β细胞功能受损,进而引起体内胰岛素分泌不足,胰岛素作用减弱而导致的机体糖、蛋白质、脂肪、水和电解质等一系列代谢紊乱的临床综合症[49]。总体来说,糖尿病可分为Ⅰ型、Ⅱ型、妊娠型和特殊类型,其中Ⅱ型占90%以上[50]。
随着Ⅱ型糖尿病在全世界范围内发病率越来越高,强调了研究并理解不同风险因子的重要性[51]。Ⅱ型糖尿病的高发病率,主要是因为现代人久坐不动的生活方式和肥胖症的患病率增加。研究表明,Ⅱ型糖尿病可以通过改变糖尿病高危人群的生活方式来预防[52]。大量研究证实,缺乏体力活动,肥胖和高热量饮食均与Ⅱ型糖尿病的发病存在密切的关系[53]。所以,有效的膳食和运动干预[38]是促进Ⅱ型糖尿病人群健康的重要手段之一。
国内外有大量人体和动物实验来共同验证食用低GI食品能够在一定程度下防治Ⅱ型糖尿病。Ryan[54]等研究发现,低GI食品能够降低总体血糖反应,减少血糖峰值,但有可能会增加患低血糖的风险。相对于餐后后期,高GI食物在前期需要更多胰岛素,以避免低血糖的发生[55],这在一定程度下,会导致胰岛素分泌紊乱,从而造成血糖上升过快。
Li[42]实验结果发现,低血糖生成指数的膳食营养补充剂可以降低II型糖尿病患者血糖水平,并帮助患者控制体重。Flavia[45]实验发现,当Ⅱ型糖尿病患者摄入高GI和低纤维的食物作为早餐后,他们的餐后血浆葡萄糖,胰岛素以及生长素反应是最不利的,这表明减少GI或者提升早餐中的纤维含量或许是一种提升病人餐后代谢特征的有效策略。针对患有高血脂的病患,将低GI食物掺入膳食中可以降低其血清甘油三酯含量和胆固醇含量[40]。
田宝明[46]分别用低GI挂面和普通挂面对糖尿病大鼠进行长期喂养,结果表明低GI挂面能控制大鼠体重处于稳定状态,极显著提高大鼠血清胰岛素、肝糖原和肌糖原的含量;糖耐量异常得到明显改善,血糖各项指标均在正常范围内,以此说明低GI挂面对糖尿病大鼠的高血糖症状具有一定改善作用。同时,翟文奕[47]采用自主研制的低GI馒头来喂食小鼠,同样验证低血糖馒头能有效的控制小鼠餐后血糖,且血糖生成指数较低,优于普通馒头。刘安军等[48]将茶多酚与茶多糖混合并研究其对高血糖小鼠身体指标的影响,结果显示,茶多糖与茶多酚的协同作用可以降低高血糖小鼠的餐后血糖值,提高脾指数及胸腺指数,促进葡萄糖转化成肝糖原,能够有效控制小鼠的血糖。
大量研究表明,低GI食品可以有效改善餐后血糖负荷,帮助控制糖尿病患者病情。调配糖尿病病人膳食时添加低GI食物,能够有效地控制病人的体重,在一定程度内缓解糖尿病症状。低GI饮食对糖尿病治疗效果的Meta分析结果显示[49],低GI饮食较高GI饮食使HbA1c降低0.43%[95%CI (0.18%,0.67%)],果糖胺水平降低0.75 mmol/L[95%CI (0.05 mmol/L,1.45 mmol/L),差异均有统计学意义(<0.05),低GI饮食有利于糖尿病患者总体血糖水平控制,GI是指导糖尿病患者饮食的有效指标。
6 问题和展望
综上所述,随着人们对健康认识程度的增加,GI将会被更多的糖尿病患者所接受。GI也将在防治慢性病方面发挥出更大的作用。目前,世界范围内糖尿病患者及潜在人群呈现逐年增长的趋势,高血糖病症的预防和控制也成为人们关注的焦点。GI因其专注于碳水化合物的“质”,弥补食物交换份法的缺陷,成为糖尿病膳食干预的重要内容。但在这一过程中对于GI的基础研究还有待进一步完善,主要包括以下内容。
(1)加强各类营养素对GI作用机理的研究。当前有一些科学研究成果表明,脂肪或膳食纤维同时和碳水化合物一起摄入时,GI值会偏低,但近年来的研究却给出它们可能会引起低血糖的结果。因此,需要进一步对这些存在争论的结果进行系统科学的深入研究。目前有关宏量营养素例如糖类、脂肪、蛋白质与GI的相互关系还缺乏中长期的数据支持。因此,需要开展关于上述食物成分对GI影响的长期研究。
(2)开发真正适合糖尿病患者需要的GI产品。目前中国人的膳食结构存在一定缺陷,可针对糖尿病患者,利用杂粮、坚果、蔬菜等原料,并通过生物发酵、挤压重组、高压粉碎等技术,对现有主食进行改良,开发真正适合糖尿病患者的低GI功能食品,既能保证饮食均衡,又能提高他们的幸福感和生活质量。
(3)加强对GI和GL长期生理效应的研究。目前,GI和血糖负荷(GL)只针对一餐的餐后血糖反应,没有考虑到其对第二餐和第三餐的影响,更没有考虑到长期的生理效应,故不能将其作为选择碳水食物的唯一依据。可通过人体试验,研究不同GI食物在一天24 h之中引起的生理效应,为日常膳食营养搭配提供更科学的理论依据。
(4)加强对影响GI综合因素的研究。血糖生成指数不仅与食材本身有关,还与食物相关方式、烹调方法、进食方式以及受试者的个体差异有关。目前认为影响食物血糖应答的可能因素有:①食物中碳水化合物含量。②食物的物化特性,主要包括食物结构、淀粉结构、食物颗粒大小、酸碱度以及加工烹调方式。③食物成分,如上文所述。这些因素在食物的消化、吸收和利用过程中通过不同的机制发挥作用。可通过科学实验,研究同一食物不同加工方式对GI的影响,或者不同淀粉结构食物的GI值等,为更进一步了解GI提供实验数据和理论依据。
[1] ABBY S, KLOSTERBUER W T, JOANNE L, Resistant starch and pullulan reduce postprandial glucose, insulin, and glp-1, but have no effect on satiety in healthy humans[J]. Journal of Agricultural and Food Chemistry 2012 (60): 11928-11934.
[2] BERTI C, RISO P, MONTI L D, et al. In vitrostarch digestibility andin vivoglucose response of gluten–free foods and their gluten counterparts[J]. European Journal of Nutrition, 2004, 43(4): 198-204.
[3] LI J , KANEKO T , QIN L Q , et al. Long-term effects of high dietary fiber intake on glucose tolerance and lipid metabolism in GK rats: comparison among barley, rice, and cornstarch[J]. Metabolism Clinical and Experimental, 2003, 52(9): 0-1210.
[4] JENKINS D J, WOLEVER T M, TAYLOR R H, et al. Glycemic index of foods: a physiological basis for carbohydrate exchange[J]. The American Journal of Clinical Nutrition, 1981, 34(3): 362-366.
[5] BAKHT R S, LING W, SHILIN L et al. Health benefits of konjac glucomannan with special focus on diabetes[J]. Bioactive Carbohydrates and Dietary Fibre, 2015, 5(2): 179-187.
[6] SANJAY B, PAULA Y, NANCY H, et al. The relationship of sugar to population-level diabetes prevalence: an econometric analysis of repeated cross-sectional data[J]. PLoS ONE, 2013, 8(2): e57873.
[7] PETERSEN B L, WARD L S, BASTIAN E D, et al. A whey protein supplement decreases post-prandial glycemia[J]. Nutrition Journal, 2009, 8(1): 47.
[8] CROWE T C, SELIGMAN S A, COPELAND L. Inhibition of enzymic digestion of amylose by free fatty acids in vitro contributesto resistant starch formation[J]. Journal of Nutrition, 2000, 130(8): 2006.
[9] LUDWIG, D. S. The glycemic index: Physiological mechanisms relating to obesity, diabetes, and cardiovascular disease[J]. JAMA (Journal of the American Medical Association), 2002, 287(18): 2414-2423.
[10] LUDWIG D S. Dietary glycemic index and obesity[J]. Journal of Nutrition, 2000, 130 (2S Suppl): 280S.
[11] SILVA F M, KRAMER C K, CRISPIM D, et al. A high-glycemic index, low-fiber breakfast affects the postprandial plasma glucose, insulin, and ghrelin responses of patients with type 2 diabetes in a randomized clinical trial[J]. Journal of Nutrition, 145(4): 736-741.
[12] TUOMILEHTO J, JAANA LINDSTRÖM, ERIKSSON J G, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance[J]. New England Journal of Medicine, 2001, 344(18): 1343-1350.
[13] BAE Y J, BAK Y K, KIM B, et al. Coconut-derived D-xylose affects postprandial glucose and insulin responses in healthy individuals[J]. Nutrition Research and Practice, 2011, 5(6).
[14] JENKINS D J A, KENDALL C W C, AXELSEN M, et al. Viscous and nonviscous fibres, nonabsorbable and low glycaemic index carbohydrates, blood lipids and coronary heart disease[J]. Current Opinion in Lipidology, 2000, 11(1): 49-56.
[15] JOHNSON R J, NAKAGAWA T, SANCHEZ-LOZADA L G, et al. Sugar, uric acid, and the etiology of diabetes and obesity[J]. Diabetes, 2013, 62(10): 3307-3315.
[16] JU C, YUE W, YANG Z, et al. Antidiabetic effect and mechanism of chitooligosaccharides[J]. Biological & Pharmaceutical Bulletin, 2010, 33(9): 1511-1516.
[17] COLLIER G, O'DEA K. The effect of coingestion of fat on the glucose, insulin, and gastric inhibitory polypeptide responses to carbohydrate and protein[J]. The American Journal of Clinical Nutrition, 1983, 37(6): 941-944.
[18] BELL K J, SMART C E, STEIL G M, et al. Impact of fat, protein, and glycemic index on postprandial glucosecontrol in type 1diabetes:implications for intensive diabetes management in the continuous glucose monitoring era[J]. Diabetes Care, 2015, 38: 1008-1015.
[19] LEV-RAN A, ANDERSON R W. The diagnosis of postprandial hypoglycemia[J]. Diabetes, 1982, 30(12): 996-999.
[20] LI D, ZHANG P, GUO H, et al. Taking a low glycemic index multi-nutrient supplement as breakfast improves glycemic controlin patients with type 2 diabetes mellitus: a randomized controlled trial[J]. Nutrients, 2014, 6(12): 5740-55.
[21] LUDWIG D S, MAJZOUB J A, AL-ZAHRANI A, et al. High glycemic index foods, overeating, and obesity[J]. Pediatrics. 1999. 103: E261-E266.
[22] MAZIARZ M P, PREISENDANZ S, JUMA S, et al. Resistant starch lowers postprandial glucose and leptin in overweight adults consuming a moderate-to-high-fat diet: a randomized- controlled trial[J]. Nutrition Journal, 2017, 16(1): 14.
[23] SIMILÄ M E, VALSTA L M, KONTTO J P, et al. Low-, medium- and high-glycaemic index carbohydrates and risk of type 2 diabetes in men[J]. British Journal of Nutrition, 2011, 105(8): 1258-1264.
[24] RYAN R L, KING B R, ANDERSON D G, et al. Influence of and optimal insulin therapy for a low-glycemic index meal in children with type 1 diabetes receiving intensive insulin therapy[J]. Diabetes Care, 2008, 31(8): 1485-1490.
[25] WOLEVER T M S. Physiological mechanisms and observed health impacts related to the glycaemic index:some observations[J]. Int J Obe. 2006, 30: S72-S78.
[26] SAKAMOTO E S Y, FUKAMI A, MIZUTANI N, et al. Ingestion of a moderate high-sucrose diet results in glucose intolerance with reduced liver glucokinase activity and impaired glucagon- like peptide-1 secretion[J]. J Diabetes Investig. 2012, 3: 432-440.
[27] SALMERON J, ASCHERIO A, RIMM E, et al.Dietary fiber, glycemic load, and risk of NIDDM in men[J]. Diabetes Care, 1997, 20(4): 545-550.
[28] SALWAW L T, MURIEI L. Improved plasma glucose control whole body glucose utilization, and lipid profile on a low glycemic index diet in type 2 diabetic men[J]. Diabetes Care, 2004, 27(2): 1866-1870.
[29] SCHULZE M B, SCHULZ M, HEIDEMANN C, et al. Fiber and magnesium intake and incidence of type 2 diabetesa prospective study and meta-analysis[J]. Archives of Internal Medicine, 2007, 167(9): 956-965.
[30] HARALAMPU S G. Resistant starch: A review of the physical properties and biological impact of RS3[J]. Carbohydrate Polymers, 2000, 41(3): 285-292.
[31] STEPHAN T, NOLAN S, KHURANA R C, et al. Lag glucose tolerance curves[J] American Journal of Medical Science, 1972, 264(41-47).
[32] SHRIVASTAVA S R L, SHRIVASTAVA P S, SUKLA P. A longitudinal study to assess the impact of exercise on clinical, biochemical, and anthropometric parameters among the type 2 diabetes patients of South India[J]. Avicenna Journal of Medicine, 2015, 5(1): 16.
[33] WOLEVER T M S, JENKINS D J A. The use of the glycemie Index in predicting the blood glucose response to mixed meals[J].The American Journal of Clinical Nutrition, 1986, 43(1): 167-172.
[34] JUN Y J, LEE J, HWANG S, et al. Beneficial effect of xylose consumption on postprandial hyperglycemia in Korean: a randomized double-blind, crossover design[J]. Trials, 2016, 17(1): 139.
[35] 常凤. 2型糖尿病运动干预方案及策略研究[D]. 武汉大学, 2015.
[36] 崔亚楠. 低血糖指数原料(谷物、豆类)及工艺筛选和配方冲调粉的研究[D]. 江南大学, 2017.
[37] 范光森, 许岱, 富志磊, 等. 血糖生成指数研究进展[J]. 中国食品添加剂, 2016, 10: 56-68.
[38] 黄玉萍, 石勇铨, 刘志民, 等. 低血糖指数饮食对糖尿病治疗效果的Meta分析[J]. 中国全科医学. 2010, 13(6C): 2010-2013.
[39] 鞠海兵, 舒子正, 沈菲菲, 等. 不同血糖指数食物对糖尿病患者代谢的影响[J]. 中华糖尿病杂志, 2004, 12(1): 39-40.
[40] 康晶燕, 傅楠, 王勇, 等. 混合膳食组成对体外消化过程中GI与食物消解的影响[J]. 现代食品科技, 2018, 34(2): 102-109.
[41] 李晓明, 刘彩虹. 食物血糖生成指数在糖尿病饮食治疗中的研究进展[J]. 医学综述, 2007, 13(7): 538-539.
[42] 刘安军, 邓颖, 王雅静. 茶多糖及协同因子的降血糖作用研究[J]. 现代食品科技, 2012, 28(2): 139-141.
[43] 刘娟, 郝丹丹, 安阳, 等. 不同配方米饭血糖生成指数和血糖负荷的测评[J]. 临床医药实践, 2015, 6: 403-406.
[44] 缪铭, 江波, 张涛. 低血糖生成指数淀粉类衍生物的研究进展[J]. 食品科学, 2008, 29(4): 452-456.
[45] 世界卫生组织. 关于糖尿病的十个事实[J]. 中国卫生政策研究, 2013, 6(10): 35.
[46] 孙海燕, 刘东. 豆渣膳食纤维对2型糖尿病大鼠血糖及血脂的影响[J]. 西北药学杂志, 2010, 25(4): 278-280.
[47] 田宝明. 低血糖指数挂面的研制及其对糖尿病大鼠糖脂代谢影响的研究[D]. 西南大学, 2015.
[48] 王爱玮, 赵琳. 低血糖指数饮食对糖尿病患者血糖影响[J]. 中国老年保健医学, 2013, 11(6): 27-28.
[49] 王润, 党斌, 杨希娟, 等. 低血糖生成指数食品的研究现状与展望[J]. 青海农林科技, 2018, 3: 68-88.
[50] 王竹. 高血糖动物模型的建立及其影响因素研究[D]. 中国疾病预防控制中心, 2009.
[51] 吴秀福, 张秀华. 糖尿病自我管理一本通[M]. 哈尔滨市: 哈尔滨出版社, 2011: 26-27.
[52] 夏正常, 朱德增, 王琳. 上海市延吉社区2型糖尿病患病率调查及危险因素分析[J]. 当代医学, 2012, 18(13): 152-154.
[53] 谢丽, 李烨琦, 杨艳, 等. 糖尿病饮食治疗现状及进展[J]. 现代医药卫生, 2015, 31(1): 75-77.
[54] 俞茂华. 糖尿病的防治[M]. 上海: 上海医科大学出版社, 2001.
[55] 翟文奕. 一种高抗性淀粉、低血糖指数主食馒头的研制及品质评价[D]. 济南大学, 2015.
[56] 张晓敏, 邓尚贵, 韩燕. 膳食纤维的功能及其在食品中的应用[J]. 农产品加工学刊, 2007, 4(11): 41-42.
[57] 赵金山,张燕,延岩, 等. 壳寡糖降血糖作用的临床观察研究[J]. 食品与药品, 2011, 3: 120-122.

The latest application and research progress of Glycemic Index
ZHONG Xue-ting1, KANG Jian-ping2, HUA Miao-miao1, ZHANG Xing-can2
(1. Sichuan Oriental Staple Food Industry and Technology Research Institute, Chengdu, Sichuan 611130, China; 2. Sichuan Food Fermentation Industry Research and Design Institute, Chengdu, Sichuan 611130, China)
Glycemic Index, proposed by Dr.Jekins in 1970, was an index that measured blood sugar capacity of food. Recent research indicated that glycemic index had positive effects on therapy of diabetic patients and weight management for the overweight. In this paper, the author introduced the concept of glycemic index, food materials grading based on GI, the relationships between GI and food components, the physiological reaction of human separately consuming high GI or low GI food, the application of GI in prevention and cure of diabetes. The review will provided scientific evidences for medical treatment and designing nutritional meal for diabetic patients in comtemporary medical science.
glycemic Index, prevention and treatment of type-2 diabetes, application and research progress
康建平,1965年出生,男,硕士,教授级高级工程师,研究方向为粮油深加工.
R151.3
A
1007-7561(2020)02-0066-07
2019-09-12
10.16210/j.cnki.1007-7561.2020.02.011
