两株南极枝孢霉属真菌Cladosporium sp.NJF4和NJF6的次级代谢产物研究
2020-04-01常俊男田晓清樊成奇黄金昌陆亚男韩清华
常俊男 田晓清 樊成奇 黄金昌 陆亚男 韩清华
研究论文
两株南极枝孢霉属真菌spNJF4和NJF6的次级代谢产物研究
常俊男1, 2田晓清2樊成奇2黄金昌2陆亚男2韩清华2
(1上海海洋大学, 上海 201306;2中国水产科学研究院东海水产研究所, 农业农村部东海与远洋渔业资源开发利用重点实验室, 上海 200090)
南极因其独特的自然环境成为潜在、重要的微生物资源库, 是产生新型生物活性物质和先导化合物菌株的潜在种源地, 南极微生物正在成为创新药物研究新的重要资源。虽然近年来对南极微生物次级代谢产物的研究逐渐增加, 但与温带和热带微生物研究相比仍处于初级阶段。对从南极普里兹湾海洋沉积物中获得的两株枝孢霉属真菌spNJF4 和 NJF6进行次级代谢产物分离及结构鉴定, 获得20个化合物。化合物结构类型包括甾醇(1)、倍半萜类(7—8)、生物碱类(9—14)、二酮哌嗪(2—5、15—17)、芳香酸(6、18—19)等, 其中倍半萜类(7—8)为首次从枝孢霉属真菌中分离得到, 以上研究将为丰富南极微生物次级代谢产物库奠定一定的研究基础。
南极真菌 次级代谢产物 分离纯化 结构鉴定
0 引言
南极被人们称为第七大陆, 是地球上最后一个被发现、唯一没有人员定居的大陆。南极大陆极端的气候条件使其成为了地球上最严苛的生境之一, 它大部分地区常年被冰雪覆盖, 永久无冰区面积仅为其总面积的0.4%左右, 气候酷寒干燥、强光辐射, 虽然在一定程度上限制了微生物的生存及繁衍, 但也使得南极地区的微生物资源的种类和性质有别于世界其他地区, 具有耐低温、耐高盐、抗辐射等特点。由于长时间的沉淀和积累, 使得极地区域海洋沉积物成为一个成分复杂且巨大的微生物栖息地。海洋沉积物中有机质含量是海水的104—105倍, 充足的营养物质中蕴藏了大量的微生物, 并且这些微生物往往具有适应其特殊环境的形态学、生理学上的特异性, 有很好的产生次级代谢产物的潜力[1]。自从1986年Pugh首次对南极海洋真菌报道以来, 最近几十年, 各国科学家对南极大陆、附近海域以及近南极地区不同基底的真菌资源多样性进行了相关的考察, 发现了100多种非地衣型真菌, 新的分类群也通过分子生物学方法不断被发现, 这表明南极地区真菌的多样性及其重要生态学意义有待深入的探索和研究[2]。
在关于南极真菌的研究中, 林文翰教授团队于2009年从南极企鹅岛附近海域沉积物来源的1株真菌中分离得到6个哌铂霉素类化合物Asperelines A–F[3]; 顾谦群教授团队对南极真菌多样性及代谢产物进行了系统研究, 建立了基于微生物-化学-生物活性相结合的系统性研究平台, 从近南极长城站地衣下土壤来源的真菌GW3-13, 普里兹湾深海沉积物来源的真菌PRB-2、sp. PR19N-1, 以及苔藓来源的真菌GWT2-24中获得多种类型的新化合物, 如二酮哌嗪类、聚酮类、倍半萜烯类及混源萜类化合物等, 其中部分化合物具有显著的细胞毒及抗病毒活性[4-8]; 刘永宏团队从南极土生真菌SCSIO 05702中得到高氧化度的-吡喃酮型倍半萜类化合物, 部分化合物对流感病毒H1N1和H3N2具有抑制作用[9]。以上研究结果表明南极真菌具有极大的物种资源和产生代谢产物的潜力, 有待进一步研究。本课题组前期从南极普里兹湾海洋沉积物中分离并鉴定了4株真菌菌株, 其中2株为枝孢霉sp. NJF4和NJF6, 对其开展了蛋白磷酸酶含量和大田软海绵酸OA对该酶的抑制作用测试, 并分析了菌株提取物中的脂肪酸类成分[10], 本文报道了sp. NJF4和NJF6中次级代谢产物分离与结构鉴定。
1 材料与方法
1.1 材料与试剂
色谱填料和试剂: HP-20大孔吸附树脂(Mitsubishi Chemical Ltd, Japan); 凝胶 Sephadex LH-20(Pharmacia Biotech, Sweden); 凝胶Sephadex G-25(Pharmacia Biotech, Sweden); 预制GF254 TLC硅胶板(青岛海洋化学公司); 液相用乙腈、甲醇(色谱级, Tedia, USA); 其余溶剂均为分析纯(AR, 上海国药集团)。
1.2 NJF4和NJF6菌株中代谢产物的分离纯化
1.2.1 菌株的发酵培养
配制2瓶800 mL YPD(酵母膏胨葡萄糖)液体培养基, 分别置于2 L三角瓶中, 121°C高温灭菌30 min, 再接入经过活化培养的NJF4和NJF6菌株, 24°C、180 rpm进行摇床发酵培养, 10 d后得到种子发酵液。将种子液按一定比例接种于含有0.75 L YPD液体培养基的2 L三角瓶中, 在24°C、180 rpm分3批进行摇床发酵培养, 每批发酵培养10—15 d, 每株菌共得到约60 L发酵液。
1.2.2 NJF4 单体化合物的提取与分离
减压抽滤发酵液, 得50 L上清液和若干菌丝体。上清液浓缩冷却后经大孔吸附树脂柱分离, 用甲醇-水溶液(20%、60%、100%)依次洗脱, 每个梯度洗脱3—5个柱体积, 收集洗脱液并蒸干得A、B、C三部分。菌丝体经超低温冰箱(–80°C)冷冻12 h后取出, 剪碎后分别加入丙酮和甲醇, 超声提取3次, 每次0.5 h, 合并萃取液并蒸干(5.6 g)。经MCI柱层析分离, 用甲醇-水溶液(20%、60%、100%)依次洗脱, 每个梯度洗脱3—5个柱体积, 收集洗脱液并蒸干得D、E、F三部分。合并A和D, 得20% 甲醇洗脱部位NJF4 I(2.5 g); 合并B和E, 得60%甲醇洗脱部位NJF4 II(4.0 g); 合并C和F, 得100%甲醇洗脱部位NJF4 III(3.7 g)。NJF4 I经正相硅胶柱层析分离, 氯仿-甲醇(10∶1→4∶1)依次洗脱, 得化合物1—5; NJF4 II经Sephadex LH-20和正相硅胶柱分离, 合并主要成分段并使用半制备液相手段进一步分离, 得单体化合物6(10.51 min)。
1.2.3 NJF6 单体化合物的提取与分离
减压抽滤发酵液, 得50 L上清液和若干菌丝体。菌丝体经超低温冰箱冷冻取出, 剪碎后分别加入丙酮和甲醇, 超声提取3次, 每次0.5 h, 合并萃取液并蒸干。浓缩后的浸膏加2.4 L纯水溶解充分, 然后分别用石油醚、氯仿、正丁醇各萃取3 次, 得到相应的石油醚(0.24 g)、氯仿(3.44 g)和正丁醇萃取物(75.1 g)。
NJF6的石油醚和氯仿部分分别用少量的MeOH溶解后合并, 用正相硅胶柱进行分离, 分别用氯仿∶甲醇=60∶1、40∶1、30∶1、20∶1、10∶1的梯度洗脱, 得到I—IX九部分。将主要成分段IV、V合并经Sephadex LH-20凝胶柱层析分离, 100%乙醇洗脱, 得到四部分命名为a、b、c、d, 将a部分经过Sephadex LH-20凝胶柱层析分离, 100%乙醇洗脱, 得到化合物9和17。对VI部分用Sephadex LH-20凝胶柱层析分离, 100% 乙醇洗脱, 得到六部分命名为VI a、VI b、VI c、VI d、VI e、VI f; VI b经Sephadex LH-20凝胶柱层析分离(氯仿︰甲醇=1︰1), 得VI b-1—VI b-3 共3个组分, VI b-1经HPLC(高效液相色谱)反复进样制备(流动相: 乙腈-0.1%三氟乙酸-水), 得到化合物18(25.38 min)、7(26.34 min)、8(27.88 min); VI b-2经HPLC反复进样制备(流动相: 乙腈-0.1%三氟乙酸-水), 得到化合物15(8.12 min); VIb-3经HPLC反复进样制备(流动相: 乙腈-0.1%三氟乙酸-水), 得到化合物11(18.08 min)和化合物12(21.80 min)。VI f经过硅胶分离得到化合物16和20。
正丁醇部分用水充分溶解后经MCI(吸附树脂)柱进行分离, 依次用MeOH∶H2O(20∶80→ 40∶60→ 60∶40→ 80∶20→ 100∶0, 每一个梯度1—1.5 L)进行梯度洗脱, 得到相应的20%、40%、60%和80%洗脱液, 60%部分甲醇-水洗脱液浓缩后用甲醇充分溶解, 经反相柱进行分离, 依次用MeOH∶H2O(30∶70→ 45∶55→ 60∶40 → 80∶20→ 100∶0)进行梯度洗脱, 得到30%、45%、60% 和80%四部分。用Sephadex LH-20凝胶柱层析法对45%部分甲醇-水浓缩液进行分离, 得到a、b、c、d、e五部分; c和d部分经HPLC反复进样制备, 得到化合物19(19.51 min)和13(18.62 min); e部分经硅胶柱色谱分离得到化合物10, 30% 部分甲醇-水洗脱液经硅胶柱色谱分离得到化合物14。
2 研究结果
2.1 NJF4次级代谢产物的结构鉴定
化合物1: 白色无定型粉末, 该化合物的1H-NMR(CDCl3, 400MHz)数据如下:H5.35(1H, m), 5.14—5.24(2H, m), 4.07(1H, m), 3.61(1H, m), 2.35(1H, m), 1.07(3H, s), 1.02(3H, d,=6.5 Hz), 0.91(3H, d,=6.6 Hz), 0.83(3H, d,=6.7 Hz), 0.82(3H, d,=6.7 Hz), 0.59(3H, s),13C NMR (125 MHz, CDCl3) 数据如下:C144.0, 135.4, 132.2, 117.6, 76.0, 73.7, 67.8, 56.0, 54.8, 43.8, 43.5, 42.9, 40.4, 39.5, 39.2, 37.2, 33.1, 33.0, 30.9, 27.9, 22.9, 22.1, 21.1, 19.9, 19.7, 18.8, 17.6, 12.3。以上数据与文献[11]报道一致, 鉴定为已知化合物5, 22-二烯-麦角甾-3, 7, 8-三醇(结构式见图1)。
化合物2: 浅褐色无定型粉末, HR-ESI-MS谱给出准分子离子峰245.0923 [M+H-H2O]+, 对应分子式为C13H14N2O4。该化合物的1H-NMR (CD3OD, 400 MHz)数据如下:H2.53—2.64(2H, m), 3.00(1H, m), 3.17(1H, m), 3.23(1H, m), 4.29 (1H, m), 7.19—7.28 (5H, m)。该化合物数据与文献[12]报道一致, 鉴定为已知化合物环(苯丙氨酸-天冬氨酸)(结构式见图1)。
化合物3: 浅褐色无定型粉末, HR-ESI-MS谱给出准分子离子峰284.1039 [M+H-H2O]+和301.1290 [M+NH4-H2O]+, 结合氢谱碳谱数据确定其分子式为C15H15N3O4。该化合物的1H-NMR (CD3OD, 400 MHz)数据如下:H0.71(1H, m), 2.00 (1H, m), 3.15(1H, dd,=4.1, 0.6 Hz), 3.47(1H, dd,=4.1, 0.6 Hz), 4.01(1H, m), 4.27(1H, m), 7.03(1H, m), 7.08—7.14(2H, m), 7.37(1H, d,=8.1 Hz), 7.62 (1H, d,= 8.1 Hz)。13C-NMR(CD3OD, 125 MHz) 数据如下:C172.8, 168.3, 167.5, 136.1, 127.8, 124.8, 121.2, 119.1, 118.7, 111.0, 108.2, 55.8, 51.6, 38.5, 29.5。该化合物数据与文献[12]报道一致, 鉴定为已知化合物环(色氨酸-天冬氨酸) (结构式见图1)。
化合物4: 浅褐色无定型粉末, HR-ESI-MS谱给出准分子离子峰274.1186 [M+H]+和547.2296 [2M+H]+, 对应分子式为C14H15N3O3。该化合物的1H-NMR(CD3OD, 400 MHz)数据如下:H2.88(1H, m), 3.31—3.38(2H, m), 3.48(1H, m), 3.80(1H, m), 4.21(1H, m), 7.01(1H, m), 7.08—7.11 (2H, m), 7.32(1H, d,=8.0 Hz), 7.61(1H, d,=8.0 Hz)。该化合物数据与文献[12]报道一致, 鉴定为化合物环(苯丙氨酸-丝氨酸)(结构式见图1)。
化合物5: 浅褐色无定型粉末,1H-NMR (CD3OD, 400MHz)数据如下:H0.12(1H, m), 0.72 (3H, d,=6.7 Hz), 0.86(1H, m), 1.21—1.38(1H, m), 2.80(1H, m), 3.18(1H, m), 3.65(1H, m), 4.21(1H, m), 6.69(2H, d,=7.8 Hz), 6.97(2H, d,=7.8 Hz)。该化合物数据与文献[12]报道一致, 鉴定为已知化合物4¢-羟基苯丙氨酸-亮氨酸(结构式见图1)。
化合物6: 白色固体, 该化合物的1H-NMR (CD3OD, 400 MHz)数据如下:H2.52(2H, t,=7.6 Hz), 2.78(2H, t,=7.6 Hz), 6.67(2H, d,=8.0 Hz), 7.02(2H, d,=7.9 Hz)。13C-NMR(CD3OD, 125 MHz)数据如下:C177.0, 156.6, 133.0, 130.1, 116.3, 37.1, 31.2。该化合物数据与文献[13]报道一致, 鉴定为已知化合物对羟基苯丙酸(结构式见图1)。
2.2 NJF6次级代谢产物的结构鉴定
化合物7: 浅黄色粉末, HR-ESI-MS谱给出准分子离子峰/249.1488([M+H]+, 计算值为249.1485), 结合氢谱碳谱数据确定其分子式为C15H20O3。该化合物的1H-NMR(CD3OD, 400 MHz) 数据如下:H7.42(1H, d,=7.2 Hz), 7.06(1H, d,=6.8 Hz), 5.47(1H, t,=6.6 Hz), 2.20(2H, dd,= 7.6, 14.8 Hz), 1.98(3H, s), 1.35(2H, dd,=7.0, 15.0 Hz), 0.95(6H, d,=6.4 Hz),13C-NMR(CD3OD, 100 MHz)数据如下:C155.9(C-1), 117.4(C-2), 121.9 (C-3), 130.2(C-3), 121.9(C-4), 130.2(C-5), 138.3 (C-6), 131.7(C-7), 135.4(C-8), 27.2(C-9), 39.9 (C-10), 28.9(C-11), 23.0(C-12), 23.0(C-13), 16.6 (C-14), 172.5(C-15), 该化合物数据与文献[14]报道一致, 鉴定为7-deoxy-7,8-didehydrosydonic acid (结构式见图1)。
化合物8: 浅黄色粉末, HR-ESI-MS谱给出准分子离子峰267.1596([M+H]+, 计算值为267.1552),结合氢谱碳谱数据确定其分子式为C15H22O4。1H-NMR(CD3OD, 400 MHz)数据如下:H7.45(1H, dd,=1.6, 8.0 Hz), 7.37(1H, d,=1.6 Hz), 7.27(1H, d,=8.0 Hz),1.60(3H, s), 0.95(2H, d,=6.4 Hz),13C-NMR(CD3OD, 100 MHz)数据如下:C169.9, 156.9, 138.0, 131.6, 127.8, 121.5, 118.6, 77.9, 43.6, 40.5, 29.0, 28.8, 23.0, 22.9, 22.9。该化合物数据与文献[15]报道一致, 鉴定为sydonic acid(结构式见图1)。
化合物9: 无色固体, HR-ESI-MS谱给出准分子离子峰164.1069([M+H]+, 计算值为164.1031), 提示其分子式为C10H13NO。1H-NMR(Pyr, 400 MHz)数据如下:H7.26(5H, m), 3.67(2H, dd,= 13.4, 7.2 Hz), 2.92 (2H, t,=7.2 Hz), 2.05(3H, s)。该化合物数据与文献[16]基本一致, 鉴定为N-乙酰苯乙胺(结构式见图1)。
化合物10: 白色无定形粉末, HR-ESI-MS谱给出准分子离子峰176.0694([M+H]+, 计算值为176.0706), 提示其分子式为C10H9NO2。1H- NMR(CD3OD, 400 MHz)数据如下:H7.54(1H, d,=8.0 Hz), 7.33(1H, d,=8.0 Hz), 7.15(1H, s), 7.09(1H, t,=7.6 Hz), 7.01(1H, t,=7.4 Hz), 3.73 (2H, s),13C-NMR(CD3OD, 100 MHz)数据如下:C119.4(C-2), 128.6(C-3), 108.9(C-3a), 119.8(C-4), 122.4(C-5), 124.6(C-6), 112.2(C-7), 138.0(C-7a), 31.9(C-8), 176.5(C-9)。该化合物数据与文献[17]报道基本一致, 鉴定为3-吲哚乙酸(结构式见图1)。
化合物11: 黄色无定形粉末, HR-ESI-MS谱给出准分子离子峰203.1123([M+H]+, 计算值为203.1179), 提示其分子式为C12H14N2O。1H-NMR(CD3OD, 400 MHz)数据如下:H7.55 (1H, d,=8.0 Hz), 7.32(1H, d,=8.4 Hz), 7.08(1H, t,= 6.2 Hz), 7.60(1H, s), 6.99(1H, t,=7.0 Hz), 3.46 (2H, t,=7.4 Hz), 2.94(2H, t,=7.2 Hz), 1.91 (3H, s)。该化合物数据与文献[18]报道基本一致, 鉴定为N-乙酰基色胺(结构式见图1)。
化合物12: 黄色油状物, HR-ESI-MS谱给出准分子离子峰122.0966([M+H]+, 计算值为122.0964), 提示其分子式为C8H11N。1H-NMR (CD3OD, 400 MHz)数据如下:H7.24(4H, m), 7.16 (1H, t,=7.0 Hz), 2.91(2H, t,=7.8 Hz), 2.56(2H, t,=7.8 Hz)。该化合物数据与文献[19]报道基本一致, 鉴定为苯乙胺(结构式见图1)。
化合物13: 白色粉末, HR-ESI-MS谱给出准分子离子峰146.0599([M+H]+, 计算值为146.0600), 提示其分子式为C9H7NO。1H-NMR (CD3OD, 400 MHz) 数据如下:H9.88(1H, s), 8.15 (1H, d,=8.0 Hz), 8.10(1H, s), 7.47(1H, d,=8.0 Hz), 7.25(2H, m)。该化合物数据与文献[20]报道基本一致, 鉴定为3-醛基吲哚(结构式见图1)。
化合物14: 黄色无定形粉末, HR-ESI-MS谱给出准分子离子峰138.0899([M+H]+, 计算值为138.0913), 提示其分子式为C8H11NO。1H-NMR(Pyr, 400 MHz)数据如下:H7.31(2H, d,=8.4 Hz), 7.16 (2H, d,=8.4 Hz), 3.13(2H, t,=7.6 Hz), 2.87(2H, t,=7.6 Hz)。该化合物数据与文献[21]报道基本一致, 鉴定为对羟基苯乙胺(结构式见图1)。
化合物15: 浅黄色粉末, HR-ESI-MS谱给出准分子离子峰261.1177([M+H]+, 计算值为261.1161), 提示其分子式为C14H16N2O3。1H-NMR (CD3OD, 400 MHz) 数据如下:H7.04(1H, d,= 8.4 Hz), 6.70(1H, d,=8.8 Hz), 4.36(1H,like), 4.04(1H, dd,=11.0, 7.4 Hz), 3.54(1H, m), 3.36 (1H, m), 3.06(2H, m), 2.19(1H, m), 1.80(2H, m), 1.21(1H, m)。该化合物数据与文献[22]报道基本一致, 鉴定为环(脯氨酸-酪氨酸)(结构式见图1)。
化合物16: 绿色固体, HR-ESI-MS谱给出准分子离子峰334.1501([M+H]+, 计算值为334.1511), 提示其分子式为C20H19N3O2。1H-NMR (Pyr, 400 MHz)数据如下:H8.07(1H, d,=8.0 Hz), 7.53(1H, d,=8.0 Hz), 7.31(1H, d,=8.8 Hz), 7.08—7.28(6H, m), 4.64(1H, m), 4.47(1H, m), 3.58(1H, dd,=14.4, 3.6 Hz), 3.23(1H, dd,=13.0, 3.4 Hz), 3.04(1H, q), 2.46(1H, dd,=13.4, 7.8 Hz),该化合物数据与文献[23]报道基本一致, 鉴定为环(苯丙氨酸-色氨酸)(结构式见图1)。
化合物17: 白色粉末, HR-ESI-MS谱给出准分子离子峰211.1435([M+H]+, 计算值为211.1441), 提示其分子式为C11H18N2O2。1H- NMR(Pyr, 400 MHz)数据如下:H4.22(2H, m), 3.53(2H, m), 2.28(2H, m), 2.17(2H, m), 1.79(1H, m), 1.67(2H, m), 0.95(3H, d,=4.8 Hz), 0.93(3H, d,=4.4 Hz)。该化合物数据与文献[24]报道基本一致, 鉴定为环(缬氨酸-脯氨酸)(结构式见图1)。
化合物18: 白色无定形粉末, HR-ESI-MS谱给出准分子离子峰245.0773([M+Na]+, 计算值为245.0784), 提示其分子式为C12H14O4。1H-NMR(CD3OD, 400 MHz)数据如下:H7.67(2H, q), 7.54(1H, t,=7.4 Hz), 7.46(1H, t,=7.2Hz), 4.07(2H, d,=6.4 Hz), 2.06(1H, m), 1.01(6H, d,=6.4 Hz)。该化合物数据与文献[25]报道基本一致, 鉴定为1,2-Benzenedicarboxylic acid(结构式见图1)。
化合物19: 黄色无定形粉末, HR-ESI-MS谱给出准分子离子峰123.0441([M+H]+, 计算值为123.0441), 提示其分子式为C7H6O2。1H-NMR (CD3OD, 400 MHz)数据如下:H8.02(1H, d,=7.2 Hz), 7.55(1H, t,=7.2 Hz), 7.44(1H, t,=7.6 Hz)。该化合物数据与文献[26]报道基本一致, 鉴定为苯甲酸(结构式见图1)。
化合物20: 无色固体。HR-ESI-MS谱给出准分子离子峰255.0646([M+H]+, 计算值为255.0613), 提示其分子式为C15H10O4。1H-NMR (Pyr, 400 MHz) 数据如下:H8.47(1H, d,=8.4 Hz), 8.17(1H, s), 7.86(1H, d,=8.4 Hz), 7.82(2H, d,=8.4 Hz), 7.29(2H, d,=8.4 Hz), 7.12(1H, d,=2.4 Hz)。该化合物数据与文献[27]报道基本一致, 鉴定为异黄酮类化合物7,4¢-二羟基异黄酮, 应是培养基成分(结构式见图1)。
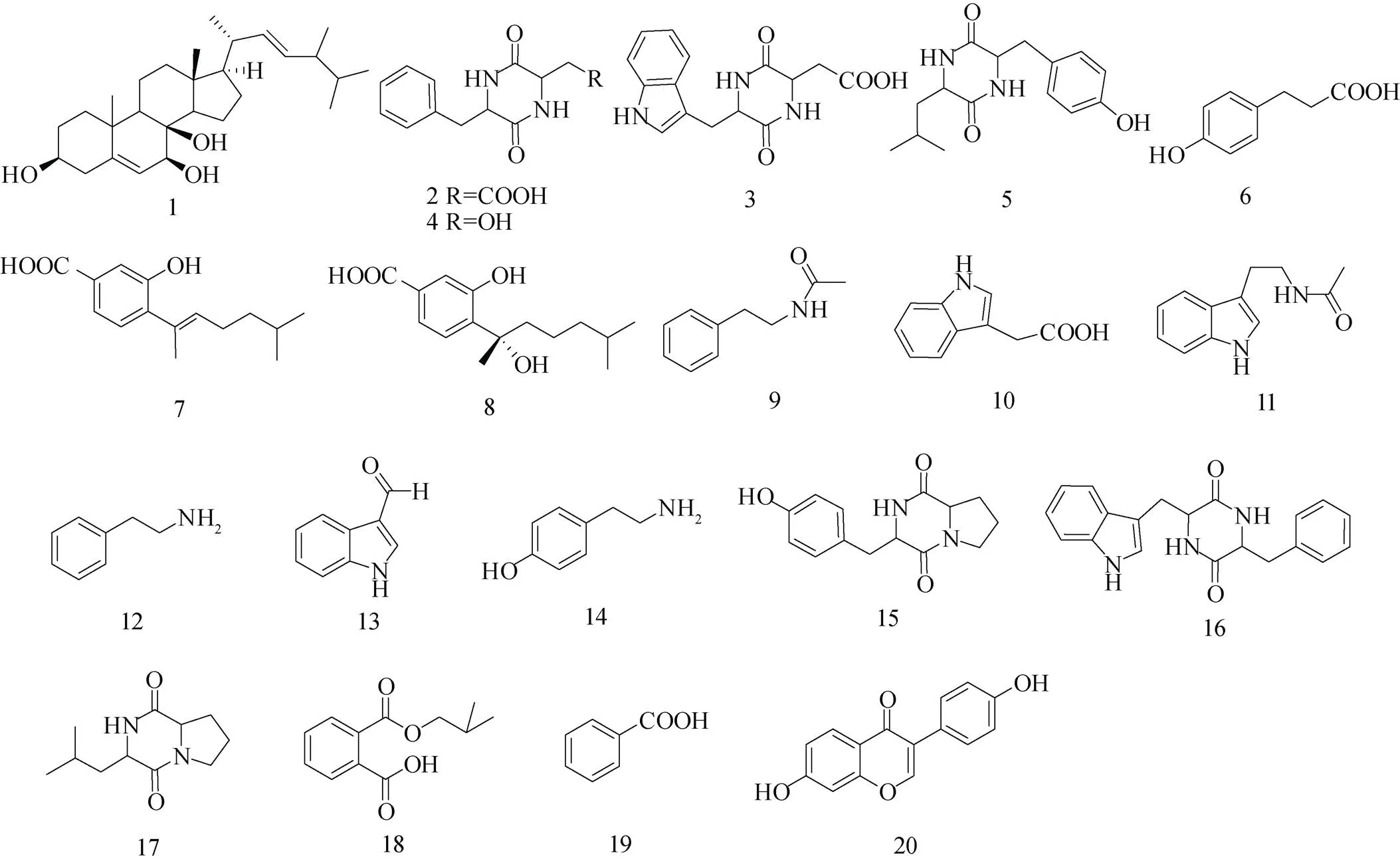
图1 从两株南极真菌中分离得到的化合物结构式. 1—6为NJF4中分离得到的化合物, 7—20为NJF6中分离得到的化合物
Fig.1. Structural formulas of compounds isolated from two Antarctic fungi NJF4 and NJF6. Compounds 1—6 were isolated from NJF4 and 7—20 were isolated from NJF6
3 结论与展望
近年来, 有多名学者对不同环境来源的枝孢霉属真菌的化学成分及活性进行研究, 并从中获得多种类型的化合物, Li等[28]前期从一株海藻内生菌EN-399中获得多个新的枝孢菌素, 该类化合物多具有抗菌及细胞毒活性, Wu等[29]从太平洋深海沉积物来源的一株真菌中获得5个新的聚酮类化合物cladosins A—E。Yu等[30]从南海灯芯柳珊瑚内生真菌中获得6个甾体及1个甾体皂苷, 其中新的孕甾烷3-hydroxy-7-ene-6, 20-dione具有潜在的抗病毒活性, Zhang等[31]从海南岛红树林木榄属植物的内生真菌.MA-299中获得4个12元大环内酯类新化合物, 该类化合物对水生菌及植物病原体均具有较好的抑制作用, 此外, 也有学者通过代谢调控的方法, 如给培养基中加入组蛋白去乙酰化酶抑制剂来改变菌株的代谢途径, 进而产生结构新颖的化合物, 李德海课题组利用此方法从马里亚纳海沟沉积物来源的L3P3中获得了4个特胺酸类化合物cladosins H—K, 其中一个化合物具有潜在的细胞毒活性[32]。本研究对南极普里兹湾海洋沉积物中获得的两株枝孢霉属真菌spNJF4和NJF6的次级代谢产物进行研究, 获得20个化合物。化合物结构类型包括甾醇(1)、倍半萜类(7—8)、生物碱类(9—14)、二酮哌嗪(2—5、15—17)、芳香酸(6、18—19)等, 其中倍半萜类(7—8)首次从枝孢霉属真菌中分离得到, 化合物12为苯乙胺, 是一种内源性神经胺, 被认为是人体的天然安非他明(PEA), PEA被认为在偏头痛、头痛和攻击性的病因中起着一定的作用[33]。化合物13为3-醛基吲哚, 对恰加斯病的病原体克氏锥虫起抑制作用, 显示出一定的抑制活性(IC50=26.9 μmol·L–1), 对Vero细胞具有中等的细胞毒性[34]。化合物14具有提升血压和兴奋子宫等药效作用 , 经过加工处理, 可用于治疗偏头痛和诊断嗜铬细胞瘤, 目前主要用于制做降低血脂药品Bezafibrate[35]。本研究虽然为丰富南极微生物次级代谢产物库奠定了一定的研究基础, 但两株菌株次级代谢产物种类较少, 获得的化合物结构类型与其他研究结果相比也较为简单, 猜测可能为单一的YPD培养基培养、且培养条件较为简单的缘故。虽然本课题组在前期也尝试过利用5种不同培养基对NJF6的代谢产物多样性进行分析, 并选择了代谢产物多样性最为丰富的YPD培养基作为发酵条件, 但是从研究结果来看, 仍然未得到较为复杂的结构。后期将进一步优化真菌的发酵条件, 尝试使用不同的海洋真菌培养基, 尝试适合的代谢调控方法, 扩大发酵规模并富集微量成分, 以期获得较为复杂的结构新颖性化合物。
综上所述, 对南极海洋来源真菌多样性及活性次级代谢产物的研究虽然取得了一定进展, 但与温带和热带真菌研究相比仍处于初级阶段, 缺少系统性和持续性。这可能是由于南极海洋极端的环境、样品采集困难等因素使南极海洋真菌多样性、次级代谢产物以及生态功能的研究受到了极大的限制。但已有的研究结果显示南极海洋真菌具有极大的物种资源和产生代谢产物的潜力, 因此有必要继续探索菌株分离的新方法, 同时采用新技术在物种多样性、功能基因挖掘和代谢产物调控等方面开展相关研究, 从而为南极海洋真菌资源的利用做出贡献。
1 张丽珉, 赵琳, 丛柏林. 南极罗斯海区域可培养微生物分离鉴定及产低温酶能力初步筛选[J]. 海洋学报, 2018, 40(8): 152-164.
2 BRIDGE P D, SPOONER B M. Non-lichenized Antarctic fungi: transient visitors or members of a cryptic ecosystem?[J]. Fungal Ecology, 2012, 5(4): 381-394.
3 REN J W, XUE C M, TIAN L, et al. Asperelines A–F, peptaibols from the marine-derived Fungus[J]. Journal of Natural Products, 2009, 72(6): 1036-1044.
4 LI L Y, LI D H, LUAN Y P, et al. Cytotoxic metabolites from the Antarctic psychrophilic fungus[J]. Journal of Natural Products, 2012, 75(5): 920-927.
5 WU G W, MA H Y, ZHU T J, et al. Penilactones A and B, two novel polyketides from Antarctic deep-sea derived fungusPRB-2[J]. Tetrahedron, 2012, 68(47): 9745-9749.
6 WU G W, LIN A Q, GU Q Q, et al. Four new chloro-eremophilane sesquiterpenes from an Antarctic deep-sea derived fungus,sp. PR19N-1[J]. Marine Drugs, 2013, 11(4): 1399-1408.
7 LIN A Q, WU G W, GU Q Q, et al. New eremophilane-type sesquiterpenes from an Antarctic deep-sea derived fungus,sp. PR19 N-1[J]. Archives of Pharmacal Research, 2014, 37(7): 839-844.
8 ZHOU H B, LI L Y, WANG W, et al. Chrodrimanins I and J from the Antarctic moss-derived fungusGWT2-24[J]. Journal of Natural Products, 2015, 78(6): 1442-1445.
9 WANG J F, WEI X Y, QIN X C, et al. Antiviral merosesquiterpenoids produced by the Antarctic fungusSCSIO 05702[J]. Journal of Natural Products, 2016, 79(1): 59-65.
10 黄金昌, 田晓清, 樊成奇, 等. 4株南极真菌的形态学和分子鉴定及其中3株的蛋白磷酸酶、脂肪酸成分分析[J]. 海洋渔业, 2017, 39(5): 562-570.
11 MITOME H, SHIRATO N, HOSHINO A, et al. New polyhydroxylated sterols stylisterols A-C and a novel 5, 19-cyclosterol hatomasterol from the Okinawan marine spongesp.[J]. Steroids, 2005, 70(1): 63-70.
12 李德海, 顾谦群, 朱伟明, 等. 海洋放线菌11014中抗肿瘤活性成分的研究I.环二肽[J]. 中国抗生素杂志, 2005, 30(8): 449-452, 468.
13 XIAO Y, WANG L B, JIN G, et al. Studies on phenolic acid constituents offruits [J]. Chinese Journal of Medicinal Chemistry, 2012, 22(3): 223-226.
14 BUNBAMRUNG N, INTARAUDOM C, SUPOTHINA S, et al. Antibacterial and anti-phytopathogenic substances from the insect pathogenic fungussp. BCC36964[J]. Phytochemistry Letters, 2015, 12: 142-147.
15 KUDO S, MURAKAMI T, MIYANISHI J, et al. Isolation and absolute stereochemistry of optically active sydonic acid fromsp. (Hysteriales, Ascomycota)[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(1): 203-204.
16 ZHAO P J, WANG H X, LI G H, et al. Secondary metabolites from endophyticsp. Lz531[J]. Chemistry & Biodiversity, 2007, 4(5): 899-904.
17 SUN D D, DONG W W, LI X, et al. Indole alkaloids from the roots ofand their antiherpes simplex virus type 2 (HSV-2) activity[J]. Chemistry of Natural Compounds, 2010, 46(5): 763-766.
18 WANG H, LIU T X, XIN Z H. A new glucitol from an endophytic fungusSalicorn 8[J]. European Food Research and Technology, 2014, 239(3): 365-376.
19 AL-REHAILY A J, AL-HOWIRINY T A, AHMAD M S, et al. Alkaloids from[J]. Phytochemistry, 2001, 57(4): 597-602.
20 周文婷, 谢海辉. 溪黄草的苯丙素、大柱香波龙烷、生物碱和烷基糖苷类成分[J]. 热带亚热带植物学报, 2018, 26(2): 185-190.
21 张建同. 海鞘降血脂有效部位的利用技术研究[D]. 上海: 上海海洋大学, 2015.
22 JAYATILAKE G S, THORNTON M P, LEONARD A C, et al. Metabolites from an Antarctic sponge-associated bacterium,[J]. Journal of Natural Products, 1996, 59(3): 293-296.
23 TULLBERG M, GROETLI M, LUTHMAN K. Efficient synthesis of 2,5-diketopiperazines using microwave-assisted heating [J]. Tetrahedron, 2006, 62(31): 7484-7491.
24 WANG C, TIAN X Q, YANG Q, et al. Diversity of secondary metabolites from two Antarctic microbessp. NJ-008 andsp. NJ-011[J]. Open Journal of Marine Science, 2014, 4(3): 214-220.
25 范彩虹, 葛发欢. 玛咔根脂溶性部位化学成分研究[J]. 中药材, 2015, 38(2): 318-322.
26 PAKRASHI A, KABIR S N, RAY H. 3-(4-hydroxy phenyl)-2-propenoic acid-a reproductive inhibitor in male rat[J]. Contraception, 1981, 23(6): 677-686.
27 PARK Y, MOON B H, YANG H, et al. Complete assignments of NMR data of 13 hydroxymethoxyflavones [J]. Magnetic Resonance in Chemistry, 2007, 45(12): 1072-1075.
28 LI H L, LI X M, MÁNDI A, et al. Characterization of cladosporols from the marine algal-derived endophytic fungusEN-399 and configurational revision of the previously reported cladosporol derivatives[J]. The Journal of Organic Chemistry, 2017, 82(19): 9946-9954.
29 WU G W, SUN X H, YU G H, et al. Cladosins A-E, hybrid polyketides from a deep sea-derived fungus,[J]. Journal of Natural Products, 2014, 77(2): 270-275.
30 YU M L, GUAN F F, CAO F, et al. A new antiviral pregnane from a Gorgonian-derivedsp. fungus[J]. Natural Product Research, 2018, 32(11): 1260-1266.
31 ZHANG F Z, LI X M, YANG S Q, et al. Thiocladospolides A-D, 12-membered macrolides from the mangrove-derived endophytic fungusMA-299 and structure revision of pandangolide 3[J]. Journal of Natural Products, 2019, 82(6): 1535-1541.
32 ZHANG Z Z, HE X Q, WU G G, et al. Aniline-tetramic acids from the deep-sea-derived fungusL3P3 cultured with the HDAC inhibitor SAHA[J]. Journal of Natural Products, 2018, 81(7): 1651-1657.
33 WOLF M E, MOSNAIM A D. Phenylethylamine in neuropsychiatric disorders[J]. General Pharmacology, 1983, 14(4): 385-390.
34 MARTÍNEZ-LUIS S, GÓMEZ J F, SPADAFORA C, et al. Antitrypanosomal alkaloids from the marine bacterium[J]. Molecules, 2012, 17(9): 11146-11155.
35 郁铭, 付春. 对羟基苯乙胺合成技术进展[J]. 精细与专用化学品, 2004, 12(12): 5-7.
SECONDARY METABOLITES from THE Antarctic FunGIsp. NJF4 AND NJF6
Chang Junnan1,2, Tian Xiaoqing2, Fan Chengqi2, Huang Jinchang2, Lu Yanan2, Han Qinghua2
(1Shanghai Ocean University, Shanghai 201306, China;2Key Laboratory of East China Sea & Oceanic Fishery Resources Exploitation and Utilization, Ministry of Agriculture, East China Sea Fisheries Research Institute, Shanghai 200090, China)
Antarctic microorganisms exhibit considerable uniqueness and biodiversity because of their harsh and special habitat. Their secondary metabolites have become an important source of bioactive substances. Research on polar microbial secondary metabolites has gradually increased in recent years, but still lags behind temperate and tropical microbial research. We conducted chemical analyses on two fungi (sp. NJF4 and NJF6) in marine sediments from Prydz Bay, Antarctica. Twenty compounds were isolated, including sterol (1), sesquiterpenes (7—8), alkaloids (9—14), diketopiperazines (2—5, 15—17), and aromatic acids (6, 18—19). The sesquiterpenoids (7—8) were isolated from this genus for the first time. This study provides a new theoretical basis to fully exploit the metabolic potential of the Antarctic microorganisms, and will play an important role in promoting research on the medicinal value of polar microbial resources.
Antarctic fungi, secondary metabolites, isolation and purification, structural identification
2019 年4 月收到来稿, 2019 年5 月收到修改稿
国家高技术研究发展计划(2012AA092105)资助
常俊男, 女, 1990 年生。硕士研究生, 研究方向为天然产物化学。E-mail: 13262601452@163.com
韩清华, E-mail: qh.han@outlook.com
10. 13679/j.jdyj.20190020
