紫草素抗雌激素对人乳腺癌MCF-7细胞周期蛋白D1表达的影响
2020-04-01高文雅陶仕英牛建昭赵丕文王燕霞饶晨晨
杨 阳 高文雅 陶仕英 牛建昭 赵丕文 王燕霞 饶晨晨 杨 蕾
乳腺癌是常见的女性恶性肿瘤之一,近年来其发生率和病死率呈不断上升的趋势,严重影响女性的身心健康[1]。研究表明,乳腺癌的发生与雌激素的刺激密切相关,降低患者体内雌激素水平可以抑制肿瘤生长[2]。临床多采用手术切除、放疗、化疗等治疗方法,但这些治疗方法对患者的身体均存在不同程度的损害,因此,寻找有效治疗肿瘤且不良反应小的抗肿瘤药物成为近年来研究的一个重要方向。紫草素(shikonin,SK)是一种萘醌类化合物,从中药紫草的根中提取,是紫草主要的有效成分。现代研究发现紫草素还具有抗炎、抗氧化、免疫调节、抗肿瘤等作用[3]。
雌激素信号通路在调节乳腺癌细胞增殖和凋亡中发挥着重要作用,ERα是雌激素信号通路中的关键因子[4,5]。多项研究表明,cyclin D1是可能受雌激素影响的重要细胞周期调控蛋白之一, ERα的促有丝分裂作用能够促进细胞和动物组织中细胞周期调节蛋白cyclin D1的表达[6,7]。笔者前期研究发现SK干预后通过调节cyclin D1周期蛋白可影响人宫颈癌SiHa细胞的周期,诱导细胞G0/G1期阻滞,MCF-7是ER阳性乳腺癌细胞,雌激素具有促进ER 阳性肿瘤增殖的作用[8,9]。本实验模拟雌激素存在的体内环境,研究SK对MCF-7细胞周期蛋白D1的影响。
材料与方法
1.药物:左旋紫草素购自中国食品药品检定研究所。原药品用无水乙醇作为溶剂配制,最终稀释浓度至(1×10-8)~(1×10-6)mol/L。阳性对照组雌二醇(estrodiol,E2)购自美国Sigma公司,用无水乙醇配制,最终稀释浓度为1×10-8mol/L[10]。
2.材料:高糖DMEM培养基(美国Hyclone公司);RPMI 1640 Medium(ATCC Modification,美国Gibco公司);胎牛血清(美国Gibco公司);活性炭-葡聚糖苷处理的胎牛血清(CDT-FBS,美国Hyclone公司);0.05%胰蛋白酶(美国Invitrogen公司);MTT(美国Sigma 公司);DMSO(美国Sigma 公司);Cyclin D1抗体(美国Proteintech公司)。
3.细胞培养:人乳腺癌MCF-7细胞购自北京协和医学院细胞中心。在含有10%胎牛血清的DMEM培养基溶液中常规培养,培养条件为5% CO2的培养箱,保持37℃恒温及相对饱和湿度。每隔3~4天进行传代,实验开始前4天用PBS洗涤,洗涤后改用无酚红DMEM(含5% CDT-FBS)培养液培养,使细胞对雌激素样物质的敏感度增加,同时可以减少来自细胞自身的雌激素对实验结果的干扰。细胞生长达到80%融合时,进行消化传代,选择对数生长期的细胞实验。实验分为空白对照组、紫草素处理组(SK组,1×10-6mol/L、1×10-7mol/L和1×10-8mol/L)、雌二醇处理组(E2组,1×10-8mol/L)。
4.免疫组织化学技术检测cyclin D1蛋白表达:MCF-7细胞消化后计数,以5×104个/毫升的细胞密度接种至24孔板。待细胞贴壁后,换含有1×10-8mol/L雌二醇和1×10-6mol/L、1×10-7mol/L、1×10-8mol/L SK的DMEM培养液培养48h后终止。吸去各孔培养基,每孔加入1ml PBS清洗3min×2次后,加入100μl的4%多聚甲醛固定20min,PBS清洗3min×3次;加入0.01%的Triton 于37℃恒温箱摇匀,孵育20min,PBS清洗3min×3次;加入0.3%的过氧化氢甲醇溶液,孵育10min,PBS清洗3min×3次;使用免疫组化试剂盒血清工作液进行封闭,20min后甩去;滴加一抗,冰箱4℃孵育,过夜后取出,用PBS冲洗5min;滴加二抗,37℃恒温箱孵育15min,PBS冲洗5min×3次;滴加辣根酶标记链霉素卵白素工作液,室温孵育15min,PBS冲洗5min×3次;DAB染色,避光放置10min,镜下观察,自来水冲洗后用苏木素复染10s,迅速冲洗。置于倒置显微镜下拍片,拍照前每孔加入1ml的PBS避免细胞干燥, 400倍放大倍数每孔随机选择6个视野,使用免疫组化软件Image pro plus进行灰度测量分析。
5.Western blot法检测cyclin D1蛋白的表达:MCF-7细胞消化计数后,以5×104个/毫升的细胞密度接种至24孔板。细胞贴壁后,换含有1×10-8mol/L雌二醇和1×10-6mol/L、1×10-7mol/L、1×10-8mol/L SK的DMEM培养液。药物作用48h后,在收集的细胞中加入细胞裂解液,12000×g离心5min,对上清液蛋白含量进行测定、分析。蛋白变性之后开始上样,SDS-PAGE 电泳(浓缩胶80V,分离胶120V),80V电压转膜75min。将PVDF膜置于5%的脱脂奶粉溶液中在37℃恒温箱振摇1h封闭,分别加cyclin D1、GAPDH一抗,4℃冰箱孵育过夜。加二抗(HRP 标记)在37℃恒温箱振摇1h后,将PVDF膜放入ECL混合液,在室温条件下水平摇床孵育5min,最后进行X线片曝光,显影、定影、扫描后,以GAPDH表达量为对照,Image pro plus软件观察分析结果,计算并统计各组灰度值。

结 果
1.免疫组织化学技术检测cyclin D1蛋白表达:紫草素作用MCF-7细胞48h后, cyclin D1蛋白棕黄色颗粒在细胞质和细胞核中有阳性表达。其中雌二醇组表达量与空白对照组比较显著增多;与空白对照组比较,SK各组表达较少,呈淡棕色,且cyclin D1蛋白表达量随着SK浓度的升高逐渐被抑制(P<0.05),详见图1。
2.Western blot法检测紫草素1×10-6mol/L、1×10-7mol/L、1×10-8mol/L不同浓度组对cyclin D1蛋白表达的作用:与空白对照组比较,紫草素作用MCF-7细胞48h后,3个药物浓度组1×10-6mol/L、1×10-7mol/L、1×10-8mol/L显著降低了cyclin D1的表达,并且随着浓度的升高表达量逐渐降低,其中1×10-6mol/L紫草素对cyclin D1表达的抑制作用最强(P<0.01),详见图2。
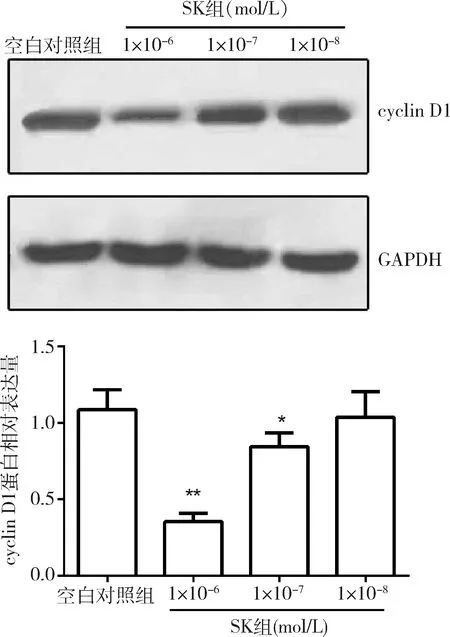
图2 紫草素作用后MCF-7细胞中cyclin D1蛋白的表达水平与空白对照组比较, *P<0.05, **P<0.01
3.Western blot法检测紫草素在雌二醇环境下对cyclin D1蛋白表达的影响:与空白对照组比较,雌二醇干预后,cyclin D1的蛋白表达量有所提高;经紫草素1×10-6mol/L单独作用后,cyclin D1的蛋白表达含量有显著降低(P<0.01);雌二醇干预后,SK对cyclin D1蛋白量的表达同样具有抑制作用(P<0.05),详见图3。
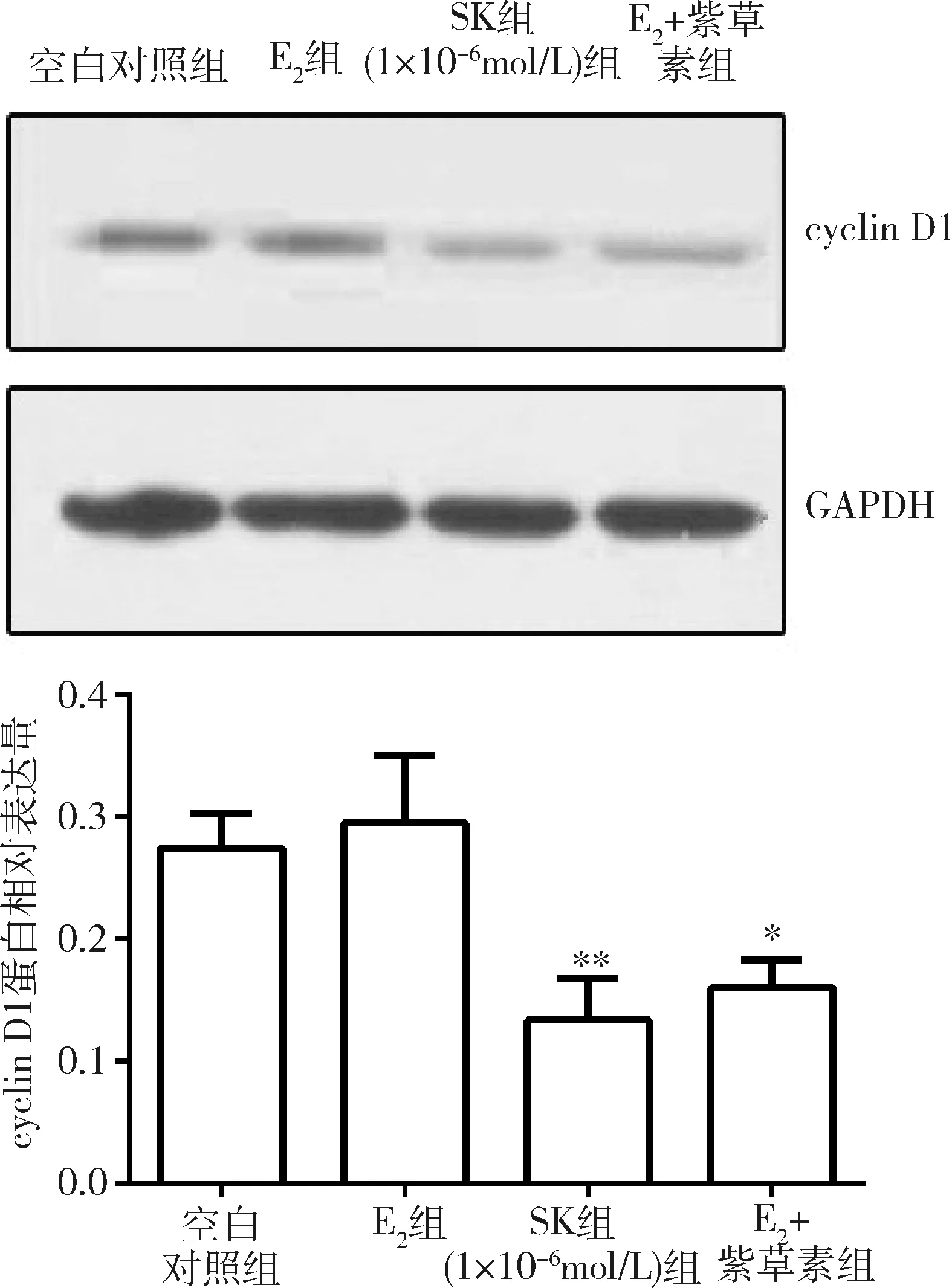
图3 紫草素对雌激素处理的MCF-7 cyclinD1蛋白表达的影响与空白对照组比较,*P<0.05, **P<0.01; E2+紫草素组;用1×10-8mol/L雌二醇处理后的SK组(1×10-6mol/L)组
讨 论
乳腺癌是一种雌激素依赖性的恶性肿瘤,雌激素效应主要受ERα介导基因组途径和非基因自途径的调节,ERα在乳腺癌增殖和凋亡中发挥重要作用,是一种经典的核受体途径[2]。研究发现,紫草素这种天然萘醌类化合物对ERα阳性表达的乳腺癌细胞具有抑制作用,但具体如何通过ERα信号通路发挥作用,还需要进一步研究和探讨[11,12]。
本实验结果显示,作用MCF-7细胞48h后, SK各浓度组与空白对照组比较,显著抑制了cyclin D1的表达,并且体现出浓度依赖性,即cyclin D1的表达量随着SK浓度的升高逐渐降低,其中1×10-6mol/L紫草素对cyclin D1表达的抑制作用最强(P<0.01)。同时,为了进一步完善此实验,探究在人体内雌激素作用条件下SK是否对乳腺癌还具有相同的抑制作用,本实验利用雌二醇模拟体内雌激素环境,探究雌二醇干预后,SK是否仍对MCF-7细胞中的cyclin D1蛋白具有抑制作用。该部分结果显示,与空白对照组比较,雌二醇单独作用条件下cyclin D1蛋白表达量有所提高; 1×10-6mol/L SK单独作用后,cyclin D1蛋白的表达量显著降低(P<0.01);雌二醇干预下,SK作用48h后,cyclin D1蛋白的表达量也有显著降低(P<0.05),这说明SK对MCF-7细胞中cyclin D1蛋白表达量的作用可能不受雌激素的影响,即在人体中SK可能会对乳腺癌具有非雌激素依赖性的抑制作用。
cyclin D1能够精确调控细胞周期,从而维持细胞正常生长发育平衡,与肿瘤的发生密切相关[13]。研究发现,cyclin D1异常表达可导致细胞周期调控失衡,细胞增殖失调,从而促进肿瘤形成[14]。cyclin D1是重要的正性调节因子,作用于G1期,参与细胞周期G1/S期调控,具体机制为cyclin D1在G1期与CDK4/CDK6结合,并使其活化,活化的CDK4/CDK6能使Rb磷酸化,磷酸化的pRb活化雌二醇F促进了DNA的合成,促使细胞由G1期进入S期,最终cyclin D1的表达能够促进细胞的分裂与增殖,当与其他基因或基因产物异常配合时,共同参与癌变的发生[15~17]。cyclin D1蛋白和乳腺的关系比较密切,研究显示将小鼠的胚胎干细胞CCND1基因敲除后发现虽然缺乏cyclin D1蛋白表达的小鼠仍具有生存和生育能力,但是存在妊娠期乳腺腺泡发育障碍和泌乳功能的缺失。周春等[18]采用免疫组织化学方法检测发现乳腺癌中cyclin D1蛋白阳性表达率明显高于良性乳腺组织。笔者前期的研究发现,紫草素对人宫颈癌SiHa细胞的增殖具有抑制作用, 其诱导G0/G1期阻滞的机制可能和cyclin D1蛋白有关[8]。黄彩梅等[19]研究发现,人子宫内膜癌Ishikawa细胞的增殖随着紫草素浓度的增加及作用时间的延长逐渐被抑制,紫草素可能是通过对雌激素信号通路中ERα、cyclin D1、c-myc蛋白表达的抑制,起到抑制Ishikawa细胞增殖的作用。这些结果都提示cyclin D1对乳腺癌细胞的发生、发展存在关键的调控作用,而紫草素有可能对cyclin D1蛋白具有抑制作用。
本研究从ERα信号通路角度出发,在前期发现的SK可影响ERα阳性乳腺癌MCF-7细胞周期,将细胞阻滞于G0/G1期的基础上,进一步探讨调控周期的作用机制,结果发现SK对cyclin D1的表达有抑制作用,并且这种抑制作用不受雌激素的影响,这为天然化合物从细胞周期角度调控ERα通路,进而调节cyclin D1的表达,最终破坏ERα阳性乳腺癌细胞的周期调控机制提供了一个可能性,但具体机制需要深入研究和探讨。
