基于α-FeOOH催化H2O2蒸气的低温烟气脱硝实验
2020-04-01何珊珊熊源泉杨思源盖洋洋
何珊珊,熊源泉,杨思源,盖洋洋
(东南大学能源热转换及其过程测控教育部重点实验室,江苏南京210096)
近年来,燃煤氮氧化物对大气环境造成了严重的危害,导致光化学烟雾、酸雨等一系列环境问题。据《2018 年世界能源统计年鉴解读》数据显示[1],煤炭在我国一次能源中占60.4%,其中80%以上的煤炭都用于直接燃烧,燃烧产生大量的。目前,燃煤锅炉多选用选择性催化还原(SCR)技术脱除,运行费用较高[3]。湿法烟气净化技术虽然可以在低温下脱除烟气中的SO2,但烟气中的NO 却无法得到有效脱除。因此,将NO转化为高价态易溶于水的氮氧化物是实现低温、高效湿法脱硝的关键[2,4],开发低温NO 预氧化系统已成为大气污染控制领域的重要研究方向[5]。
过氧化氢(H2O2)作为一种绿色氧化剂,近年来在烟气脱硝领域受到众多学者的广泛关注[6-9]。研究发现,过渡金属氧化物可以催化H2O2产生·OH,其标准氧化还原电位(2.80V)高于H2O2(1.77V)[10-11],可在低温下快速氧化。Zhong等[12-13]利用铁基催化剂催化H2O2脱硝,当H2O2流量为0.4mL/min 时对初始浓度为500μL/L 的NO 实现80%的脱除效率,但存在H2O2消耗大的问题。本文作者课题组为保证在一定NO脱除效率的情况下减少H2O2消耗量,在催化H2O2之前使H2O2汽化与烟气均匀混合,以混合气相经过催化剂进行催化氧化NO,之前采用Fe2O3和Fe2(SO4)3作为催化剂在自行设计的实验台架上取得了较好的脱硝效果[5,14-16],其中Fe2O3催化H2O2在H2O2和NO 的摩尔比为5 时,结合液相吸收NO的脱除率达到78%。
针铁矿(α-FeOOH)是分布最广的结晶铁(氢)氧化物之一,广泛存在于沉积物和沉积岩中[17]。在水体污染物处理技术中,α-FeOOH 是一种典型的类芬顿反应催化剂,可有效活化H2O2,提高大分子有机污染物处理能力[18]。然而,α-FeOOH 对H2O2蒸气的活化尚缺少系统的研究报道。α-FeOOH的表面基团包括两性铁羟基(Fe-OH),且比表面积大,具有活化H2O2蒸气的潜在优势[19-20]。因此,本文进行了以α-FeOOH 为类芬顿催化剂的低温预氧化NO实验研究,考察了不同实验工况条件下α-FeOOH 催化剂的性能,分析了液相氧化产物组分,并通过X 射线衍射、扫描电镜、比表面积、X光电子能谱和红外光谱等现代表征手段阐述了反应前后催化剂的理化特性。
1 实验材料和方法
1.1 实验试剂
双 氧 水 (H2O2, 质 量 分 数 为30%)、Fe(NO3)3·9H2O、NaOH,成都市科龙化工试剂厂,分 析 纯; 3000μL/L NO/N2、 10000μL/L SO2/N2、99.999%N2及模拟空气,南京上元气体有限公司。
1.2 催化剂制备
α-FeOOH 运用沉淀-水解法制备[21-23]。配制溶液方法如下:将A溶液(180mL 5mol/L氢氧化钠溶液)在不断搅拌中加入B溶液(100mL 1mol/L硝酸铁溶液)中,搅拌1min,加超纯水至2L,调节pH至12,再搅拌10min后加入具塞瓶中,在70℃下老化68h,然后过滤离心,再用超纯水洗涤至pH 为中性后,用无水酒精洗涤3 次,最后将沉淀物在100℃下干燥12h,研磨筛分至100目备用。
1.3 实验装置与方法
催化H2O2氧化脱硝实验在自行搭建的实验台上完成(图1)。实验模拟烟气由高纯氮、模拟空气、NO 和SO2混合而成,烟气总流量为1.5L/min,NO 初始浓度为500μL/L,氧气体积分数为7%,各组分气体经质量流量计按所需配比控制,流经混气罐混合,在烟气预加热管道段对烟气用电加热带进行加热。实验前,将H2O2溶液(质量分数为30%)与超纯水配制成所需的摩尔浓度,利用注射泵(型号BYZ-810)将H2O2溶液注入汽化管段(汽化处为直径为20mm 的圆球),H2O2加热汽化后与烟气混合一起经过反应段。反应段是一根内径2cm、长50cm 的石英玻璃管。将催化剂放置在反应段的布风板上,利用电加热带进行加热,烟气和H2O2混合气相经过催化剂时,发生式(1)~式(4)的反应[21]。H2O2被催化产生·OH。·OH具有强氧化性,快速氧化NO 成高价态氮氧化物,如式(5)~式(8)。尾气经撞击式吸收器收集预氧化后的液相产物用于后续测试,后经过冷凝装置和干燥器(在预氧化实验开始前测定初始NO 浓度为500μL/L,排除干燥剂等对实验的干扰),然后通入烟气分析仪(型号ecom EN2,NO 量程达5000μL/L,精密度为1μL/L)分析各组分含量。实验时烟气预热温度、汽化温度、反应温度由温度控制单元控制,烟气温度为140℃,催化剂为α-FeOOH粉末,质量为2g。
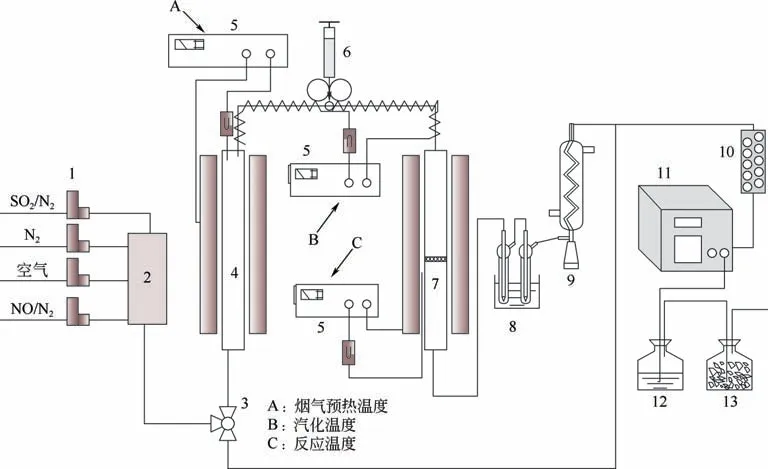
图1 氧化实验装置图
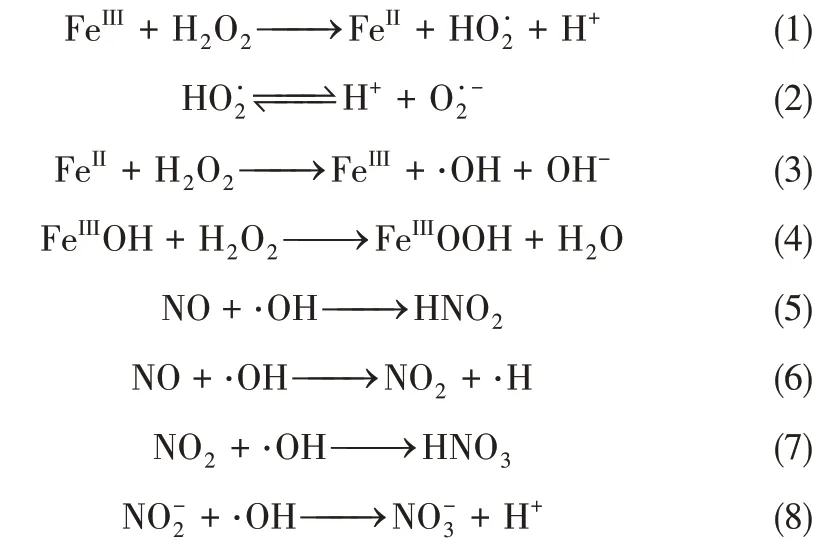
1.4 催化剂及氧化后液相产物表征
离子色谱(IC)测试采用美国Dionex ICS-900离子色谱仪;X射线衍射(XRD)测试采用日本理学Rigaku D/MAX 2500 PC型X射线衍射仪;X射线光电子能谱(XPS) 测试采用Thermo ESCALAB 250XI光谱仪;傅里叶转换红外线光谱(FTIR)采用NEXUS-670 型(NICOLET)红外光谱仪;催化剂比表面积和孔径(BET)采用美国仪器公司的ASAP2020 全自动比表面积及孔隙度分析仪;扫描电子显微镜(SEM)采用德国的LEO1530VP 型扫描电子显微镜。
1.5 数据处理
用烟气分析仪测定进出口的NO 浓度(反应开始1h后,测40min取平均值),NO的脱除效率按式(9)计算。

式中,η为NO 的脱除效率,%;Cin、Cout分别为进出口烟气中NO的浓度,μL/L。
2 实验结果与讨论
2.1 脱硝效率的测试与分析
2.1.1 H2O2流量的影响

图2 H2O2流量对于脱硝效率的影响
首先,在不使用催化剂的条件下考察H2O2流量对NO 脱除效率的影响。由图2可知,当H2O2流量从1.5mL/h增加到4mL/h时,NO的脱除效率随之从17.8%缓慢增加至32%,但仅靠H2O2本身的氧化作用,NO 的脱除效率整体较低。在相同实验工况条件下,加入2g α-FeOOH 催化剂后,NO 脱除效率均有大幅度提升,说明α-FeOOH 可提高H2O2对NO 的氧化能力。H2O2流量从1.5mL/h 增加到4mL/h的过程中,脱硝效率大体呈增长趋势。当流量为2.5mL/h 时,脱硝效率达76.4%;当流量为3mL/h时,脱硝效率比流量为2.5mL/h时略低,仅67.5%,但再增加H2O2流量脱硝效率又呈增加的趋势。因为·OH 是一种高反应性,强氧化性自由基,其不仅可与NO发生氧化反应,还可与分解过程中的多种物质发生湮灭反应(如·OH和H2O2)。NO的总氧化效率不仅与H2O2分解产生·OH 有关,还与·OH的湮灭反应有关[24]。体系内H2O2含量低时,氧化作用占主导,随着H2O2流量加大,产生的·OH增多,更多的·OH 与NO 发生反应,脱硝效率相应提高;当注入H2O2过量时,产生的·OH来不及与NO反应而直接与H2O2或·OH 本身发生反应,产生低氧化活性的HO·2和O2,如式(10)和式(11),对体系反应活性产生抑制影响,从而导致脱硝效率下降[24]。实验中流量增加至3.5mL/h 和4mL/h 时,实验结束后在汽化段有积液出现,说明注入的H2O2没有完全汽化,而预氧化效率升高的可能原因是汽化不完全,使得参与催化的H2O2少于注入的H2O2,从而产生的·OH 湮灭较少。因此,考虑H2O2的利用率和经济性,后续实验采用2.5mL/h的H2O2流量,且实验在2g催化剂作用下进行。
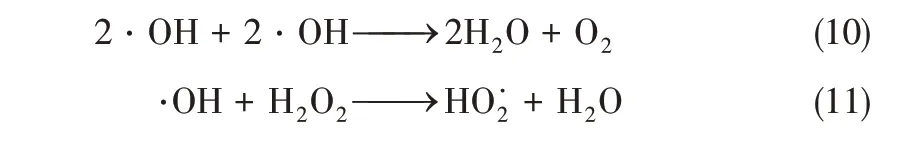
2.1.2 H2O2浓度的影响
在0~10mol/L 范围内选取0(只含超纯水)、2mol/L、4mol/L、6mol/L、8mol/L和10mol/L 的H2O2浓度,研究其对脱硝效率的影响。由图3可知,H2O2浓度是影响氧化NO效果的关键因素之一。当H2O2浓度为0时,NO脱除效率为0,说明催化剂本身无法氧化脱除NO。当H2O2浓度增加时,NO脱除效率随着H2O2浓度的增加而持续增加,在H2O2浓度为10mol/L时,对NO的氧化脱除效率达76.4%。因为随着注入H2O2浓度的增加,与催化剂接触的H2O2增多,产生的·OH 增多,对NO 的氧化作用增强,因此增加H2O2浓度有利于脱硝效率的提高。
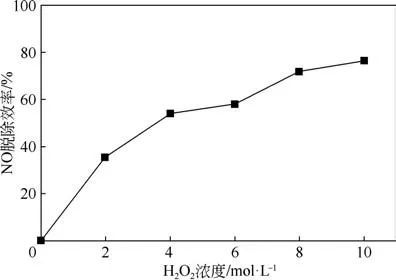
图3 H2O2浓度对于脱硝效率的影响
2.1.3 汽化温度的影响
实验时,通过加热使注入系统的H2O2溶液发生汽化,汽化温度对NO 脱除效率的影响如图4 所示。随着汽化温度的升高,NO 的脱除效率呈现先升高后降低的趋势。汽化温度从80℃升高到140℃时,脱硝效率从49.8%升高到76.4%。这是因为汽化温度过低时,注入的H2O2汽化不完全,参与反应的H2O2少于设计值,催化产生的·OH 少,使得NO 氧化效率低,实验现象也存在汽化温度较低时汽化管道会有H2O2溶液残留。当汽化温度高于140℃时,脱硝效率又逐渐降低。这是因为H2O2受热易分解,如式(12),O2氧化性低,不易与NO 快速反应,所以温度升高加速了H2O2分解,催化反应产生的·OH 减少,NO 脱除效率随之降低。所以实验选取较合适的140℃作为汽化温度。
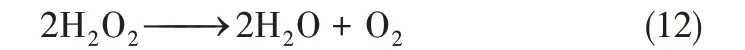
2.1.4 反应温度的影响

图4 汽化温度对于脱硝效率的影响
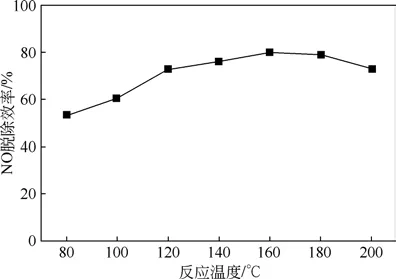
图5 反应温度对于脱硝效率的影响
在实验室规模的装置上,研究了反应温度对NO 脱除效率的影响,如图5 所示。当反应温度从80℃上升到160℃时,脱硝效率由53%上升到80%,温度继续升高后脱硝效率下降。造成上述现象的原因可能是:反应温度在低温时,H2O2蒸气受冷会发生液化吸附在催化剂表面,不利于催化氧化反应进行;适当升高反应温度,使烟气和H2O2蒸气在催化剂层中运动更剧烈,分散更均匀,与催化剂的接触效果更好,使得催化产生·OH 的效果更好,从而促进脱硝效率增加;而继续升高温度可能加速了·OH的湮灭,减弱了NO的氧化,所以过高的反应温度反而不利于NO的脱除。
2.1.5 烟气中O2和SO2共存对脱硝效率的影响
烟气共存气O2和SO2对NO 脱除效率的影响如图6所示。图6(a)是O2体积分数对脱硝效率的影响,O2体积分数从1%增加到9%,脱硝效率几乎没有变化,说明烟气中的O2对NO 的氧化作用微乎其微,在脱硝过程中起重要作用的是H2O2经催化剂后生成的·OH,同时验证了2.1.3 节中汽化温度升高过多时H2O2分解成O2和H2O会使脱硝效率降低。图6(b)是SO2浓度对脱硝效率的影响,为了研究在高硫气氛中该技术的应用前景,因此实验考察了0~3000μL/L浓度之间的SO2对NO脱除效率的影响。当SO2浓度从0 升高到1000μL/L 时,脱硝效率从76.4%上升到86.4%,说明低浓度的SO2对脱硝效率具有促进作用;而随着SO2浓度从1000μL/L升高到3000μL/L 时,NO 脱除效率下降,这是因为当SO2浓度过高时,SO2会大量消耗·OH,如式(13)和式(14),使得脱硝效率降低。
2.1.6 催化剂稳定性实验
催化剂长时间运行对NO 脱除效率的影响如图7 所示。随着反应时长的增长,NO 的脱除效率都保持在76%左右,没有发生明显变化,说明8h 反应过程中,催化剂活性一直保持稳定。
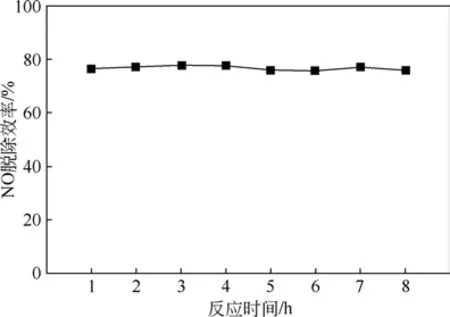
图7 反应时间对脱硝效率的影响
2.2 催化氧化后液相产物分析
通过撞击式吸收器冷凝收集催化氧化后的液相产物,利用IC 分析冷凝液中阴离子成分,结果如图8所示。
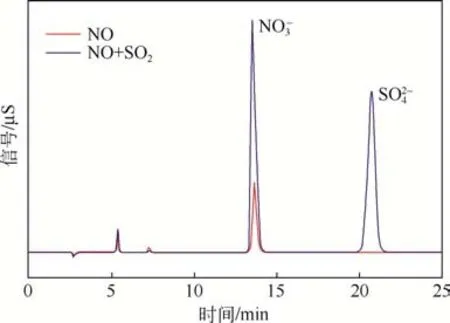
图8 氧化后液相产物的离子色谱图
由图8可见,在单独脱硝实验中,冷凝液中仅含有NO-3,几乎不含NO-2,说明·OH 有足够的氧化能力将NO氧化为HNO3,或者NO-2已在储存过程中被氧化。在同时脱硫脱硝实验中,氧化后的产物主要是和,且相比于单独脱硝的实验结果,氧化产物中的信号峰有明显提高。液相成分实验结果与2.1.5 节中的NO 脱除效率变化规律一致,进一步说明当α-FeOOH 作为催化剂时,低浓度SO2对NO脱除有一定的促进作用。
2.3 催化剂表征结果
2.3.1 XRD分析
反应前后催化剂的XRD谱图如图9所示。由图9可知,新鲜催化剂的衍射峰和α-FeOOH(JCPDS No.29-0713)的衍射峰一致,说明制备的催化剂是α-FeOOH且成型良好。反应8h后催化剂的XRD谱图没有明显变化,晶体结构符合α-FeOOH的结构,这说明催化剂在反应过程中具有很好的稳定性。
2.3.2 SEM分析
采用SEM 对反应前后催化剂的表观形貌进行分析,结果如图10 所示。新鲜催化剂主要是直径在50~100nm的针状体结构[图10(a)和图10(b)],长度在800~1000nm,说明催化剂的形貌尺寸较为均匀。在实验8h 后,催化剂样品的SEM 图如图10(c)和图10(d)所示,主体结构没有发生明显变化,但反应后催化剂顶部的针状结构消失,直径变粗,大部分为100nm左右。上述形貌变化表明,较细棒体的催化剂在催化反应中逐渐团聚,催化剂表面的团聚造成催化剂活性比表面积的减少。
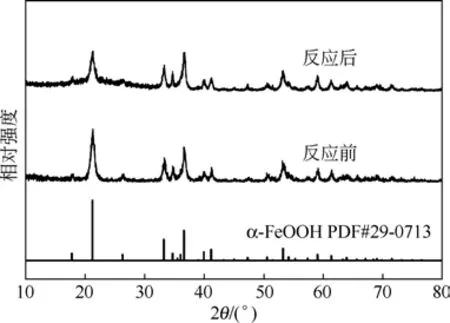
图9 反应前后催化剂的XRD谱图

图10 反应前后催化剂SEM图
2.3.3 XPS分析
催化剂长时间(8h)反应前后的XPS测试结果如图11 所示。图11(a)为α-FeOOH 的Fe 2p 谱图,谱图由卫星峰(718.5eV)的Fe 2p2/3和Fe 2p1/2组成,结合能710.5eV和724eV对应Fe(Ⅲ)峰[25-27];由图11(b)可以看出,N1s 谱图上只在406.8eV 处出现了一个峰,此处峰的结合能属于的结合能,说明催化反应后催化剂表面有硝酸盐附着[16]。
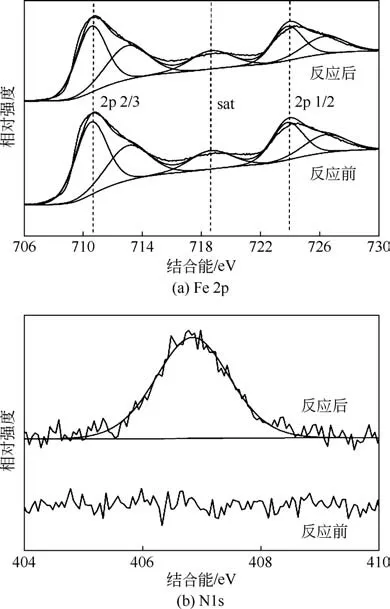
图11 反应前后催化剂XPS谱图
2.3.4 FTIR分析
长时间反应前后以及同时脱硫脱硝后的FTIR谱图如图12 所示。由谱图可以看出,催化剂的特征峰基本保持一致。催化剂在3140cm-1处的伸缩振动吸收峰归因于α-FeOOH的表面羟基[28],3400cm-1处振动吸收峰属于表面H2O分子的拉伸模态或氢键表面OH 基团的包络而形成的[28-29]。在1630cm-1、890cm-1、790cm-1、630cm-1处 振 动 吸 收 峰 属 于α-FeOOH 的Fe OH 和Fe OH Fe 特征吸收峰[28-33],峰形均尖锐对称,说明催化剂产品结晶良好。FTIR分析与2.3.1节中对催化剂样品的XRD分析一致,证实了催化剂的物相组成为α-FeOOH。需要注意,1380cm-1处是N O 的振动吸收峰,反应前后的变化说明在实验中生成了并吸附在催化剂表面[34],这与XPS结果吻合;同时脱硫脱硝后催化剂在1125cm-1处出现了基团的振动吸收峰,说明脱硫脱硝反应后在催化剂表面产生了硫酸盐[29]。

图12 反应前后催化剂FTIR谱图
2.3.5 BET分析
图13为催化剂长时间反应前后的N2吸附-解吸等温线和孔径分布曲线,图线显示样品均为Ⅳ型吸附等温线,并且存在H3 型回滞环,说明催化剂形成了窄狭缝形状的介孔。在相对压强为0.9 时吸附量发生急剧上升说明催化剂中存在大孔[33],结合孔径分布图说明催化剂的孔隙主要为介孔,其他也存在大孔。表1显示了催化剂在反应前后的孔结构变化,其中催化剂的比表面积较大,易于催化反应的进行,反应前后比表面积、孔容和平均孔径基本变化不大,说明在反应中催化剂没有发生大面积团聚和孔堵塞现象,在反应中催化剂的孔隙结构都较稳定。

表1 催化剂反应前后孔结构参数
3 结论
本文研究了α-FeOOH 催化H2O2的脱硝性能,主要结论如下。
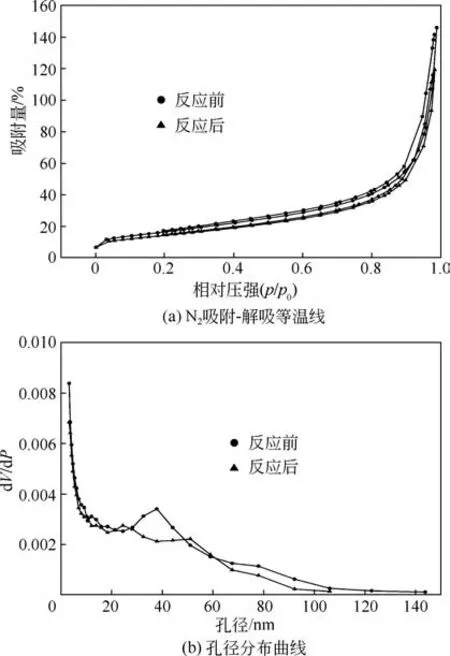
图13 催化剂长时间反应前后的N2吸附-解吸等温线和孔径分布曲线
(1)α-FeOOH可有效催化H2O2产生·OH,提高脱硝反应效率。H2O2流量和浓度对脱硝效率有明显影响,当H2O2流量一定时,增加H2O2浓度可有效促进脱硝效率;当H2O2浓度一定时,存在最优H2O2流量使得脱硝效率达到最大,以2.5mL/h 注入10mol/L H2O2时脱硝效率达到76.4%。汽化温度适当升高促进了H2O2汽化和与烟气的均匀混合,从80℃升高到140℃时,NO脱除效率从48.9%上升到了76.4%;当反应温度从80℃升高到160℃时,NO去除效率从53%上升到了80%,进一步提高汽化温度和反应温度,脱硝效率反而降低,温度过高和过低都不利于·OH的产生和反应。
(2)同时脱硫脱硝实验结果表明,少量SO2可以促进NO 的脱除,SO2浓度在1000μL/L 时脱硝效率达到86.4%,其后继续升高SO2浓度会导致脱硝效率降低,而O2浓度变化对脱硝效率的影响甚微。
(3)离子色谱测试表明,催化氧化后主要的液相氧化产物为HNO3和H2SO4。
(4)表征结果表明,长时间反应后α-FeOOH的结构和表面特性保持不变,具有较强的稳定性,α-FeOOH作为催化剂有较强的实用性和发展潜力。
