慢性砷暴露诱导小鼠肺结构损伤和免疫失衡
2020-04-01李秀娟仪慧兰曾群
李秀娟,仪慧兰,曾群
(1.山西大学 生命科学学院,山西 太原 030006;2.山西大学 环境与资源学院,山西 太原 030006; 3.山西中医药大学 基础医学院,山西 太原 030024)
砷是环境中广泛存在的一种类金属元素。自然过程或人为因素(如采矿、金属冶炼等)导致砷在一些地区的空气、水或土壤中含量较高[1-2]。砷可通过呼吸吸入、食物和饮水摄入、皮肤吸收进入人体,其中饮用含砷水是人群砷摄入的主要途径[3-4]。据不完全统计,地下水砷含量超出世界卫生组织(WHO)饮用水标准(10 μg/L)的国家有105个,暴露人群达2亿人[5]。我国约有1960万人面临着饮用高砷水的健康风险[6]。流行病学调查显示,长期饮用高砷水可引起呼吸急促、支气管扩张、肺功能下降等症状,诱发慢性咳嗽、肺炎、慢阻肺等呼吸道疾病[7-9],增加肺癌的发生率和死亡率[5,10-11]。研究表明,大鼠饮用含砷水4周后,肺组织发生炎性病理损伤[12]。小鼠灌胃含砷水或饮用含砷水后,肺促炎细胞因子及CD4+T细胞亚群分化相关基因表达改变[13]。小鼠孕期饮水砷暴露会影响子鼠肺脏发育,使肺容积、肺泡数量及表面积均明显减小,肺黏液分泌(Clca3, Muc5b, Scgb3a1)、先天免疫(Reg3γ, Tff2, Dynlrb2, Lplunc1)及形态发生(Sox2)相关基因表达上调[14]。体外实验证明,砷可改变人原代支气管上皮细胞(HBE)免疫球蛋白的表达,降低肺上皮抵抗细菌感染的能力[15];砷还可诱导巨噬细胞M2极化,促进人支气管上皮细胞(BEAS-2B)间质转化[16]。经口摄入砷可对肺脏产生毒效应,但慢性暴露对肺结构及功能的影响目前还少见报道。
现有研究认为,砷摄入会破坏机体原有的氧化还原平衡,砷诱发的炎症、疾病及机体功能紊乱大多与其诱导的活性氧(ROS)水平增高相关[17-18]。本实验以小鼠为研究对象,检测了长期饮水摄入砷后小鼠肺的氧化应激、组织结构及免疫相关基因表达水平,探讨砷对肺脏的损伤效应,为揭示慢性饮水砷暴露对呼吸道的毒性作用机制提供实验依据。
1 材料和方法
1.1 动物染毒及取材
模拟居民饮水砷污染,实验动物采用自由饮用三价砷化物亚砷酸钠(NaAsO2)水溶液的方式摄入砷。考虑到大部分实验动物比人更耐受砷[19-20],同时结合课题组的前期研究,确定实验组的染毒剂量(以砷计)为5 mg/L(略高于目前我国高砷暴露地区饮用水砷含量)或50 mg/L,对照组小鼠饮用蒸馏水。24只4周龄C57BL/6雄性小鼠(15±2 g,购于中国食品药品检定研究院),按体重随机分为3组(n=8),标准条件饲养一周后开始染毒。实验期间小鼠自由饮水,喂食山西医科大学提供的全价营养颗粒饲料,连续染毒180 d。染毒结束禁食12 h后,1%的戊巴比妥钠麻醉小鼠,称重、解剖,迅速取出肺组织,预冷的PBS(pH 7.4)漂洗后,左大叶肺于4%中性甲醛中固定,其余的肺组织液氮冷冻后-80℃保存。
1.2 石蜡切片的制备
固定好的肺组织经梯度酒精脱水、二甲苯透明、石蜡包埋后切片,苏木素-伊红(H&E)染色,光学显微镜下观察。
1.3 组织氧化指标测定
取100 mg左右冻存的肺组织,冰浴匀浆后3 500 r/min低温离心15 min,取上清用于氧化指标的测定。丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)活性及总抗氧化能力(T-AOC)测定均严格按试剂盒(南京建成)说明进行,蛋白含量采用考马斯亮蓝法测定[21]。
1.4 总RNA提取及定量PCR(qPCR)
Trizol法提取肺组织总RNA,去除基因组DNA后,以oligo dT为引物反转录合成cDNA。参照qPCR试剂说明建立20 μL的反应体系,每个样本设两个重复进行基因扩增。以β-actin为内参,采用2-ΔΔCt法[22]计算基因的相对表达量。IFN-γ基因(NM_008337)引物序列为F-P:5′AGCAACAGCAAGGCGAAAA-3′;R-P:5′CTGGACCTGTGGGTTGTTGA-3′,其余基因引物序列参照文献[23]。
1.5 统计分析
采用SPSS 21统计软件分析数据,结果以Mean± SE表示。One-way ANOVA 法检验各组之间的差异显著性。*P<0.05,**P<0.01表示处理组与对照组间的差异显著;#P<0.05,##P<0.01表示50 mg/L As组与5 mg/L As组间的差异显著。
2 结果与分析
2.1 染毒小鼠一般情况
根据饮水量和体重计算5 mg/L As组和50 mg/L As组小鼠的砷摄入量分别为0.82 mg/(kg·d)和4.82 mg/(kg·d)。整个实验期间小鼠生长状况良好,未出现死亡。与对照组相比,砷染毒后小鼠肺脏重量与体重的比值(脏体比)未发生显著性变化。
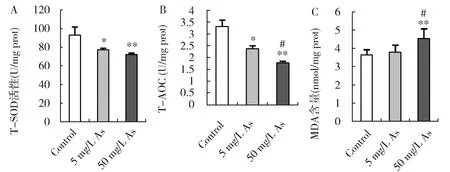
图1 砷暴露对小鼠肺组织T-SOD活性(A)、T-AOC(B)和MDA含量(C)的影响Fig.1 Effects of arsenic on T-SOD activity (A) T-AOC (B),and MDA content (C) in mouse lungs

注:A:对照组; B:5 mg/L As组; C:50 mg/L As组图2 小鼠肺组织切片(×200,标尺=100 μm)Fig.2 Characteristics of the mouse lungs
2.2 砷对小鼠肺组织的氧化损伤效应
小鼠饮用含砷水180 d后,肺组织T-SOD活性和T-AOC均显著降低,50 mg/L As组小鼠肺MDA含量显著增高(图1),表明砷暴露抑制了活性氧清除酶T-SOD活性及组织总抗氧化能力,打破了肺组织细胞的氧化还原平衡,造成肺组织氧化损伤。
2.3 砷对小鼠肺组织结构的影响
观察肺组织结构发现,对照组小鼠肺泡结构清晰,肺泡空间大,肺泡壁较薄(图2A);5 mg/L As组小鼠的肺泡囊缩小,肺泡隔增厚,肺组织有炎性细胞浸润(图2B);50 mg/L As组小鼠肺泡囊普遍较小,肺泡隔明显增厚,并伴有肺泡隔的断裂和融合,炎性细胞明显增多(图2C)。结果表明,饮水砷暴露诱发了小鼠肺脏组织结构的损伤,且损伤具有剂量依赖性。
2.4 砷对小鼠肺IFN-γ基因转录的影响
IFN-γ是辅助性T细胞1(Th1)的标志性细胞因子,作为强有力的巨噬细胞活化因子,可促进炎症的发生。与对照组相比,5 mg/L As组小鼠肺IFN-γ mRNA水平有增高趋势,但未出现显著差异,50 mg/L As组IFN-γ mRNA水平呈极显著增高(图3),表明一定水平的砷摄入可诱导肺组织中促炎细胞因子IFN-γ的表达。此结果与肺组织结构炎性损伤结果(图2)一致。
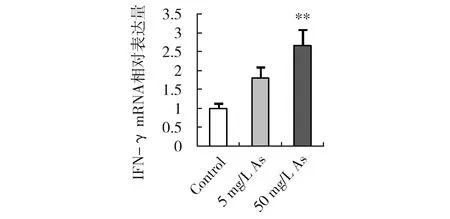
图3 砷暴露对小鼠肺组织IFN-γ基因转录的影响Fig.3 Effects of arsenic on IFN-γ mRNA level in mouse lungs
2.5 砷对小鼠肺Th2细胞因子基因转录的影响
Th2细胞主要分泌IL-4、IL-5及IL-13等细胞因子,其中IL-4是决定Th2细胞分化的关键细胞因子。IL-4、IL-5和IL-13基因在5 mg/L As组表达水平无明显改变,在50 mg/L As组均显著降低(图4A-C),说明高剂量砷能抑制肺组织中Th2细胞因子的转录。同期,IL-4/IFN-γ mRNA比值显著下降(图4D),提示砷暴露组小鼠肺组织出现了免疫失衡,表现为Th1反应增强,Th2反应抑制。
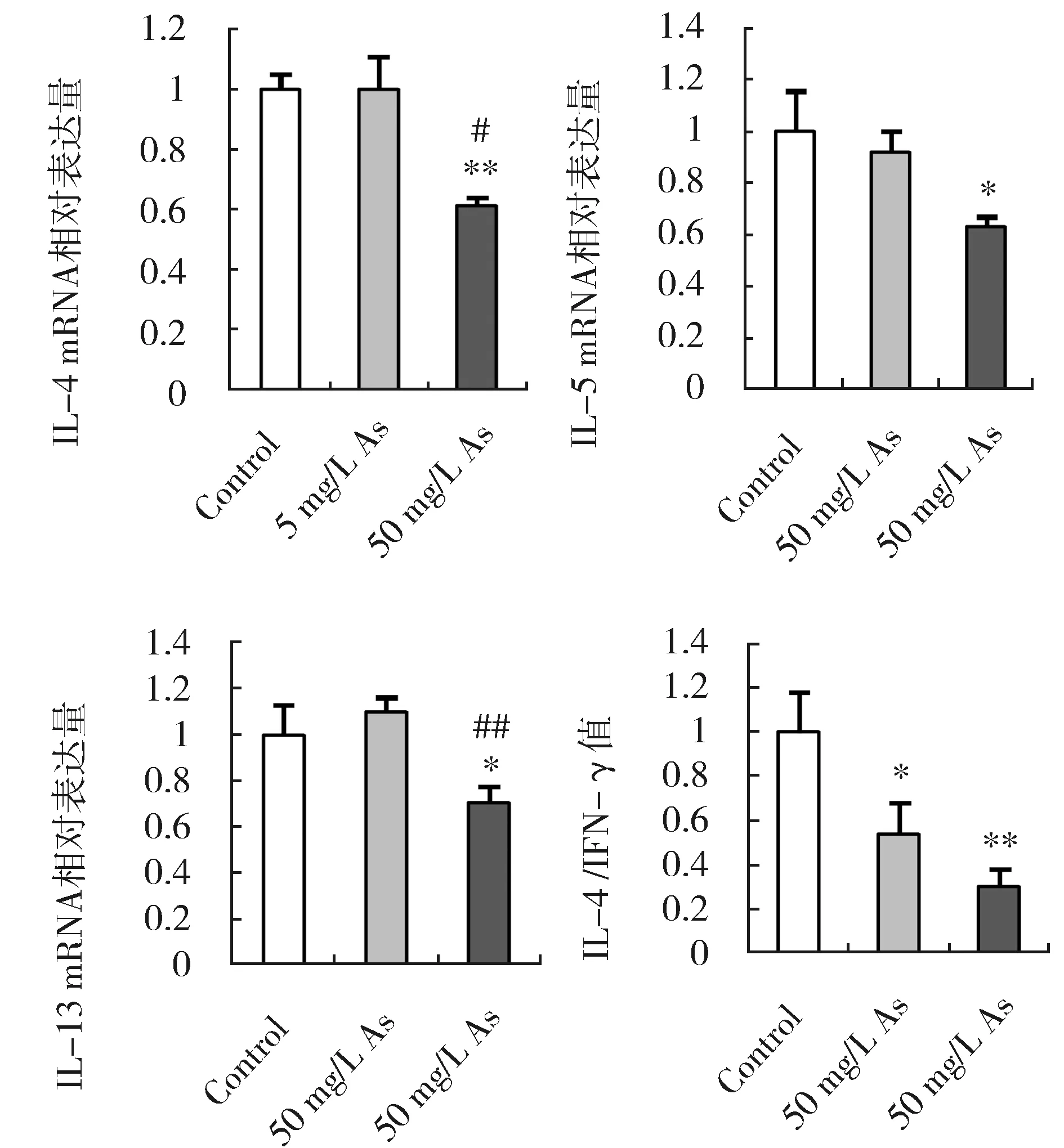
图4 砷暴露对小鼠肺组织IL-4,IL-5和IL-13基因转录及IL-4/IFN-γ值的影响Fig.4 Effects of arsenic on the mRNA levels ofTh2 cytokines and the ratio of IL-4/IFN-γ mRNA in mouse lungs
3 讨论
高砷地下水广泛存在于世界各地,通过饮水慢性摄入砷可诱导机体多个器官或组织损伤[5,18]。本研究表明,通过饮水摄入砷会造成小鼠肺组织结构损伤及免疫失衡,砷对肺脏的毒效应可能与砷暴露引发的细胞氧化损伤相关。
无机砷在细胞内的甲基化代谢过程会产生大量ROS[18]。此外,砷对巯基(-SH)有很高的亲和力,可以与含-SH的功能蛋白、酶及小分子化合物发生反应,干扰细胞的正常代谢,抑制多种抗氧化酶活性及抗氧化物质水平,最终导致ROS水平的增加[5]。ROS可攻击细胞的蛋白质、脂类和DNA等生物大分子,破坏分子结构,引起细胞生理功能紊乱,诱导疾病的发生。本研究砷组小鼠肺T-SOD活性及总抗氧化能力下降,说明砷摄入抑制了内源性抗氧化酶及抗氧化物质的活性,机体清除自由基的能力下降,使同期体内产生的过量自由基不能及时清除,引发肺脏组织氧化损伤,MDA升高。已有研究表明,白藜芦醇可通过提高机体抗氧化能力缓解砷摄入对大鼠肺组织的损伤[24]。因此,我们推测本研究砷暴露引起肺组织结构的改变可能与其诱导的氧化损伤相关。
已有研究表明,高水平的ROS可诱导促炎细胞因子的表达,诱发炎症[25]。本研究在小鼠饮用含砷水180 d后检测到IFN-γ表达水平的升高,并观察到肺组织中炎性细胞浸润,表明砷摄入引发了小鼠肺脏的炎症反应。炎症发生时往往会伴随中性粒细胞的增多,而坏死的中性粒细胞会释放蛋白溶解酶,破坏肺泡弹性纤维,导致肺泡弹性减弱,影响正常呼吸。砷染毒组小鼠肺脏组织中增厚的肺泡隔和缩小的肺泡囊会影响肺部气体交换,导致肺功能下降。本实验动物肺脏炎症和病理性损伤与砷暴露人群中出现的呼吸急促、肺功能下降、慢性咳嗽、肺炎等症状一致。
辅助性T细胞亚群Th1和Th2的平衡在炎症和免疫过程中发挥重要作用。Th1细胞主要参与细胞免疫,介导细胞毒和局部炎症相关的免疫应答;Th2细胞可促进IgE介导的超敏反应和体液免疫应答。Th2细胞可通过负反馈调节机制抑制Th1免疫反应而发挥抗炎作用,而Th2免疫反应的减弱也会促进Th1驱动的炎症发生[26]。本研究小鼠饮水砷暴露180 d后,5 mg/L As组肺IL-4/IFN-γ mRNA比值显著降低,50 mg/L As组IFN-γ mRNA水平极显著增高,Th2细胞因子基因表达均显著下调,IL-4/IFN-γ mRNA比值极显著降低,表明长期饮水摄入砷可引起小鼠肺组织Th1/Th2免疫失衡,表现为Th1炎症反应增加,Th2抗炎反应减弱。已有文献报道,昆明小鼠单次灌胃2.5-10 mg/kg NaAsO2水溶液,24 h后肺组织Th2优势应答,抗炎反应增强;C57BL/6小鼠连续饮用100 mg/L NaAsO2水溶液90 d后,肺Th1和Th2细胞因子均被诱导表达[13]。上述文献中急性和亚慢性砷暴露的肺免疫反应与本研究结果不同,可能与所选小鼠的品系、染毒剂量及染毒时间不同有关[27]。
4 结论
长期经口摄入一定剂量的砷可诱导小鼠肺氧化损伤,引起肺组织结构改变和免疫失衡。低剂量砷摄入造成了轻微的肺组织病理损伤;摄入高剂量砷诱导了肺组织脂质过氧化损伤和免疫失衡,Th1炎症反应加强,小鼠肺组织损伤加重。
