黄连素通过靶向GRP78增强结肠癌细胞对5-氟尿嘧啶的敏感性
2020-04-01剌晓琴金晓弟张立超李卓玉
剌晓琴,金晓弟,张立超,李卓玉,,*
(1.山西大学 生物技术研究所,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006; 3.山西大学 生物医学研究院,山西 太原 030006)
0 引言
黄连素,又称为小檗碱,是一种异喹啉类的植物性生物碱,作为黄连的主要活性成分,长期以来被用作非处方口服药物治疗肠道感染和腹泻[1],又因其抗菌、抗高血脂、抗糖尿病、抗炎和抗氧化等多种功效的显现而被开发为临床药物[2-3]。随着研究的深入,小檗碱的抗肿瘤作用也逐渐得到认可,尤其是作为临床肿瘤治疗的辅助药物。Pandey等发现黄连素通过靶向胃癌细胞中的Survivin和STAT3增强了5-Fu的化疗敏感性[4];Yu等发现黄连素通过抑制NF-κB的表达增强了肠癌细胞对伊立替康的敏感性[5];Palmieri等也证实了黄连素在增强喉癌细胞HEP2对5-Fu和顺铂敏感性方面具有一定作用[6]。肿瘤在化疗过程中对药物敏感性的减弱及其在治疗过程中所产生的副作用是癌症治疗中急需解决的问题,而黄连素增强化疗敏感性的分子机制一直没有得到深入的研究,因此探讨黄连素增强化疗敏感性的机制将有助于其在肿瘤临床的应用。
葡萄糖调节蛋白78(GRP78)是内质网中重要的应激蛋白,在肿瘤缺氧、缺糖以及酸性微环境的刺激下,结肠癌、乳腺癌、肝癌、胃癌、食道癌、脑癌、前列腺癌和黑素瘤等多种类型的肿瘤中会发生GRP78的高表达[7-9]。不仅胞内高水平的GRP78会促进肿瘤细胞抵抗凋亡,逃逸免疫,形成耐药性[10-11],同时过表达的GRP78在逃过内质网回收系统的监视而被分泌到胞外后也能促进肿瘤生长进程[12]。研究表明,肿瘤分泌型GRP78能够激活内皮细胞中的ERK和Akt信号,帮助血管内皮细胞抵御硼替佐米的凋亡诱导作用[13];还能够通过骨髓间充质干细胞表面的TGF-β1受体,激活细胞内TGF-β/Smad信号,促使骨髓间充质干细胞向肿瘤相关成纤维细胞分化[14];也能够诱导巨噬细胞向具有M2型特征的肿瘤相关巨噬细胞方向极化[15]。由此可见,肿瘤分泌型GRP78对肿瘤微环境具有强大的改造功能。因此,如果能够干预肿瘤细胞中GRP78的分泌,阻断其对微环境的影响,将有助于增强化疗药物的抗肿瘤作用。
本文旨在阐明黄连素抑制GRP78分泌的分子机制,为以GRP78为靶向的肿瘤治疗提供一定的理论基础,也为基于肿瘤微环境的药物开发提供新的思路和方向。
1 材料与方法
1.1 试剂与抗体
药品:黄连素(纯度质量分数为98%)购于中国百灵威科技有限公司;5-氟脲嘧啶(5-Fu,纯度质量分数≥99%)和MTT购于美国Sigma公司;结晶紫和三磷酸腺苷溶液购于中国索莱宝公司。
培养基和血清:RPMI-1640、DMEM培养基和胎牛血清购于美国GIBCO公司。
试剂盒:外泌体提取试剂盒购于美国Thermo Fisher公司;ATP酶活性测定试剂盒购于苏州科铭生物技术有限公司。
抗体:Caspase-7(WB: 1∶1 000)抗体购于美国CST公司;GRP78(WB: 1∶1 000)抗体购于中国武汉三鹰生物技术有限公司;GAPDH(WB: 1∶5 000)、CD63(WB: 1∶1 000)抗体购于英国Abcam公司。
1.2 细胞培养
人结肠癌细胞系DLD1、HCT-116培养于37℃,体积分数为5% CO2,湿度饱和的恒温培养箱中。所用培养基中均含有体积分数为10%胎牛血清和体积分数为1%青链霉素。
1.3 rGRP78蛋白的诱导表达和纯化
为了模拟分泌型GRP78,我们构建了原核表达的重组GRP78(rGRP78),具体的蛋白体外表达与纯化步骤详见参考文献[16]。
1.4 纳米粒子示踪技术(NTA)
使用德国ZetaView PMX 110纳米颗粒跟踪分析仪可实时直接通过光学显微镜收集观测纳米颗粒的散射光信号,然后对其在溶液中的布朗运动进行拍摄,最后对每个布朗运动的粒子进行追踪及分析,快速准确地计算出外泌体的流体力学半径及浓度。具体操作步骤为:收集无血清条件培养基,并在4℃下4 000 r/min离心30 min,然后将上清液在PBS中稀释至250倍。设置仪器参数并将测试样品加入比色杯中测量。每种样品溶液的体积达到1.5~2 mL。样品的测量时间为1 min。
1.5 分子对接
从中医药数据库(http:∥tcm.cmu.edu.tw)中检索黄连素的化合物结构,应用Chemdraw软件画出黄连素分子结构,并用Cherm3D进行能量优化,最终利用AutoDockTools软件将文件转化为PDBQT格式。从PDB数据库中调取GRP78不同结构域的蛋白结构数据,并去除其配体分子、水分子及无关紧要的金属离子等。在Linux终端下运行Autodock 4.2 软件,依次加载GRP78蛋白的不同结构域和能量优化后的黄连素,用Autogrid计算格点能量,对接运算采用拉马克遗传算法,各化合物与蛋白之间的结合情况用半经验的自由能评价方法评价。参数设置过程中,将参数“能量最大评价次数”确定为2 500 000,运行次数确定为100,其他参数采用软件的默认设置,最终获得对接结果。
1.6 数据统计与分析
结果中的数据均为3次独立试验所得结果的均值±标准差(Mean±SD),使用单因素方差分析(ANOVA)检验各组之间的差异,并使用Student’st比较两组之间差异的显著性,P<0.05,P<0.01被认为具有统计学意义。
2 结果
2.1 分泌型GRP78阻断了黄连素对5-Fu的化疗增敏作用
5-Fu是临床上常用的癌症化疗药物[17]。我们利用MTT、克隆形成实验评估了黄连素在5-Fu抗肿瘤中的作用。结果表明虽然黄连素在低浓度下对HCT-116和DLD1细胞没有明显的作用,但是在与5-Fu联合用药后,以浓度依赖的方式显著抑制了结肠癌细胞的存活(图1A和1B)。进一步的克隆形成及western blot结果表明,黄连素和5-Fu联合用药明显抑制了结肠癌细胞的克隆形成能力,促进了凋亡相关蛋白Caspase-7的激活(图2A和2B)。这些数据表明黄连素可以增强5-Fu的抗肿瘤作用。但在培养基中添加rGRP78蛋白后,黄连素对5-Fu的增敏作用减弱(图1A,1B,2A和2B),表明分泌型GRP78能够阻断黄连素的化疗增敏作用。
2.2 黄连素抑制了HCT-116和DLD1细胞中GRP78外泌体的分泌
肠癌细胞经不同浓度的黄连素处理24 h后,收集其培养基检测了GRP78的分泌量。结果显示,黄连素以浓度依赖的方式抑制了HCT-116和DLD1细胞中GRP78的分泌(图3A和3B)。肠癌细胞中GRP78主要以外泌体的形式被分泌到胞外[12],因此为了检测黄连素是否抑制了GRP78进入外泌体,我们将培养基中的外泌体分离,并通过Western blot检测了外泌体中GRP78的变化情况。结果表明:黄连素处理后外泌体中GRP78的量明显受到了抑制,但是作为外泌体中特异性标记物的CD63并没有受到黄连素作用的影响,表明黄连素对GRP78的作用是特异的(图3C和3D)。GRP78分泌量的减少可由外泌体数目的减少引起,也可能是由GRP78进入外泌体的数量减少而导致,进一步利用NTA即使检测黄连素处理前后外泌体的粒径和数目,结果显示:黄连素的处理没有影响外泌体的大小和浓度(图3E)。这些结果表明黄连素很可能抑制了GRP78被分选入外泌体而阻断其分泌。

(A、B) 利用MTT实验检测经不同浓度的黄连素和5-Fu单独处理、二者联合处理或者40 nmol/L rGRP78同时处理24 h后,HCT-116和DLD1细胞的存活率,*P<0.05,**P<0.01。图1 分泌型GRP78对黄连素与5-Fu协同效应的逆转作用(A, B) MTT assays were used to detect the cell viability.HCT-116 and DLD1 cells were treated with different doses of berberine or 5-Fu alone,or in combination in the presence or abscence of rGRP78 (40 nmol/L) for 24 h, *P<0.05,**P<0.01Fig.1 Secreted GRP78 reversed the synergistic effect of berberine and 5-Fu

(A) 利用克隆形成实验检测经黄连素、5-Fu单独处理或者二者联合处理以及40 nmol/L rGRP78同时处理7 d后,HCT-16和DLD1细胞的克隆形成能力。 (B) HCT-116和DLD1细胞如A所述处理24 h后,利用western blot检测细胞中Caspase-7的变化。图2 分泌型GRP78阻断了黄连素对5-Fu的化疗增敏作用(A) Colony forming experiments were performed for HCT-116 and DLD1 cells treated with5 μmol/L (10 μmol/L) berberine or 20 μmol/L (100 μmol/L) 5-Fu alone,or in combination in the presence or absence of 40 nmol/L rGRP78 for 7 days.(B) Western blot was used to detect the level of Caspase-7 in HCT-116 andDLD1 cells treated as described in A for 24 hFig.2 Secreted GRP78 blocked the chemotherapeutic sensitization of berberine on 5-Fu
2.3 黄连素分子和GRP78的ATP酶结构域发生了相互作用
基于上述结果推测:黄连素增强5-Fu的抗肿瘤效应可能是通过与肿瘤细胞中GRP78发生了直接的相互作用,影响了其被分选进入外泌体。为了证明这一推测,利用分子对接技术进行虚拟对接分析,结果显示黄连素能够与GRP78相互结合(图4A)。为了进一步确认这一现象,黄连素-Fe3O4磁珠与rGRP78和经黄连素处理后的细胞裂解液孵育后进行pulldown实验,随后用GRP78抗体通过免疫印迹检测。结果表明:黄连素不仅与体外纯化的rGRP78结合,也能与内源性的GRP78结合(图4B和4C)。
已知GRP78的N端含有ATP酶结构域,能够将ATP水解成ADP,在C端有底物结合结构域,能够特异性结合有七肽序列的多肽[18-19]。因此,针对GRP78的两个特异性结构域构建GRP78的两个截短体GFP-GRP78-N280和GFP-GRP78-C(400-654)(图4D)后将其转入细胞,利用黄连素-Fe3O4进行pulldown实验来进一步检测黄连素与GRP78结合的结构域。结果表明:含有ATP结合位点的GFP-GRP78-N280和完整的GRP78蛋白能够与黄连素发生相互作用,而含有多肽结合结构域的GFP-GRP78-C(400-654)截短体不能与黄连素结合(图4E)。
上述结果表明,黄连素与GRP78的结合位点位于GRP78的ATP酶结构域,所以推测:黄连素可能与ATP竞争性地结合GRP78。再利用rGRP78与黄连素-Fe3O4去确定黄连素是否可以竞争性地抑制ATP结合到GRP78。结果表明随着ATP浓度的增加,黄连素与GRP78的结合逐渐减少(图4F)。由此可见,黄连素确实以竞争性结合的方式与GRP78存在相互作用,且该相互作用为非共价结合。这些结果进一步表明黄连素与GRP78的ATP酶催化结构域存在相互作用。
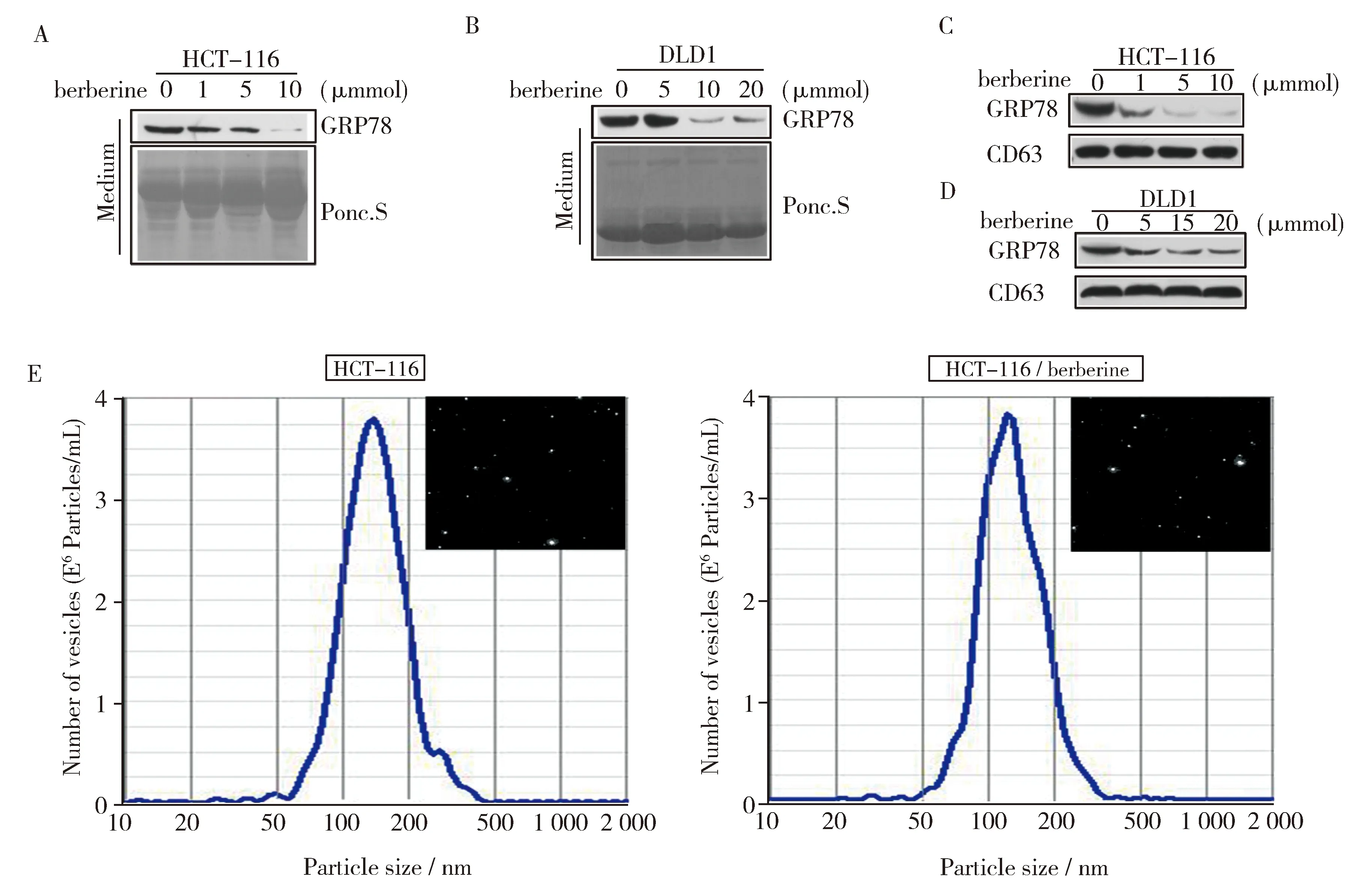
(A、B) 利用western blot检测经黄连素处理后,HCT-116和DLD1细胞培养基中GRP78的变化。(C、D) 利用western blot检测黄连素处理后,HCT-116和DLD1细胞外泌体中GRP78蛋白的变化。(E) NTA技术检测5 μmol/L黄连素处理后HCT-116细胞外泌体中大小和数目的变化。图3 黄连素抑制了GRP78以外泌体的形式分泌(A, B) Western blot of GRP78 levels in the culture supernatants of HCT-116 and DLD1 cells treated with berberine.(C, D) GRP78 protein levels were analyzed by western blot in exosomes of HCT-116 and DLD1 cells treated with berberine.(E) NTA was used to detect the size and number of exosomes in HCT-116 cells treated with 5 μmol/L berberine.Fig.3 Berberine inhibited the secretion of GRP78 via exosomes
2.4 黄连素抑制GRP78的ATP酶活性并通过构象转换调节GRP78的功能
由于ATP的结合和水解对于维持GRP78蛋白的活性是必需的[20],因此我们检测了黄连素对rGRP78的ATP酶活性的影响。结果显示随着黄连素浓度的升高,GRP78的ATP酶活性随之减弱(图5A),表明黄连素与GRP78结合后可以抑制其ATP酶活性。研究表明,在哺乳动物细胞中,GRP78以可相互转化的寡聚体和单体形式存在[21],单体形式是可以与未折叠蛋白质结合的活性形式。以寡聚体形式存在的GRP78为失活状态,但与ATP结合后可转化为有活性的单体形式[22]。我们的研究结果也显示随着ATP剂量的增加,可以有效地将HCT-116细胞内二聚体GRP78转化为单体(图5B),而黄连素的加入则诱导了胞内GRP78由活性的单体形式转化为无活性的二聚体形式(图5C和5D)。为了进一步验证黄连素与ATP之间对于GRP78的竞争性作用,将ATP和黄连素与HCT-116细胞共同孵育,结果显示:ATP可促进GRP78单体的形成,而黄连素的加入会消除ATP的作用,使得GRP78转化为失活的二聚体形式(图5E)。这些结果表明,黄连素可以通过与ATP竞争性的结合抑制GRP78的ATP酶活性,进而引起其构象的改变。
3 讨论
黄连素用于抗肿瘤主要是与各种抗癌药物联合使用起到增效减毒的作用。Pan等发现黄连素通过抑制AMPK-HIF-1α来逆转乳腺癌对多柔比星的化疗耐药性[23];Zhang等发现黄连素通过增加ROS水平逆转HER2阳性乳腺癌细胞对拉帕替尼的耐药性[24];Wen等也发现黄连素能够通过上调P21的表达来增强乳腺癌细胞对他莫昔芬的敏感性[25]。从上述研究可以看出,黄连素在逆转肿瘤耐药方面具有重要作用,但对于相应机制的研究还停留在相对粗浅的阶段,首先,对黄连素的具体作用靶点以及作用机制没有明确的结论;其次,对黄连素逆转耐药的机制探讨,主要聚焦在肿瘤细胞本身,而忽视了实体肿瘤的重要组成部分-肿瘤微环境的作用。本研究发现GRP78能够作为黄连素的作用靶点,它与GRP78的ATP酶结构域发生直接的相互作用,而这种作用通过特异性抑制GRP78的ATP酶活性而实现。GRP78蛋白质以多种形式存在,单体形式反映了GRP78的最大活性,而各种二聚体或低聚物显示了较低活性或无活性的GRP78[20]。我们的结果显示黄连素可以使GRP78从活性的单体形式转化到无活性的二聚体或寡聚形式。这些结果表明黄连素可能是参与了细胞中GRP78功能的调节,而GRP78功能的丧失便使其无法进入分选途径而分泌到胞外发挥促肿瘤作用。
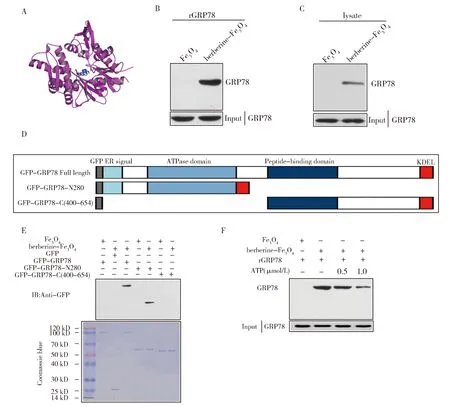
(A) 黄连素与GRP78相互作用的分子对接结果。(B、C) 利用竞争性结合实验检测berberine与GRP78的相互作用。将rGRP78和HCT-116细胞裂解液分别与berberine-Fe3O4耦合磁珠在4℃下孵育过夜,使用GRP78抗体通过免疫印迹确认二者的相互作用。(D) GRP78全长及其截短体的示意图。(E) 黄连素与GRP78相互作用结构域的确认。GFP-GRP78、GFP-GRP78-N280和GFP-GRP78-C(400-654)质粒转染HCT-116细胞48 h后,将细胞裂解液与berberine-Fe3O4耦合磁珠在4℃下孵育过夜,使用GFP抗体(上图)和考马斯蓝染色(下图)分析二者的相互作用。(F) rGRP78与berberine-Fe3O4耦合的磁珠在4℃孵育过夜,将ATP(0.5或1 μmol/L)加入到反应体系中并在25℃下温育30 min。使用GRP78抗体通过蛋白质印迹分析二者的相互作用。图4 黄连素能够与GRP78相互作用(A) Molecular docking results of the interaction between berberine and GRP78.(B, C) rGRP78 protein and the lysate of HCT-116 cells wereincubated with berberine-Fe3O4 beads overnight at 4℃, respectively.The interaction between GRP78 and berberine was confirmed by immunoblotting using GRP78 antibody.(D) Schematic representation of the full length of GRP78 and its truncation.(E) GFP-GRP78, GFP-GRP78-N280 and GFP-GRP78-C (400-654) plasmids were transfected into HCT-116 cells for 72 h,and the cell lysate was incubated with berberine-Fe3O4 beads overnight at 4℃.The interaction was analyzed using GFP antibody (top panel) and Coomassie blue staining (bottom panel).(F) rGRP78 and berberine-Fe3O4 beads were incubated overnight at 4℃. ATP (0.5 or 1 μmol/L) was added to thereaction solution and incubated for 30 min at 25℃. The interaction was analyzed by western blot using GRP78 antibody.Fig.4 Berberine interacted with GRP78

(A) 不同浓度的黄连素与rGRP78共孵育后,检测黄连素对rGRP78的ATP酶活性的影响, *P<0.05,**P<0.01。(B) ATP对GRP78构象的影响。将不同剂量的ATP (1,10或30 μmol/L)与HCT-116细胞于25℃下在25 μL反应混合物中(20 mmol/L HEPES (pH 7.0))孵育30 min后,使用非变性凝胶电泳进行GRP78的构象变化分析。(C、D) 黄连素对HCT-116和DLD1细胞中GRP78构象的影响。(E) 将ATP(10 μmol/L)和不同剂量的黄连素(1,5或10 μmol/L)一起温育。蛋白质在非变性凝胶上分离,随后通过免疫印迹进行检测。M,单体;D,二聚体。图5 黄连素对GRP78的ATP酶活性和构象的影响(A) ATPase activity of rGRP78 was examined, *P<0.05, **P<0.01.(B) ATP concentrations on the conversion of the GRP78 dimer to a monomer in HCT-116 cells.Different doses of ATP (1, 10 or 30 μmol/L) with HCT-116cells were incubated for 30 min at 25℃ in a 25 μL reaction mixture [20 mmol/L HEPES (pH 7.0)].The analysis for conformational changes was performed using non-denaturing gel electrophoresis.(C, D) Effect of berberine on the conformation of GRP78 in HCT-116 and DLD1 cells.(E) ATP (10 μmol/L) was incubated with different doses of berberine (1, 5 or 10 μmol/L).Proteins were separated on non-denaturing gels and subsequently detected by immunoblotting. M, monomer; D, dimer.Fig.5 Effects of berberine on ATPase activity and conformation change of GRP78
GRP78在多种肿瘤中的过度表达使其在肿瘤中的定位发生了变化。研究表明在细胞膜、胞质、肿瘤分泌物等都发现有GRP78的存在,而其定位的异常对肿瘤的发生发展起到了明显的促进作用[26-27]。因此,GRP78抑制剂的寻找可能是肿瘤治疗的趋势。目前临床药物主要是针对实体瘤发挥抗肿瘤作用,有一些报道已经显示Isthmin可作为细胞表面GRP78的抑制剂[28-29],HA15和HK40A可作为胞内GRP78的抑制剂[30-31],但针对肿瘤分泌型GRP78的抑制剂却鲜有报道。已有研究表明GRP78可作为胃癌的血清诊断指标[32],而且它有强大的改造肿瘤微环境的功能[33],所以分泌型GRP78抑制剂的筛选也就成为肿瘤治疗中亟待解决的任务。本研究首次发现了黄连素可以作为分泌型GRP78的抑制剂,阻断其被进入外泌体进而被分泌到胞外,从而达到改善肿瘤微环境的目的。因此,黄连素可以用作辅助药物与靶向肿瘤的抗癌药物相结合以治疗肿瘤。
4 结论
本研究发现使用外源纯化的rGRP78蛋白模拟肿瘤分泌型GRP78可以逆转黄连素在5-Fu抗肿瘤中的协同效应,表明黄连素可能是通过抑制GRP78分泌发挥化疗增敏作用。进一步的机制研究证实了黄连素增强5-Fu的抗肿瘤效应是通过与肿瘤细胞中GRP78发生了直接的相互作用,抑制了GRP78的ATP酶活性,导致了GRP78活性的丧失,进而影响了GRP78被分选进入外泌体,从而使肿瘤细胞失去了通过分泌型GRP78调控微环境的能力,增强了肿瘤细胞对化疗药物的敏感性。这表明GRP78是导致肿瘤细胞对化疗药物不敏感的重要原因,而黄连素能够通过直接靶向GRP78发挥逆转肿瘤耐药的作用。
