磷硫代siRNA的抗肿瘤基因沉默活性研究
2020-04-01王均,黄震
王 均, 黄 震
(四川大学生命科学学院 生物资源与生态环境教育部重点实验室, 成都 610065)
1 引 言
2018年8月11日,在RNA干扰现象被发现20周年之际,首例siRNA药物Patisiran通过美国FDA审批并正式上市[1-2].功能核酸在疾病治疗,预防和诊断领域中掀起医药革命的浪潮.虽然未修饰的功能核酸(例如siRNA)介导的基因沉默具有无限潜力,但化学修饰通常被用来改善siRNA的代谢稳定性,体内递送和药代动力学特性,主要包括2′-甲氧基修饰(2′-O-Me)、2′-氟基化修饰(2′-F)、2′-氧烯丙基修饰(2′-O-allyl)、2,4-二硝基苯基醚修饰(2′-O-DNP)、4′-硫代修饰(4′-S)、硫磷代修饰(phosphorothioate linkages, PS)和5-溴尿嘧啶修饰(5-bromouracil)[3]等.其中,磷硫代修饰(硫原子取代磷酸位点的非桥键氧原子,即磷酸酯基PO变为硫代磷酸酯基PS)因能有效提高siRNA的核酸酶抗性而被广泛应用于基因功能鉴定和临床试验等研究领域[4].目前,硫磷代siRNA(PS-siRNA)的合成方式主要有两种:化学合成和体外酶促转录合成,由于硫代磷酸酯基(PS)是具有手性的,其可产生Sp和Rp两种不同的非对映异构体[5],因此,化学合成PS-siRNA时,如不控制底物单体的立体特异性,通常会得到具有不同生化性质的PS-siRNA混合物,且目前尚无高效合成立体特异性硫磷代寡聚核苷酸的化学合成体系[6].此外,相关研究发现化学合成得到的PS-siRNA的基因敲除活性与天然siRNA相当[7]或更低[8],且具有较明显的细胞毒性[9].与化学合成相比,Griffiths等人发现:用T7 RNA聚合酶体外转录合成磷硫代RNA时,T7 RNA聚合酶能特异性识别并结合-磷硫代核苷三磷酸(NTPaS)的Sp异构体,在RNA延伸过程中,其发生构型翻转,最终得到Rp型的磷硫代RNA纯净物[10].同时,与富含Sp手性中心的PS-siRNA相比,富含Rp手性中心的PS-siRNA具有更大的血清稳定性和更有效的基因沉默活性[6],因此,用T7 RNA聚合酶转录合成的Rp型PS-siRNA可能具有更高的核酸酶抗性和生物学活性.
另外近年来,实验研究发现PLK1基因过表达于多种类型的人类肿瘤组织中,如神经胶质瘤[11]、甲状腺癌[12]、头颈部鳞状细胞癌[13]、黑色素瘤[14]、结直肠癌[15]、食管癌[16]、卵巢癌[17]、乳腺癌[18]和前列腺癌[19]. 自然,它被认为是肿瘤性疾病和病毒性疾病的潜在治疗靶点[20-21].为了进一步探索磷硫代修饰的潜在应用价值,本文针对癌症治疗靶点PLK1,设计了3条特异性siRNA序列,并用T7 RNA聚合酶和NTPaS体外转录合成了PS-siRNAs,探究了PLK1 nat-siRNAs和PLK1 PS-siRNAS血清稳定性和基因沉默活性的差异性.实验发现酶促合成的PS-siRNAs能在不影响siRNA基因沉默活性的基础下,显著提高siRNA的血清稳定性.因此,酶促合成的PS-siRNA可作为siRNA的应用形式,以延长siRNA的生物活性半衰期,使其基因干扰效果持续时间更长,为肿瘤性疾病和病毒性疾病等疑难杂症的治疗带来新的希望.
2 材料与方法
2.1 材 料
2.1.1 细胞株 肝癌细胞株HepG2购自于ATCC细胞库
2.1.2 主要试剂 胎牛血清(FBS)购自于Gibco生物公司;高糖培养基DMEM和胰蛋白酶购自于Hyclone生物公司;核酸siRNA marker,cDNA合成试剂盒和ECL显色液购自全式金公司;RNA提取试剂盒购自于promaga 公司;Rfect小核酸转染试剂购自于百代生物公司;qRT-PCR试剂购自于Takara生物公司;苯甲磺酰氟化物(PMSF)和RIPA裂解液均购自于索莱宝生物公司;BCA蛋白质定量试剂盒购自于康为世纪生物公司;anti-PLK1抗体和anti-GAPDH抗体购自于abcam公司;山羊抗兔IgG-HRP抗体和山羊抗鼠IgG-HRP抗体购自于Proteintech生物公司.
2.2 方 法
2.2.1 PLK1 siRNAs和PLK1 PS-siRNAs的体外转录合成及纯化 以PLK1的mRNA序列为模板(GenBank序号为NM_005030),设计靶向性敲除PLK1的siRNA序列(表1和2,其中,*表示该核苷酸位点为磷硫代核苷酸).如图1所示,由于NTPaS的合成及应用挑战,本文使用a-磷硫代三磷酸腺苷(ATPaS)、a-磷硫代三磷酸胞苷(CTPaS)和a-磷硫代三磷酸尿苷(UTPaS)[22]和T7聚合酶体外转录合成了部分磷硫代修饰的Rp-PS-siRNA[23].首先,在生工生物公司订购合成PLK1-siRNAs的DNA单链模板(表1).在保证DNA模板纯度极高的基础上,将互补的100 μmol/L DNA单链退火成20 μmol/L的DNA双链.依据转录体系加入各组分和两组双链DNA,混合均匀并轻微离心后,置于37 ℃水浴锅中过夜孵育(同时合成正义链RNA和反义链RNA,合成的RNA可形成双链).随后用DNA酶Ⅰ消化DNA模板,RNase T1分解RNA一条链的GGG部分,并用苯酚-氯仿-异戊醇抽提法、乙醇沉淀法和超滤法进行样品纯化.最后,用12.5%非变性聚丙烯酰胺凝胶电泳检测样品的纯度和完整性.

表1 合成siRNA的DNA模板序列

表2 siRNA序列
(*表示该核苷酸的a磷酸位点氧原子被硫原子所取代)
2.2.2 PLK1 siRNAs和PLK1 PS-siRNAs的血清稳定性试验 5 μmol/L nat-siRNA或PS-siRNA分别与50%胎牛血清(FBS)等体积混合均匀,放置于37 ℃水域锅中孵育.0、1、2、4、6、8、12和24 h小时后取2 μL样品上样,用12.5%非变性聚丙烯酰胺凝胶电泳检测siRNA或PS-siRNA的剩余量.Image J软件分析三次独立试验的灰度值,并用Origin软件制图.
2.2.3 细胞培养与转染试剂的筛选 将HepG2细胞(ATCC细胞库)以5×103细胞/孔的密度接种于96孔组织培养板中,用含10% 胎牛血清(FBS, Gibco)的高糖培养基(DMEM, Hyclone)在37 ℃和5% CO2条件下培养12 h.根据Lipofectamine 2000、Lipofectamine 3000、Ribofect转染试剂和Rfect小核酸转染试剂的厂家说明书,将带荧光FAM基团的siRNA(转染终浓度为10 nmol/L)与四种不同的转染试剂混合均匀后,孵育HepG2细胞4 h,更换培养基,用荧光显微镜观察其转染效率的差异性.
2.2.4 qRT-PCR分析 在qRT-PCR分析中,用RNA提取试剂盒提取总RNA后,使用反转录试剂盒合成cDNA.根据人类PLK1 mRNA(GenBank序号为NM_005030)和GAPDH mRNA(GenBank序号为NM_002046)的序列,设计PLK1和GAPDH基因的PCR引物(表3).随后,以1 μL cDNA作为模板,用Ex-Taq酶(Takara)对PLK1和GAPDH进行PCR扩增.95 ℃预变性5 s;95 ℃×5 s、55 ℃×10 s、72 ℃×10 s扩增40个周期;95 ℃×10 s、60 ℃×60 s、97 ℃×1 s一个周期后得到荧光曲线.利用罗氏LC96软件,以管家基因GAPDH mRNA作为内源参考标准,采用ΔCT法测定PLK1 mRNA的相对表达量.通过熔融曲线分析验证了PCR产物的特异性.
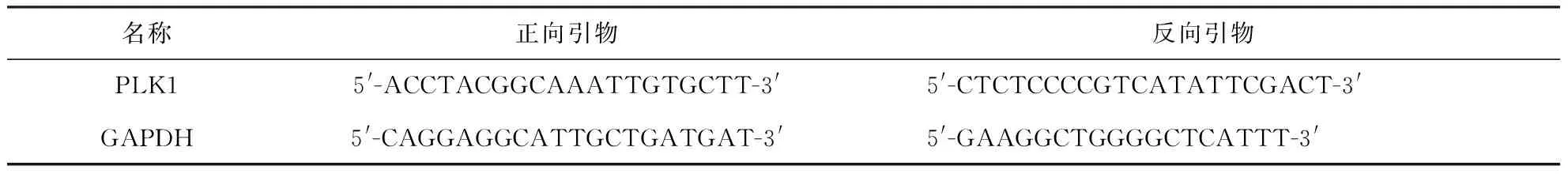
表3 引物序列
2.2.5 蛋白质印迹分析 在蛋白质印迹分析中,用含PMSF的RIPA裂解液提取总蛋白后,使用BCA蛋白质定量试剂盒测定各样品的总蛋白浓度.用10% SDS-PAGE凝胶电泳分离15 μg总蛋白样品(200 V电泳1h),将36 kD GAPDH蛋白和68 kD PLK1从SDS-PAGE凝胶中转移到0.2 μm PVDF膜上(冰浴条件下,200 mA转膜2 h).5%脱脂奶粉封闭1 h后,4 ℃过夜孵育anti-PLK1抗体(兔单克隆抗体,1∶2 000稀释)和anti-GAPDH抗体(鼠单克隆抗体,1∶5 000稀释).用TBST缓冲液以1∶2 000的稀释比例分别稀释山羊抗兔IgG-HRP抗体和山羊抗鼠IgG-HRP抗体,室温孵育二抗1 h.最后用ECL化学发光法进行显色,以管家基因GAPDH的蛋白作为内源参考标准,归一化后得到靶基因PLK1蛋白的相对表达量.
3 结果与讨论
3.1 nat-siRNAs和PS-siRNAs的体外转录合成
如图1所示,利用T7聚合酶体外转录合成siRNAs,用12.5%非变性聚丙烯酰胺凝胶电泳检测样品的纯度和完整性,得到了纯度较高的PLK1 nat-siRNAs和PLK1 PS-siRNAs.
3.2 PS-siRNA血清稳定性试验
不同的化学修饰能不同程度地提高siRNA核酸酶稳定性,使其进入生物体后不易被核酸水解酶降解并可持久发挥药效,为了验证酶促合成的PS-siRNAs是否能增强siRNA的核酸酶抗性,比较nat-siRNAs和PS-siRNAs血清稳定性的差异是至关重要的.如图2所示,随着时间的延长,PS-siRNAs的剩余量明显高于nat-siRNAs的剩余量.与FBS孵育24 h后,当剩余天然siRNA1含量为21.51%时,剩余的PS-siRNA1含量为71.6%(P< 0.01),同时,PS-siRNA2和PS-siRNA3的剩余量也显著性高于相对应的nat- siRNAs(68.37%versus 32.27%,P< 0.01; 63.99% versus 19.05%,P< 0.01).这表明酶促合成的PS-siRNA能显著性增强siRNA的血清稳定性,从而可作为siRNA的储存形式以延长siRNA的半衰期,为siRNA实现低剂量高效果提供可能性,为siRNA临床应用和新药研发领域奠定理论基础.
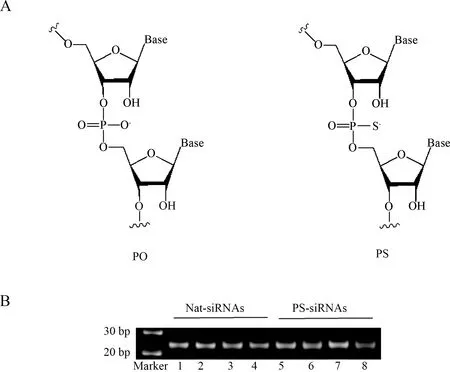
图1 PLK1 nat-siRNAs和PS-siRNAs的转录合成1.磷硫代修饰寡聚核糖核苷酸结构示意图;B. PLK1 siRNAs长度为25bp;泳道1、5为非特异siRNA序列;泳道2、6为siRNA1序列;泳道3、7为siRNA2序列;泳道4、8为siRNA3序列.Fig.1 Synthesis of PLK1 nat-siRNAs和PS-siRNAsStructure of phosphothioate oligonucleotides; B. The length of PLK1 siRNAs supposed to be 25 bp; lane 1 and 5 are non-specific siRNA; lane 2 and 6 are siRNA1, lane 3 and 7 are siRNA2; lane 4 and 8 are siRNA3.
3.3 转染试剂的筛选
由于不同转染试剂有着不同的化学性质和递送机制,不同细胞株对不同的转染试剂的敏感程度各不相同.为了筛选出肝癌细胞株HepG2的最佳转染试剂,对常见的四种转染试剂Lipofectamine 2000、Lipofectamine 3000、Ribofect转染试剂和Rfect小核酸转染试剂的转染效率进行了分析和比较.结果如图3所示,与Lipofectamine 2000、Lipofectamine 3000、ribofect转染试剂的转染效率相比,Rfect小核酸转染试剂的转染效率最大.因此,在后续的基因沉默试验中,采用Rfect转染试剂来递送nat-siRNAs和PS-siRNAs.
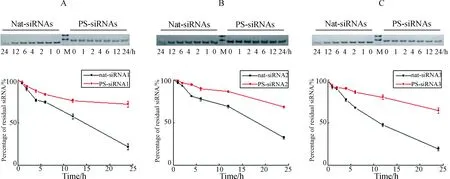
图2 nat-siRNAs与PS-siRNAs的血清稳定性
A.nat-siRNA1与PS-siRNA1的血清稳定性;B. nat-siRNA2与PS-siRNA2的血清稳定性;C. nat-siRNA3与PS-siRNA3的血清稳定性. 条形代表标准偏差,数据收集于三次独立试验.
Fig.2 Serum stability of nat-siRNAs and PS-siRNAs
A.Serum stability of nat-siRNA1 and PS-siRNA1; B. Serum stability of nat-siRNA2 and PS-siRNA2; C. Serum stability of nat-siRNA3 and PS-siRNA3. Bars represent the standard deviation, Data collected from three independent experiments.

图3 不同转染试剂的转染效率对比
A.Lipofectamine 2000;B. Lipofectamine 3000;C. Ribofect转染试剂;D. Rfect小核酸转染试剂.
Fig.3 Comparison of different transfection reagents
A.Lipofectamine 2000; B. Lipofectamine 3000; C. ribofect transfection reagent; D. rfect small nucleic acid transfection
3.4 nat-siRNAs和PS-siRNAs的基因沉默效果
过去相关研究表明:化学合成得到的PS-siRNA通常为混合物,且其基因敲除活性与天然siRNA相当或更低.为了探究酶促合成的PS-siRNA在显著提高siRNA血清稳定性的同时,是否影响siRNA的生物学功能,采用qRT-PCR和Western blotting等半定量办法分析比较了nat-siRNA和PS-siRNA的基因沉默效果.结果如图4所示,在mRNA水平上,以PBS组作为对照组,当25 nmol/L siRNA1使PLK1的mRNA表达量降低45%时,等剂量的PS-siRNA1敲降了43.2%的PLK1 mRNA;同时,PS-siRNA2 和PS-siRNA3的基因沉默活性也相似于对应的nat-siRNAs(38.7% versus 46.2%; 20% versus 27%).在蛋白质水平上,PS-siRNA1、PS-siRNA2与PS-siRNA3的干扰活性均相似于对应的nat-siRNAs,(61.1% versus 61.9%; 63.06% versus 55.2%; 20.3% versus 25.6%).经分析对比发现:序列特异性的siRNAs或PS-siRNAs使PLK1 mRNA和PLK1蛋白质的相对表达量均显著下降.其中,等剂量情况下,特异性序列1与序列2的基因沉默活性相似,且显著性高于特异序列3的RNA干扰效率,这表明了同一基因的不同敲除靶点具有不同的基因沉默效率,进而印证了siRNA序列设计的重要性.此外,与nat-siRNAs相比,PS-siRNAs的特异性干扰效果没有明显的变化.因此,通过酶促生物合成的方式,硫磷代修饰能在不影响siRNA基因沉默活性的基础上,显著性增加siRNA的血清稳定性,延长PS-siRNAs的半衰期,使其干扰效果持续时间更长,为PS-siRNAs用于肿瘤性疾病和病毒性疾病治疗提供可能性.
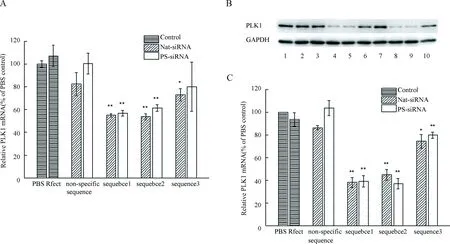
图4 PLK1 nat-siRNAs和PLK1 PS-siRNAs的基因沉默效果
A.mRNA水平上,PLK1 nat-siRNAs和PLK1 PS-siRNAs的基因沉默效果;B, C. 蛋白水平上,PLK1 nat-siRNAs和PLK1 PS-siRNAs的基因沉默效果;1. PBS; 2. Rfect转染试剂; 3. 非特异性nat-siRNA; 4. nat-siRNA1; 5. nat-siRNA2; 6. nat-siRNA3; 7. 非特异性PS-siRNA; 8. PS-siRNA1; 9. PS-siRNA2; 10. PS-siRNA3. 数据收集于3次独立实验,* :P<0.05;**:P<0.01.
Fig.4 Gene silencing effects of PLK1 nat-siRNA and PLK1 PS-siRNA
A.Gene silencing effects of PLK1 nat-siRNAs and PLK1 PS-siRNAs at the level of RNA; B, C. Gene silencing effects of PLK1 nat-siRNAs and PLK1 PS-siRNAs at protein level; 1. PBS; 2. Rfect reagent; 3. non-specific nat-siRNA; 4. nat-siRNA1; 5. nat-siRNA2; 6. nat-siRNA3; 7. non-specific PS-siRNA; 8. PS-siRNA1; 9. PS-siRNA2; 10. PS-siRNA3; Data were collected from three independent experiments; *P<0.05; **:P< 0.01.
4 讨 论
随着首例siRNA药物Patisiran的正式上市,具有基因沉默活性的天然siRNA和修饰性siRNA广泛应用于疾病治疗、预防和诊断相关领域.研究表明,对nat-siRNA不同基团进行不同的化学修饰可不同程度上增加或降低siRNA的核酸酶抗性,同时,过多的或不当的化学修饰会使其不被RNA干扰机制所识别,从而降低siRNA的基因沉默活性.其中,磷硫代修饰因能有效提高siRNA的核酸酶抗性而被广泛应用于基因功能鉴定和临床试验等研究领域.由于硫代磷酸酯基(PS)是具有手性的,其可产生Sp和Rp两种不同的非对映异构体,因此,化学合成PS-siRNA时,通常会得到具有不同生化性质的PS-siRNA混合物,从而影响RNA干扰机制,使其基因敲除活性与天然siRNA相当或更低.与化学合成相比,酶促合成可得到具有更高核酸酶抗性和生物学活性的Rp-PS-siRNA纯净物.为了进一步探究磷硫代修饰的潜在应用价值,本文针对癌症治疗靶点PLK1,设计了3条特异性siRNA序列,用ATPaS、CTPaS、UTPaS和T7聚合酶体外转录合成了部分磷硫代修饰的Rp-PS-siRNA,探究了PLK1 nat-siRNAs和PLK1 PS-siRNAs血清稳定性和基因沉默活性的差异性.结果发现,通过酶促生物合成的方式,磷硫代修饰能在不影响siRNA基因沉默活性的基础下,显著性提高siRNA的血清稳定性.因此,酶促合成的PS-siRNA可作为siRNA的应用形式,以延长siRNA的生物活性半衰期,并为siRNA以及其它功能核酸的生物药物创新和生物医学临床研究奠定理论和应用的一个新基础.目前,尽管siRNA药物研发领域中充满难题和挑战,针对越来越多的疾病表征多变性,只有从基因水平进行靶向性治疗才能达到“治标治本”的效果.随着相关技术的不断改良、完善与进步,siRNA药物的其它弱点(如脱靶性,免疫原性和低递送率等)也终将被克服,siRNA将成为以基因表达调控为导向的第三代医药产业革命的中坚力量.
