壳聚糖-海藻酸钠微球固定化木瓜蛋白酶的工艺研究*
2020-03-31苗艳丽廖铭能杨明珠梁子健吴湛霞梁晓欣邱庆聪
苗艳丽,廖铭能,杨明珠,梁子健,吴湛霞,梁晓欣,邱庆聪
(广东海洋大学化学与环境学院,广东 湛江 524088)
木瓜蛋白酶(Papain),又称木瓜酶,是番木瓜(Carieapapaya)中一种具有广泛底物专一性的低特异性蛋白水解酶[1]。木瓜蛋白酶分解蛋白质的能力非常强,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香 L-氨基酸。具有酶活高、适用pH范围广、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化等行业得到广泛应用。但其稳定性差,在温度、pH和无机离子等外界因素影响下,容易变性失活。酶的固定化通常是用固体材料将酶束缚或限制于一定区域内,但是仍能进行其特有的催化反应,并且可以回收及重复利用的一类技术。为了提高木瓜蛋白酶的稳定性,研究者们正努力探索酶类药物的固定化载体和固定化方法。杨頔[1]、李红[2]、袁春桃等[3]采用了固定化酶的方法,将其固定在合适的载体上,较多报道的固定化载体为壳聚糖[4]。其他,有李琳、丁利君和刘佳炜等[5-7]分别以竹纤维素、壳聚糖-埃洛石纳米管微球和明胶-壳聚糖-海藻酸钠凝胶为载体研究了其对木瓜蛋白酶的固定化作用。
固定化酶的载体选择上天然高分子载体最大的特点是无毒性,有很好的生物相溶性和生物粘连性,近年研究比较热门的天然高分子载体如壳聚糖(chitosan,CTS)、海藻酸钠等。而且越来越多的研究者采用具有生物黏附性天然高分子制备而成的微球,作为各种蛋白酶、药物等活性物质的固定化载体。因此,本研究以壳聚糖-海藻酸钠微球为载体,戊二醛为交联剂,通过测定木瓜蛋白酶的活性回收率为指标,采用星点设计-效应面法优化固定木瓜蛋白酶的条件。通过壳聚糖-海藻酸钠微球固定化木瓜蛋白酶来提高其稳定性,从而扩大了木瓜蛋白酶的应用范围;为后期工业生产推广打下了基础;目前相关研究在国内很少见报道。
1 实 验
1.1 试 剂
木瓜蛋白酶(20万U/g),广西南宁庞博生物工程有限公司;壳聚糖,脱乙酰度 90%(分子量约 10 万);海藻酸钠(分析纯),上海源叶生物科技有限公司;干酪素(分析纯),上海源叶生物科技有限公司;L-酪氨酸(分析纯),国药集团化学试剂有限公司;25%戊二醛(分析纯),国药集团试剂有限公司;其他试剂均为分析纯,均购自国药集团试剂公司。
1.2 仪 器
TU-1901双光束紫外可见光分光光度计,北京普析通用仪器公司;PHS-2F pH 计,上海雷磁仪器厂;AL204电子分析天平,梅特勒-托利多公司;JB-2恒温磁力搅拌器,金坛市富华仪器有限公司;HH-6 数显电子恒温水浴锅,金坛市晶玻实验仪器厂。
1.3 实验方法
1.3.1 壳聚糖-海藻酸钠空白微球的制备[8-9]
先将含2%(体积分数)司盘-80 的液体石蜡置于60 ℃、500 RPM 水浴锅中,搅拌均匀作为油相。再将1.5%海藻酸钠溶液逐滴加入到油相中,搅拌成 O/W型乳剂,用7号针头将含适量CaCl2的1% 壳聚糖乙酸溶液滴加到处于搅拌状态的乳剂中,滴毕继续搅拌 30 min。再加入6%油 相体积的 25%戊二醛溶液,交联 2 h,离心 10 min 后弃去上层油相,用乙醇洗涤下层微球后,再用石油醚洗涤微球,加入丙酮分散,常温干燥即得。
1.3.2 固定化木瓜蛋白酶的制备[10-12]
将壳聚糖-海藻酸钠空白微球放在 0.2 mol/L pH=7.2的磷酸缓冲液中浸泡 24 h,抽滤,干燥。称取适量壳聚糖-海藻酸钠空白微球置于小烧杯中,加入新配制的木瓜蛋白酶溶液适量,吸附4 h,并不时搅拌,然后滴入戊二醛溶液适量,搅拌交联 3 h后,用 0.2 mol/L pH=7.2的磷酸缓冲液洗去多余的戊二醛溶液和木瓜蛋白酶溶液,直到在275 nm处无吸收峰。抽滤,即得固定化木瓜蛋白酶的壳聚糖-海藻酸钠复合微球。
1.3.3 固定化木瓜蛋白酶活性测定[13]
称取固定化木瓜蛋白酶微球0.1 g置于10 mL具塞比色管中,于(37±0.2)℃水浴中保温 10 min,加入已预热的酪蛋白溶液适量,摇匀,反应40 min;加入已预热的三氯乙酸溶液5.00 mL,摇匀,反应10 min;用干燥滤纸滤过,取滤液,在2 h内,在波长为275 nm处用蒸馏水作参比测出滤液的吸光度A1。
称取固定化木瓜蛋白酶微球0.1 g置于10 mL具塞比色管中,于(37±0.2)℃水浴中保温 10 min,加入已预热的三氯乙酸溶液5.00 mL,摇匀,反应10 min,加入已预热的酪蛋白溶液适量,摇匀,反应 40 min,用干燥滤纸滤过,取续滤液,在 2 h内,在波长为 275 nm 处用蒸馏水作参比测出滤液的吸光度A2。
用蒸馏水作参比,在波长 275 nm 处测定 50 μg/mL酪氨酸标准溶液的吸光度A3。
根据以下公式计算结果:
试样中木瓜蛋白酶活力X1(U/g)按式(1)计算:
(1)
式中:A1——试样溶液的吸光度
A2——空白试验的吸光度
A3——酪氨酸标准溶液的吸光度
m1——对照品溶液中每毫升含酪氨酸的量,μg
m2——试样的质量,g
n——试样溶液的稀释倍数
U(g)表示固定化酶活力,回收率按下式计算:
1.4 星点设计-效应面法优化木瓜蛋白酶固定化条件
为了探求每个因素对固定化木瓜蛋白酶的影响,采用星点设计-效应面法拟合优化,得到固定化木瓜蛋白酶的最佳工艺。以A(壳聚糖与海藻酸钠的配比),B(加酶量),C(戊二醛浓度),D(固定化温度)为自变量(表1),以固定化木瓜蛋白酶活性回收率为因变量,采用星点设计-效应面法进行多元线性回归拟 合,优化固定化条件,进行预测分析,实验条件根据表1进行设计,结果如表2所示。
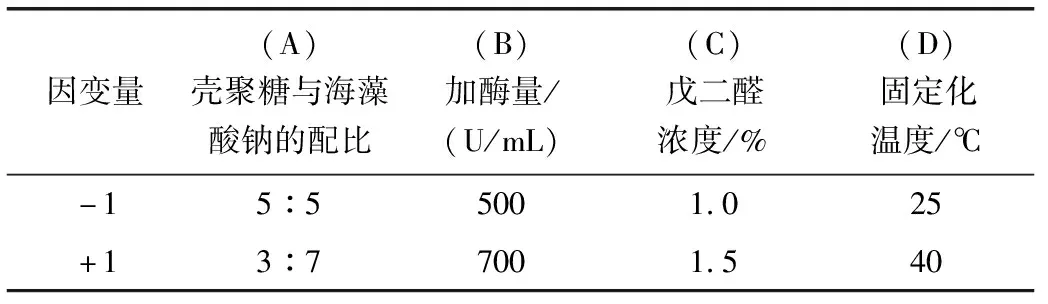
表1 木瓜蛋白酶固定化条件
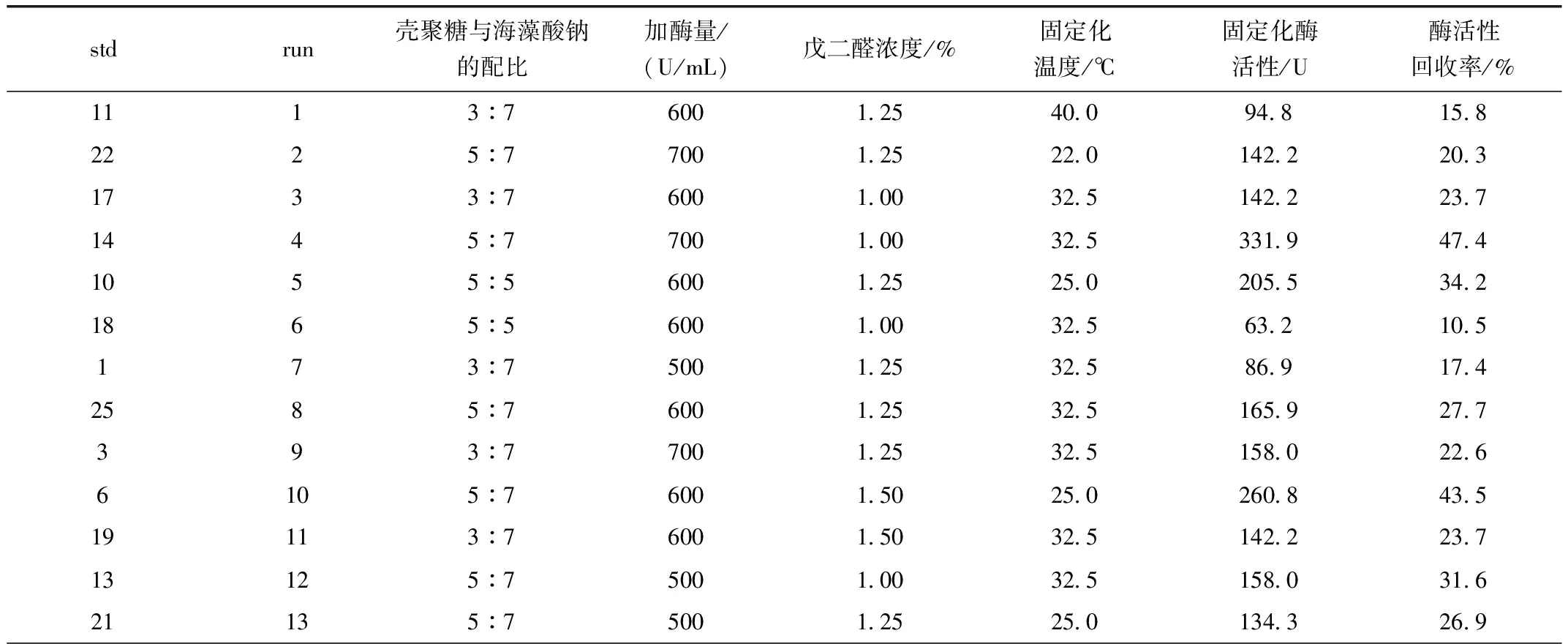
表2 星点设计木瓜蛋白酶活性测定结果
续表2
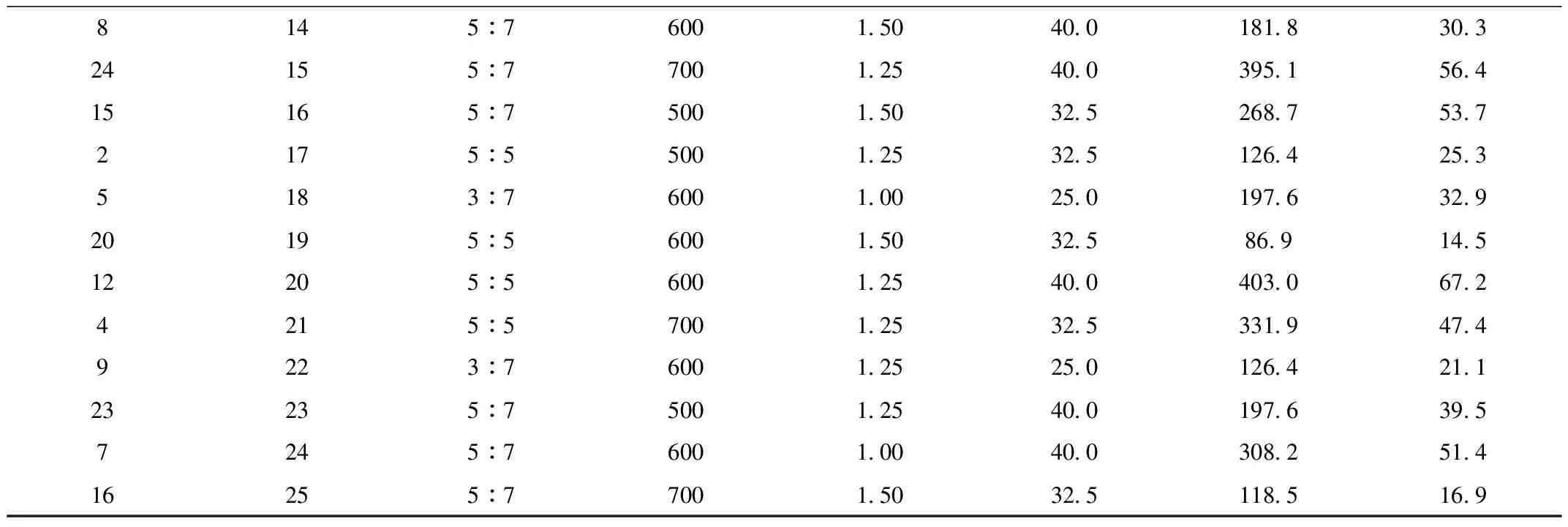
8145 76001.5040.0181.830.324155 77001.2540.0395.156.415165 75001.5032.5268.753.72175 55001.2532.5126.425.35183 76001.0025.0197.632.920195 56001.5032.586.914.512205 56001.2540.0403.067.24215 57001.2532.5331.947.49223 76001.2525.0126.421.123235 75001.2540.0197.639.57245 76001.0040.0308.251.416255 77001.5032.5118.516.9
2 结果与讨论
2.1 各因素模型拟合图以及工艺优化分析
2.1.1 各因素对酶活性回收率的影响
以考察指标拟合的数学模型为基础,描绘等高线图,固定4个变量,2个为中心点值,其余2个考察对象为相应考察指标,代入目标函数方程,绘制等高线图,结果见图1~图4。
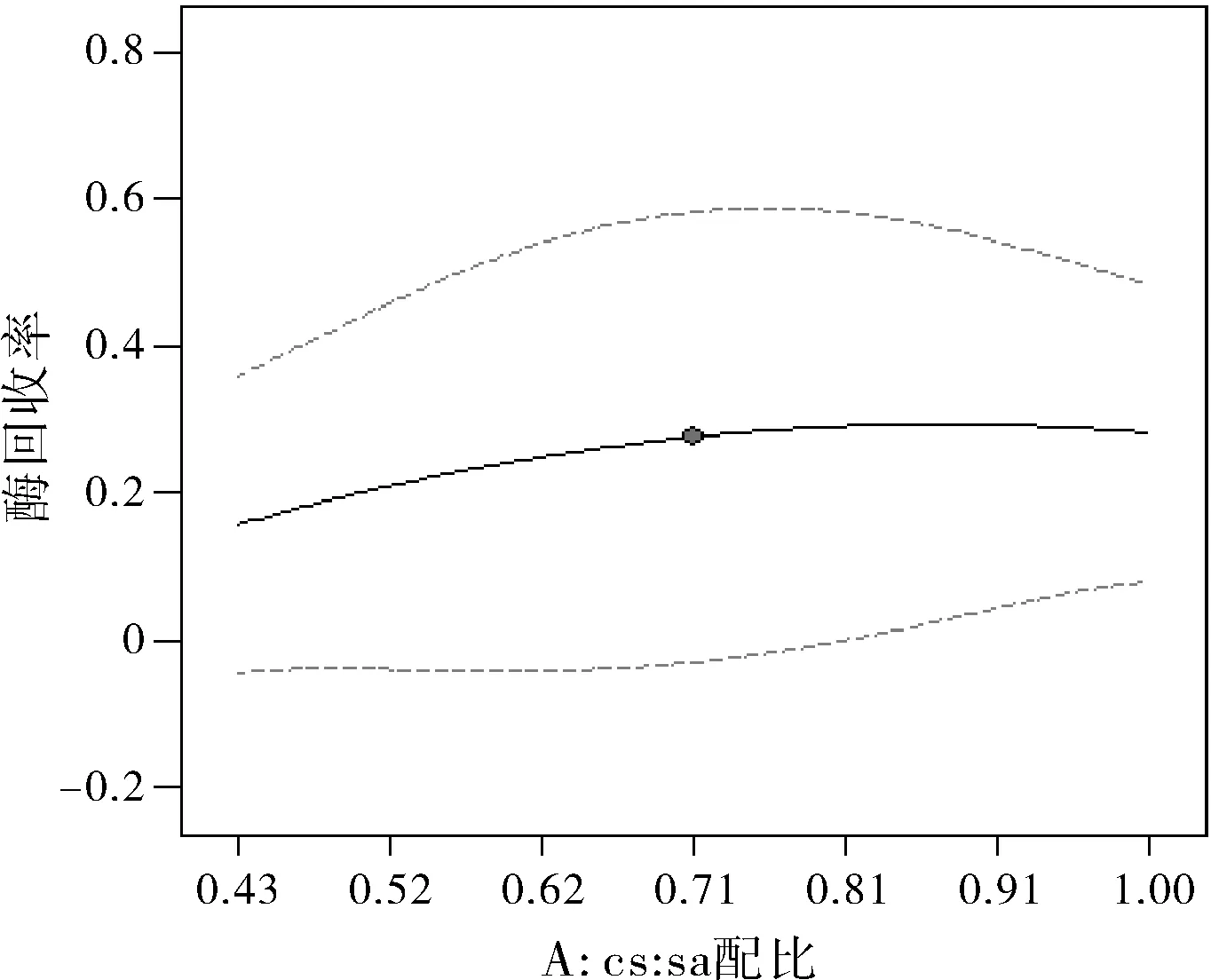
图1 CS与SA的配比对酶活性回收率的影响
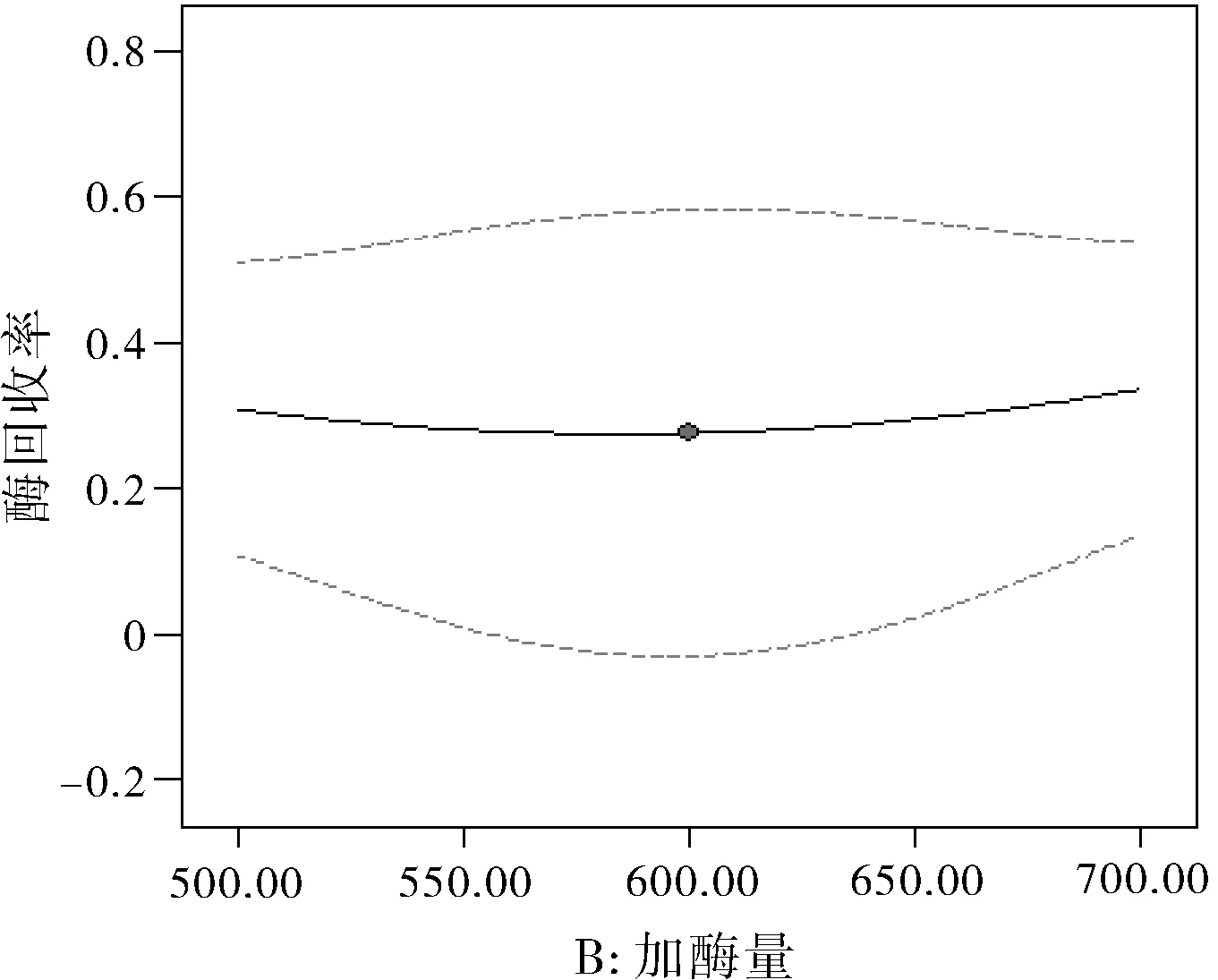
图2 加酶量对酶活性回收率的影响
图1中曲线为凸形,在 18%~24%之间。可见壳聚糖(CS)与海藻酸钠(SA)的配比对酶活性回收率的影响并不大,且中点右边比左边高,可知质量比为3:7的微球对固定酶效力不大。图2中曲线为凹形,在 20%~40%之间。可见加酶量对酶活性回收率的影响较显著,中点右边,随着加酶量增大,酶活性回收率也随之增大;但在中点左边,酶活性回收率随着加酶量增大反而减小。
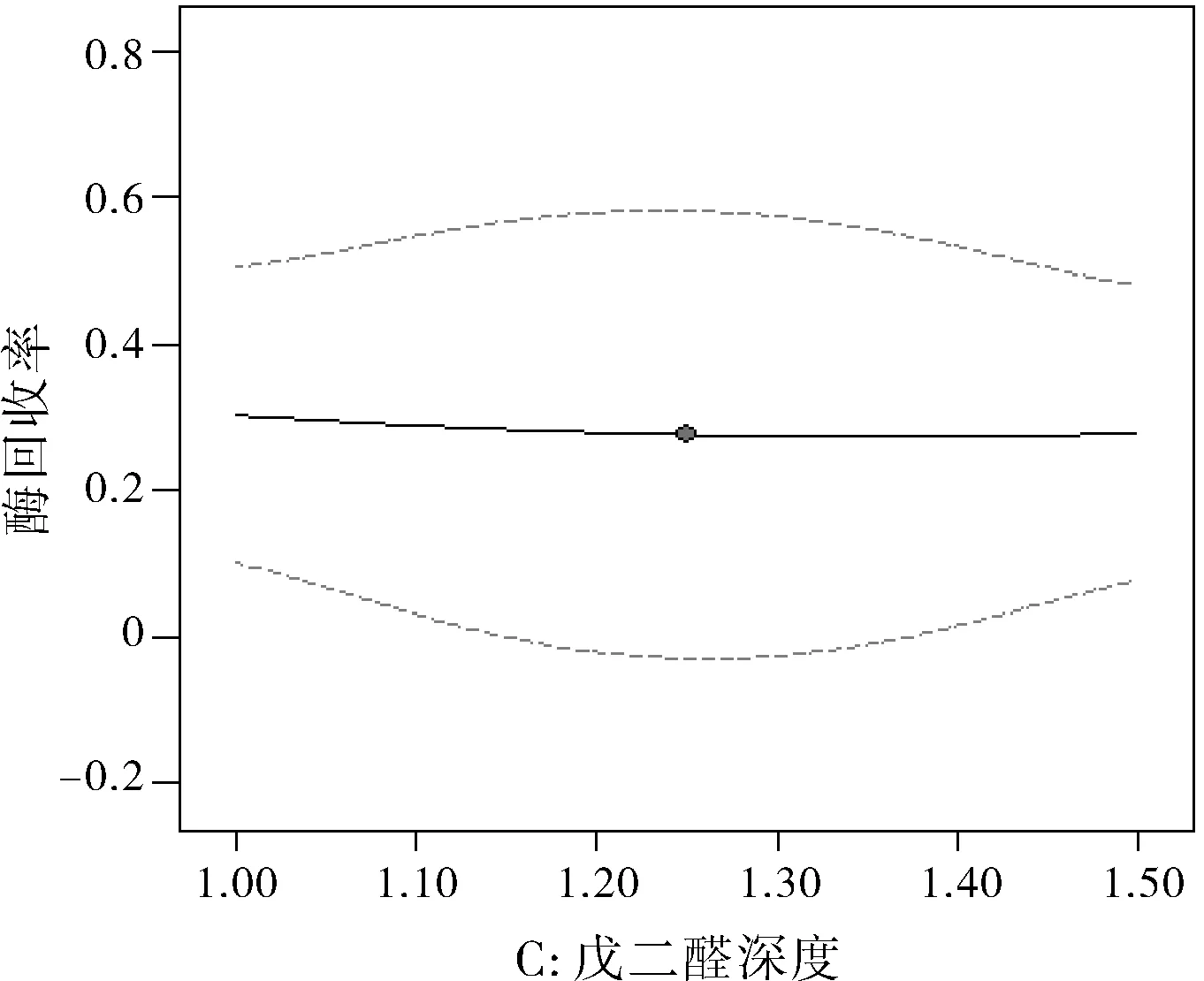
图3 戊二醛浓度对酶活性回收率的影响
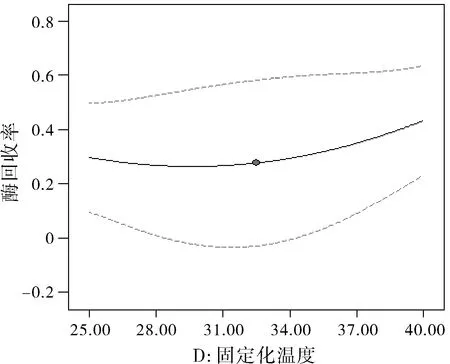
图4 固定化温度对酶活性回收率的影响
由图3中曲线为凹形,在 27%~30%之间。可见戊二醛浓度对酶活性回收率的影响并不大,中点右边酶活性回收率基本不随戊二醛浓度的增大而变化,而左边酶活性回收率则随着戊二醛浓度的增大而减少。图4中曲线为凹形,在 27%~42%之间。可见固定化温度对酶活性回收率的影响显著,中点右边酶活性回收率随着固定化温度增大而显著增大,而左边酶活性回收率随着固定化温度增大先减少后又增大。
2.1.2 各影响因素的交互作用
CS与SA的配比(A)和加酶量(B)、CS与SA的配比(A)和固定化温度(D)、加酶量(B)和戊二醛浓度(C)、加酶量(B)和固定化温度(D)之间的交互作用的等高线图分别如图5~图8所示。
等高线的形状可反映出交互效应的强弱大小,等高线越密集,说明二者交互作用越显著,等高线越疏则相反,椭圆形表示两因素交互作用显著,而圆形则相反[14]。
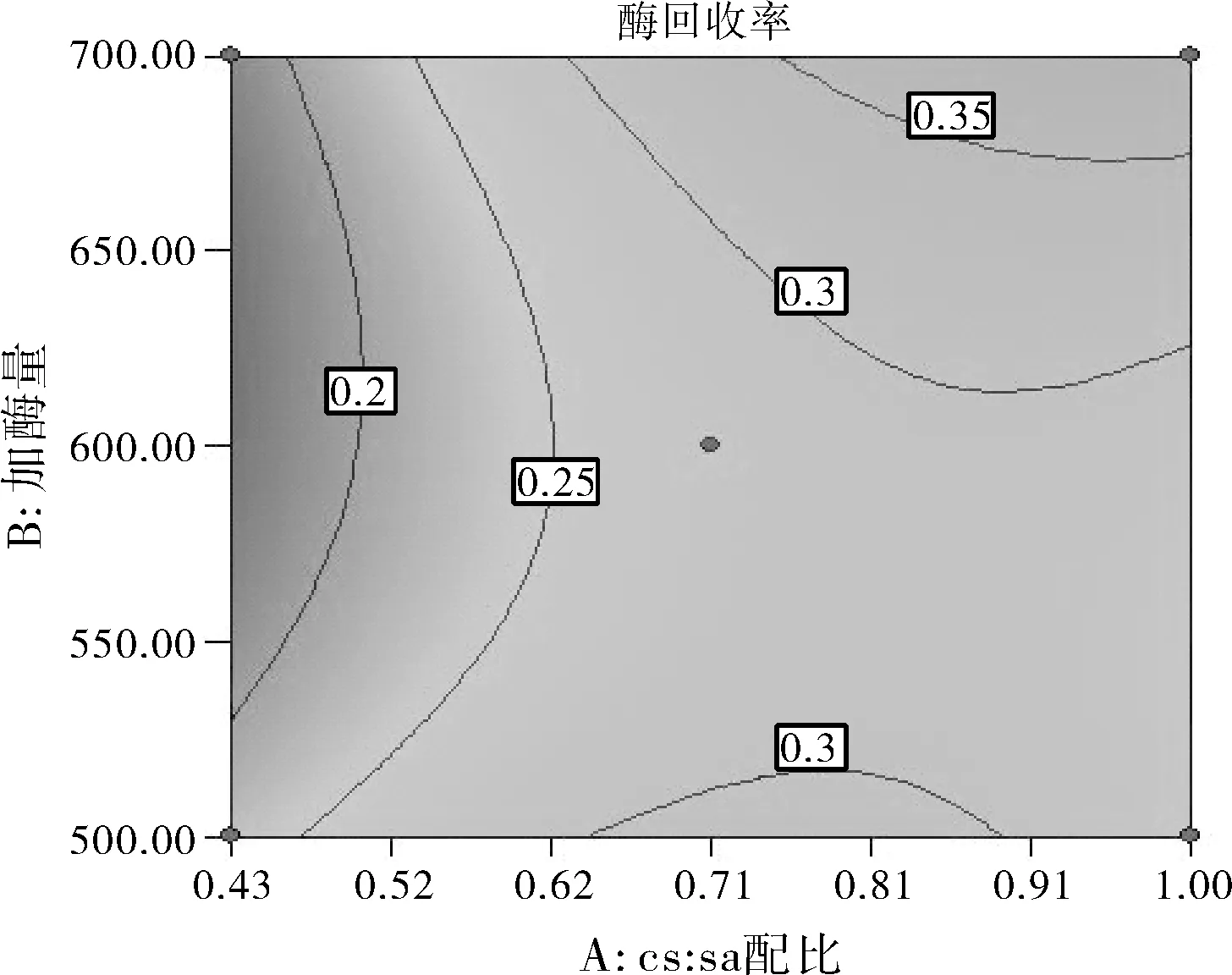
图5 CS与SA的配比和加酶量之间的交互作用
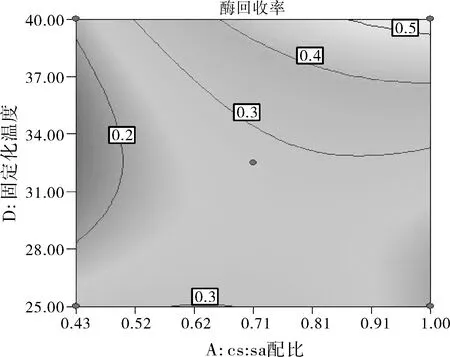
图6 CS与SA的配比和固定化温度之间的交互作用
由图5中等高线的分布可知,CS与SA的配比(A)和加酶量(B)的交互作用比较显著。酶活性回收率最高点在右上角。可知质量比为 3:7(0.43)时,随加酶量的增加酶活性回收率稍有增大;当质量比为 5:5(1.00)时,酶活性回收率随加酶量的增加而显著增大。酶活性回收率的变化随着CS与SA的配比的变化小于加酶量的变化,说明加酶量对酶活性回收率的影响较大。由图6中等高线的分布可知,CS与SA的配比(A)和固定化温度(D)之间的交互作用比较显著。酶活性回收率最高点在右上角。可知质量比为3:7(0.43)时,酶活性回收率随固定化温度的增大而增大,但在28 ℃以上并不显著;质量比为5:5(1.00)时,酶活性回收率随固定化温度增大而有较显著的增大。
由图7中等高线的分布可知,加酶量(B)和戊二醛浓度(C)之间交互作用比较显著。酶活性回收率最高点在右下角,而左上角也出现了较高点。加酶量为500 U/mL时,酶活性回收率随戊二醛浓度的增大而增大;加酶量为700 U/mL时,酶活性回收率随戊二醛浓度的增大而显著减少。由图 8中等高线的分布可知,加酶量(B)和固定化温度(D)之间交互作用比较显著。酶活性回收率最高点在右上角。加酶量为500 U/mL时,酶活性回收率随固定化温度增大的变化并不显著;加酶量为700 U/mL 时,酶活性回收率随固定化温度增大而增大。
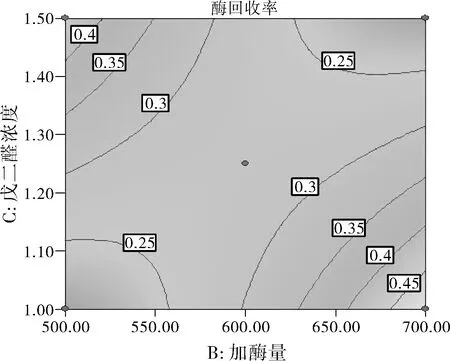
图7 加酶量和戊二醛浓度之间的交互作用
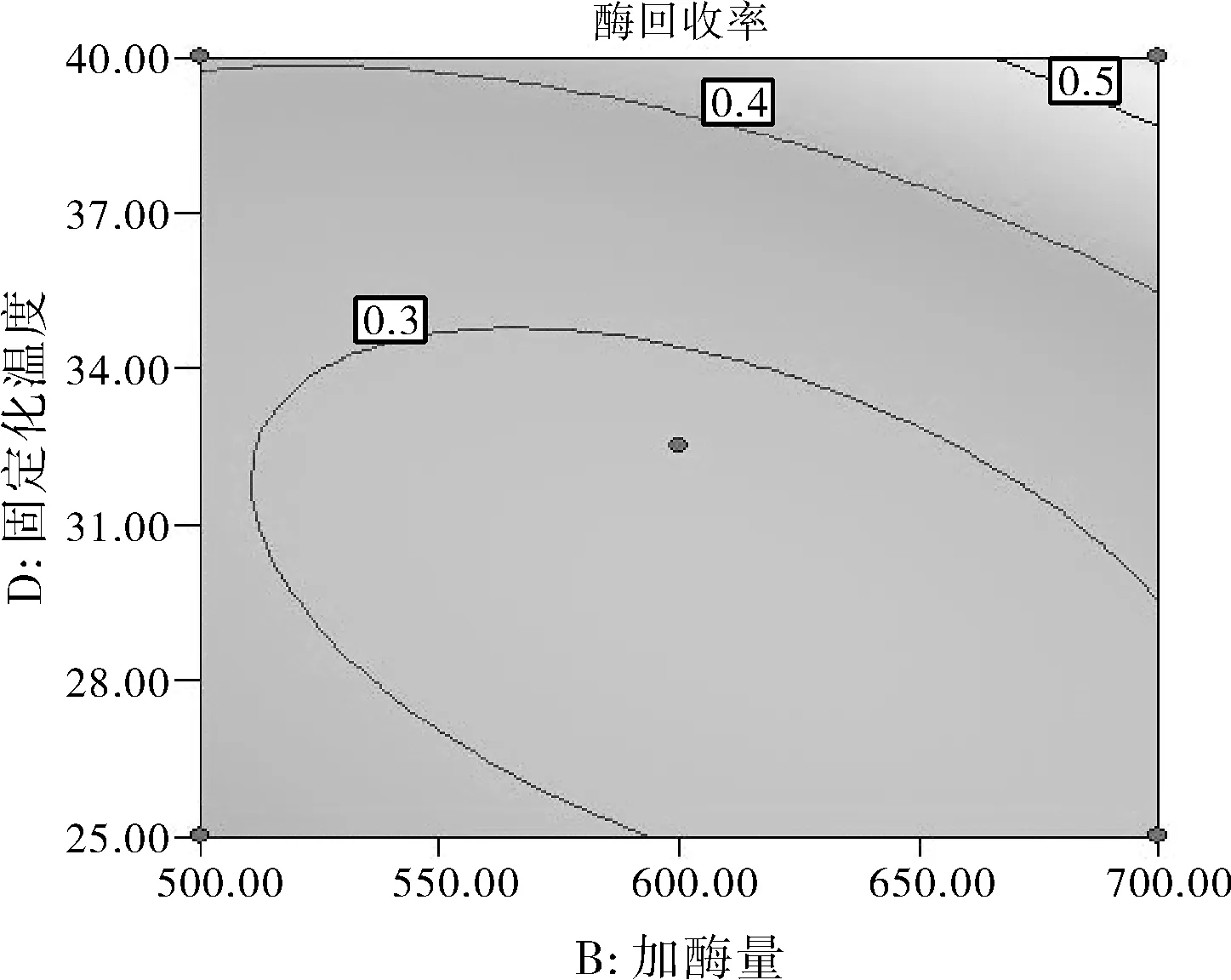
图8 加酶量和固定化温度之间的交互作用
2.2 最佳工艺参数确定及验证性实验
由一系列实验测试所得数据通过 Design-Expert 软件的拟合,预测固定木瓜蛋白酶的最优条件为:A(壳聚糖与海藻酸钠的配比)为 5:5、B(加酶量)为700 U/mL、C(戊二醛浓度)为 1.0%、D(固定化温 度)为 40 ℃,酶活性回收率为69.05%。
按照“1.3.2”项下的最佳条件进行木瓜蛋白酶的固定化试验,3次平行试验得到木瓜蛋白酶的活性回收率分别为:68.70%、69.00%、69.10%,平均值为68.93%,与预测值69.05%接近。该预测值与实际值非常接近,说明回归模型建立的准确可靠,具有较好的实用价值。
2.3 固定化木瓜蛋白酶的稳定性实验
2.3.1 温度实验
本实验通过在不同温度和不同pH条件下测试固定化木瓜蛋白酶进行稳定性研究。按照“3.2”项下的最佳条件进行木瓜蛋白酶的固定化实验,取一定量的固定化酶分别置于室温(25±2)℃、高温(40±1)℃的环境中,每隔一定的时间(1、3、5 d)分别测定固定化木瓜蛋白酶的活性,计算出酶活性回收率,实验结果见表3。
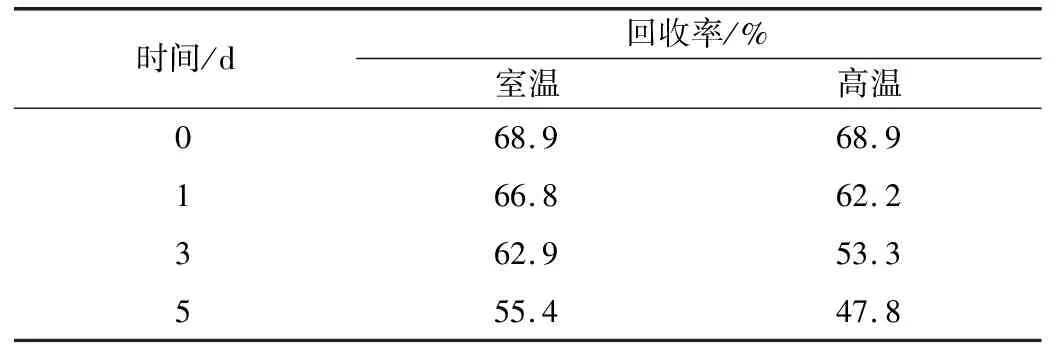
表3 不同贮存温度对固定化酶活性回收率的影响
由表3可见,固定化产物在室温(25±2)℃、高温(40±1)℃的条件下5 d内稳定性良好,相较于自由凝血酶固定化的凝血酶稳定性显著提高,贮存时间显著延长。
2.3.2 酸碱度实验
本实验通过在不同pH条件下测试固定化木瓜蛋白酶进行稳定性研究。按照“2.2”项下的最佳条件进行木瓜蛋白酶的固定化实验,取一定量的固定化酶分别置于pH值为6.0、6.5、7.0、7.5、8.0的缓冲溶液溶解浸泡,在室温放置 72 h,分别测定固定化木瓜蛋白酶的活性,计算出酶活性回收率,实验结果见表4。

表4 不同 pH 对固定化酶活性回收率的影响
由表4可知,固定化菠萝蛋白酶对酸碱度比较敏感,pH为7.0时酶活性回收率最好。
3 结 论
以壳聚糖和海藻酸钠为原材料,采用乳化交联法制备空白微球。将壳聚糖-海藻酸钠空白微球吸附木瓜蛋白酶并通过戊二醛固定,测定固定化木瓜蛋白酶的活性回收率为最终指标。用星点设计-效应面法对其优化实验条件。通过进行一系列实验,最终结果表明最优条件为:A(壳聚糖与 海藻酸钠的质量配比)为 5:5、B(加酶量)为 700 U/mL、C(戊二醛浓度)为 1.0%、D(固定化温度)为 40 ℃。后又通过稳定性实验得出贮存温度为 25.0 ℃,贮存酸碱度为 7.0。木瓜蛋白酶的固定化效果良好,酶活性回收率为 68.9%。
