载锌与ε-聚赖氨酸抗菌膜的制备及其抗菌、物理性能研究
2020-03-31赵瑜婕顾小炼张鑫利伍金娥
汪 慧,吴 旻,赵瑜婕,顾小炼,张鑫利,常 超,2,,伍金娥,2,
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉轻工大学 大宗粮油精深加工教育部重点实验室,农产品加工与转化湖北省重点实验室,湖北 武汉 430023)
食品在保藏的过程中易腐败,其腐败的主要因素在于微生物生长。目前,我国多数利用聚丙烯、聚乙烯、聚酯等材料加工合成食品包装膜[1]。这些材料制成的包装膜虽然加工过程方便、成本低,对食品的保鲜有重要作用,能够很好地隔离外界环境以及微生物对食品的污染;但由于其材料的不可降解,使得环境被污染。因此,开发新型天然的可降解可食性保鲜膜将是一个十分具有前景的研究领域。
20世纪80年代,日本学者初次发现ε-聚赖氨酸(ε-polylysine,ε-PL)对细菌、真菌的生长繁殖都有明显的抑制作用[2]。ε-PL是一种由赖氨酸单体分子α-羧基和ε-氨基形成酰胺键而连接成的均聚氨基酸[3]。这类直链多聚体约由20~30 个赖氨酸残基组成,由一类白色链霉菌(Streptomyces albulus)代谢产生[4-5],具有安全无毒、广谱抑菌性、水溶性好、热稳定性好等优点,此外,ε-PL在日用化妆品工业、基因载体、药物制剂等领域也有广阔应用[6-7]。目前我国已经批准ε-PL作为食品防腐剂应用于焙烤制品、熟肉制品以及果蔬汁生产中[8]。传统的补锌制剂主要是硫酸锌,而新型有机补锌制剂主要是葡萄糖酸锌(zinc gluconate,ZG)。和传统的补锌制剂硫酸锌相比,ZG具有吸收速率快、安全性高、利用率高等优点[9]。另外,ZG常常作为人和动物的补锌制剂,在医学临床领域也发挥极其重要的作用[10]。海藻酸钠、阿拉伯胶和甘油无毒,对人体无害,是可食性材料,可用于制备食品保鲜、绿色环保、可食用的包装膜[11-12]。ε-PL用于可食性抗菌膜的制备已有不少文献报道,余作龙等[13]以豌豆淀粉/ε-PL为主要基材,以甘油、海藻酸钠等为增塑剂制备了复合膜包装材料;柏韵等[14]研究发现,利用壳聚糖、ε-PL和卡拉胶对中国对虾进行复合涂膜能够抑制其贮藏期间细菌的生长;吴海霜等[15]利用ε-PL-壳聚糖/聚乙烯复合膜对鲜切茄子进行真空包装。但目前鲜见将ε-PL与ZG复合的抗菌膜,本研究以海藻酸钠、阿拉伯胶和甘油制备基础膜,以ε-PL、ZG为抗菌剂,制备出一种安全无毒、可食用的新型抗菌功能膜,并研究该复合膜的性质和探讨其对生鲜肉微生物抑菌的效果,为食品工业合理利用保鲜膜提供理论依据。
1 材料与方法
1.1 材料与试剂
菌株、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌O157:H7(Escherichia coli O157:H7)由武汉轻工大学食品微生物实验室提供。
LB培养基:将10 g胰蛋白胨、5 g酵母粉、10 g NaCl、1 000 mL蒸馏水混合均匀,于121 ℃灭菌15 min,得到LB液体培养基,备用;LB固体培养基在LB液体培养基的基础上加入培养基质量2%的琼脂。
海藻酸钠、甘油 国药集团化学试剂有限公司;阿拉伯胶 亿鑫生物科技有限公司;ε-PL、ZG、琼脂粉武汉楚诚正茂科技工程有限公司;氯化钠、酵母膏、蛋白胨 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
酶标仪 美国Enspire公司;Milli-Q超纯水器 美国Millipore公司;SW-CJ-2FD双人超净工作台 苏州净化设备有限公司;YXQ-LS-70A自动高压灭菌锅 上海博迅实业有限公司;UltraScan VIS台式分光测色仪 上海信联创作有限公司;S-3000N型扫描电子显微镜 上海上天精密仪器有限公司;RGD-1型电子拉力试验机深圳市瑞格尔仪器有限公司;数字测微计 深圳新德亚精密仪器有限公司;物性仪 英国SMS公司。
1.3 方法
1.3.1 ε-PL与ZG最适复配质量浓度的确定
采用微量稀释法测定ε-PL的最小抑菌浓度(minimum inhibitory concentration,MIC)[16]。取两块无菌的96 孔板置于超净台上,将初始质量浓度为42 mg/mL的ε-PL溶液用无菌水倍比稀释,分别将S. aureus和E.coli O157:H7两种菌悬液调至相同浓度(106~107CFU/mL),分别取50 μL加入相对应的96 孔板中,混匀后置于37 ℃培养箱中培养24 h,利用酶标仪于600 nm波长处测定其OD值[17],判定MIC。
结合上述ε-PL的1/2 MIC,采用微量稀释法确定利用1/2 MIC ε-PL与ZG复配后,复配液对两种食源性病原菌的最佳抑菌浓度。具体为:取两块无菌的96 孔板置于超净工作台上,将初始浓度为0.05 mol/L的无菌ZG溶液用无菌水倍比稀释,分别将S. aureus和E. coli O157:H7两种菌悬液配制相同浓度(106~107CFU/mL),分别取50 μL加入相对应的96 孔板,再加入ε-PL溶液使ε-PL的质量浓度为1/2 MIC。将96 孔板置于37 ℃培养箱中培养24 h,利用酶标仪于600 nm波长处测定其OD值,确定与1/2 MIC、ε-PL溶液复配后ZG溶液的MIC。
1.3.2 ZG与ε-PL协同抗菌的效果测定
为评价ZG与ε-PL协同抗菌的效果,设计4 个ZG浓度(0.15、0.6、2.5、10 mmol/L)、3 个ε-PL浓度(0.33、0.65、1.3 mg/mL)。将系列浓度的ε-PL、ZG以及菌液(S. aureus或E. coli O157:H7)分别加入对应的96 孔板中,混匀后放入37 ℃恒温培养箱中培养24 h,利用酶标仪于600 nm波长处测定OD值并且计算抑制率。空白对照组为用无菌水代替ZG和ε-PL溶液,其他成分与ZG与ε-PL联用组一致。抑制率按公式(1)[18]计算。
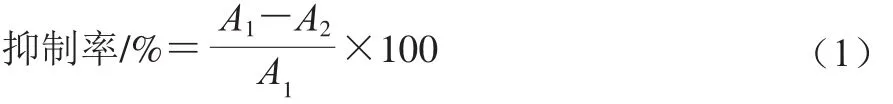
式中:A1为空白对照组的OD值;A2为ZG与ε-PL联用组的OD值。
1.3.3 膜的制备方法
每100 mL去离子水中加入2.5 g海藻酸钠、1 g阿拉伯胶、甘油2 g,分散后在恒温磁力搅抖器上搅抖至溶液成透明的胶体状态,静置至气泡消失,即得基础膜液。取20 g基础膜液,加入适量的一定浓度的ZG、ε-PL溶液,搅抖使溶液混合均匀,超声波破碎至气泡消失,然后取15 g液体至直径为9 cm的培养皿,涂膜,置于干燥箱中38~40 ℃干燥12 h后,起膜即得抗菌膜。
1.3.4 膜的抑菌圈实验
将两种受试菌分别涂布到不同的LB固体培养基上(菌液浓度为106~107CFU/mL),用打孔器在膜上打出同样大小(直径6 mm)的膜片备用,然后将膜片分别贴在均匀涂布了菌种的固体培养基的表面,将培养皿倒置培养于37 ℃恒温箱中24 h,用游标卡尺测量抑菌圈直径的大小。
1.3.5 抗菌膜的物理性能测定
1.3.5.1 表面形态观察
采用S-3000N型扫描电子显微镜观察抗菌膜的表面形貌,样品贴在样品盘上进行表面真空喷金,然后进行拍照。
1.3.5.2 厚度的测定
膜的厚度使用数字测微计测量,数据精确到0.000 1 mm,进行5 次测量,记录数据并且计算平均值。
1.3.5.3 水蒸气透湿量的测定
膜的水蒸气透湿量的测定参照GB/T 1037—1988《塑料薄膜和片材透水蒸气性试验方法 杯式法》方法进行。
1.3.5.4 阻氧性的测定
称取10 g大豆油于250 mL锥形瓶中,用已经制备好的膜封口,并用石蜡进行密封;放置于60 ℃的烘箱中,在10 d后揭开膜测定油样的过氧化值,并将锥形瓶口敞开的油样作为对照。过氧化值的测定根据GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》进行。
1.3.5.5 色度的测定
膜的色度使用UltraScan VIS台式分光测色仪进行测定,L值为亮度,a和b值为色度坐标,a值表示红(+)绿(-)度,b值表示黄(+)蓝(-)度[19-20]。
1.3.5.6 抗拉伸强度与断裂伸长率的测定
用切纸机将膜剪成45 mm×25 mm的长条,膜的机械性能用物性仪测定,探头型号为A/TG,有效拉伸长度设置为50 mm,测试速率为1.0 mm/s。抗拉伸强度为拉伸过程中膜断裂时单位横截面上的力,按公式(2)计算,断裂伸长率按公式(3)计算。
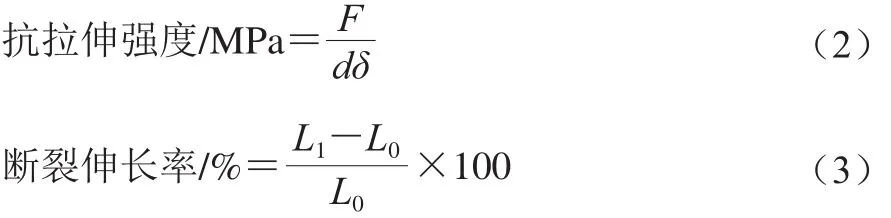
式中:F为最大拉力/N;δ为膜的厚度/mm;d为膜样的宽度/mm;L0为膜拉伸前的有效长度/mm;L1为膜断裂时的长度/mm。
1.3.5.7 傅里叶变换红外光谱的测定
采用傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)仪测定膜的红外结构,使用KRS-5型ATR探头,扫描范围为400~4 000 cm-1。
1.3.6 抗菌膜对生鲜肉微生物抑菌效果的评价
样品分实验组和对照组,实验组和对照组分别用ε-PL/ZG复合抗菌膜和基础膜包裹生鲜肉,在37 ℃恒温箱中放置24 h后分别测定菌落总数,菌落总数按照GB 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数测定》的方法测定。
1.4 数据处理和分析
利用Excel软件整理数据并作图,采用SPSS Statistic 17.0软件对数据进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 ε-PL与ZG最适复配质量浓度的确定
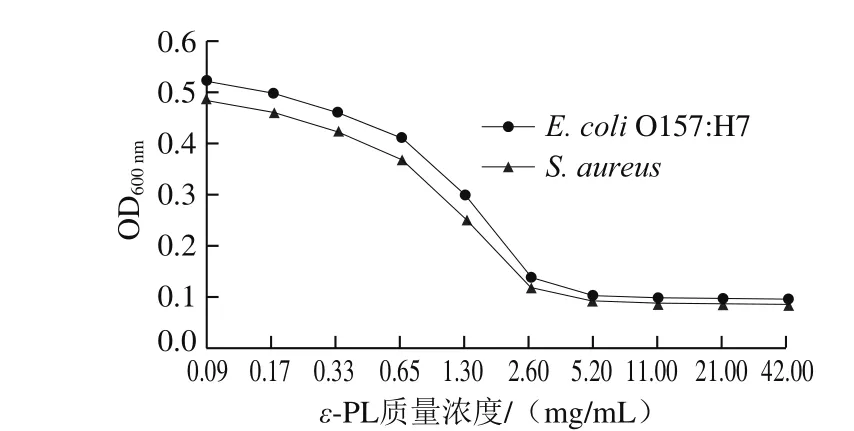
图 1 不同质量浓度ε-PL对S. aureus和E. coli O157:H7生长的影响Fig. 1 Effect of ε-PL concentration on the growth of S. aureus and E. coli O157:H7
如图1所示,ε-PL对S. aureus的抑制能力随着其质量浓度的增加而增强,当ε-PL质量浓度超过2.60 mg/mL时,两种菌液的OD600nm趋于平缓,并且培养液澄清透明,可确定ε-PL对S. aureus和E. coli O157:H7的MIC为2.60 mg/mL。
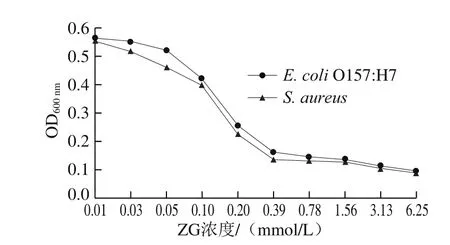
图 2 ε-PL与ZG复配对S. aureus和E. coli O157:H7生长的影响Fig. 2 Combined effect of ε-PL and ZG on the growth of S. aureus and E. coli O157: H7
固定ε-PL的质量浓度为1/2 MIC(1.3 mg/mL),用不同浓度的ZG与之复配,观察复合液对S. Aureus和E.coli O157:H7的抑制效果。由图2可知,所配复合液对两种菌的抑制效果基本保持一致,均随着ZG浓度(0.01~0.39 mmol/L)的增加而增强;当ZG的浓度增加至0.39 mmol/L时,培养液澄清透明,再增大ZG浓度,OD600nm基本不变;因此,在溶液体系中与1.3 mg/mL ε-PL复配的ZG最适浓度为0.39 mmol/L,且ZG与ε-PL联合使用的抑菌效果要强于单一的ε-PL。
2.2 ZG与ε-PL的协同抗菌效果
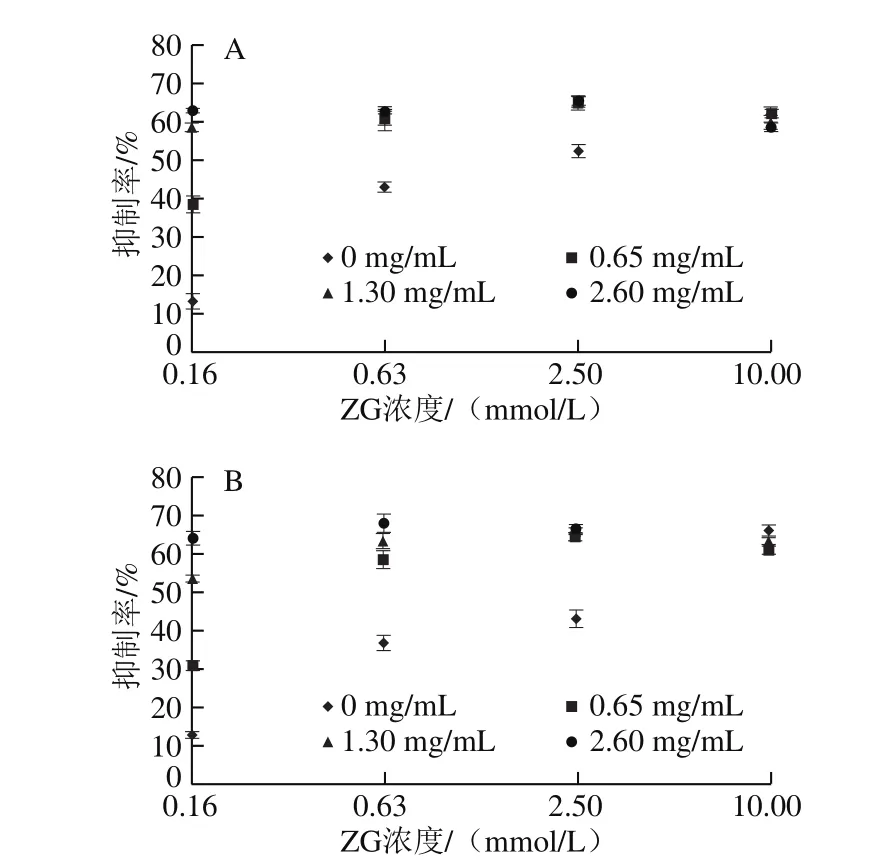
图 3 ZG与ε-PL复配对E. coli O157:H7(A)和S. aureus(B)的抑制效果Fig. 3 Synergistic antibacterial activity of ZG and ε-PL on E. coli O157:H7 (A) and S. aureus (B)
由图3可知,当ZG浓度低于10.00 mmol/L时,ZG与ε-PL联合使用的抑菌效果要强于单一的ZG,具有协同抗菌效应,但ZG在高浓度(10 mmol/L)时,与ε-PL无协同抗菌效应,其原因是过高浓度的ZG抑制了细菌生长[21]。有研究表明,ε-PL具有10 个以上赖氨酸残基,具有抑菌活性[5],并且能破坏微生物细胞膜的正常结构,阻碍微生物体内的所有生物合成代谢过程,使细胞的物质、能量和信息传递中断,导致细胞受损[22]。一方面,Zn2+可与细菌体内含—SH的酶发生作用,破坏细菌正常的新陈代谢,而导致细菌死亡[23];另一方面,大多数细菌细胞膜带负电荷,Zn2+的正电荷在静电作用下可与细菌的细胞膜接触,从而使细菌生长受阻或死亡[24]。当ZG与ε-PL结合时,呈现相互协同效应。
2.3 ε-PL/ZG抗菌膜的抗菌性能
以海藻酸钠(2.5 g/100 mL)、阿拉伯胶(1 g/100 mL)、甘油(2 g/100 mL)与去离子水为基础膜成分,固定ZG的浓度0.39 mmol/L,设计系列ε-PL质量浓度,制备8 组抗菌膜并进行抑菌圈实验(表1)。
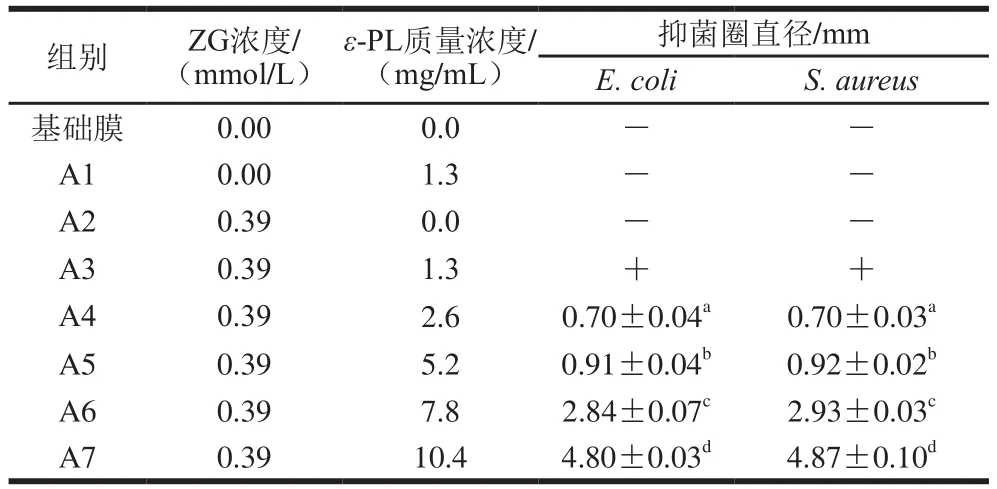
表 1 抗菌膜中ZG与ε-PL的配比浓度及其对抑菌圈直径的影响Table 1 Diameters of inhibition zones of indictor strains when exposed to antibacterial films with different concentrations of ZG and ε-PL
由表1可知,基础膜、仅添加1.3 mmol/L ε-PL的抗菌膜(A1)以及仅添加0.39 mmol/L ZG的抗菌膜(A2)均未出现明显的抗菌效果,且膜上有部分细菌生长。当ε-PL质量浓度不小于2.6 mg/mL时,抗菌膜对E. coli和S. aureus产生了良好的抗菌效果,抑菌圈直径随着ε-PL质量浓度的增加而增大。综上,后续实验测定含2 mg/mL ε-PL、0.39 mmol/L ZG抗菌膜的物理指标并评价其抗菌效果。
2.4 ε-PL/ZG抗菌膜的物理性质
2.4.1 ε-PL/ZG膜的表面形态
通过电子扫描显微镜可以对复合膜的表面形貌进行分析,清晰地观察到膜液共混体系内部各相的分散状态以及相界面之间的结合情况,可对共混体系中组分的相容程度进行定性评价[25]。由图4可知,基础膜的表面较为粗糙,膜中交联点分布不均匀,膜的结构也相对松散。而添加ε-PL/ZG的抗菌膜表面较为光滑平整,膜中交联点分布得比较均匀,膜的结构更加紧密。这是因为在基础膜液中加入ε-PL/ZG后,海藻酸钠会和Zn2+发生交联作用,使得膜中的交联点分布比较均匀,膜分子间排列更紧致,从而使得膜的结构变得更加紧密。

图 4 ε-PL/ZG抗菌膜(A)和基础膜(B)的扫描电子显微镜图Fig. 4 Scanning electron microscopic images of the ε-PL/ZG antibacterial film (A) and control film (B)
2.4.2 ε-PL/ZG膜的厚度、水蒸气透湿量与阻氧性
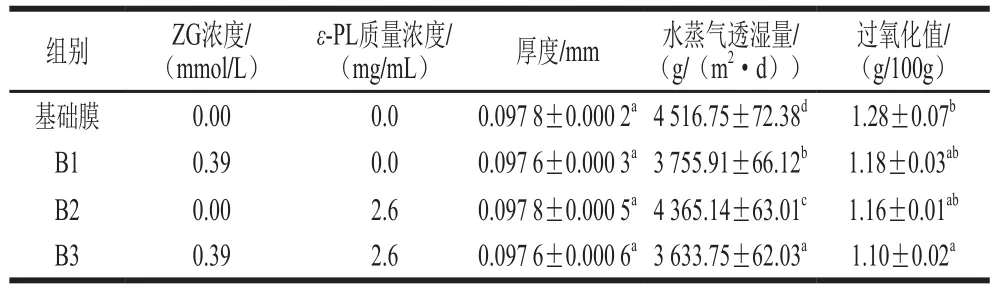
表 2 ε-PL/ZG膜的厚度与水蒸气透湿量Table 2 Thickness and water vapor permeability of the ε-PL/ZG film
从表2可以看出,在相同成膜液量(15 g)的情况下,添加ZG和ε-PL对抗菌膜的厚度影响很小,但对其阻隔性(阻水性和阻氧性)产生了显著影响,不同组别抗菌膜的厚度范围为0.097 6~0.097 8 mm。影响膜的水蒸气透湿量的因素主要是聚合物分子链间作用力和分子链间的自由体积两个方面,分子链间作用力越小,分子链间的自由体积越大,膜的渗透性越大[26],ε-PL/ZG膜的水蒸气透湿量为3 633.75 g/(m2·d),小于基础膜的水蒸气透湿量,表明ε-PL/ZG膜具有较好的阻水性。无膜覆盖的大豆油过氧化值为1.39 g/100 g,显著高于有膜覆盖油样的过氧化值,表明海藻酸钠基膜和复合膜均具有较好的阻氧作用。加入ε-PL/ZG后,膜的水蒸气透湿量和氧气透过量略有减小,可能是由于弱极性的ε-PL与海藻酸钠分子之间的相互作用使膜分子间紧密排列,改善了膜对水蒸气和氧气的阻隔性。加入ε-PL/ZG后,海藻酸钠会与溶液中的Zn2+发生交联反应使得膜的结构变得更加紧密,使得膜的阻水性和阻氧性效果更好。
2.4.3 ε-PL/ZG膜的色度
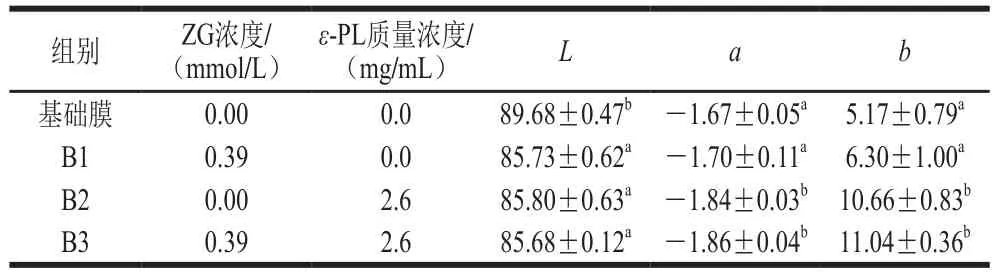
表 3 ε-PL/ZG膜的色度参数Table 3 Color parameters of the ε-PL/ZG film
从表3可以看出,加入ZG和ε-PL后,抗菌膜的L值减小,而a的绝对值、b值均增大,说明与基础膜相比,载锌与ε-PL抗菌膜的亮度有所减弱,颜色变绿、变黄。这可能是因为加入的Zn2+与海藻酸钠的聚合链的缔合链段之间产生三维结构,从而使膜表面出现许多“孔洞”,ε-PL渗透于海藻酸钠分子的间隙和所形成的“孔洞”中,由于ε-PL溶液本身为黄色,加入后会使膜的颜色加深,使得所测定的a和b值的绝对值增大[27]。
2.4.4 ε-PL/ZG膜的抗拉伸强度与断裂伸长率
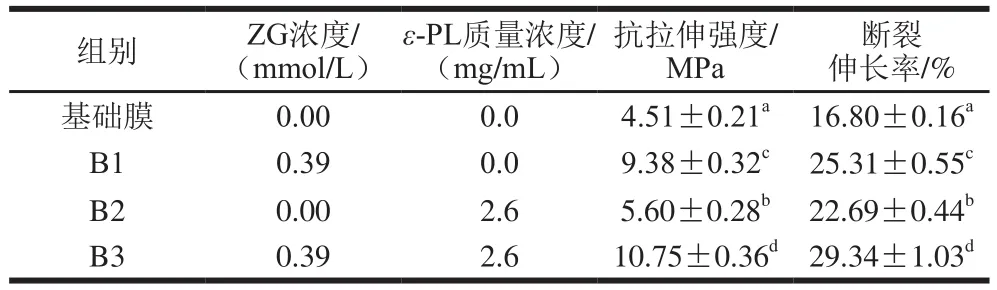
表 4 ε-PL/ZG膜的抗拉伸强度和断裂伸长率Table 4 Tensile strength and elongation at break of the ε-PL/ZG film
抗菌膜力学性能的变化与其本身微观网络结构和分子间作用力有关[28]。由表4可知,在加入ZG溶液后,膜的抗拉伸强度和断裂伸长率增大,其原因是海藻酸钠会和溶液中的Zn2+发生交联反应,膜中交联点分布得比较均匀,使得膜的结构变得更加紧密。在加入ε-PL后,膜的抗拉伸强度和断裂伸长率也增大,其原因可能是由于海藻酸钠是线性多糖,其分子中的OH-和ε-PL的NH3+间发生相互作用形成网状结构,使膜内分子结合更加紧密[29]。结果表明在膜液中添加ε-PL/ZG会在一定程度上提高膜的抗拉伸强度,对变形的抗力也增大,同时也提高了膜的断裂伸长率,增大了膜的韧性。NH3+
2.4.5 ε-PL/ZG膜的FT-IR分析结果
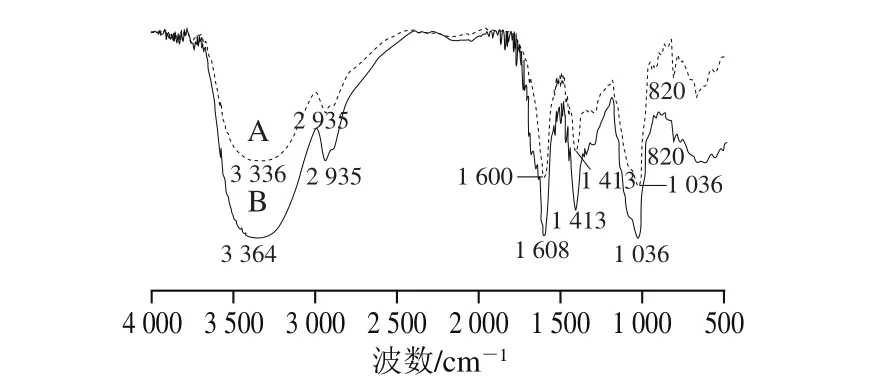
图 5 基础膜(A)与ε-PL/ZG抗菌膜(B)的FT-IR图Fig. 5 Fourier transform infrared spectra of control film (A) and ε-PL/ZG antibacterial film (B)
通过FT-IR可鉴别化合物中的化学键类型[30],由图5可知,基础膜中3 200~3 500 cm-1处出现宽峰,这属于—OH伸缩振动峰[31],与海藻酸钠中含有羟基有关。2 960~2 850 cm-1处出现C—H的伸缩振动峰,是海藻酸钠的特征峰;1 600 cm-1处出现的是C=O的伸缩振动峰,是阿拉伯胶的特征峰[32];1 036、1 413 cm-1处是C—O的弯曲振动峰。基础膜中820 cm-1处出现的C—OH伸缩振动在ε-PL/ZG抗菌膜中稍微减弱,推测是ε-PL的氨基和海藻酸钠分子中的羟基发生了交联;并且加入ε-PL/ZG后,C=O的伸缩振动峰发生位移,由1 600 cm-1处移至1 608 cm-1处,说明抗菌膜分子之间形成了较为强烈的相互作用,这些结果也佐证了抗菌膜机械性能的改善。
2.5 ε-PL/ZG抗菌膜对生鲜肉微生物抑菌效果
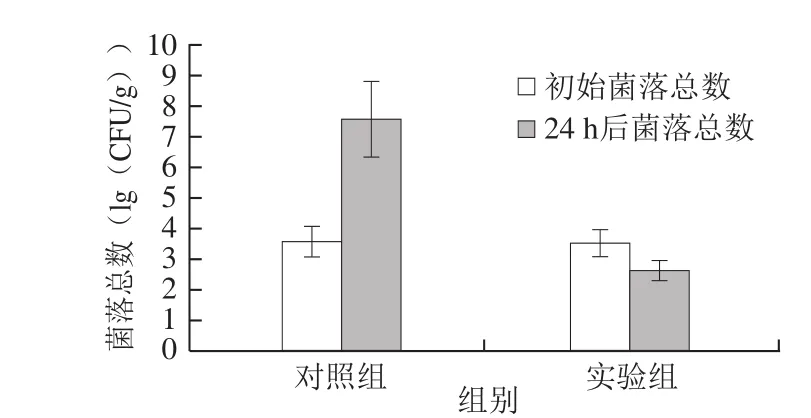
图 6 ε-PL/ZG抗菌膜对鲜肉在37 ℃下贮藏24 h后菌落总数的影响Fig. 6 Changes in total bacterial counts in chilled pork wrapped with ε-PL/ZG antibacterial film after storage at 37 ℃ for 24 h
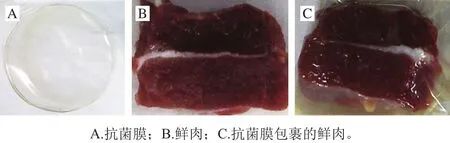
图 7 不同处理组生鲜肉贮藏结束后的照片Fig. 7 Pictures of fresh meat with different treatment after storage
肉品腐败变质的主要原因是细菌大量滋生导致蛋白质分解[33]。GB 4789.2—2016《食品安全国家标准菌落总数测定》将肉的鲜度按菌落总数分为3 个等级:一级鲜度的菌落总数低于1×104CFU/g,二级鲜度的菌落总数在1×104~1×106CFU/g之间,菌落总数高于1×106CFU/g时为变质肉。贮藏结束后,对照组菌落总数增加明显,而用抗菌膜包裹的实验组菌落总数远远低于对照组(图6),同时抗菌膜包裹后鲜肉内部清晰可见(图7),不影响视觉效果,表明载锌与ε-PL的抗菌膜具有很好的杀菌效果和通透性。
3 结 论
本研究中,以海藻酸钠(2.5 g/100 mL)、阿拉伯胶(1 g/100 mL)、甘油(2 g/100 mL)与去离子水为基础膜成分,添加0.39 mmol/L ZG、2.60 mg/mL ε-PL制备的抗菌膜具有较好的抗菌效果。该抗菌膜厚度为0.097 6 mm、水蒸气透湿量3 633.75 g/(m2·d),抗拉伸强度为10.75 MPa、断裂伸长率为29.34%。添加ε-PL/ZG溶液,可使膜的结构变得更加紧密,增强膜的抗拉伸强度,增大膜的断裂伸长率,减少膜的水蒸气透湿量,该膜既能控制细菌的生长,还能补锌,天然环保,在食品包装领域具有广阔的开发和应用前景。
