主动自发气调对桃吉尔霉抑制效果的影响
2020-03-31刘莎莎张玉笑员丽苹张新华郭衍银
刘莎莎,张玉笑,王 亮,员丽苹,陈 勇,张新华,郭衍银
(山东理工大学农业工程与食品科学学院,山东 淄博 255049)
桃吉尔霉(Gilbertella persicaria)是具有广泛宿主的一种霉菌,可以侵染梨[1]、番茄[2]、海南蒲桃[3]、树莓[4]、木瓜[5]、茄子[6]等,而且是导致桃[7]、火龙果[8-9]贮藏过程中出现软腐病的重要病原菌之一,可造成巨大经济损失。目前,控制采后微生物危害的主要措施是化学杀菌剂和生物防治。但杀菌剂易造成化学残留、降低食品安全性及病原菌产生耐药性等问题[10],而生物防治则存在抑菌效果不稳定、易被环境因子干扰的问题[11]。因此在果蔬贮藏过程中,寻求一种绿色安全有效的控制桃吉尔霉生长的方法显得尤为重要。
研究表明,气调不仅对果蔬具有较好的保鲜作用,同时对微生物侵染也有一定的控制作用[12-13]。基于一般气调使用O2、CO2和N23 种气体,但主要起保鲜作用的是O2和CO2两种气体(N2主要起平衡作用)的观点,本实验室系统研究了O2/CO2气调对果蔬保鲜效果的影响,并取得不错效果。如在10 ℃下,50%(体积分数,下同)O2+50% CO2不仅能提高西兰花能量利用效率[14],且可降低含硫化合物异味代谢[15],体现出O2/CO2气调的独特保鲜优势。同时,90% O2+10% CO2不仅对生姜具有很好的保鲜作用[16],且可有效抑制生姜贮藏期间姜蛆带来的危害[17]。
主动自发气调是将需要贮藏的果蔬放在密闭的容器中,依靠初始充入的气体及果蔬自身的呼吸作用,快速达到预定的气体环境条件的一种保鲜方式,非常适合现代物流运输保鲜。本课题组在蒜薹保鲜研究中得出,80% O2+20% CO2主动自发气调在20 ℃下具有很好的保鲜效果[18],但O2/CO2主动自发气调能否在微生物控制方面起到应有作用需要进一步研究。为此,本实验通过研究密封容器内不同初始O2/CO2气体比例对桃吉尔霉生长的影响,探究主动自发气调对桃吉尔霉的调控作用及其在果蔬保鲜中的潜在价值,为果蔬贮藏过程中病害的控制提供依据。
1 材料与方法
1.1 材料与试剂
桃吉尔霉(Gilbertella persicaria)分离自新鲜桃子,所分离菌株经山东泓迅生物科技有限公司Blast比对鉴定,确定为桃吉尔霉菌株。
葡萄糖 天津市化学试剂研究所;琼脂、果胶、羧甲基纤维素钠、磷酸氢二钠、磷酸二氢钠 天津市光复精细化工有限公司;柠檬酸、柠檬酸钠、乙酸、乙酸钠、无水乙醇 烟台市双双化工有限公司;三羟甲基氨基甲烷、乙二胺四乙酸、邻苯三酚、邻苯二酚、浓盐酸、愈创木酚、过氧化氢、果胶、硫酸镁、氯霉素、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠、亚硫酸钠 天津市凯通化学试剂有限公司;苯酚、氢氧化钠、盐酸 莱阳市康德化工有限公司。所用试剂均为分析纯。
1.2 仪器与设备
DDS-307A电导率仪 上海精科雷磁仪器;MR-07825-00 O2/CO2测定仪 丹麦丹圣贸易公司;UV-1750紫外-可见分光光度计 日本岛津国际贸易有限公司;GL-20G-2台式高速冷冻离心机 上海安亭仪器制造厂;XW-80A漩涡混合器 上海青浦沪西仪器厂;AL-1D4精密分析天平 瑞士梅特勒-托利多仪器有限公司;XS-212-20光学显微镜 苏州胜视电子设备有限公司;GXZ-260B光照生化培养箱 宁波江南仪器厂;SW-CJ-1D超净工作台、LS-50HD立式自动电热压力灭菌锅济南来宝医疗器械有限公司;RDL380P气调包装机成都罗迪博尔机械设备有限公司。
1.3 方法
1.3.1 桃吉尔霉的培养与处理
将在4 ℃下保存的桃吉尔霉活化3 次后,于PDA培养基上扩大培养[19],配制成浓度为106CFU/mL的孢子悬浮液,取20 μL孢子悬浮液接种于培养皿(直径9 cm)中央。待菌悬液晾干后将培养皿置于气调袋内,每个气调袋放4 个培养皿。然后,每个气调袋经RDL380P气调包装机分别充入80% O2+20% CO2、90% O2+10% CO2、100% O2和自然空气,以自然空气作为对照,每个处理10 个气调袋,置于(20.0±0.5)℃恒温培养箱内培养,于第4、6、8、10、12、14天进行相关指标的测定,实验做3 次重复。
1.3.2 指标测定
1.3.2.1 桃吉尔霉菌落形态观察
第5、10天时,将培养皿从气调袋内拿出,转移到无菌操作台上,进行拍照,重点观察菌落颜色、菌丝生长范围、孢子生长状况。
1.3.2.2 桃吉尔霉微观形态观察
第5、10天时,将培养皿从气调袋内拿出,在无菌操作台上,滴一滴无菌水于载玻片中央,用无菌接种环在培养皿内挑取桃吉尔霉菌丝置于载玻片上,盖上盖玻片。在光学显微镜下进行霉菌的微观形态观察,重点观察桃吉尔霉的菌丝体、囊轴、孢子囊的形态。
1.3.2.3 CO2体积分数测定
利用O2/CO2测定仪定期测定气调袋内的CO2体积分数。
1.3.2.4 桃吉尔霉孢子量计数
孢子量计数参考郭宇欢[20]的方法。在超净工作台中,用打孔器(直径6 mm)在菌落边缘处随机打取3 块菌碟,置于50 mL离心管中,并加入15 mL无菌水,振荡10 min后两层纱布过滤,然后加10 mL水,分两次冲洗纱布和离心管,制成孢子悬浮液,显微镜下对孢子进行计数。
1.3.2.5 桃吉尔霉孢子DNA释放量、电导率的测定
孢子DNA释放量、电导率的测定按照Zeng Xinping等[21]的方法。在菌落边缘用直径6 mm的打孔器随机取3 块菌碟,加入10 mL无菌水,漩涡混合器振荡过滤后去除菌丝,用0.05 mol/L、pH 7.2的磷酸缓冲液15 mL分3 次冲洗,转移到20 mL的缓冲液中,后配制成相同浓度(106CFU/mL)的孢子悬浮液。12 000 r/min离心3 min除去菌体,上清液于260 nm波长处测定OD值,以磷酸缓冲液作为空白,以OD260nm表征孢子DNA的释放量;采用电导率仪测定上清液的电导率。
1.3.2.6 桃吉尔霉细胞壁降解酶活力测定
取1.3.2.5节制备的8 mL 106CFU/mL孢子悬浮液,超声波粉碎机破壁15 min,4 ℃下10 000 r/min离心10 min,取上清液作为待测酶液。多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲基半乳糖醛酸酶(pectin methylgalacturonase,PMG)活力测定分别以果胶、果胶酸钠为底物,在各自体系中加入酶液后混匀,在50 ℃下水浴10 min,然后利用DNS显色法测定540 nm波长处的吸光度[22]。以50 ℃下每毫升粗酶液每分钟分解底物释放1 μg还原糖所需要的酶量表征酶活力,单位为U/mL。
1.3.2.7 桃吉尔霉抗氧化酶活力测定
在2 组离心管中均加入4 mL 106CFU/mL的孢子悬浮液,4 ℃ 10 000 r/min条件下离心10 min,收集菌体。超氧化物歧化酶(superoxide dismutase,SOD)的提取用预冷的0.2 mol/L pH 7.8磷酸盐缓冲液洗涤,过氧化物酶(peroxidase,POD)的提取用0.2 mol/L pH 6.5的磷酸盐缓冲液洗涤,洗涤3 次后,弃去上清液收集菌体。后将两者所得的菌体各自重悬于3 mL预冷的0.2 mol/L pH 7.8和0.2 mol/L pH 6.5的磷酸盐缓冲液中,再进行冰浴超声波破壁15 min,4 ℃、12 000 r/min离心20 min,取上清液用于测定酶活力。SOD活力采用邻苯三酚自氧化法,定义25 ℃时抑制50%邻苯三酚自氧化速率时所需的量为1 个酶活力单位(U);POD活力测定采用愈创木酚氧化法测定470 nm波长处的吸光度,将吸光度每秒改变0.001定义为1 个酶活力单位(U)。SOD和POD活力单位均为U/mL[22]。
1.4 数据统计与处理
所得数据使用SPSS 19.0软件采用最小显著性差异法(least significant difference,LSD)进行显著性分析及相关性分析,P<0.05表示差异显著,并用Excel软件作图。
2 结果与分析
2.1 主动自发气调对桃吉尔霉菌落形态的影响
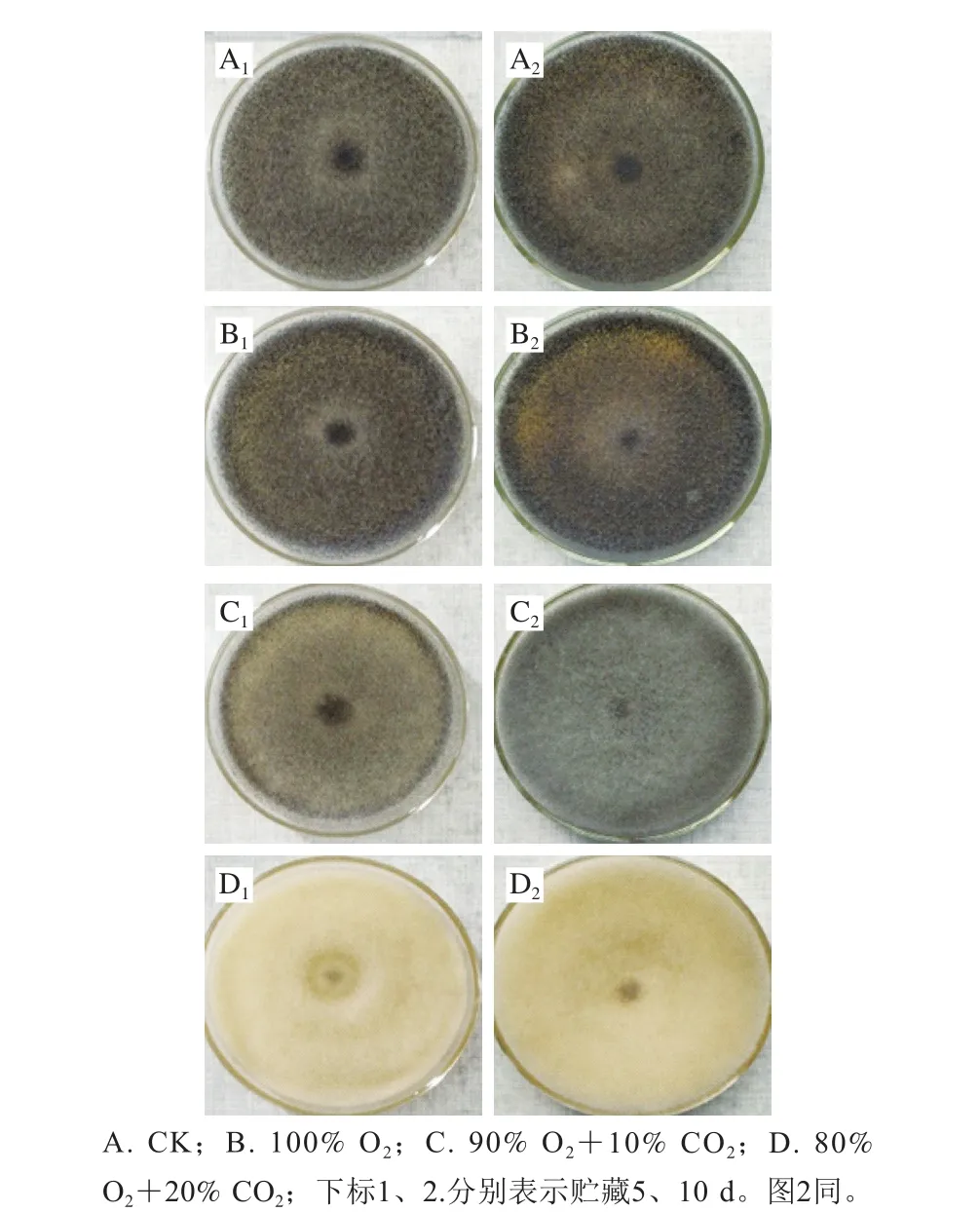
图 1 不同处理下桃吉尔霉在培养基上的生长状况Fig. 1 Growth status of Gilbertella persicaria on medium under different treatments
由图1可知,初始O2/CO2比例对桃吉尔霉生长影响极大,CK组在第5天时培养皿内就长满了菌丝及黑色孢子,100% O2处理组的菌丝及孢子生长量与CK组类似。随着CO2比例的升高,桃吉尔霉生长受到的抑制越大,90% O2+10% CO2处理组的培养皿内虽然长满了菌丝、孢子,但其颜色明显淡于CK组,80% O2+20% CO2处理组虽然有菌丝生成,但无黑色孢子产生。
2.2 主动自发气调对桃吉尔霉微观形态的影响
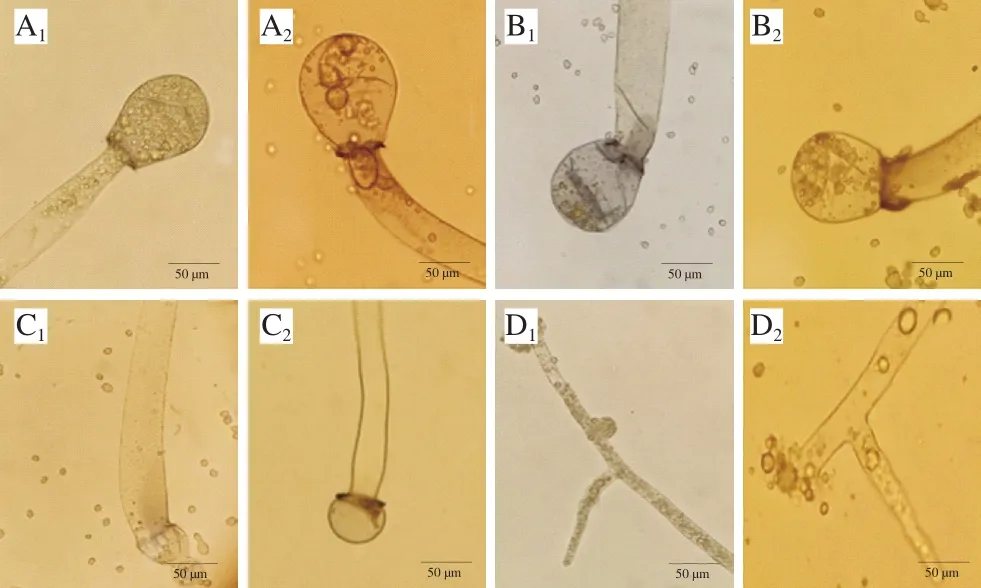
图 2 桃吉尔霉在显微镜下的菌丝和囊轴形态(×400)Fig. 2 Mycelia and columella morphology of Gilbertella persicaria (× 400)

图 3 桃吉尔霉在显微镜下孢子囊及释放孢子的形态(×400)Fig. 3 Morphology of sporangia and released spores of Gilbertella persicaria (× 400)
如图2、3所示,第5天时,CK组的菌丝体粗细均匀,表面光滑,囊轴圆滑饱满,孢子囊破裂后可释放分生孢子;100% O2处理组菌丝体较为粗壮,囊轴饱满且较CK组更大,孢子囊破裂可释放大量分生孢子;90% O2+10% CO2处理组的菌丝体与CK组无明显差别,但囊轴出现畸形,呈葫芦状,且孢子量减少,孢子囊释放的分生孢子较少;80% O2+20% CO2处理组的菌丝体开始出现分枝,孢子囊在菌丝顶端未成熟且呈现畸形,未发现脱落的孢子囊,因此没有其孢子囊及释放孢子的图片。第10天时,CK、100% O2处理组的菌丝体较5 d时更粗大,囊轴更加饱满,但孢子囊释放的孢子数目减少,这可能与桃吉尔霉完成一个生长周期有关。与第5天相比,90% O2+10% CO2处理组的菌丝体变细,囊轴较之前更小,少量孢子囊破裂;80% O2+20% CO2处理组则出现菌丝体分枝增多、孢子囊破裂畸形、自溶等现象。
2.3 气调袋内CO2体积分数和O2体积分数的变化
如图4A所示,CO2体积分数随桃吉尔霉处理时间延长呈现逐渐上升趋势,并在第10天达到平稳阶段。80% O2+20% CO2、90% O2+10% CO2处理组在培养末期(14 d)CO2体积分数分别达到了32.6%、18.1%。而CK、100% O2处理组CO2体积分数上升较慢,直到末期仍维持较低水平,且CO2体积分数均低于20%。100% O2处理组CO2体积分数低于CK组,其他O2/CO2组处理高于CK组,各处理组间差异显著(P<0.05)。如图4B所示,O2体积分数随桃吉尔霉处理时间延长呈现逐渐下降趋势,除CK处理组外,其他3 个处理组的O2体积分数虽有下降,但其体积分数均高于65%。
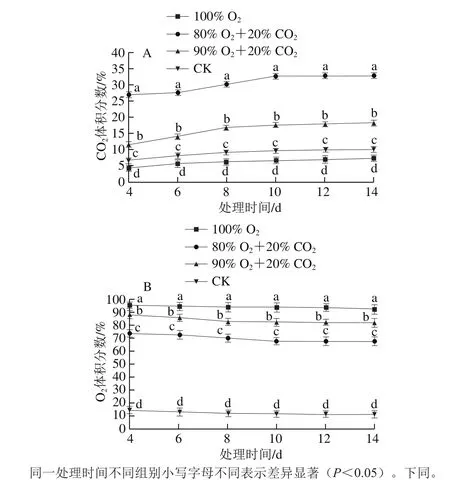
图 4 不同处理气调袋内CO2(A)和O2(B)体积分数变化Fig. 4 Changes in CO2 (A) and O2 (B) contents in normal and modified atmospheres
2.4 主动自发气调对桃吉尔霉孢子量的影响

图 5 不同处理对桃吉尔霉孢子量的影响Fig. 5 Effect of different treatments on the amount of Gilbertella persicaria spores
桃吉尔霉在生长繁殖过程中,孢子萌发,产生菌丝,菌丝顶端生成孢子囊并散发分生孢子。如图5所示,各处理组孢子量随着处理时间的延长呈先上升后下降的趋势。CK、100% O2、90% O2+10% CO2处理组均在第12天时出现峰值,且90% O2+10% CO2处理组孢子量显著低于CK组(P<0.05)。培养12 d后孢子量下降,可能与后期培养基营养成分减少或CO2浓度过高抑制有关。80% O2+20% CO2处理组因无孢子产生,故图中未出现该组折线。
2.5 主动自发气调对桃吉尔霉孢子电导率和DNA释放量的影响
在霉菌培养过程中,自身衰老或者外部环境因素的影响会导致细胞膜透性的增加。电导率是反映膜透性的指标[23]。从图6A可以看出,随着处理时间延长,桃吉尔霉电导率呈现逐渐增大的趋势。与CK组相比,100% O2处理显著降低了电导率,90% O2+10% CO2处理显著增大了电导率(P<0.05),对细胞膜的破坏最严重。因此高O2高CO2气调处理可导致细胞膜透性增加,CO2浓度越高,对菌细胞损伤越严重。

图 6 不同处理对桃吉尔霉孢子电导率(A)、孢子DNA释放(B)的影响Fig. 6 Effects of different treatments on conductivity (A) and spores DNA release (B) of Gilbertella persicaria
孢子DNA释放量可以反映细胞膜破坏程度及细胞内成分的外泄情况。如图6B所示,各处理组孢子内DNA释放量均呈现先快速增长、再平缓过度、最后下降的趋势。整个处理过程中,100% O2处理组DNA释放量显著低于CK组(P<0.05),说明100% O2对桃吉尔霉细胞膜无破坏效果;在处理前10 d,90% O2+10% CO2处理组DNA释放量高于CK组,说明主动自发气调对细胞造成了伤害,但末期低于CK组,可能与末期90% O2+10% CO2处理组孢子量大幅度减少有关。因此主动自发气调处理可破坏细胞膜的完整性,导致孢子内DNA流出,从而达到抑菌效果。后期桃吉尔霉孢子DNA释放减少,可能与末期孢子量下降有关。
2.6 主动自发气调对桃吉尔霉SOD、POD活力的影响
SOD和POD是生物机体防御活性氧伤害的关键酶类[24]。由图7A可知,随着处理时间的延长,SOD活力呈现先升后降再升的趋势,在第6天时呈现一个峰值。在各处理组中,100% O2处理组SOD活力最高,而90% O2+10% CO2处理组最低,100% O2、CK和90% O2+10% CO2处理组的SOD平均活力分别为1 474.1、1 171.4、956.8 U/mL。如图7B所示,POD活力也是第6天出现峰值,然后稍下降,10 d后有所上升,100% O2、CK和90% O2+10% CO2处理组的POD平均活力分别为0.318、0.253、0.203 U/mL,且达到显著差异水平(P<0.05)。
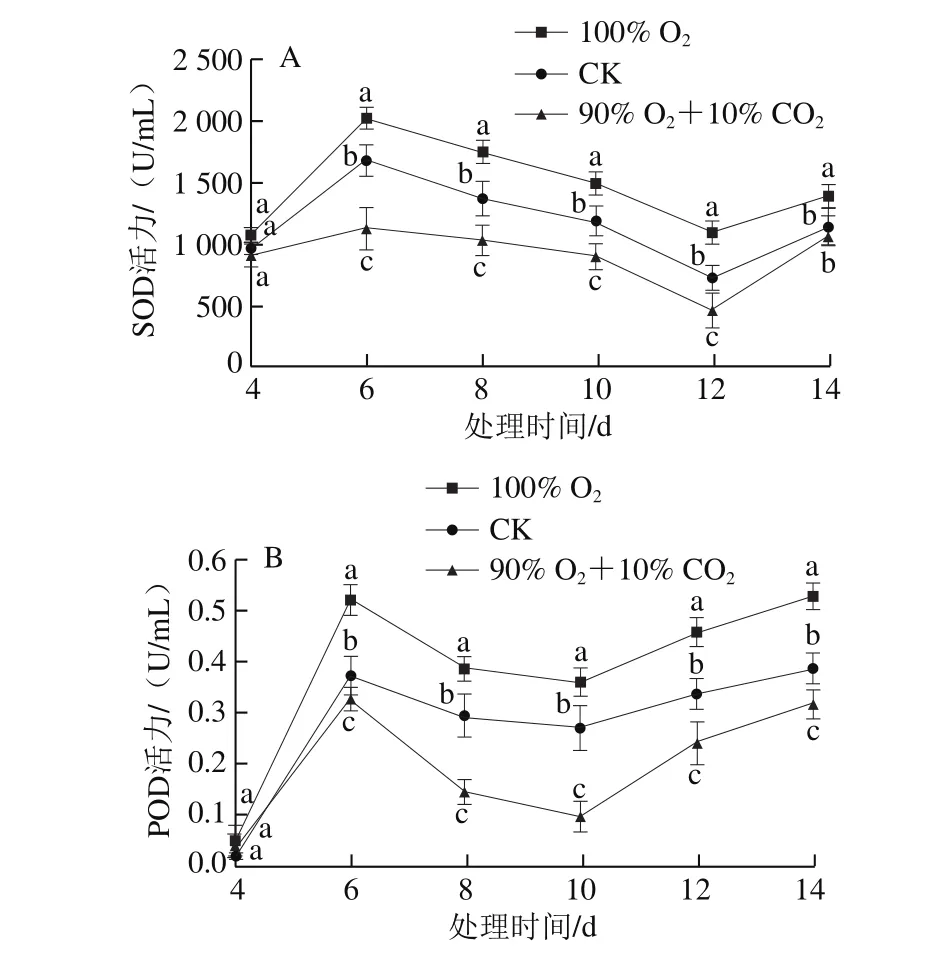
图 7 不同处理对桃吉尔霉SOD(A)、POD(B)活力的影响Fig. 7 Effects of different treatments on the activities of SOD (A) and POD (B) of Gilbertella persicaria
2.7 主动自发气调对桃吉尔霉PG、PMG活力的影响
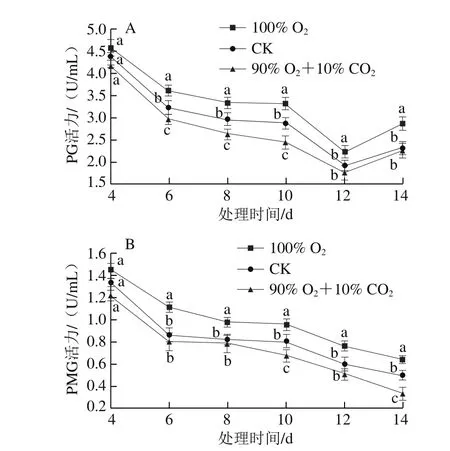
图 8 不同处理对桃吉尔霉PG(A)、PMG(B)活力的影响Fig. 8 Effects of different treatments on the activities of PG (A) and PMG (B) of Gilbertella persicaria
PG、PMG作为水解酶可以分解果胶类物质,在降解植物细胞壁中发挥着重要作用[25]。由图8可知,随着处理时间的延长,PG、PMG活力基本呈现下降趋势。就整个培养期间的活力而言,100% O2组PG、PMG活力均最高,CK组其次,90% O2+10% CO2处理组最低,这3 个处理组PG和PMG的平均活力分别为3.32、2.94、2.71 U/mL和0.99、0.81、0.73 U/mL,差异达显著水平(P<0.05)。说明高CO2环境可抑制PG和PMG活力,降低桃吉尔霉的致病性。
3 讨 论
研究表明,气调能抑制果蔬表面的病原物侵染,Sitton等[26]指出‘旭’、‘元帅’和‘金冠’苹果在CO2体积分数高于2.8%时进行气调贮藏,能显著抑制由灰葡萄孢菌引发的灰霉病;苹果在5% CO2+3% O2或3% O2的气调条件下贮藏可显著降低炭疽病菌的生长及其细胞壁降解酶的活性[27]。但是低O2和高CO2的贮藏易造成CO2伤害、异味等问题[28-29],影响贮藏品质。自高氧气调被提出以来,其已在蘑菇[30]、桑葚[31]等果蔬保鲜方面体现出优势,但对香蕉保鲜没有效果甚至产生负面影响[32]。有研究指出,气调过程中O2、CO2比例具有明显的交互作用,增加O2含量可减轻CO2伤害,增加CO2含量可抑制高O2引起的呼吸作用[33]。为此,本课题组前期对O2/CO2气调保鲜技术进行了研究,并在西兰花、生姜保鲜方面取得不错效果[34-36],且主动自发气调在蒜薹保鲜方面也具有积极作用[18]。为此,本实验选择以O2/CO2气体作为桃吉尔霉的处理方式,以期为O2/CO2的主动自发气调控制微生物危害提供依据。本实验结果表明,与CK组相比,100% O2处理有利于霉菌菌丝及孢子的生长,这与桃吉尔霉是好氧性微生物有关,而90% O2+10% CO2处理对霉菌生长有抑制作用,80% O2+20% CO2处理则完全抑制了霉菌孢子的产生,表明O2/CO2的主动自发气调对霉菌具有很好的抑制效果。
Amanatidou等[37]研究发现,90% O2+10% N2能显著降低敏感性乳酸菌L. sakesens的生长速率和生活力,而对耐性乳酸菌L. sakeins的生长却没有影响。进一步研究指出,在细胞生长稳定期,L. sakesens胞质超氧阴离子的浓度是L. sakeins中的10 倍,而L. sakeins胞质中SOD活力比L. sakesens高10~20 倍,表明活性氧清除能力在L. sakeins抵御气调胁迫中起重要作用。郭衍银等[38]研究指出,与100% O2相比,15 ℃下40% O2+60% CO2气调贮藏可减少活性氧积累,保持SOD和POD活力,并能有效延长西兰花保鲜期,表明CO2结合O2具有抑制活性氧产生或消除活性氧的作用,也为O2/CO2气调保鲜提供了理论依据。植物细胞壁是植物与其病原真菌相互作用的场所,病原真菌在识别寄主过程中,会分泌细胞壁降解酶来降解植物细胞壁以便入侵,PG和PMG则是微生物侵染寄主并致病的水解酶类[39]。为了降解植物细胞壁,病原真菌分泌的细胞壁降解酶必须通过真菌质膜向胞外分泌[40],PG则是真菌最先向胞外分泌的酶之一,PMG在随后侵染中起致病作用[39]。本实验结果表明,O2/CO2主动自发气调处理降低了桃吉尔霉SOD、POD、PG和PMG活力,且随着CO2比例的升高而增强,表明桃吉尔霉应对环境能力的减弱和致病能力的降低。Kader等[41]研究表明高氧可抑制某些细菌和霉菌生长,但如果将高氧配合高二氧化碳(15%~20% CO2)使用会比仅使用任意一种气体处理所得到的抑菌效果更为显著。Hoogerwerf等[42]研究表明80% O2+20% CO2处理能显著抑制灰葡萄孢菌的生长,且效果显著优于100% CO2处理,这与本研究结果一致,其可能原因是O2促使菌体呼吸代谢的同时,吸入CO2的量也增多,在二者协同作用下造成更大的伤害。
自发气调可分为被动自发气调和主动自发气调两类[43],被动自发气调主要是利用果蔬本身的呼吸作用平衡气调袋中的O2、CO2浓度,对于透气包装材料选择因果蔬种类而异,且达到所需气体环境的时间周期长,目前市场上保鲜膜种类繁多、透气特性差异较大,难以制定统一的保鲜标准;而主动自发气调具有气体平衡快、不必考虑包装材料透气特性等优点,易于制定统一标准。且主动自发气调是在密闭容器中进行,而密闭容器易于搬运,特别适于现代物流运输的保鲜。
O2/CO2主动自发气调对于控制桃吉尔霉致病性有良好的效果,在O2、CO2的协同作用下,可造成桃吉尔霉菌丝损伤、电导率及孢子DNA释放量增加,SOD、POD、PG和PMG活力降低,甚至致使桃吉尔霉不能产生孢子,进而降低其在果蔬贮藏中的危害,特别是当O2/CO2主动自发气调的CO2比例超过10%情况下,抑制效果更为显著。该研究结果为果蔬贮藏过程中霉菌的控制提供了理论参考。
