魔芋甘露寡糖抗肥胖活性及机制
2020-03-31温永平闫巧娟江正强
温永平,朱 迪,孙 健,闫巧娟,江正强,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.蒙牛高科乳制品(北京)有限责任公司,北京 101107;3.中国农业大学工学院,北京 100083)
肥胖是一种常见慢性代谢疾病,受到环境、饮食不均衡以及遗传等多种因素影响,这些因素导致能量摄入和吸收利用的不平衡[1]。体质量增加、高脂血症、高血糖症和慢性炎症等,已成为肥胖患者核心表现[2]。肥胖不但影响生活品质,也会诱发多种慢性疾病,包括癌症、心脑血管病、内分泌失调和二型糖尿病[3],每年直接或者间接导致全世界数千万人死亡。目前,全球约13%成年人属于肥胖人群[4]。因此,防治和缓解肥胖及其并发症是亟待解决的公共健康问题。目前,药物是治疗肥胖的常用且有效手段。功能性寡糖是由2~10 个单糖通过糖苷键连接的低度聚合糖,来源广泛,不易被消化道吸收,具有多种生物活性,包括抗菌、抗氧化、抗糖尿病、抗高血压、抗炎、抗癌、免疫刺激剂和促进矿物质吸收等[5],可开发为抗肥胖膳食补充剂。研究表明,甘露寡糖可以通过调节肠道微生物,改善宿主代谢,减少肝脂肪变性,改善葡萄糖耐受性,防治饮食诱导的肥胖[6]。
魔芋甘露寡糖(konjac mannooligosaccharides,KMOS)是由β-D-甘露糖和β-D-葡萄糖残基组成的一种可溶性功能性寡糖,通过魔芋葡甘露聚糖水解获得[7]。目前研究认为,魔芋甘露寡糖具有缓解2,4,6-三硝基苯磺酸诱导的结肠炎作用[8]、增加老年BALB/c小鼠的免疫活性[9]、通过调节肠道菌群增效二甲双胍的降血糖作用以及缓解高脂膳食诱发的体质量增加的作用[7,10]、通过调节糖原代谢通路和胰岛素分泌等缓解高糖水平诱发的大鼠代谢综合征[11],通过调节肠道菌群干预机体脂代谢过程的作用[12]等。但关于魔芋甘露寡糖抗肥胖及其诱发的氧化应激反应的作用及机理尚鲜见报道。
本研究以高脂膳食诱导的C57BL/6J小鼠为实验动物模型,通过膳食干预作用,探究魔芋甘露寡糖对小鼠体质量及脂代谢的调控作用及分子机制,以期为功能性寡糖可能的抗肥胖机制的深入研究以及为开发具有抗肥胖特性的膳食补充剂提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
2 月龄SPF级健康雄性C57BL/6J小鼠购自北京维通利华实验动物技术有限公司。实验动物质量合格证明编号:No. 11002900036533,生产许可证号:SCXK(京)2014-0010。饲料购自北京科奥协力饲料有限公司,包括标准饲料(D12450B)和高脂饲料(D12492,60%热量来自脂肪)。
魔芋甘露寡糖(平均分子质量约342.3~1 639.44 Da,甘露糖与葡萄糖的物质的量比1.45∶1,聚合度2~10)西安源森生物科技有限公司;总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、游离脂肪酸(non-esterified fatty acid,NEFA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、活性氧自由基(reactive oxygen species,ROS)及载脂蛋白E(apolipoprotein E,APOE)检测试剂盒 南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海鑫乐生物科技有限公司;mRNA提取试剂盒、mRNA反转录试剂盒 日本Takara公司。
1.2 仪器与设备
CFX系列实时荧光定量(quantitative real-time polymerase chain reaction,qPCR)仪 伯乐生命医学产品(上海)有限公司;BS-420自动分析仪 深圳迈瑞生物医疗电子股份有限公司;BX60光学显微镜 日本奥林巴斯公司。
1.3 方法
1.3.1 动物饲养、模型构建、实验分组及样品采集
选取10 周龄的雄性C57BL/6J小鼠在标准条件(12 h/12 h光暗循环、相对湿度(55±5)%、温度(25±2)℃)下饲养。1 周适应性喂养后,将小鼠随机分成7 组,每组12 只:对照组(Control组,饲喂标准饲料),魔芋甘露寡糖对照组(KMOS-H组,饲喂标准饲料+1 200 mg/(kg mb·d)魔芋甘露寡糖),模型组(HFD组,饲喂60%高脂饲料),魔芋甘露寡糖高、中、低剂量处理组(HFD+KMOS-H、HFD+KMOS-M、HFD+KMOS-L组,分别饲喂高脂饲料+400、800、1 200 mg/(kg mb·d)魔芋甘露寡糖),二甲双胍处理组(HFD+Met组,饲喂高脂饲料+400 mg/(kg mb·d)二甲双胍)。高脂膳食小鼠体质量比对照组高20%,即认定为肥胖小鼠[13]。同时给予高热量高脂食物与受试样品,考察待测样品预防肥胖和降脂的效果。实验周期为12 周,实验期间动物自由摄食和自由饮水。动物方案经中国农业大学机构动物伦理委员会原则批准。
小鼠禁食16 h后,在颈脱位之前,通过从C57BL/6J小鼠摘出眼球来收集血液样品,3 500 r/min和4 ℃下离心15 min后,分离血清,并进行分装,保存于-80 ℃冰箱中。快速分离肝脏和脂肪等组织,用生理盐水清洗组织,除去组织残留的血液。用滤纸吸干后,称质量。部分样品固定于体积分数10%福尔马林溶液中,保存在4 ℃冰箱,用于形态观察;部分样品冻存于-80 ℃冰箱,用于后续指标分析。
1.3.2 小鼠体质量、饮水量及摄食量检测
实验期间,每周进行体质量、饮水量和摄食量的监测,按照下式进行能量摄入计算。
摄入能量/kJ=食物摄入量/g×饲料能量/(kJ/g)
1.3.3 血清生化指标检测
取小鼠血清,按照试剂盒检测操作要求,检测血清中TC、LDL-C、HDL-C、NEFA的浓度,以及SOD、CAT、POD的活力和ROS、GSH的表达水平。按照ELISA试剂盒的操作要求进行血液中TNF-α、IL-6和MCP-1水平检测。
1.3.4 肝脏组织生化分析
肝脏组织于液氮中研磨并称取一定质量,于生理盐水中进行匀浆。用试剂盒检测APOE和NEFA的表达水平。
1.3.5 脂肪组织HE染色
采用苏木精-伊红(hematoxylin-eosin,HE)染色法,取已固定的皮下脂肪、附睾脂肪、肾周脂肪和肩胛脂肪进行脱水、石蜡包埋、常规切片、HE染色等操作。以200 倍放大率,在光学显微镜下观察组织形态并拍照,进行病理学分析。
1.3.6 肝脏组织免疫组化分析
取肝脏组织进行脱水、石蜡包埋、常规切片、过氧化氢消融、室温封闭、脂肪酸转运酶/白细胞分化抗原36(cluster of differentiation,CD36)抗体孵育、对应的二抗孵育、3,3-二氨基联苯胺着色和脱水干燥等操作。以200 倍放大率,在光学显微镜观察CD36表达量并拍照分析。
1.3.7 逆转录qPCR检测
使用mRNA提取试剂盒,从脂肪组织和肝脏组织中提取总RNA。使用PrimeScriptTMRT Master Mix RR036A试剂盒对1 μg总RNA进行反转录反应。使用POWER SYBR Green master mix试剂盒,以cDNA作为模板,分析mRNA表达水平。qPCR程序如下:初始保持步骤,在95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,40 个循环;72 ℃ 30 s。55~95 ℃逐步获得熔解曲线。在通过基因GAPDH标准化后,使用(2-ΔΔCt)比较方法,分析靶基因的表达量。靶基因的引物见表1。

表 1 qPCR分析的引物序列Table 1 Primer sequences used for quantitative real-time polymerase chain reaction
1.4 数据统计分析
所有数据表示为3 次或更多次独立实验的平均值±标准误差。数据的差异显著性通过单因素方差分析进行比较,采用SPSS 19.0软件中的Tukey多范围检验。
2 结果与分析
2.1 魔芋甘露寡糖对高脂膳食诱导的小鼠体质量和器官质量的影响
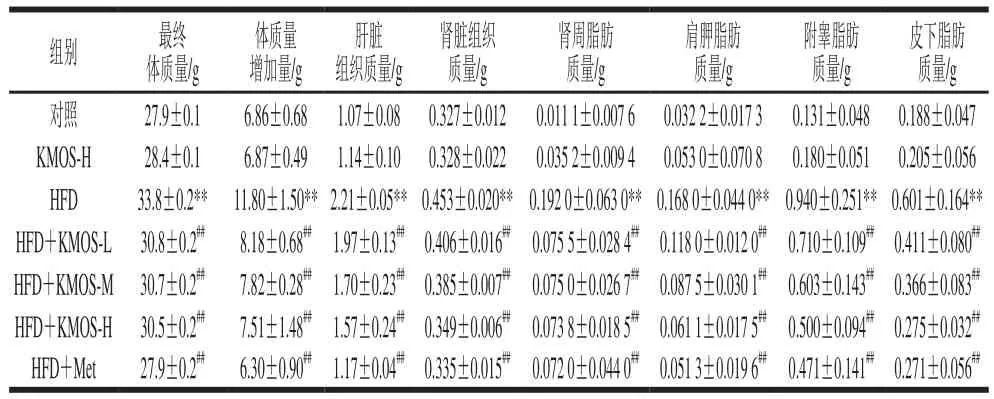
表 2 魔芋甘露寡糖对高脂膳食诱导小鼠的体质量和器官质量的影响Table 2 Effect of KMOS on body mass and organ mass of HFD-induced mice
由表2可知,相比对照组,HFD组小鼠最终体质量增加21.15%(P<0.01)。魔芋甘露寡糖处理组小鼠最终体质量和体质量增加量均极显著低于HFD组(P<0.01),分别减少了9.76%和36.36%。由此可见,魔芋甘露寡糖有显著下调小鼠体质量的作用。相比对照组,HFD组肝脏、肾脏、肾周脂肪、肩胛脂肪、附睾脂肪和皮下脂肪组织的质量极显著增加(P<0.01)。与HFD组相比,魔芋甘露寡糖处理组和二甲双胍处理组肝脏、肾脏及脂肪组织的质量均极显著降低(P<0.01)。魔芋甘露寡糖高剂量处理后,肝脏、肾脏、肾周脂肪、肩胛脂肪、附睾脂肪和皮下脂肪的质量分别减少28.96%、22.96%、61.56%、63.63%、46.81%和54.24%,说明魔芋甘露寡糖能够显著改善肝脏和肾脏组织脂肪聚积,缓解脂肪组织堆积,从而抑制高脂膳食诱导的小鼠体质量增加趋势。此外,魔芋甘露寡糖对正常小鼠各组织器官质量均无显著性的影响(P>0.05)。
2.2 魔芋甘露寡糖对高脂膳食诱导的小鼠血脂指标的影响
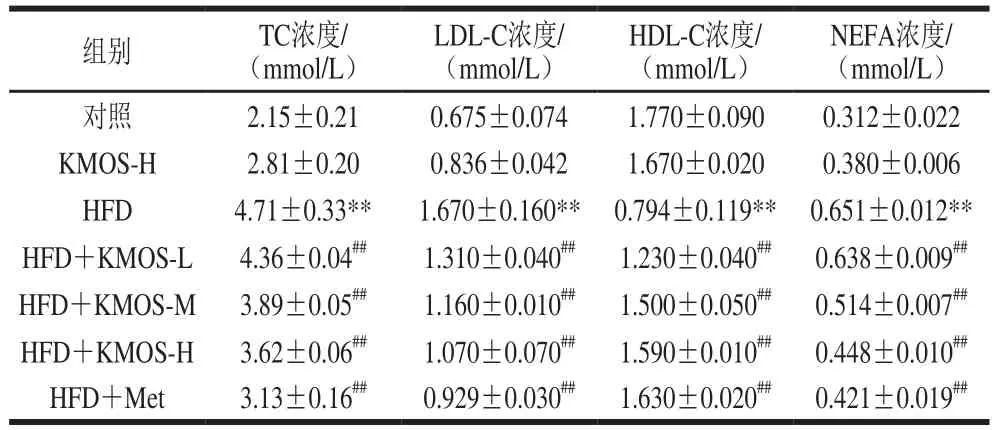
表 3 魔芋甘露寡糖对高脂膳食诱导小鼠血脂水平的影响Table 3 Effect of KMOS on blood lipid levels of HFD-induced mice
由表3可知,与对照组相比,高脂膳食极显著增加小鼠血清中TC、LDL-C和NEFA水平(P<0.01),并下调HDL-C水平。相比HFD组,魔芋甘露寡糖处理组极显著改善小鼠血脂异常情况(P<0.01),且呈剂量依赖性。其中,高浓度魔芋甘露寡糖极显著降低小鼠TC、LDL-C和NEFA水平(P<0.01),抑制率分别为23.14%、35.93%和31.18%,HDL-C水平提高约1.0 倍。表明魔芋甘露寡糖具有显著调节小鼠血脂代谢的作用。
2.3 魔芋甘露寡糖对高脂膳食诱导的小鼠血液氧化应激指标的影响
如图1A~C所示,高脂膳食极显著增加血清中炎症因子水平(P<0.01),包括TNF-α、IL-6和MCP-1。魔芋甘露寡糖呈现剂量依赖性地降低高脂膳食诱导的小鼠炎症因子浓度,高剂量的魔芋甘露寡糖对炎症因子TNF-α、IL-6和MCP-1水平分别降低21.72%、60.97%和66.69%。表明魔芋甘露寡糖能极显著下调高脂膳食诱导小鼠炎症反应。进一步研究发现,高脂膳食极显著增加血清中的ROS水平(图1D)(P<0.01),魔芋甘露寡糖高、中、低剂量处理组对ROS水平的抑制率分别为67.78%、31.61%和33.82%。此外,图1E所示魔芋甘露寡糖极显著缓解由高脂膳食诱发的抗氧化物酶(SOD、GSH、CAT和POD)活力降低(P<0.01)。相比HFD组,魔芋甘露寡糖高剂量处理组的SOD、GSH、CAT和POD的活力极显著增加了6.09%、45.28%、61.73%和12.58%。以上结果表明,魔芋甘露寡糖通过激活抗氧化物酶活性缓解高脂膳食诱导小鼠的炎症反应。
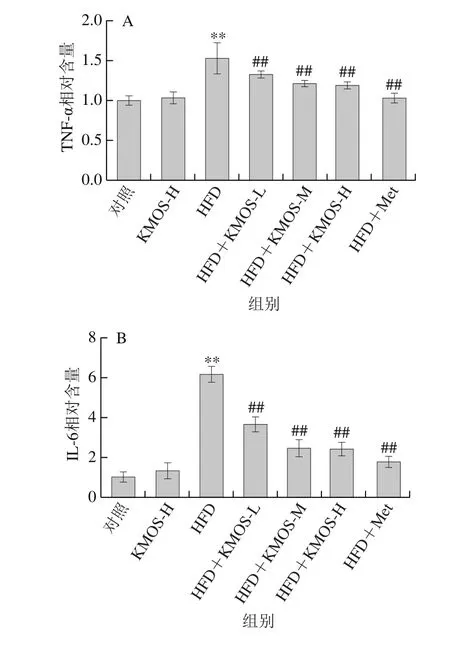
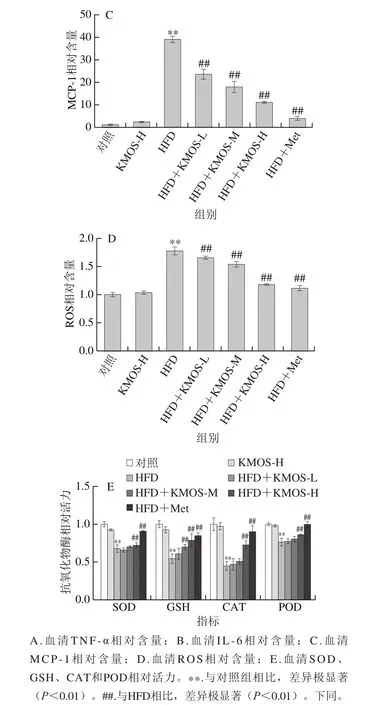
图 1 魔芋甘露寡糖对高脂膳食小鼠血清炎症因子水平和抗氧化物酶活性的调节作用Fig. 1 Effect of KMOS on inflammatory factor levels and antioxidant enzyme activities in serum of HFD-fed mice
2.4 魔芋甘露寡糖对高脂膳食诱导的小鼠脂肪组织的影响
如图2A、B所示,高脂膳食显著增加肾周脂肪、肩胛脂肪、附睾脂肪和皮下脂肪组织的细胞面积(P<0.05)。不同浓度的魔芋甘露寡糖显著减小脂肪组织细胞面积,并且在相同视野中,脂肪细胞数目极显著增加(P<0.01)。魔芋甘露寡糖高剂量处理组极显著下调4 种脂肪组织的平均面积(P<0.01),对于肾周脂肪、肩胛脂肪、附睾脂肪和皮下脂肪组织的细胞面积分别下调56.41%、77.71%、75.77%和81.38%。如图2C所示,HFD组脂肪生成关键基因极显著升高(P<0.01),包括氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors,Pparγ)、胆固醇调节元件结合蛋白1c(sterol regulatory element-binding protein 1c,Srebp1c)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase 1,Acaca)和脂肪酸合酶(fatty acid synthase,Fasn)基因。而高浓度的魔芋甘露寡糖则极显著下调Pparγ、Srebp1c、Acaca和Fasn的表达(P<0.01),分别下调28.29%、51.48%、29.40%和46.72%。结果表明,魔芋甘露寡糖正向调节脂肪组织脂质代谢过程。
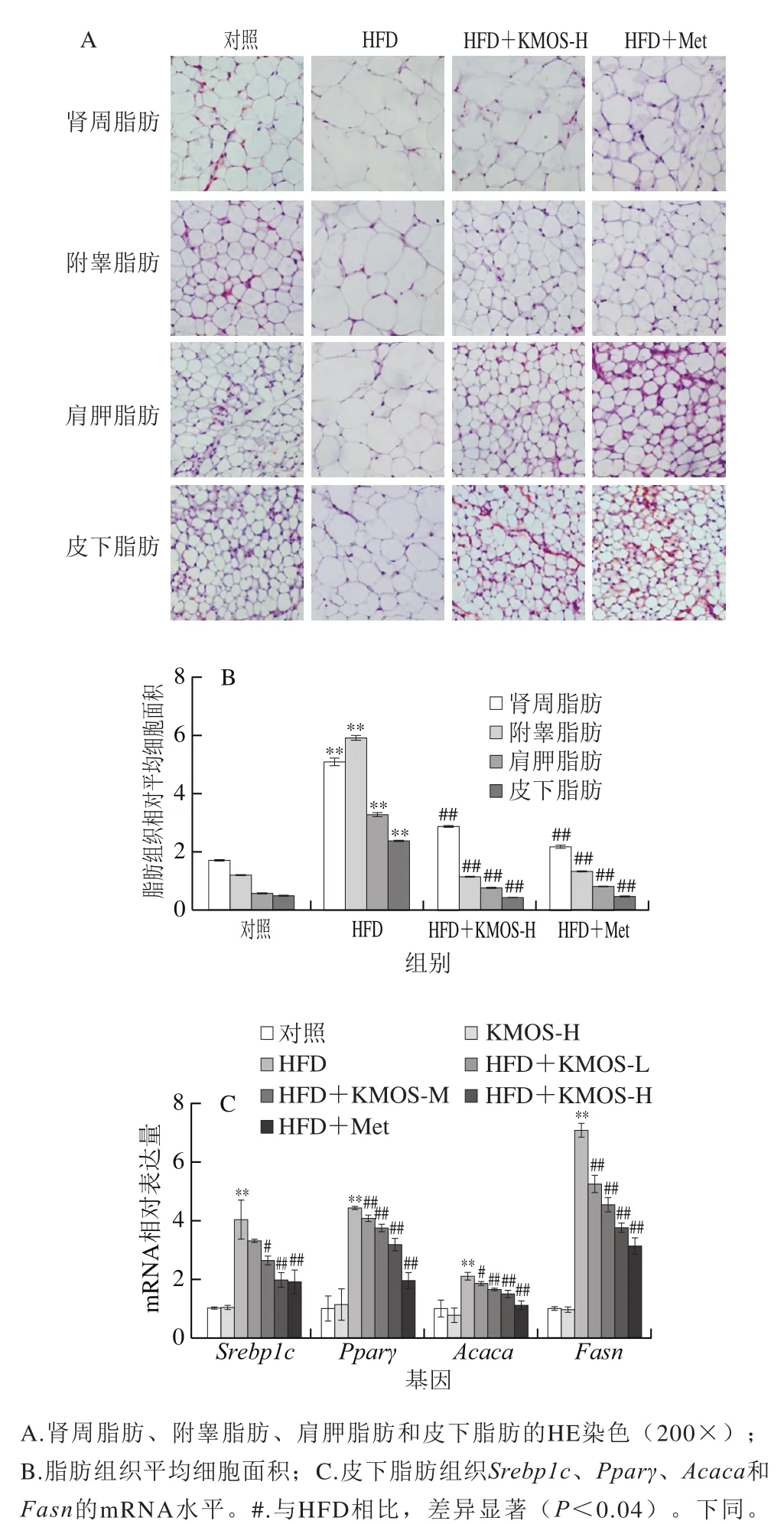
图 2 魔芋甘露寡糖对高脂膳食小鼠脂肪组织分布和脂代谢相关基因表达的调节作用Fig. 2 Regulation of KMOS on adipose tissue distribution and lipid metabolism-related gene expressions in HFD-fed mice
2.5 魔芋甘露寡糖对高脂膳食诱导的小鼠肝脏组织的影响

图 3 魔芋甘露寡糖对高脂膳食小鼠肝脏脂肪积聚和脂代谢相关基因表达的调控作用Fig. 3 Regulation of KMOS on liver fat accumulation and lipid metabolism-related gene expression in HFD-fed mice
如图3A所示,高脂膳食显著增加肝脏中CD36的表达,而魔芋甘露寡糖抑制CD36的表达,表明魔芋甘露寡糖能缓解由高脂膳食诱导的肝脏脂质聚积。如图3B所示,魔芋甘露寡糖极显著抑制由高脂膳食诱发的NEFA水平升高和APOE水平下调(P<0.05),高浓度魔芋甘露寡糖下调NEFA水平(约61.76%),并上调APOE的mRNA表达(约95.17%)。结果表明,魔芋甘露寡糖对肝脏组织NEFA和APOE具有一定调控作用。进一步探究脂质代谢相关基因表达情况。如图3C所示,对于高脂膳食小鼠,魔芋甘露寡糖显著促进胆固醇代谢关键基因肝受体(liver X receptors,LXR)的mRNA表达(P<0.05)(约提升86.82%);显著抑制胆固醇合成限速酶基因羟甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl-glutaryl-coenzyme A reductase,Hmgcr)表达(P<0.05)(约减少60.45%)。如图3D所示,高脂膳食处理组脂肪生成相关基因表达水平显著上调(P<0.05)。魔芋甘露寡糖浓度依赖性抑制Pparγ、Srebp1c、Acaca和Fasn的mRNA表达,抑制率分别为56.69%、41.45%、47.85%和32.01%。因此,魔芋甘露寡糖正向调控肝脏组织胆固醇代谢和脂质代谢过程。
3 讨 论
众所周知,肥胖是由于能量代谢不平衡,导致机体内脂肪过度累积,表现为脂肪细胞数量增加或体积增大[1]。肥胖与多种代谢性疾病关系紧密[14]。功能性寡糖由于具有多种有效的生物活性和无副作用的特点,成为开发抗肥胖的膳食补充剂的重要配料[15]。多种寡糖已经被证明有抗肥胖的作用,如壳寡糖和新琼寡糖[16-17]。研究结果表明,魔芋甘露寡糖降低高脂组小鼠血清甘油三酯和胆固醇,升高密度脂蛋白,说明魔芋葡甘露寡糖有明显的降脂作用[18]。同样的,魔芋甘露寡糖可以显著减慢体质量增加,降低血清脂质水平,缓解胰岛素抵抗,并改善肠道菌群的组成,从而发挥抗肥胖的功能活性[10]。由此,甘露寡糖对于脂肪代谢发挥积极的干预,而具有减肥的潜力[6,19],但其作用机制并不明确。本研究证实魔芋甘露寡糖具有显著的减肥功效,且通过调节脂肪组织和肝脏组织的脂代谢过程以及干预炎症反应发挥其抗肥胖的功能活性。
本实验所选用的高脂膳食诱导的HFD组小鼠,在体质量、体脂含量以及血脂水平均显著高于正常组小鼠。膳食补充魔芋甘露寡糖显著降低肥胖小鼠的体质量、脂肪聚积和单个脂肪体积,下调TC、NEFA和LDL等的水平,该作用效果与阳性对照组相似。研究认为,功能性寡糖主要通过改变肠道微生物组成,影响能量代谢,改善脂代谢过程[20]。除此之外,慢性炎症也是心血管疾病、慢性肾病、糖尿病和癌症等疾病的一个关键风险因素,其潜在的机制包括氧化应激引发的功能失调、中心性肥胖、肠道通透性增加、微生物群组成变化和细胞衰老等[2]。过量的脂肪堆积后,ROS介导的细胞因子(IL-6、TNF-α和MCP-1)分泌异常,外周组织和中枢神经系统受到影响,导致炎症反应和氧化应激增强[21]。反之,与肥胖相关的全身性慢性炎症又直接影响机体的糖脂代谢紊乱和胰岛素抵抗[22]。由此可知,氧化应激成为诱发肥胖相关并发症的主要分子机制之一[23]。如同壳聚糖,魔芋甘露寡糖也可以通过其对慢性炎症的干预作用,来解释魔芋甘露寡糖多种代谢活性[24]。本研究显示,魔芋甘露寡糖抑制炎症因子,如TNF-α、IL-6和MCP-1的表达,下调血清中活性氧浓度,增加SOD和CAT等抗氧化物酶活力。因此,魔芋甘露寡糖干预具有抗肥胖、降血脂、慢性炎症和预防肝脂肪变性等多种功能活性,并且可能通过抑制高脂膳食诱发的氧化应激水平改善脂代谢紊乱,但两者之间的关系及具体的作用机制仍有待于进一步研究。
为了进一步研究魔芋甘露寡糖抑制高脂膳食引起的脂肪聚积和肝脏脂滴过度积累的潜在机制,本实验探讨了其调节肝脏组织和脂肪组织的脂肪合成相关基因表达的作用。PPARγ是核受体超转录因子家族的重要成员,是调控脂肪细胞分化的关键因子[16,25]。有研究认为,PPARγ可以通过调节炎症反应和与脂质合成和脂肪酸β-氧化的各种相关代谢酶,改善脂质代谢和胰岛素敏感性,是调控肥胖、胰岛素抵抗和心血管疾病的核心[26-27]。研究表明,壳寡糖(GO2KA1)通过肠α-葡糖苷酶和脂肪组织PPARγ的表达介导抗糖尿病的功能活性[28]。相似地,本研究证明了魔芋甘露寡糖通过调节脂肪合成相关基因表达,如Pparγ、Srebp1c、Acaca和Fasn,对脂代谢调控发挥了关键的作用。此外,CD36可以直接介导肝脏组织长链脂肪酸摄取和转运,也是LDL、糖化蛋白和游离脂肪酸等炎性代谢产物的识别蛋白,并促进脂肪酸的摄取和氧化作用,CD36被认为是机体代谢和炎症反应链接的桥梁[29]。本研究表明,魔芋甘露寡糖显著的缓解由高脂膳食诱发的肝脏组织中CD36的表达增加。在肝脏组织中,魔芋甘露寡糖还通过显著的促进胆固醇代谢关键基因LXR的表达,并抑制Hmgcr的表达,调控胆固醇代谢过程。其中,LXR是一个核受体,调节肝脏胆固醇和脂肪酸代谢。研究认为LXR激活可抑制高脂血症诱导的肝脏脂肪聚积[30]。作为LXR的下游基因,Hmgcr基因调控HMG-CoA还原酶的表达[31]。HMG-CoA还原酶是胆固醇合成中的关键酶,参与低密度脂蛋白的代谢过程,并受到胆固醇和他汀类药物的抑制[32]。综上,魔芋甘露寡糖通过调节脂肪合成和胆固醇代谢关键基因,影响肝脏脂质聚集。
4 结 论
魔芋甘露寡糖能够抑制高脂膳食小鼠体质量增加,降低血脂水平,调整体脂分布;调控脂代谢关键基因表达,改善肝脂肪变性;调节氧化应激水平,抑制炎症反应。魔芋甘露寡糖可以作为膳食补充剂的配料,发挥抗肥胖、缓解肝脂肪变性以及改善高脂膳食诱发氧化应激的功能活性。
