榆干离褶伞溶栓酶对酒精损伤血管内皮细胞的保护作用
2020-03-31李芳芳沈明花
李芳芳,丛 贺,沈明花
(延边大学医学院,吉林 延吉 133002)
酒精作为各种酒类饮品的主要成分,与心脑血管疾病的发生密切相关。长期大量饮酒可引起血压的升高[1-2]、脂质代谢的紊乱及心肌细胞的损伤,从而增加罹患心血管疾病的风险和心血管疾病意外的发生[3-6]。血管内皮细胞作为血管系统的重要组成部分,在心血管疾病的病理生理过程中起至关重要的作用。血管内皮细胞不仅起到机械屏障作用,还通过分泌一些活性物质参与机体的凝血及血管的舒缩等反应[7-8]。饮酒后,经胃肠道的吸收进入血液循环的酒精可直接作用于血管内皮细胞。酒精对血管内皮细胞具有双向调节作用,低剂量酒精可以保护血管内皮细胞[9],而高剂量则起到抑制作用[10]。研究表明,血管内皮细胞通过自身的乙醇脱氢酶及多种氧化酶的催化作用参与酒精的代谢过程[11-12]。当长期大量饮酒时,血管内皮细胞作为血管最内层结构,直接接触血液中的酒精或其代谢产物,因此成为直接或间接遭受酒精毒性作用的靶点。
榆干离褶伞(Lyophyllum ulmarium),又名榆生离褶伞、榆干侧耳、大榆蘑等,主要分布于河北、吉林、黑龙江、河南等地。研究发现,榆干离褶伞具有抗氧化[13]、保肝[14]、溶栓、降血脂[15]等作用。榆干离褶伞溶栓酶(fibrinolytic enzyme from Lyophyllum ulmarium,LUFE)是从榆干离褶伞菌丝体中分离纯化的分子质量为50 kDa的溶栓酶,它在体外可以水解纤维蛋白及纤维蛋白原[16]。近年来的研究表明,LUFE具有保护血管内皮细胞[17]、抑制血小板活化作用[18]。鉴于大量饮酒对血管内皮细胞的危害性,本实验将以酒精诱导血管内皮细胞的损伤,探讨LUFE对酒精所致血管内皮细胞损伤的保护作用,旨在为榆干离褶伞对心脑血管系统保护作用的研究提供实验依据。
1 材料与方法
1.1 材料与试剂
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs) 武汉博士德生物工程有限公司;LUFE(比活力为750.6 U/mg pro)由延边大学医学院生物化学与分子生物学研究室分离纯化[16]。
澳洲胎牛血清和DMEM培养基 美国Gibco公司;胰蛋白酶、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、罗丹明123(rhodamine 123,Rh123)、双氢罗丹明123(dihydrorhodamine 123,DHR123) 美国Sigma公司;吖啶橙/溴化乙啶(acridine orange/ethidium bromide,AO/EB)双染色试剂盒北京索莱宝生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 南京建成生物工程研究所;BCA试剂盒 碧云天生物技术公司;兔抗细胞色素c、cleaved半胱氨酸天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)-3、cleaved caspase-9、Bax和Bcl2抗体 美国Santa Cruz公司;乙醇 国药集团化学试剂有限公司。
1.2 仪器与设备
RT-2100型酶标仪 深圳雷杜公司;激光共聚焦显微镜SP5II 德国徕卡仪器有限公司;二氧化碳细胞培养箱 美国Shel Lab公司;凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 细胞培养
HUVECs培养于含体积分数10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2培养箱中培养。
1.3.2 LUFE对HUVECs活力的影响
将细胞密度为1×105/mL的HUVECs接种到96 孔板中,分为对照组、损伤组、LUFE低剂量组和LUFE高剂量组,每组设8 个复孔。待细胞贴壁后弃去陈旧培养液。损伤组及LUFE各剂量组均加入含200 mmol/L乙醇的无血清培养液,以诱导内皮细胞的损伤。对照组以等容生理盐水代替乙醇。乙醇作用4 h后,LUFE低、高剂量组分别加入1 μg/mL和4 μg/mL的LUFE,对照组和损伤组以无血清培养基代替LUFE。培养24 h后,MTT法[17]测定490 nm波长处的OD值(OD490nm),按照下式计算各组HUVECs存活率。

将细胞接种于6 孔板,细胞分组与处理同上。将各组细胞培养24 h后,取上清液检测LDH活力,其操作按试剂盒说明书进行。
1.3.3 SOD、GSH-Px活力及MDA含量的检测
将细胞接种于6 孔板,细胞分组与处理同1.3.2节。各组细胞培养24 h后用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞两次,用细胞刮板刮下细胞,1 000 r/min离心10 min。弃去上清液,收集细胞,反复冻融破碎细胞。再次离心10 min,取上清液,用BCA试剂盒检测蛋白浓度。按试剂盒说明书测定细胞裂解液的SOD、GSH-Px活力及MDA含量。
1.3.4 细胞ROS水平的检测
细胞ROS水平的检测采用DHR123染色法。将细胞接种于6 孔板,细胞分组及处理同1.3.2节。将各组细胞培养12 h后用胰蛋白酶消化,各组收集1×106个细胞,用PBS重悬,然后以终浓度为1 μmol/L的DHR123避光条件下孵育45 min。收集细胞,以PBS漂洗2 次,重悬后在激发波长488 nm、发射波长525 nm条件下在流式细胞仪检测各样本平均荧光强度(mean fluorescence intensity,MFI),该值代表细胞ROS水平。
1.3.5 AO/EB染色法观察细胞凋亡
取对数生长期细胞接种于6 孔板爬片内,细胞分组及处理同1.3.2节。培养24 h后用PBS洗涤,加入20 μL/mL AO/EB工作液(100 mg/L AO和100 mg/L EB等体积混合液),室温染色5 min。封片后在荧光显微镜下观察拍照。
1.3.6 细胞跨膜电位的检测
跨膜电位检测采用Rh123染色法。实验分组及处理过程同1.3.2节。10 μg/mL的Rh123染液代替1 μmol/L的DHR123,其余操作同1.3.4节。用流式细胞仪检测细胞的MFI,该值代表细胞的跨膜电位。
1.3.7 Western blot法检测细胞细胞色素c、cleaved caspase-9、cleaved caspase-3、Bax和Bcl-2蛋白表达
将细胞接种于6 孔板,实验分组及处理方法同1.3.2节。将各组细胞培养24 h后分别收集细胞,加入裂解液在4 ℃静置30 min后以12 000 r/min离心20 min。取上清液,使用BCA法进行蛋白定量。取40 µg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),电转至聚偏氟乙烯膜,质量分数5%脱脂奶粉室温封闭2 h后分别加入相应的一抗,4 ℃孵育过夜。用TBST洗涤后加入二抗,室温孵育1 h,冲洗,最后显影。
1.4 数据统计分析
数据用 ±s表示,用SPSS统计软件处理,流式细胞仪分析结果中荧光强度及其他实验结果的差异性比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 LUFE对细胞活力的影响

表 1 LUFE对细胞存活率和LDH活力的影响Table 1 Effect of LUFE on viability and LDH activity in HUVECs
如表1所示,与对照组相比,损伤组细胞存活率明显下降,细胞培养上清液LDH活力升高;与损伤组相比,LUFE低、高剂量组细胞存活率不同程度地升高、细胞培养上清液LDH活力下降,结果表明,LUFE对酒精诱导的HUVECs的损伤具有保护作用。
2.2 LUFE对细胞SOD、GSH-Px活力及MDA含量的影响
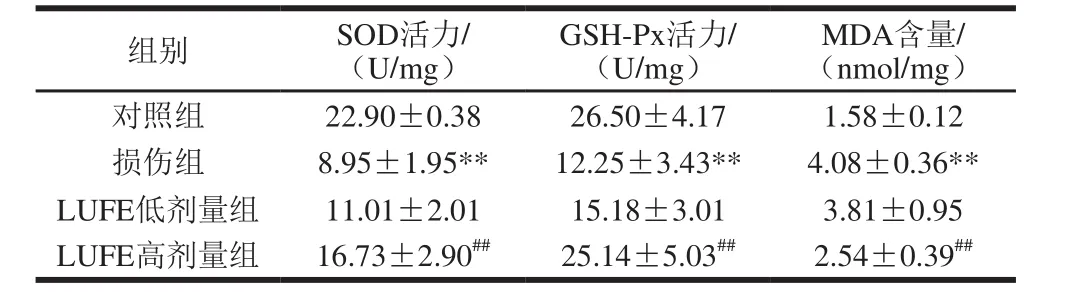
表 2 LUFE对细胞SOD、GSH-Px活力及MDA含量的影响Table 2 Effect of LUFE on SOD and GSH-Px activity and MDA contents
由表2可知,与对照组比较,损伤组细胞的SOD和GSH-Px活力极显著降低,而MDA水平极显著升高(P<0.01)。与损伤组相比,LUFE高剂量组SOD和GSH-Px活力极显著升高,MDA含量极显著降低(P<0.01)。
2.3 LUFE对细胞ROS的影响
细胞中产生的ROS可将DHR氧化成Rh123而发出荧光,其荧光强度反映细胞内ROS水平。对照组(图1A)细胞的荧光强度平均值为286.80,损伤组(图1B)的荧光强度为484.97,是对照组的1.7 倍,这就说明酒精作用后细胞内ROS水平极显著升高(P<0.01)。LUFE低、高剂量组细胞荧光强度平均值分别为396.66、356.43,与损伤组相比不同程度地减少,差异显著(P<0.05)(图1C、D)。这就提示LUFE可以抑制酒精所致的ROS水平的升高。
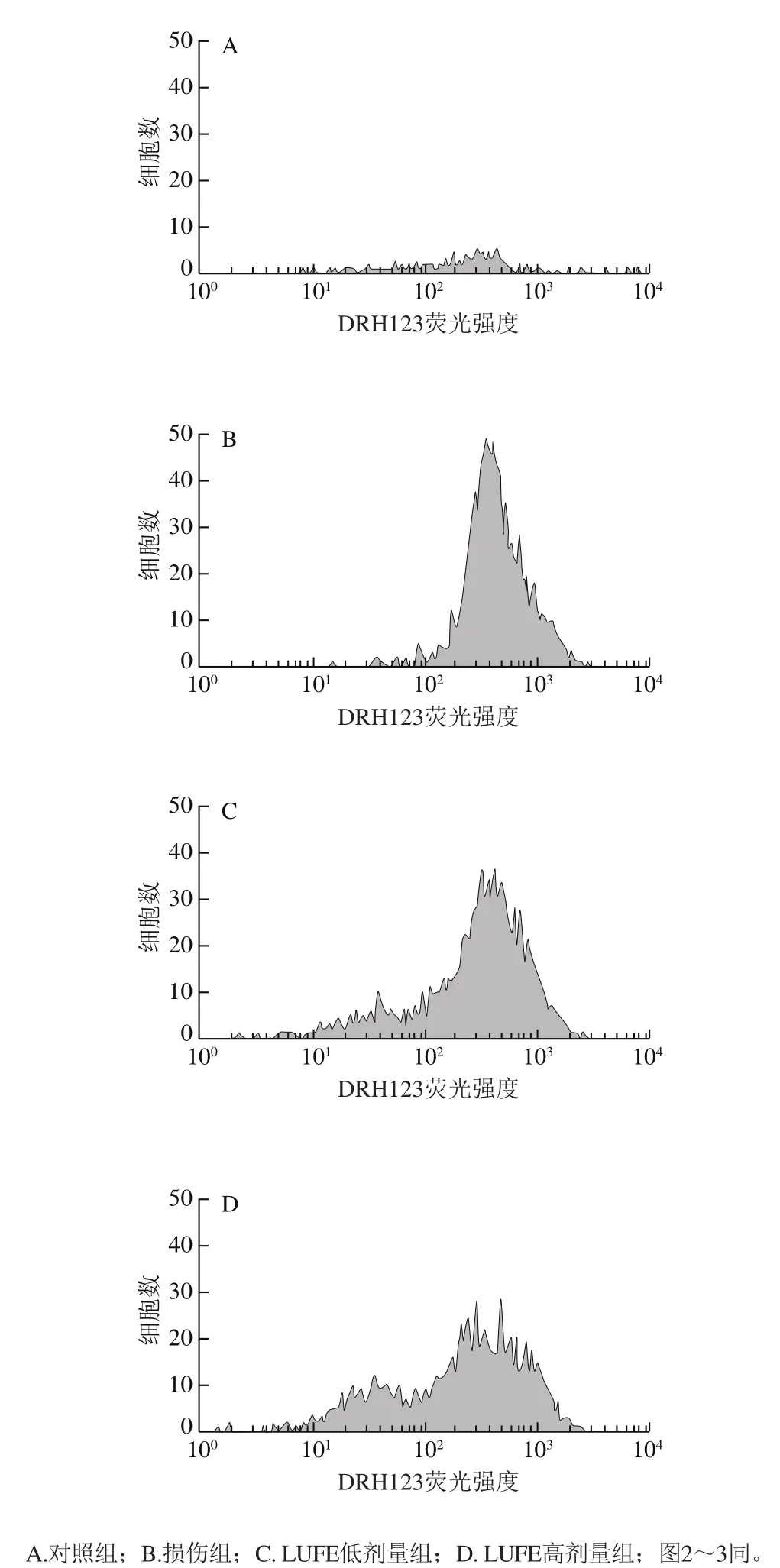
图 1 LUFE对细胞ROS的影响Fig. 1 Effect of LUFE on intracellular ROS level
2.4 LUFE对细胞线粒体跨膜电位的影响
用Rh123染色,以流式细胞仪检测线粒体跨膜电位。图2显示,与对照组(910.21)相比,损伤组的细胞荧光强度下降至633.42,差异极显著(P<0.01),这就说明酒精作用以后细胞线粒体跨膜电位显著降低。而LUFE低、高剂量组的荧光强度分别为828.52、896.21,与损伤组相比极显著升高(P<0.01),并随着用药剂量的增加呈升高趋势。

图 2 LUFE对细胞内线粒体跨膜电位的影响Fig. 2 Effect of LUFE on mitochondrial transmembrane potential in HUVECs
2.5 细胞AO/EB染色结果
AO/EB染色中AO透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光。在凋亡细胞中因染色质固缩或断裂,因此AO使其染上致密浓染的黄绿色荧光。EB仅能透过破损的细胞膜嵌入DNA而呈橘红色。AO/EB染色结果表明,对照组的细胞形态正常,细胞核发出绿色均匀荧光。损伤组细胞数明显减少,细胞呈现凋亡形态学改变-细胞核固缩、呈浓染的黄绿色荧光。与损伤组相比,LUFE低、高剂量组细胞数量增多,凋亡细胞明显减少,这一结果表明LUFE能抑制酒精所致的HUVECs凋亡(图3)。
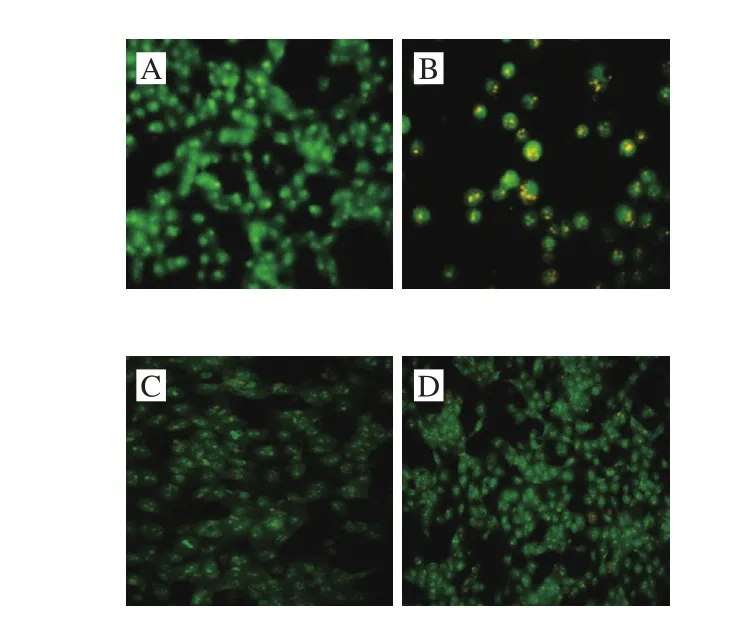
图 3 LUFE对酒精诱导的HUVECs凋亡的影响(×200)Fig. 3 Effect of LUFE on apoptotic morphology in HUVECs induced by alcohol (× 200)
2.6 LUFE对Bax和Bcl-2蛋白表达的影响
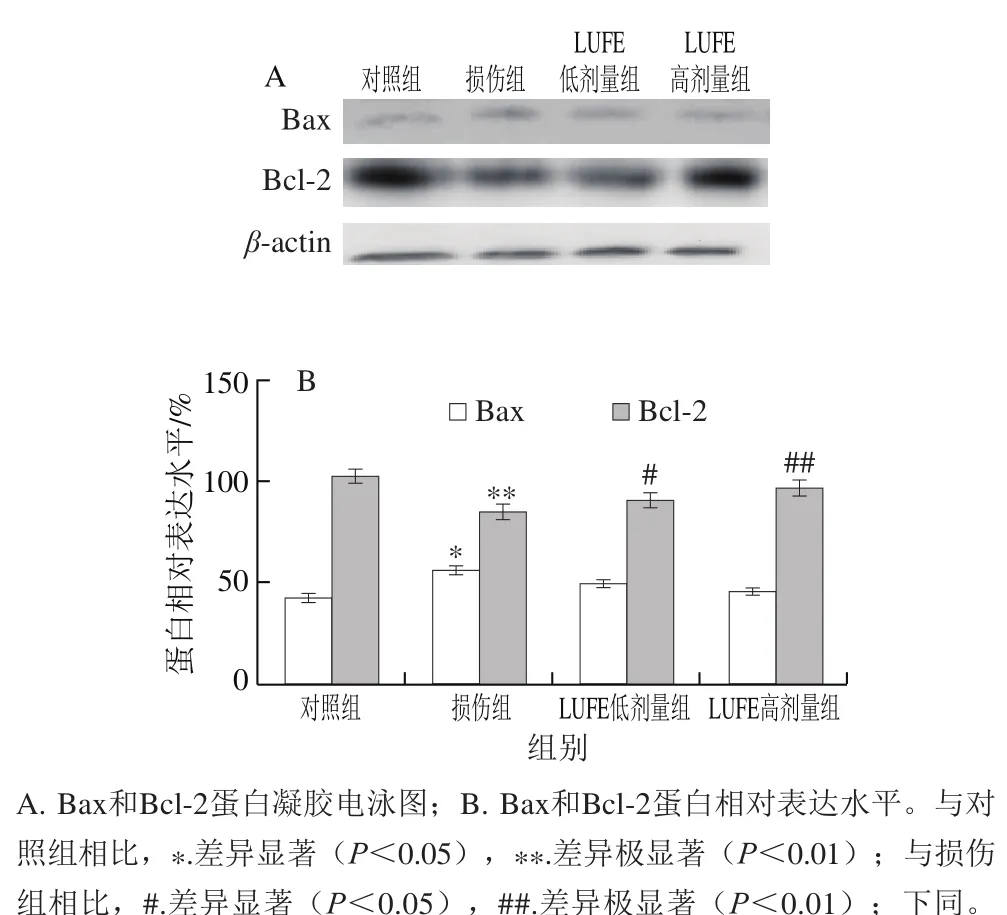
图 4 LUFE对Bax和Bcl-2蛋白表达的影响Fig. 4 Effect of LUFE on the expression of Bax and Bcl-2 in HUVECs
如图4所示,与对照组相比,损伤组Bax表达增加,而Bcl-2表达减少,具有显著性差异。与损伤组相比,LUFE低、高剂量组Bax表达略减少,而Bcl-2表达明显增加,这就说明LUFE降低Bax/Bcl-2比值,即具有抗凋亡作用。
2.7 LUFE对细胞色素c、cleaved caspase-9和cleaved caspase-3蛋白表达的影响
与对照组相比,损伤组细胞色素c、cleaved caspase-9和cleaved caspase-3的表达均增加。与损伤组相比,LUFE低、高剂量组细胞细胞色素c、cleaved caspase-9和cleaved caspase-3的表达均减少,并随着剂量的增加,其表达程度越低(图5)。
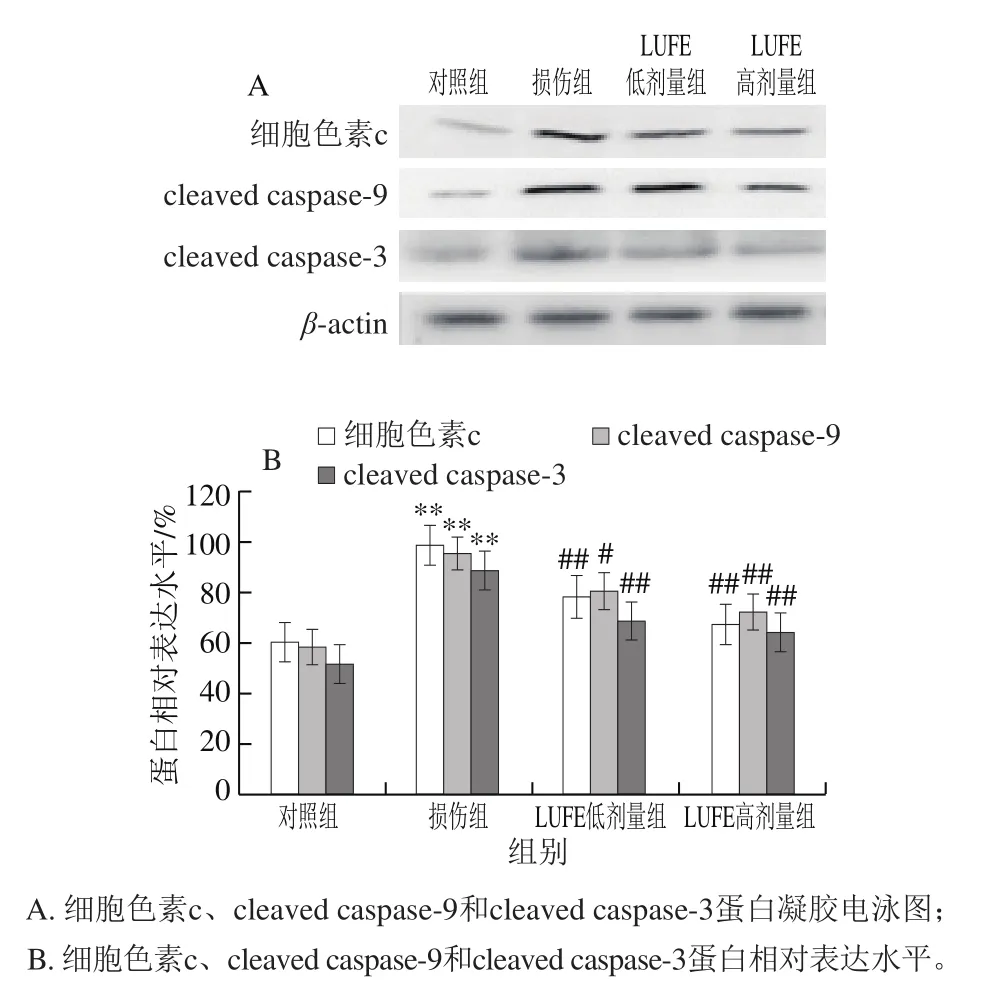
图 5 LUFE对细胞色素c、cleaved caspase-9和cleaved caspase-3蛋白表达的影响Fig. 5 Effect of LUFE on the expression of cytochrome c, cleaved caspase-9 and cleaved caspase-3 in HUVECs
3 讨 论
长期过量饮酒是心血管病的危险因素[19]。研究表明过量饮酒可引起酒精性心肌病[20]、心血管意外等[21]。心血管系统是酒精作用的主要靶器官之一。在心血管疾病的发生过程中内皮细胞的损伤起重要作用。酒精代谢过程中产生的大量ROS[22-23],引发氧化应激,氧化损伤细胞膜、DNA、酶、蛋白质等结构[24],最终引起细胞凋亡或细胞坏死[25-26]。在前期研究中发现LUFE对过氧化氢诱导的氧化应激有保护作用[17],由此设想LUFE是否对酒精诱导的HUVECs损伤有保护作用。为此,本实验探讨了LUFE对酒精干预后的HUVECs的影响及其相关机制。
实验结果表明,酒精作用后血管内皮细胞的存活率下降、细胞培养上清液LDH漏出量增多。同时对细胞凋亡的检测结果(AO/EB染色结果)显示,酒精作用后细胞数减少、其形态发生变化、部分细胞发生凋亡。而LUFE干预后细胞存活率上升,凋亡细胞数明显减少,提示LUFE对酒精诱导的细胞损伤具有保护作用。
酒精在代谢过程中产生大量ROS,引起组织细胞的损伤。本实验中酒精作用后ROS水平显著升高。高水平的ROS消耗大量抗氧化酶,导致SOD、GSH-Px活力下降;同时因活性氧所致的脂质过氧化作用增强,引起其产物MDA水平增高。本研究中,不同剂量LUFE作用于损伤HUVECs后抑制ROS的生成,说明LUFE可通过降低ROS水平,来保护酒精所致的内皮细胞氧化应激损伤。SOD、GSH-Px水平是反映机体氧化应激反应的重要指标,其水平的高低反映机体的抗氧化能力。LUFE干预后提高SOD、GSH-Px活力,同时抑制脂质过氧化作用,这提示LUFE可能通过提高抗氧化酶活力来抑制ROS的生成。
线粒体是ROS产生的主要场所,也是容易受ROS攻击的目标[27]。酒精可损伤mtDNA,影响细胞能量代谢、增加ROS的生成[28]。本实验中,酒精代谢过程中产生的大量ROS破坏线粒体膜的完整性,降低线粒体跨膜电位,这与其他文献结果一致[29]。研究表明,线粒体膜电位下降是线粒体途径细胞凋亡发生的早期事件之一[30]。本实验中酒精作用后促凋亡蛋白Bax表达增加,抗凋亡蛋白Bcl-2表达减少,而这种Bax/Bcl-2比值的增加引起线粒体膜通透性转换孔的开放,细胞色素c释放到胞质中,后者通过介导凋亡复合体的生成,促进cleaved caspase-9和cleaved caspase-3的活化而启动线粒体途径的细胞凋亡。本研究结果表明,LUFE降低Bax/Bcl-2比值,提高线粒体跨膜电位,抑制线粒体细胞色素c释放,从而抑制cleaved caspase-9和cleaved caspase-3的活化,即抑制线粒体途径的细胞凋亡。
综上所述,LUFE对酒精所致的血管内皮细胞有保护作用,其机制可能与其抗氧化、抑制酒精诱导的线粒体途径细胞凋亡有关。
