基于转录组技术研究藻蓝蛋白在抑制非小细胞肺癌中的调控作用
2020-03-31吴婷婷张佳雯王成涛
郝 帅,李 爽,王 静,吴婷婷,张佳雯,王成涛
(北京市食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学食品与健康学院,北京 100048)
藻蓝蛋白源于螺旋藻、蓝藻、红藻等海洋生物,是一种天然无毒的藻类蛋白质[1]。由于其水溶性好、颜色鲜亮等特点,藻蓝蛋白作为公认的食品着色剂被广泛应用于多种食品行业中;近年来研究表明,藻蓝蛋白可以作为一种功能因子参与肿瘤抑制、减轻炎症、抵抗氧化损伤和衰老等多种生理调控过程,并且不产生毒副作用[2-5]。有研究报道,藻蓝蛋白对肺癌、乳腺癌、肝癌、以及黑色素瘤等多种肿瘤细胞具有明显的抑制作用[6-12]。藻蓝蛋白生物活性的发现引起了广大研究者的极大兴趣,在海洋类功能性食品的开发和利用方面具有重要的研究价值。
近年来,汽车尾气的排放、工业废气污染以及PM2.5雾霾的扩散等环境问题日益严重,这些环境污染会对人体肺部造成巨大损伤并引起癌变。由于肺癌细胞易发生远端转移,使得肺癌成为目前全球第一大恶性肿瘤,发病率和致死率在各类肿瘤中占据首位[13]。而随着我国人口老龄化程度加剧,1998年—2015年,我国的肺癌发病率与死亡率始终保持逐年上升的趋势,肺癌已经成为危害我国居民健康最主要的恶性肿瘤[14-15]。肺癌的病理分型按组织学可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)两大类,近年被诊断的肺癌中,约85%属于非小细胞肺癌[16-17]。因此,寻找与肺癌发生、转移过程相关的蛋白,研究藻蓝蛋白在肺癌中的生物学功能,深入探索其作用机制,可为非小细胞肺癌的诊断、预防甚至治疗提供思路与依据。
转录组学技术(RNA-seq技术)是近年来发展起来的转录水平测序技术,具有高通量、成本低、准确性高等优势。目前,转录组技术已经用于多种肿瘤模型中关键基因的筛选和调控机制研究中,具有鲜明的技术优越性。例如,Jian Jinlong等采用转录组技术研究了p204蛋白的抗肿瘤调控机制[18];Aldaz等利用转录组技术对野生型与p53突变型的乳腺癌小鼠进行了差异基因的筛选,发现了一系列p53所调控的新基因[19]。此外,Ying Jun等同样采用了转录组技术探究了藻蓝蛋白在抑制卵巢癌SKOV-3细胞增殖中的调控机制,他们发现p53信号通路活性的改变可能是藻蓝蛋白抑制卵巢癌的一条重要途径[20]。本研究以一株典型的非小细胞肺癌H460细胞为模型,采用转录组技术对藻蓝蛋白在H460细胞中的潜在靶点进行分析,以期揭示藻蓝蛋白的抗肺癌机制,为非小细胞肺癌的治疗和功能性食品添加剂藻蓝蛋白的开发提供了理论参考。
1 材料与方法
1.1 材料与试剂
人类非小细胞肺癌H460细胞系,购于美国模式培养物集存库,保存于北京市食品添加剂工程技术研究中心。
藻蓝蛋白标准品 美国Envirologix公司;DMEM细胞培养基 美国Gibco公司;胎牛血清 天津康源生物技术有限公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 天根生物技术有限公司;TRIzol试剂 北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
细胞培养箱 德国Heraeus公司;漩涡振荡仪德国IKA公司;超净工作台 上海博迅医疗生物仪器股份有限公司;数字型电子天平 德国Sartorius公司;CFX96Touch荧光定量PCR仪 美国Bio-Rad公司;Bioanalyzer 2100核酸检测仪 美国安捷伦公司;RNA-seq高通量测序仪 美国Illumina公司。
1.3 方法
1.3.1 细胞培养
非小细胞肺癌H460细胞培养于含有体积分数10%胎牛血清、0.1 mg/mL链霉素以及100 units/mL青霉素的DMEM培养基中,培养条件为37 ℃、5% CO2。细胞每3~4 d传代一次,取对数生长期的细胞用于实验。
1.3.2 细胞存活率实验
收集处于对数生长期的H460细胞,胰酶消化,以每孔5 000 个细胞量铺于96 孔板中,放置培养箱中培养12 h,分别加入终浓度为0、0.6、1.2、2.4、4.8、9.6 μmol/L(质量浓度分别为0、20、40、80、160、320 mg/L)的藻蓝蛋白,继续放置培养箱培养48 h后,加入10 μL MTT溶液(储备液质量浓度为5 mg/mL)孵育4 h,加入100 μL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-HCl裂解液继续孵育12 h,检测570 nm波长处吸光度,统计数据并根据下式计算藻蓝蛋白作用细胞48 h的细胞存活率(R)。

1.3.3 细胞生长曲线测定
将处于对数生长期的细胞接种于96 孔板(5×104个/孔)12~16 h,细胞贴壁生长后添加终浓度为4.8 μmol/L藻蓝蛋白处理,并加入10 µL的MTT(储备液质量浓度为5 mg/mL),4~6 h后加入100 µL的SDS-HCl裂解液,12 h后测定570 nm波长处吸光度。以生长时间为横坐标,吸光度为纵坐标绘制细胞生长曲线。
1.3.4 克隆实验
取对数期细胞接种于6 孔板(2×102个/孔),置于37 ℃、5% CO2培养箱中培养24 h待细胞完全贴壁,随后分别采用浓度为0、2.4、4.8、9.6 μmol/L的藻蓝蛋白处理细胞。培养2~3 周,当6 孔板中形成大约50 个克隆数时终止培养,并用吉姆萨染液染色计数克隆数。
1.3.5 流式细胞术检测细胞凋亡
取生长状态良好的细胞接种在T25培养瓶中培养24 h,分别加入0、2.4、4.8 μmol/L的藻蓝蛋白处理72 h,胰酶消化后在室温1 000 r/min离心10 min,用100 µL双染孵育液将洗干净的细胞沉淀重悬,加入5 µL AnnexinV-FITC染液,再加入5 µL 7-AAD染液,冰上20 min避光染色。充分混匀后上机检测细胞的凋亡情况,统计早期凋亡、晚期凋亡的细胞比例。
1.3.6 用于转录组测定的H460细胞的前处理
前一天晚上将H460细胞进行传代处理,细胞密度大约50%左右。第二天待细胞完全贴壁后,采用藻蓝蛋白处理细胞(其中对照组采用相同体积的磷酸盐缓冲液(phosphate buffer saline,PBS)处理细胞),每个处理组做3 个生物学平行组,藻蓝蛋白处理48 h后收集细胞进行后续实验。研究结果中1~3号样本为对照组;4~6号样本为藻蓝蛋白处理组。
1.3.7 细胞cDNA文库的构建
在4 ℃条件下,采用TRIzol试剂提取H460细胞总RNA。RNA样本浓度和纯度采用Bioanalyzer 2100核酸检测仪测定,其中满足OD260nm/OD280nm≥1.8、OD260nm/OD230nm≥1.5并且RNA完整度数量(RNA integrity number,RIN)≥8.0条件的RNA样本可用于后续实验。随后在RNA样本中加入破碎液将mRNA断裂成碎片,随后用于反转录合成cDNA的第一条链;cDNA第二条链利用dNTPs,RNA酶H以及DNA聚合酶进行合成。双链cDNA随后进行末端修复和连接,凝胶纯化后采用PCR扩增技术构建cDNA文库。
1.3.8 RNA-seq测序以及生物信息学分析
转录组测序采用5 µg RNA样品进行实验。原始读长中去除含有测序引物以及低质量的读长后,进行序列拼接形成高质量的读长片段。采用TopHat将高质量的读长片段与人类基因组序列进行比对,随后通过UCSC基因组数据库进行序列注释。通过非冗余蛋白质数据库、非冗余序列和SwissProt数据库,运用BLAST算法以E值10-5为限定条件进行序列的同源性比对。转录组分析获得的转录本和基因采用GO聚类、KEGG聚类进行分析,确定转录本的功能信息。
1.3.9 差异基因的表达分析
差异基因表达量(differentially expressed genes,DEGs)利用RSEM 1.2.31软件进行分析,该方法基于每百万读长中来自于某基因每千碱基长度的片段数(fragments per kilobases per millionreads,FRKM)的方法进行计算,获得基因表达量FRKM。基因的差异比对采用DESeq软件进行分析,对DESeq检测结果按照差异显著性标准(差异基因的表达量变化高于2 倍且错误发现率指标小于0.05)进行筛选,统计基因显著性差异表达调节的情况。
1.3.10 实时荧光定量PCR检测基因的表达
采用5 µmol/L藻蓝蛋白处理H1299细胞48 h后,利用TRIzol法提取细胞总RNA进行定量PCR的检测。2 µg总RNA用于进行反转录,获得cDNA,采用SYBR Green实时荧光定量PCR试剂盒进行检测(GAPDH作为内参)。基因的相对表达量采用2-ΔΔCt法进行计算,每个样本进行4 个生物学重复。其中定量PCR的引物设计如表1所示。

表 1 用于定量PCR反应的引物序列Table 1 Primer sequences used for qPCR
1.3.11 Western Blot检测
收集细胞,加入适量体积的RIPA裂解液进行细胞裂解和蛋白抽提;利用Bradford法测定其浓度。将蛋白采用质量分数12%的SDS分离胶进行分离,随后进行转膜处理;转膜结束后,根据目的条带大小剪膜,用5%脱脂奶粉封闭目的条带1.5 h、孵育一抗过夜。第2天于37 ℃恒温静置孵育二抗1 h,经TBST溶液清洗3 次,孵发光液显色,洗片机曝光目的条带蛋白,扫描仪扫描胶片并保存图片。
1.4 数据统计分析
实验数据均以平均值±标准差表示,采用SPSS 11.0软件进行单因素方差分析,其中P<0.05为显著性差异,P<0.01为极显著差异。
2 结果与分析
2.1 藻蓝蛋白对H460细胞生长的抑制作用
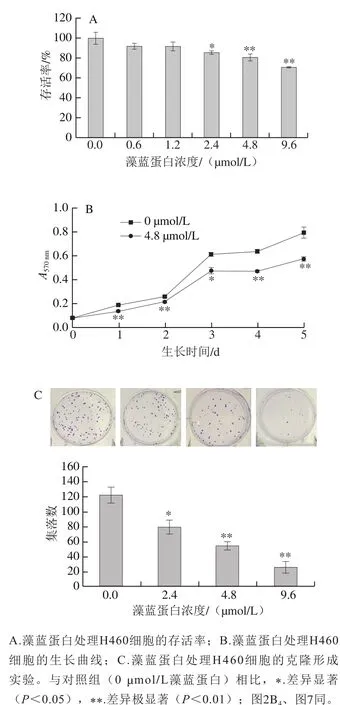
图 1 藻蓝蛋白对H460细胞生长的抑制作用Fig. 1 Inhibitory effect of phycocyanin on H460 cell growth
首先采用藻蓝蛋白处理正常培养的H460细胞,利用细胞存活率、细胞增殖和集落形成实验检测藻蓝蛋白对细胞增殖的影响。图1A显示,随着藻蓝蛋白浓度的增加,细胞存活率出现浓度依赖性下降,4.8 µmol/L和9.6 µmol/L浓度处理能够引起细胞存活率发生极显著降低;图1B显示藻蓝蛋白能够显著降低细胞的体外增殖能力;图1C显示,随着藻蓝蛋白浓度的增加,细胞的群落形成能力逐渐降低。以上结果均表明藻蓝蛋白能够显著抑制非小细胞肺癌H460的体外增殖能力。
2.2 藻蓝蛋白对H460细胞凋亡的影响
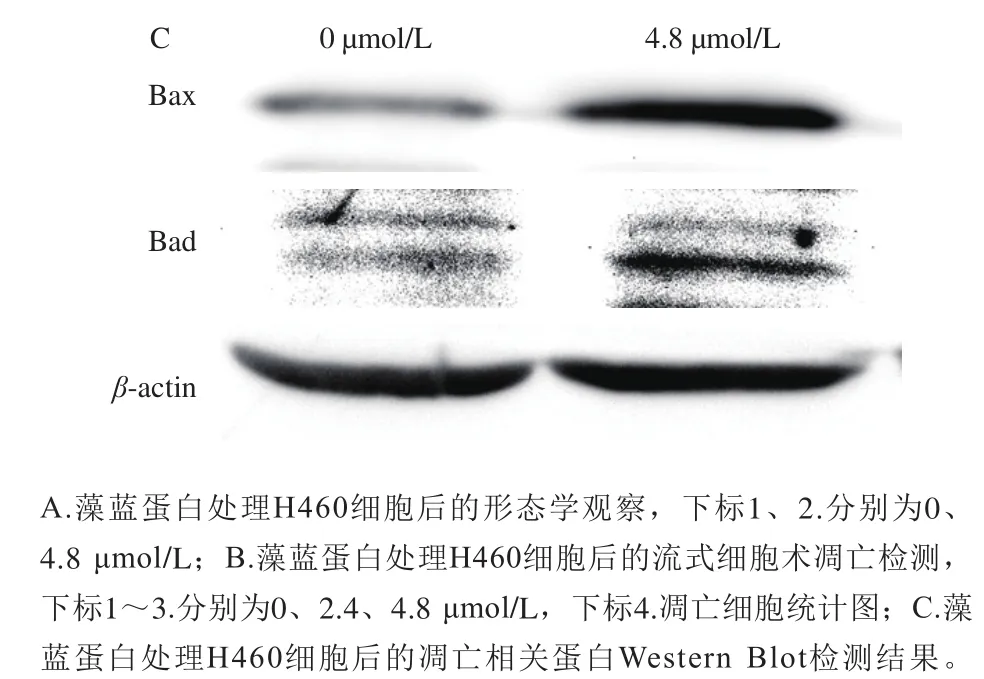
图 2 藻蓝蛋白对H460细胞凋亡的影响Fig. 2 Effect of phycocyanin on the apoptosis of H460 cells
采用细胞形态学观察、流式细胞术和Western Blot实验检测了藻蓝蛋白对H460细胞凋亡的影响。图2A显示,藻蓝蛋白处理后,细胞生长状态发生改变,正常贴壁生长的细胞数量明显降低;随后采用流式细胞术对处理后细胞的凋亡比例进行了检测,图2B显示,随着藻蓝蛋白浓度的增加,H460细胞早期和晚期凋亡的比例显著增加;同时,图2C显示,藻蓝蛋白能够增加促凋亡蛋白Bax和Bad的表达量。以上结果表明,藻蓝蛋白不仅能抑制H460细胞的生长,还能够显著促进细胞的凋亡。为了进一步探究藻蓝蛋白在H460细胞中的调控机理,对藻蓝蛋白处理前后的H460细胞进行了高通量转录组测序研究。
2.3 RNA质量控制
表型实验结果表明,4.8 µmol/L浓度的藻蓝蛋白已经能够引起H460细胞的生长和凋亡发生极显著改变,因此,采用此浓度进行H460细胞的转录组学分析。采用1.3.6节方法将藻蓝蛋白与PBS对照分别处理正常培养的H460细胞,48 h后收集细胞提取总RNA用于转录组学分析。首先对细胞总RNA的纯度和完整度等指标进行了检测。图3分别采用核酸凝胶电泳和核酸分析仪对RNA的完整性进行了检测,结果显示,RNA 18S和28S亚基条带清晰,并且在相应的时间出峰完整,集中程度高;表2显示了RNA质量控制的基本参数,6 个样本的RNA总量均超过15 µg,OD260nm/OD280nm大于1.8,OD260nm/OD230nm大于1.5,RNA 完整值(RNA integrity number,RIN)均大于8,表明RNA样本完整,没有发生降解,并且纯度和浓度较高,可以进行后续转录组学测序分析。


图 3 细胞总RNA的完整度检测Fig. 3 Integrity analysis of total bacterial RNA

表 2 RNA质量控制基本参数Table 2 Essential parameters of RNA quality control
2.4 差异基因的筛选分析结果
采用高通量转录组测序技术对藻蓝蛋白处理组与对照组的H460细胞中的差异基因进行了筛选。由图4可知,共获得了2 532 个表达量显著差异的基因,其中显著上调基因1 491 个,占差异基因总数的58.9%;显著下调基因1 041 个,占差异基因总数的41.1%。
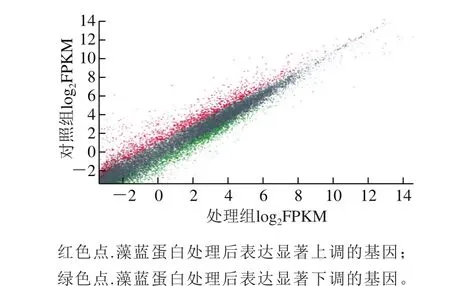
图 4 藻蓝蛋白处理后差异基因模式散点图Fig. 4 Scatter diagram of differentially expressed genes induced by phycocyanin treatment
为了进一步研究藻蓝蛋白对H460细胞的调控作用,对差异基因进行了GO功能分析。表3显示了GO分析中差异基因参与的排名前10 位的生物学过程。其中,差异基因主要调控了细胞增殖负调控过程、细胞程序性死亡调控、细胞凋亡过程的调控、细胞因子应答反应这几类生物学过程。目前,已有一些研究表明,藻蓝蛋白能够抑制另一类非小细胞肺癌A549细胞的增殖[21-23],而本研究的分析结果进一步证实了前期的报道,也反映了转录组测序结果的客观性和准确性。

表 3 排名前10位的差异基因的GO功能分析Table 3 Top 10 ranked differentially expressed genes in GO analysis
2.5 差异基因的聚类分析结果
差异基因在不同样本中具有不同的表达量,表达模式相似的基因通常具有功能的相关性,因此根据差异基因的表达情况进行了聚类分析。图5显示了2 532 个差异基因的聚类分析结果,根据表达量的不同,除9 个基因不具有明显的表达规律以外,大部分差异基因能够聚成4大类,分别为:表达显著下调的基因类别A(1 022 个基因),表达显著上调的基因类别B(1 393 个基因),表达极显著下调的基因类别C(14 个基因),以及表达极显著上调的基因类别D(94 个基因),4 类基因的表达模式如图6所示。
在这些差异基因中,挑选出了10 个感兴趣的差异基因并进行了分类,结果发现,Cdk2、Cdc25、PCNA、TLR4等影响细胞增殖的基因均出现了显著下调(A类);p27、p21等抑制细胞增殖的基因出现了显著上调(B类);Bcl-2、NKD1等癌基因出现了极显著下调(C类);而CCT6、GBP2等促凋亡基因出现了极显著上调(D类)。这10 个差异基因的转录组分析结果如表4所示。这些结果表明,藻蓝蛋白能够调控PCNA等多种基因的表达而抑制H460细胞的增殖,并促进其的凋亡。研究结果为探究藻蓝蛋白在非小细胞肺癌中的调控提供了参考,也为肺癌治疗提供了潜在的靶点。
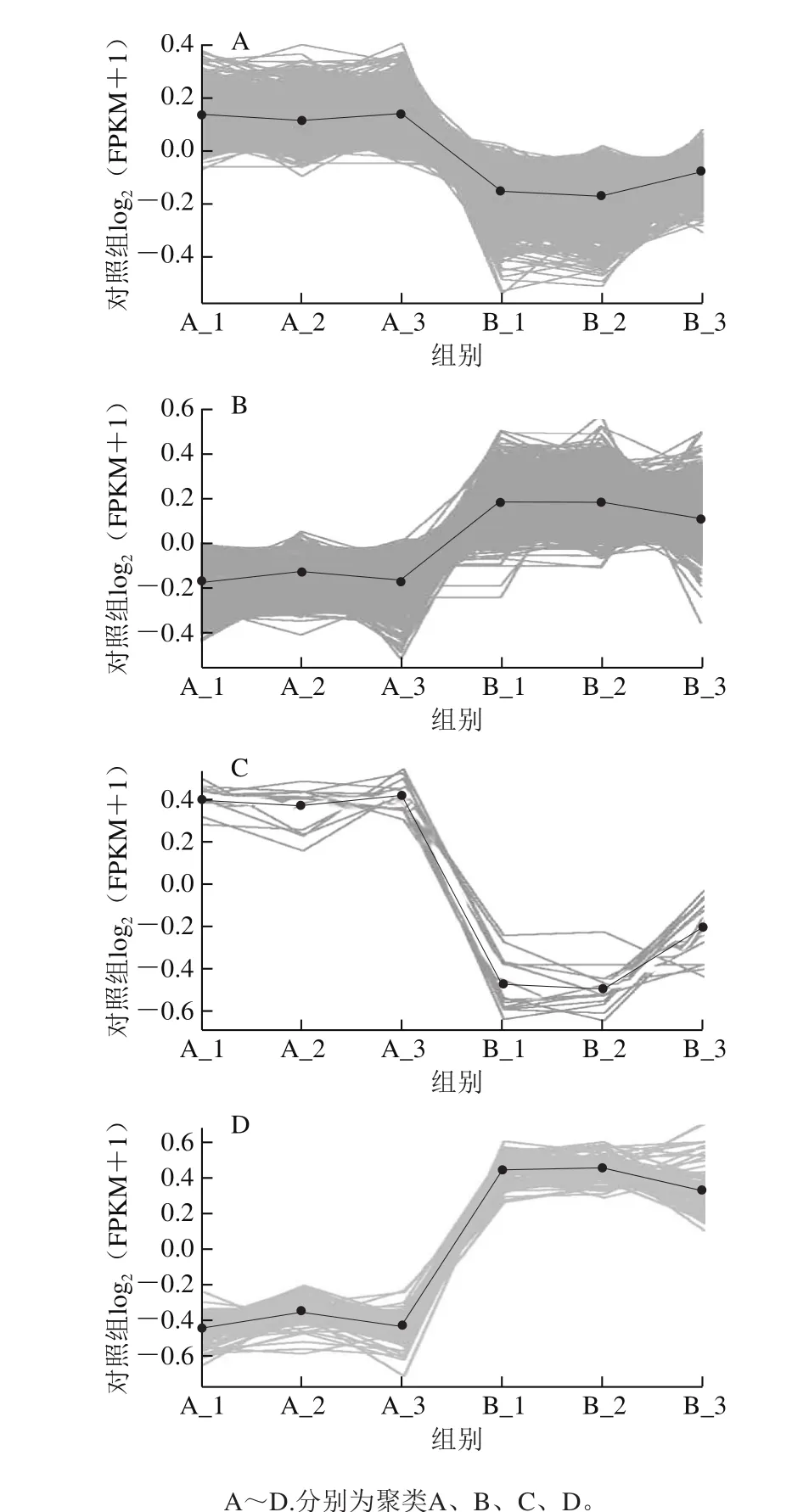
图 6 4 类差异基因表达的聚类模式图Fig. 6 Four cluster patterns of differentially expressed genes
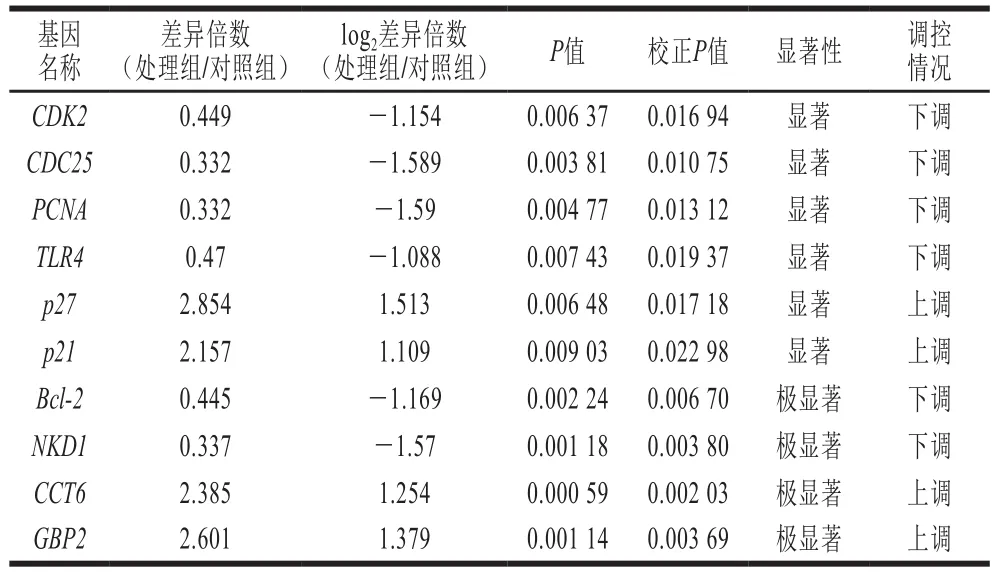
表 4 10 个感兴趣差异基因的转录组表达情况Table 4 RNA-seq analysis of 10 differentially expressed genes
2.6 定量PCR验证差异基因的表达
对筛选得到的上述几个关键基因进行了定量PCR的验证。如图7所示,细胞周期调控基因Cdk2、Cdc25、PCNA以及TLR4在藻蓝蛋白处理后出现了显著下调,周期抑制基因p27和p21则出现了上调;促凋亡基因CCT6和GBP2在藻蓝蛋白处理后出现了显著上调,而抑凋亡基因Bcl-2和NKD1的表达趋势出现了相反的情况。此结果与转录组测序的基因表达量结果相一致,进一步证实了这些关键调控基因的表达受到了藻蓝蛋白的调控,进而引起了H460细胞的增殖抑制和凋亡效应,为解释藻蓝蛋白在非小细胞肺癌的调控机制提供了重要的理论依据。

图 7 差异基因的定量PCR结果Fig. 7 qPCR analysis of differentially expressed genes
2.7 藻蓝蛋白调控H460细胞的信号通路分析结果
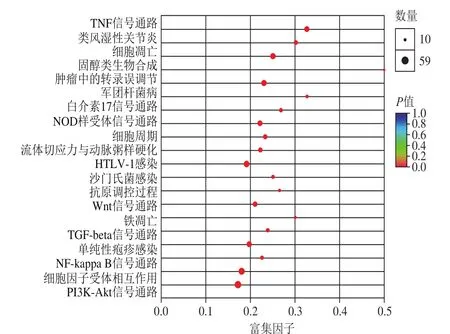
图 8 差异基因的KEGG富集分析Fig. 8 KEGG enrichment analysis of differentially expressed genes
采用KEGG数据库对差异基因可能参与的信号通路进行了富集分析,图8显示了富集程度排在前20位的信号通路。结果表明,在筛选得到的差异基因中,主要参与了与肿瘤生长和凋亡相关的TNF信号通路、IL-17信号通路、Wnt信号通路、NF-κB信号通路以及PI3K-Akt信号通路等。其中PI3K-Akt信号通路所含有的差异基因的数量最多。Kim等通过研究发现,p21可以作为一个下游调控因子参与Akt信号通路,从而调节细胞周期[24],Chen等也在血细胞癌U937细胞中发现Akt与p21具有相互调控的效应[25],这表明藻蓝蛋白可能通过调控Akt信号通路影响细胞周期进程,进而抑制H460细胞的增殖。此外,也有相关研究报道Akt与Bcl-2在卵巢癌、胃癌和喉癌中具有相互调控的作用[26-28],表明Akt也参与了细胞凋亡过程。因此,KEGG分析表明Akt可能是藻蓝蛋白调控H460细胞增殖和凋亡的一个重要途径。
此外,在转录组分析结果中,一些典型的参与Akt信号通路的上游调控因子如TLR2、TLR4以及IRS1也被作为差异基因删选出来,它们的转录组分析结果如表5所示。藻蓝蛋白处理后,这些基因的转录水平出现了极显著下调。随后,对其中2 个差异基因(TLR2和TLR4)以及PI3K-Akt信号通路中的两个经典蛋白AKT和磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的磷酸化水平进行了检测(图9)。PTEN是一种非常重要的肿瘤抑制蛋白,同时也是PI3K-Akt信号通路的抑制子,磷酸化后被激活[29-30]。图9显示,藻蓝蛋白处理H460细胞后,TLR2、TLR4和IRS1的蛋白水平出现了明显降低,与转录组结果一致,同时,PTEN的磷酸化水平出现了显著增加,并且Akt的磷酸水平出现了显著降低。以上研究结果表明,藻蓝蛋白能够显著降低PI3K-Akt信号通路的活性,进而对细胞增殖起到抑制作用。
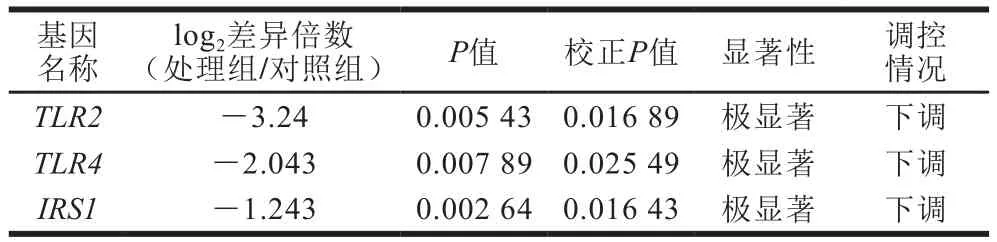
表 5 与Akt信号通路相关的3 个差异基因的转录组表达情况Table 5 RNA-seq analysis of 3 differentially expressed genes related to Akt signal pathway
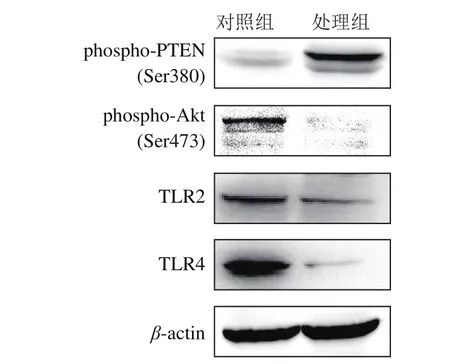
图 9 藻蓝蛋白处理H460细胞后Akt信号通路的检测Fig. 9 Akt pathway analysis in H460 cells after phycocyanin treatment
3 结 论
本研究以高通量转录组技术为研究手段,对藻蓝蛋白处理后的H460细胞进行了转录组测序。结果表明,藻蓝蛋白处理后,共筛选得到2 532 个表达量显著差异的基因,其中显著上调基因1 491 个,占差异基因总数的58.9%;显著下调基因1 041 个,占差异基因总数的41.1%。这些差异基因主要参与了细胞增殖和凋亡相关的生物学调控过程;对差异基因进行聚类分析显示,4 类不同的基因表达模式被聚类,包含了与细胞增殖和凋亡相关的重要基因:Cdk2、Cdc25、PCNA、TLR4、p27、p21、CCT6、GBP2、Bcl-2、NKD1;定量PCR验证结果显示,差异基因的表达趋势与转录组结果一致;此外,差异基因的KEGG富集分析显示,藻蓝蛋白能够参与调控TNF、IL-17、Wnt、NF-κB以及PI3K-Akt等信号通路,其中PI3K-Akt信号通路富集的差异基因数量最多;Western Blot结果进一步确认了藻蓝蛋白能够显著降低H460细胞中Akt信号通路的活性,进而抑制细胞增殖并促进凋亡。本研究全面探究了藻蓝蛋白在H460细胞中的调控机制,为抗肿瘤类功能性食品因子的开发和利用提供了重要的依据,同时也为非小细胞肺癌的靶向治疗提供了理论参考。
