基于核磁共振法测定运动膳食补充剂中4种苯乙胺类物质
2020-03-31李海涛
李海涛
(郑州工业应用技术学院,河南新郑451100)
苯乙胺类物质(phenethylamines,PEAs)是一类具有苯乙胺骨架结构的天然合成化合物,具有药理活性,常用作兴奋剂、激素、神经递质、抗抑郁药物等[1]。世界反兴奋剂机构(World Anti-doping Agency,WADA)禁止参加竞技运动比赛的运动员使用苯乙胺及其衍生物,因为这些物质具有刺激和增强机体性能的作用[2]。PEAs 是在减肥与运动营养补充剂中发现的一类非常受欢迎的成分。美国国立卫生研究院膳食补充标签数据库(Dietary Supplement Label Database,DSLD)列出了一系列膳食补充剂,在其中就包含PEAs。此外,有些产品可能将植物及其提取物当做PEAs 的天然来源,特别是仙人科、柑桔属及何首乌属等植物,而其中一些植物已被用作膳食补充剂的成分[3]。此外,在许多膳食补充剂中也发现了一些人工合成的PEAs,其中包括已被标记为药物或新型物[4]。
为了保证膳食补充剂的安全性,研究者们制定了多种PEAs 的定性和定量分析方法。其中包括酸性高锰酸钾化学发光检测的高效液相色谱法[5]、气相色谱-质谱[6]以及高效毛细管电泳等[7]。由于PEAs 是一类结构相似的极性胺,在复杂的基质中,其分析测定可能带来较大的挑战。色谱和电泳法因其在单独组分检测前的高效分离能力而成为首选的分析技术。然而,这些方法需要标准物质PEAs 作为定性和定量的参考物质,为了确定某些特定的PEAs 作为检测和分析的目标,可能需要对样品的组成预先了解。核磁共振(nuclear magnetic resonance,NMR)是测定结构的一种有效手段,可用于定量分析。由于它具有高重现性、自动化、不需要相同的参考物质进行量化和通用检测等优点,受到越来越多的关注。核磁共振已成功地应用于生物材料提取物、食品、草药和膳食补充剂等复杂混合物的分析[8]。它是非选择性的,不需要事先了解混合物中的化学成分,本研究以20 种运动膳食补充剂为研究对象,基于核磁共振法对产品配方中的苯乙胺、辛弗林、甲基辛弗林和大麦芽碱这4 种主要的苯乙胺类物质进行了定性分析和定量测定。通过一维和二维NMR 谱的分析,对补品中的标记PEAs 和未标记PEAs 进行了检测和鉴定,不需进行色谱预分离。此外,还建立并验证了一种定量核磁共振法多重检测待测样品辅料中4 种苯乙胺类物质的含量。
1 材料与方法
1.1 仪器与试剂
1.1.1 膳食补充剂样品
本研究中涉及的20 种运动膳食补充剂购买途径为市售与网购(因涉及到生产企业的产品隐私,依相关规定研究中均由样品编号替代)。样品选购原则均基于产品的标签信息包含至少一个以下所涉及的概念或声明:“减肥”、“代谢率加强”、“兴奋剂”、“脂肪营养”、“食欲调节”、“燃烧卡路里”、“精神集中/提升情绪”等。产品外观为胶囊、粉末或片剂形式(均在产品保质期内)。
1.1.2 试剂
苯乙胺(≥99 %)、辛弗林(≥98 %)、大麦芽碱(≥97.5%)、3-(三甲基甲硅烷基)丙酸钠盐(sodium 3-trimethylsilyl -[2,2,3,3]tetradeuteropropanoate,TSP):西格玛奥德里奇(上海)贸易有限公司;甲基辛弗林(≥98%):美国ChromaDex 公司。
1.1.3 仪器
Milli-Q 净水系统:美国密理博(中国)有限公司;MicrofugeR16 离心机:美国贝尔曼库尔特有限公司;Agilent DD2-500MHz 型核磁共振仪(配备OneNMR 探针和Agilent Vnmrj 4.0 软件):美国Varian 公司。
1.2 试验方法
1.2.1 定性分析
将20 种运动膳食补充剂样品依次编号为S1、S2、S3、……、S20,并分别称取100 mg 的均质粉末放置于2 mL 的离心管中,加入400 μL 氘代甲醇/氘化水溶液(体积比为4 ∶1),加入适量0.5 mmol/L TSP 作为内标;涡旋搅拌混合30 s 后在室温25 ℃下超声处理15 min。在25 ℃、13 000 r/min 的参数下离心 7 min。 在 NMR分析前,将上清液(200 μL)转移至 3 mmol/L NMR 管中备用。
1.2.2 定量分析
精确称取50 mg~250 mg 样品并溶解在5 mL HCl-KCl 水溶液(含有 0.15 mol/L HCl 和 0.15 mol/L KCl)中。在室温25 ℃下超声处理20 min,然后以4 000 r/min离心 7 min。准确地移取200 μL 上清液并与100 μL含有1.5 mmol/L TSP 的重水溶液混合。将混合溶液转移到3 mmol/L NMR 管中进行NMR 的分析测定(每个样品进行3 次重复试验)。
制备 D2O/H2O(1 ∶2,体积比),含有 0.1 mol/L HCl、0.1 mol/L KCl 及0.5 mmol/L TSP 溶液用于标准溶液的制备和稀释。在 4.4、4.3、4.0 mg/mL 和 3.0 mg/mL 的浓度下配制苯乙胺、辛弗林、大麦芽碱和甲基辛弗林的标准原液。通过对标液的梯度稀释,制备了含有4 种标准化合物不同浓度(2 μg/mL~2 200 μg/mL)的标准溶液。用校正曲线测定了膳食补充剂中4 种PEAs 的含量。通过绘制特征共振峰面积比建立单独的校准曲线。其内参比TSP 在0.0 ppm 与校准浓度范围内对应的浓度水平之间的比值为1.15 ppm。
1.2.3 验证试验
本研究基于检测方法的选择性、特异性、稳定性、线性度、检出限(limit of detection,LOD)、定量限(limit of quantification,LOQ)、准确度、精密度和重复性等多方面考量,对该方法进行验证试验。所有验证参数都是依据“人用药品注册技术要求国际协调会议(international council for harmonization,ICH)”准则 Q2(R1)[9]的要求进行。对验证样本和标准解决方案进行了日内测试(6 次/d)与日间测试(5 次/d,连续 3 d)。
1.2.4 核磁共振测定条件
在499.79 MHz 处测量了1H NMR 谱,用预饱和脉冲程序抑制了H2O 信号。光谱宽度为8 503 Hz,扫描次数为128,数据点为44 218,弛豫延迟为15 s,采集时间为 2.6 s,脉冲宽度为 7.40 μs(90°)。针对 Vnmrj 4.0软件的反转恢复脉冲序列,对苯乙胺类物质和TSP 共振信号的纵向弛豫时间T1 进行了测量和计算。结果表明,其靶1H 信号的T1 值在1.0 s~2.9 s 之间。因此,在定量测量条件下,所有这些共振可以被认为是完全放松的。HSQCAD 和gHMBCAD 的最佳耦合常数分别为145 Hz 和8 Hz。对于CIGAR-HMBC 试验,将15N谱宽设为-10 ppm~300 ppm,化学位移为0 ppm,优化耦合常数范围为4 Hz~10 Hz,瞬态数32,增量数256。核磁共振数据处理用Mnova 软件,用0.3 Hz 谱线展宽对自由诱导衰变(free induction decays,FID)进行傅里叶变换。对光谱进行基线校正。在化学位移δ=0.0 ppm时,根据TSP 信号标定了NMR 谱的化学位移。利用Mnova 软件提供的谱反褶积(GSD)函数和峰值拾取法对所有选定的NMR 峰进行了集成。
2 结果与分析
2.1 苯乙胺类物质提取方法的优化
为确定最佳的萃取条件,选取适量的补充剂进行了以下4 种萃取体系的优化评价试验,分别为A:甲醇/水(体积比为 4 ∶1);B:乙腈/水(体积比为 4 ∶1);C:氯化氢水溶液(0.1 mol/L HCl);D:苯(样品先在 0.1 mol/L NaOH 溶液中溶解)。结果表明,体系A 最能有效地提取补充剂样品中的大部分化学成分,在样品中所有成分的回收率方面优于体系B;系统C 不但有较高的提取率和重现性,而且可以显着地减少样品矩阵的干扰。体系D 能够为待测样品提供相对干净的1H NMR谱,但若想要达到有效的回收率则需要大量的苯。因此,系统A 被用于定性分析,系统C 用于定量检测。在C 体系中加入适量的KCl,可对萃取液的pH 值产生缓冲作用。此外,还观察到在C 体系中加入KCl 可在某些组分的1H NMR 谱中产生尖锐的共振峰[10]。
2.2 补充剂中PEAs的定性分析
苯乙胺类物质的分子结构简单,只有两个特征片段,即苯基和乙胺。理论上,其1H NMR 谱中苯基的化学位移范围在δH6.0 ppm~7.5 ppm 内表现出特征共振,乙胺在δH3.0 ppm~5.0 ppm 范围内表现出特征共振。本研究首次在溶剂体系A 中测定了其1H NMR 谱。在此基础上,如果在1H NMR 谱的相应化学位移范围内没有检测到其特征共振,则可以筛选出不含(或其含量低于该方法的LOD 值)这4 种苯乙胺类物质的补充剂样品。基于二维核磁共振试验对20 个待测样品进行了鉴定分析。特别是利用1H-15N CIGAR-HMBC 核磁共振试验,对苯乙胺类物质特有的乙胺部分的信号进行了选择性检测,结果如图1 所示。

图1 样品S1 的二维核磁共振谱图Fig.1 2D NMR spectra of sample S1
由图1 可知样品 S1 的二维1H-15N CIGAR,gCOSY,gHMBCAD 和HSQCAD 等高线谱图。如图1(B)CIGAR 谱图中,可以观察到质子信号(三重态)在δH2.98 ppm 处与氮信号在δH31.8 ppm 处之间存在着1H-15N 相关性,表明样品制剂中存在胺组分。类似地,从样品S1 的4 个谱图中确定苯乙胺的结构。这些信号反映了结构中的氮原子并通过二维光谱分析证实了这两种含氮组分的存在。
本研究对20 种运动膳食补充剂(样品编号依次为S1~S20)进行了相关的定性分析,其结果如表1 所示。

表1 样品定性分析检测结果Table 1 Test results for qualitative analysis of samples
由表1 可知,4 种苯乙胺类物质的结构、NMR 共振分配相关数据以及样品定性分析结果。在20 种补充剂中,有10 种样品含有苯乙胺,含有辛弗林和甲基辛弗林的样品数分别为8 种和5 种,而含有大麦芽碱的样品数为5 种。其中4 种苯乙胺类物质均未检出的样品有4 个,分别为S4、S6、S10 和S16。在本研究中,在含有不同化学成分的样品光谱中可观察到苯乙胺类的一些质子信号有少量的化学位移漂移,但碳化学位移几乎是恒定的。由于13C 谱通常比1H 谱简单得多,因此13C NMR 是复杂混合物定性分析中一种有效的辅助手段。
2.3 验证试验
基于ICH 标准对该定量方法进行了相关的验证试验。所有的苯乙胺类物质均提供了它们自己的特征共振峰,且互不干扰,以便进行更加精确地计算。通过二维NMR 试验验证了该化合物的峰级分布。此外,利用反褶积函数来提高峰面积积分的精度[11]。通过对4种苯乙胺类物质的线性度、LOD 和LOQ 进行相关验证试验。如表2 所示。
由表2 可知,校正方程的较高相关系数表明4 种化合物在较宽的动态浓度范围内具有良好的线性响应。基于标液在 2 μg/mL~400 μg/mL 范围内建立的校准曲线,测得 LOD=3.2 σ/s 和 LOQ=9.8 σ/s(其中 σ 为回归曲线y 截距的标准差,s 为校准曲线的斜率)[12]。
通过日内和日间(连续3 d)的相关测定对该方法的精密度和重现性进行了检验。如表3 所示。
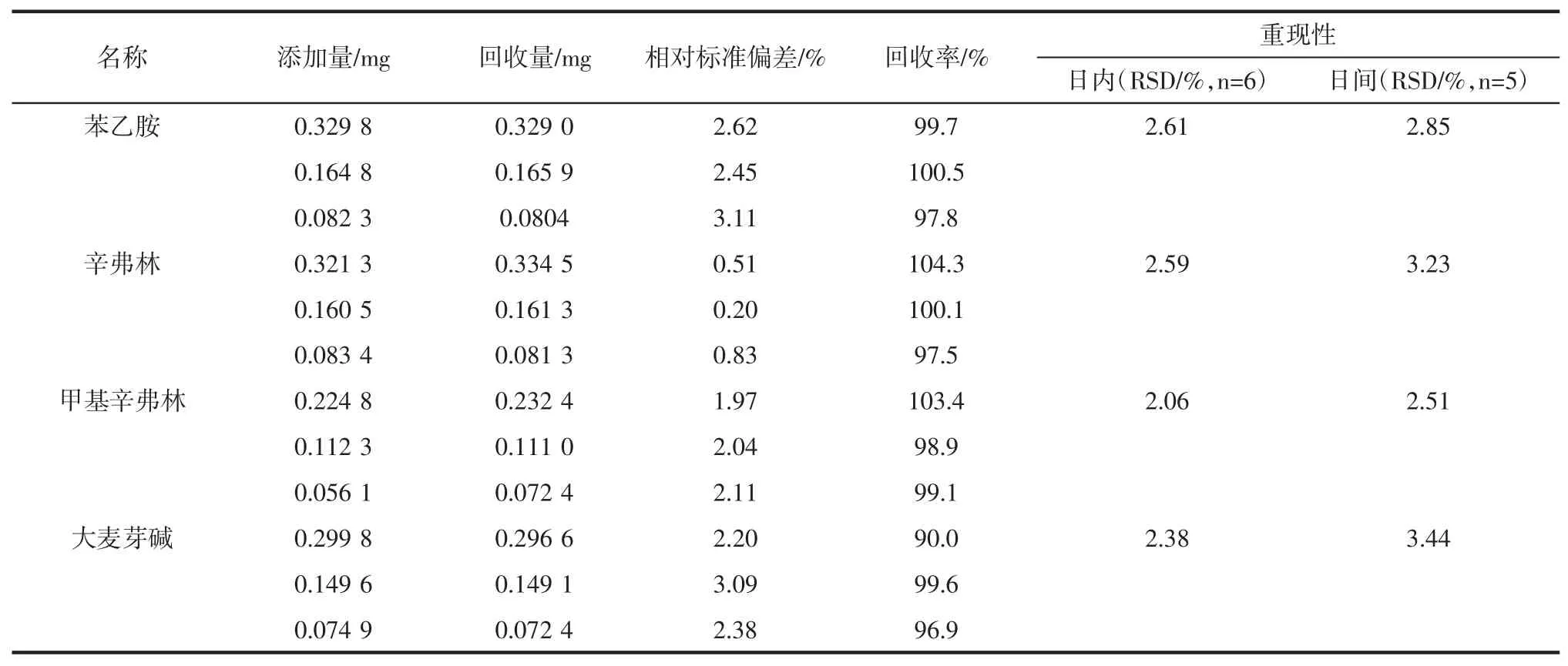
表3 4 种苯乙胺类物质定量分析相关参数Table 3 Quantitative analysis parameters of four phenylethylamines
由表3 可知,4 种苯乙胺类物质的相对标准偏差(relative standard deviation,RSD)均小于 3.5%。因4 种物质的含量均在96.9%~104.3%之间,表明所建立的核磁共振法对运动膳食补充剂中4 种苯乙胺类物质的定量是可靠准确的。
2.4 样品中4种苯乙胺类物质的多重检测
针对20 份样品依据上述方法对苯乙胺、辛弗林、大麦芽碱和甲基辛弗林的浓度(质量百分比,mg/100 mg)进行了多重检测,分析结果见表4。

表4 多重检测20 份样品中4 种苯乙胺类物质的含量Table 4 Multiple detection of 4 phenylethylamines in 20 samples mg/100 mg

表4 多重检测20 份样品中4 种苯乙胺类物质的含量Table 4 Multiple detection of 4 phenylethylamines in 20 samples mg/100 mg
由表4 可知,该方法可以多重检测这4 种苯乙胺类物质,并且在20 份样品中,有10 个产品中检出了苯乙胺,含量变化范围为0.8%~28.9%,占调查产品的一半。然而在样品S2 和S20 的产品标签中并没有提到苯乙胺。样品S20 的标签中只提到了甲基辛弗林,而实际并未检测此物质,而是检测到未提及的苯乙胺。而针对 S20 产品的日推荐食用剂量(1 粒/次,2 次/d)应摄入1 350 mg 的物质含量,而依据本研究的检测结果计算,实际食用量约412 mg。针对辛弗林的检测结果可知,在所有样品中有8 个样品检出该物质,其含量在0.6%~5.7%。样品S6 与S12 虽然在产品标签中有提到,但实际未检测到。而在检出苯乙胺的10 个样品中又有50%的样品同时检出了辛弗林。在8 个辛弗林的检出样品中又有3 个样品标签中未提及含有辛弗林。甲基辛弗林的检测结果显示出其含量在0.2%~11.9%之间。而在4 种物质都未检出的样品S4、S6、S10 和S16 均有提到含甲基辛弗林,但都未检出。针对大麦芽碱的检测则可知3 个样品中的大麦芽碱均与其它苯乙胺类物质同时存在,未单独检出。
3 结论
本研究利用核磁共振法来鉴别和量化膳食补充剂中的4 种常见的苯乙胺类物质。NMR 可以提供丰富的检测信息,使被检产品的配方成分作为一个整体而得以识别出来,不需要事先了解补充剂中成分的具体信息。基于一维和二维NMR 技术(包括1H-15N CIGAR-HMBC)对20 个商品保健品中检测和鉴定了4 种苯乙胺类物质,即苯乙胺、辛弗林、甲基辛弗林和大麦芽碱,建立并验证了多重测定样品中4 种苯乙胺类物质含量的核磁共振定量方法。这项研究发现,在多数情况下,未贴上标签的苯乙胺类物质在补充剂中被检测到,而标签上所列的苯乙胺类物质实际上未检测到。研究还发现,苯乙胺类物质(包括总量和单个物质含量)的浓度在不同的补充剂中差异很大。核磁共振技术作为一种有效的检测手段,在未来的膳食补充剂和新型苯乙胺类物质的检测分析方面将得到充分地肯定与有效利用。
