顶空固相微萃取-气相色谱-嗅闻-质谱联用分析红香酥梨的香气成分
2020-03-31李美萍李彩林王华瑞张生万尉立刚郭彩霞
李美萍,李彩林,王华瑞,张生万,尉立刚,郭彩霞
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院,山西太原030006)
梨属于蔷薇科苹果亚科。红香酥梨是由中国农业科学院郑州果树研究所以库尔勒香梨与鹅梨杂交选育而成的新品种[1-2],该果耐贮藏、抗旱、早果丰产[3]、果肉细嫩、香浓、多汁、石细胞少[4],因此具有良好的发展前景和研究价值。
目前国内对红香酥梨的研究大多集中在种植栽培贮藏保鲜上[5-8],而对红香酥梨中香气成分的研究相对较少,对其香气成分萃取条件的系统优化以及与嗅觉分析相结合探讨红香酥梨特征香气物质尚未见文献报道。
目前对梨中香气成分的研究主要采用顶空固相微萃取[9-10]、静态顶空[11]、超声波提取[7]、溶剂辅助风味蒸发[12]等方法富集,气相色谱-质谱联用进行分离鉴定。而顶空固相微萃取(headspace solid phase microextraction,HS-SPME)是将萃取、富集、浓缩、进样于一体的样品前处理方法,具有无需有机溶剂、成本低、样品用量少、灵敏度高等优点,是提取香气成分的重要手段。
气相色谱-嗅闻-质谱(gas chromatography-olfactometry-mass spectrometry,GC-O-MS)是将气相色谱的分离能力与人的嗅觉结合起来对香味成分进行鉴定[13],并确定特征香气成分的一种方法,近年来GC-O技术已广泛应用于各种食品香气成分的研究中,Riu-Aumatell 等[14]利用GC-O-MS 技术研究了几种果汁的香气成分,发现该方法可以快速地将调配果汁与天然果汁区分开,Du Xiaofen 等[15]利用GC-O、气味活度值(odor activity value,OAV)和感官评价几种方法相结合对两种亚热带草莓香气特征进行了表征,何聪聪等[12]采用固相微萃取和溶剂辅助风味蒸发两种方法结合GC-O-MS 对无籽西瓜中香气成分进行了分析,由此说明利用仪器分析鉴定食品中香气成分已成为一种趋势。香气成分的种类和含量不仅是影响果实品质的重要因素之一,也是果实评价的基础。随着食品工业对天然风味物质需求的增加,果实香气日益受到关注[16],因此对红香酥梨中香气成分的研究与分析具有重要意义。
本试验以山西运城地区的红香酥梨为材料,采用HS-SPME-GC-O-MS 联用技术对红香酥梨中香气成分进行分析,同时结合相对气味活度值(relative odor activity value,ROAV)对红香酥梨中特征香气成分的贡献进行评价,旨在充分了解红香酥梨香气成分的组成,同时也可以建立红香酥梨香气成分提取、分离、定性和定量的方法,为今后红香酥梨的品质评价提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
红香酥梨:山西省运城市盐湖区百忍堂农场,挑选成熟度一致、无病虫害、无腐烂、无机械损伤的红香酥梨作为试验材料,采后存放于山西省农业科学院农产品贮藏保鲜研究所冷库中(-1±0.5)℃,后熟至其最佳风味期时检测果实香气。
氯化钠(分析纯):天津市光复科技发展有限公司;C7~C40 正构烷烃(色谱纯):上海安谱科学仪器有限公司。
1.2 仪器与设备
7890A-5975C 气相色谱-质谱联用仪:美国Agilent 公司;DF-101S 型集热式恒温加热磁力搅拌器:郑州长城科工贸有限公司;50/30 μm 聚二乙烯苯/碳分子筛/聚二 甲 基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)、65 μm 聚二甲基氧烷/聚二乙烯苯(polydimethylsiloxane/divinylbenzene,PDMS/DVB)、75 μm 碳分子筛/聚二甲基氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)、100 μm 聚 二 甲基硅氧烷(polydimethylsiloxane,PDMS)固相微萃取头:美国 Supelco 公司;ODP3 嗅闻仪:德国 Gestel 公司。
1.3 方法
1.3.1 样品处理
挑选表面完好、无病虫害的新鲜红香酥梨,去梗去心后放入榨汁机中压榨。准确称取新鲜梨浆3.0 g 于20.0 mL 顶空瓶中,加入0.9 g NaCl 并加入磁转子,用带有橡胶隔垫的瓶盖密封,放入集热式恒温加热磁力搅拌器中于60 ℃下平衡30 min,然后将老化好的50/30 μm DVB/CAR/PDMS 固相微萃取头插入顶空瓶中距梨浆1 cm 处萃取45 min,待GC-O-MS 分析。
1.3.2 单因素试验
选取萃取头(50/30 μmDVB/CAR/PDMS;65 μm-PDMS/DVB;75 μm CAR/PDMS;100 μm PDMS)、萃取时间(15、25、35、45、55 min)、样品用量(1、2、3、4、5 g)、萃取温度(30、40、50、60、70 ℃)、平衡时间(10、20、30、40、50 min)、解吸时间(1、2、3、4、5 min)为影响因子,总峰面积和峰个数为响应指标进行单因素试验,平行测定3 次。
1.3.3 响应面试验
在单因素试验的基础上选取样品用量、萃取时间、萃取温度为影响因子,设计三因素三水平的响应面优化试验,设计因素水平编码表见表1。

表1 响应面分析试验因素水平表Table 1 Factors and levels in the response surface design
1.3.4 GC-O-MS 条件
GC 条件:HP-5MS Agilent 色谱柱(30 m×0.25 mm,0.25 μm),进样口温度 250 ℃,载气 He,纯度为99.999 %,流速1 mL/min,不分流进样。程序升温:初温 40 ℃,保持 2 min,以 4 ℃/min 的速率升至 65 ℃,以2 ℃/min 的速率升至 150 ℃,再以 10 ℃/min 升至 300 ℃保持5 min。
MS 条件:电子电离源(electron ionization,EI);电子电离能量70 ev;离子源温度230 ℃;四级杆温度150 ℃;质量扫描范围 m/z 33~500;质谱库为 NIST11;扫描模式为全扫描。
嗅闻方法:ODP3 嗅闻仪的传感线温度240 ℃;补充 N2;接口温度为 180 ℃。
1.3.5 定性和定量分析
在1.3.4 的条件下对处理好的红香酥梨样品进行测定,质谱图通过人工解析并与标准质谱库NIST11进行对照,保留匹配度大于75 的化合物,并在相同色谱条件下对C7~C40 正构烷烃的色谱进行扫描,按文献[17-18]方法计算得到各化合物的保留指数(retention index,RI)与文献[19-20]进行比较,并结合 GC-O共同对红香酥梨中香气成分进行定性。
采用峰面积归一化法对各化合物的相对含量进行定量分析。
1.3.6 红香酥梨特征香气成分的评价
1.3.6.1 相对气味活度值(ROAV)的计算
用各化合物相对含量进行分析,结合各化合物在水中的感觉阈值按下式计算ROAV[21-22]值。

式中:CA为第A 种物质的相对百分含量,%;Cmax为OAV 最高物质的相对百分含量,%;TA为第A 种物质的感觉阈值;Tmax为OAV 最高物质的感觉阈值。
1.3.6.2 香气强度分析
在1.3.4 的条件下由5 位评价员在嗅闻仪检测口对红香酥梨中香气成分进行嗅闻分析,并记录闻到香气成分的保留时间、香味特征及香气强度,香气强度分为 0、1、2、3、4 共 5 个等级,0 表示基本无气味、1 表示气味微弱、2 表示气味中等、3 表示气味明显、4 表示气味非常明显,同一种物质被3 人以上嗅闻到并有相似嗅觉描述和香气强度时可作为试验数据记录下来,取香气强度的平均值作为香气相对强度值,整理结果与文献[23-27]进行对比分析。
1.4 数据处理
每个数据测定3 次,取平均值。采用origin 8.5 软件作图,Design Expert8.0 软件对方法进行优化并进行方差分析和相关性分析,P<0.05 在统计学上具有显著性差异,P<0.01 在统计学上具有极显著性差异。
2 结果与分析
2.1 HS-SPME萃取条件优化
2.1.1 萃取头的选择
不同萃取头对萃取效果的影响见表2。

表2 不同萃取头对萃取效果的影响Table 2 Effect of different SPME fibers on the extraction efficiency
不同萃取头对香气成分的吸附能力不同,选择萃取头时应考虑其涂层材料即萃取头极性[28],由表2 可知,50/30 μm DVB/CAR/PDMS 萃取头吸附得到红香酥梨香气成分的有效峰个数最多,且总峰面积最大,说明该萃取头能较好地吸附红香酥梨中香气成分,因此本试验选取该萃取头用于红香酥梨香气成分的萃取。
2.1.2 样品用量的选择
不同样品用量对萃取效果的影响见图1。
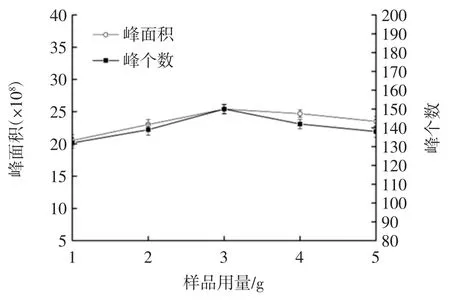
图1 不同样品用量对萃取效果的影响Fig.1 The effect of different sample amount on the extraction
由图1 可知,随着样品用量增加,萃取头所吸附物质的总峰面积和峰个数呈先上升后下降的变化趋势,当样品用量为3 g 时,总峰面积和峰个数均达到最大,这是因为样品用量过低时一些含量低的物质难以被萃取头吸附到,但当样品用量过高时色谱柱的分离效果降低,因此峰个数和峰面积均有所减少。
2.1.3 萃取温度的选择
不同萃取温度对萃取效果的影响见图2。

图2 不同萃取温度对萃取效果的影响Fig.2 The effect of different extraction temperature on the extraction
由图2 可知,随着萃取温度增加,萃取头所吸附物质的峰个数和总峰面积呈上升趋势,当萃取温度为60 ℃时峰个数和总峰面积均达到最大,当温度继续升高,峰个数基本保持不变,总峰面积略微下降,这是由于升高温度,挥发性物质扩散速度变快,萃取头吸附量逐渐上升,但当温度过高时,可能会导致梨汁中的水分在萃取头上凝结成水滴,从而降低了萃取头的吸附效果,同时许多风味物质都是热稳定性差的化合物,温度升高可能会导致它们发生化学变化[29],因此萃取头所吸附香气成分的峰个数和峰面积会略微下降。
2.1.4 萃取时间的选择
不同萃取时间对萃取效果的影响见图3。
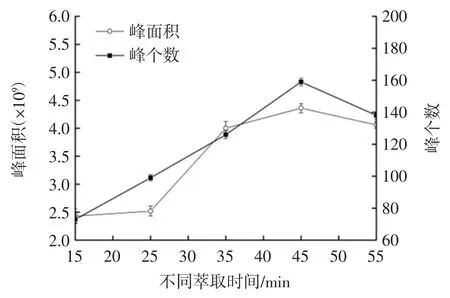
图3 不同萃取时间对萃取效果的影响Fig.3 The effect of different extraction time on the extraction
由图3 可知,随着萃取时间增加,萃取头所吸附香气成分的峰个数和总峰面积呈先上升后下降的变化趋势,这是由于随着萃取时间增加,萃取头吸附量逐渐上升,萃取到的物质浓度增加,当萃取时间过长又会导致萃取头上固有组分流失,从而导致萃取效果变差[29],峰个数和峰面积减少。当萃取时间为45 min 时,峰个数和总峰面积均达到最大,说明此时萃取头的吸附-解吸达到动态平衡。
2.1.5 平衡时间的选择
不同平衡时间对萃取效果的影响见图4。

图4 不同平衡时间对萃取效果的影响Fig.4 The effect of different equilibrium time on the extraction
平衡的作用是使红香酥梨中香气成分转移到顶空瓶顶部,以利于萃取头吸附[30],由图4 可知,平衡时间为30 min 时萃取头所吸附香气成分的峰个数和峰面积达到最大,因此选取的平衡时间为30 min。
2.1.6 解吸时间的选择
不同解吸对萃取效果的影响见图5。

图5 不同解吸时间对萃取效果的影响Fig.5 The effect of different desorption time on the extraction
解吸是使吸附在萃取头上的香气成分在高温条件下分解下来,适当的解吸时间有利于香气成分的解吸,但解吸时间过长会使萃取头上的一些物质分解从而影响试验结果,缩短萃取头使用寿命[31],因此应选择合适的解吸时间,由图5 可知,当解吸时间为4 min 时峰个数和峰面积达到最大,因此选取解吸时间为4min。
2.2 响应面优化试验方案
由于解吸时间和平衡时间对萃取效果影响不太显著,样品用量、萃取时间、萃取温度对萃取效果有较大的影响,因此在单因素试验的基础上,采用Box-Behnken 模型,设计三因素三水平响应面优化试验,响应面试验设计及结果见表3。

表3 响应面试验设计及结果Table 3 Design and results of response surface experiments
2.2.1 模型方程的建立与显著性检验表
对各因素回归拟合后,获得峰个数(Y)的回归方程:
Y=125.80-7.25A+7.38B+12.13C+6.25AB+4.25AC+0.000BC-20.90A2-26.15B2-14.15C2
从方程中二次项系数的值均为负数,可以得知该方程代表的抛物面开口向下,因而具有极大值点,可以进行优化分析,方程一次项系数绝对值大小可以判断各因素对响应值的影响程度,由此可以得出影响萃取红香酥梨香气成分因素的顺序依次为:萃取温度>萃取时间>样品用量。
对模型进行方差分析,结果见表4。
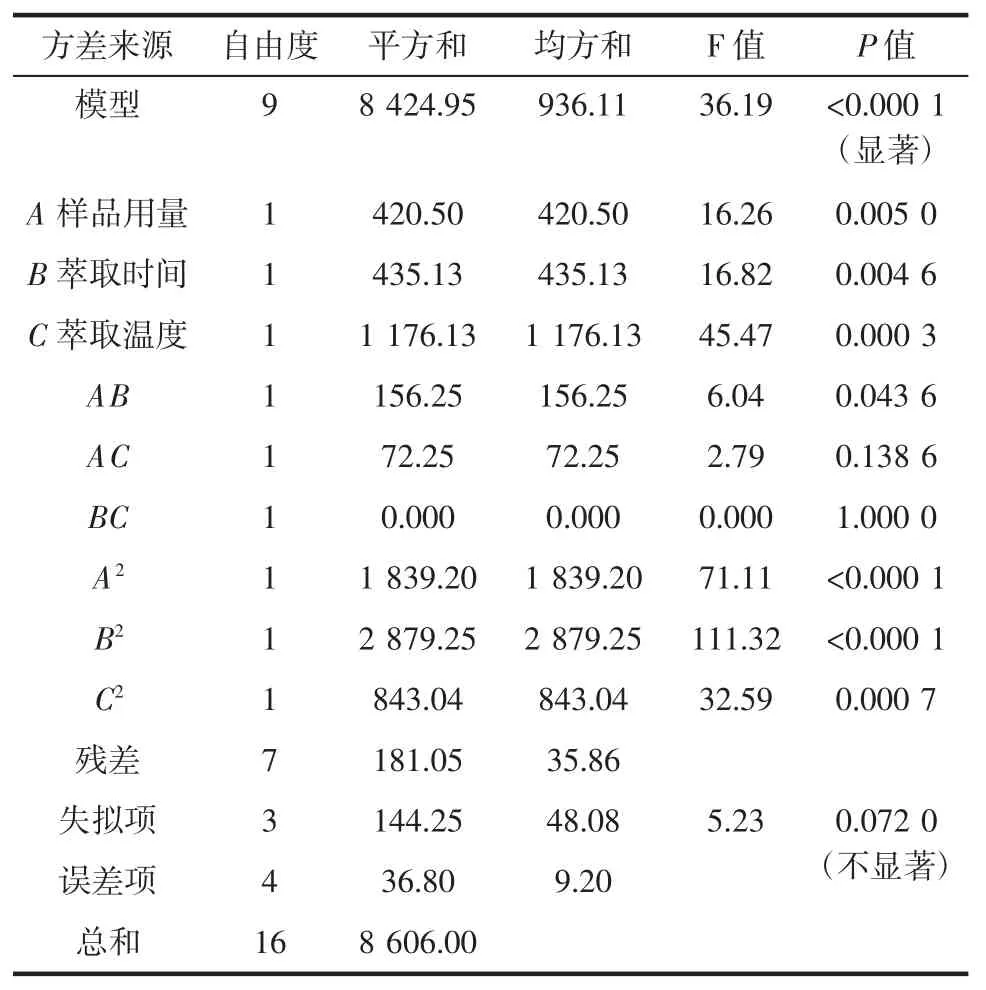
表4 回归方程方差分析Table 4 Variance analysis of regression equation
由表4 可知,试验建立的回归模型P<0.000 1 达到极显著水平,失拟项(P=0.072 0>0.05)不显著,R2值为0.979 0,这个数据说明回归模型和预测值之间有较好的拟合度,因此,利用该模型对红香酥梨香气成分萃取条件进行优化是可靠的。
由表4 还可知,试验建立的回归模型的一次项B、C 的 P 值分别为 0.004 6、0.000 3(P<0.05)因此萃取时间、萃取温度对峰个数的影响是显著的,二次项A2、B2的P 值均小于0.000 1 说明它们对峰个数的影响均极显著,交互项 AB 的 P 值为 0.043 6(P<0.05)说明样品用量和萃取时间的交互作用对峰个数的影响显著,由F 值大小可知对响应值峰个数的影响顺序依次为萃取温度>萃取时间>样品用量,这与前面的结论一致。
2.2.2 各因素交互作用的等高线和响应曲面分析
在其他因素水平编码为0 的条件下,利用Design Expert8.0 软件作各因素相互交互作用的等高线和三维立体响应曲面图,见图6~图8。

图6 样品用量、萃取时间交互作用对峰个数影响的等高线和响应面Fig.6 Contours and response surface that affect the number of peaks as a function of extraction time and sampling volume

图7 样品用量、萃取温度交互作用对峰个数影响的等高线和响应面Fig.7 Contours and response surface that affect the number of peaks as a function of extraction temperature and sampling volume
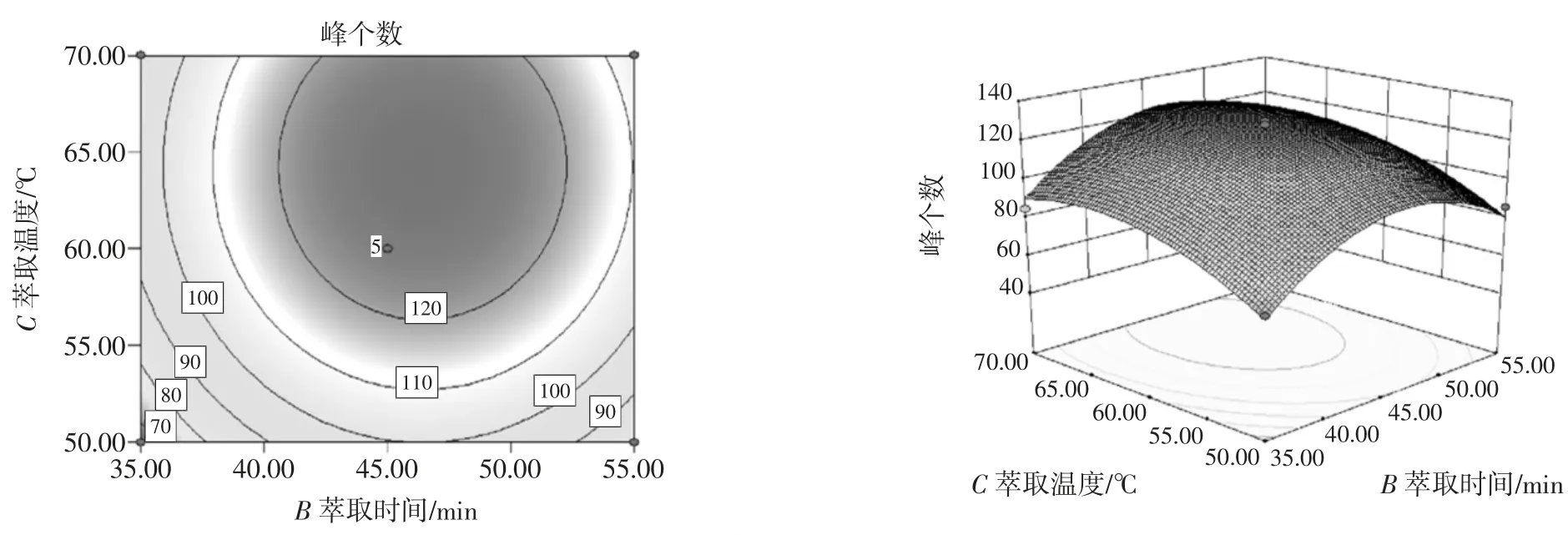
图8 萃取时间、萃取温度交互作用对峰个数影响的等高线和响应面Fig.8 Contours and response surface that affect the number of peaks as a function of extraction temperature and extraction time
图6 是在萃取温度60 ℃的条件下,样品用量和萃取时间对峰个数影响的等高线和响应面,随着样品用量和萃取时间的增加,萃取得到的有效峰个数呈先上升后下降趋势,且由响应曲面的坡度较陡和等高线呈椭圆形可知样品用量与萃取时间的交互作用对峰个数影响显著,当样品用量为2.89 g、萃取时间为46.27 min时萃取得到的有效峰个数最多。
图7 是在萃取时间45 min 的条件下,样品用量和萃取温度对峰个数影响的等高线和响应面,随着样品用量的增加,萃取得到的有效峰个数呈先上升后下降的趋势,随着萃取温度的增加,萃取得到的有效峰个数呈先上升后基本不变的趋势,这与单因素的结果一致,当样品用量为2.89 g,萃取温度为64.11 ℃萃取得到的有效峰个数最多。
图8 是在样品用量为3 g 的条件下,萃取时间和萃取温度对峰个数影响的等高线和响应面,由等高线呈圆形可知,萃取时间和萃取温度的交互作用对峰个数影响不显著,当萃取温度为64.11 ℃、萃取时间为46.27 min 时萃取得到的有效峰个数最多。
2.2.3 最佳工艺条件的确定与验证
根据响应面模型预测得到萃取红香酥梨香气成分的最佳条件为:样品用量2.89 g、萃取温度64.11 ℃、萃取时间46.27 min,在此条件下得到峰个数的预测值为129,考虑到试验的可行性,将萃取条件调整为样品用量2.9 g,萃取温度64 ℃,萃取时间46 min,在此条件下进行3 次验证试验,结果显示萃取得到的峰个数为127,实测值是预测值的98.45%,表明此萃取条件是可行的。
2.3 红香酥梨香气成分分析
按1.3.1 的方法对红香酥梨样品进行处理,按1.3.4 的条件对其进行测定,其香气成分种类及含量见表5。
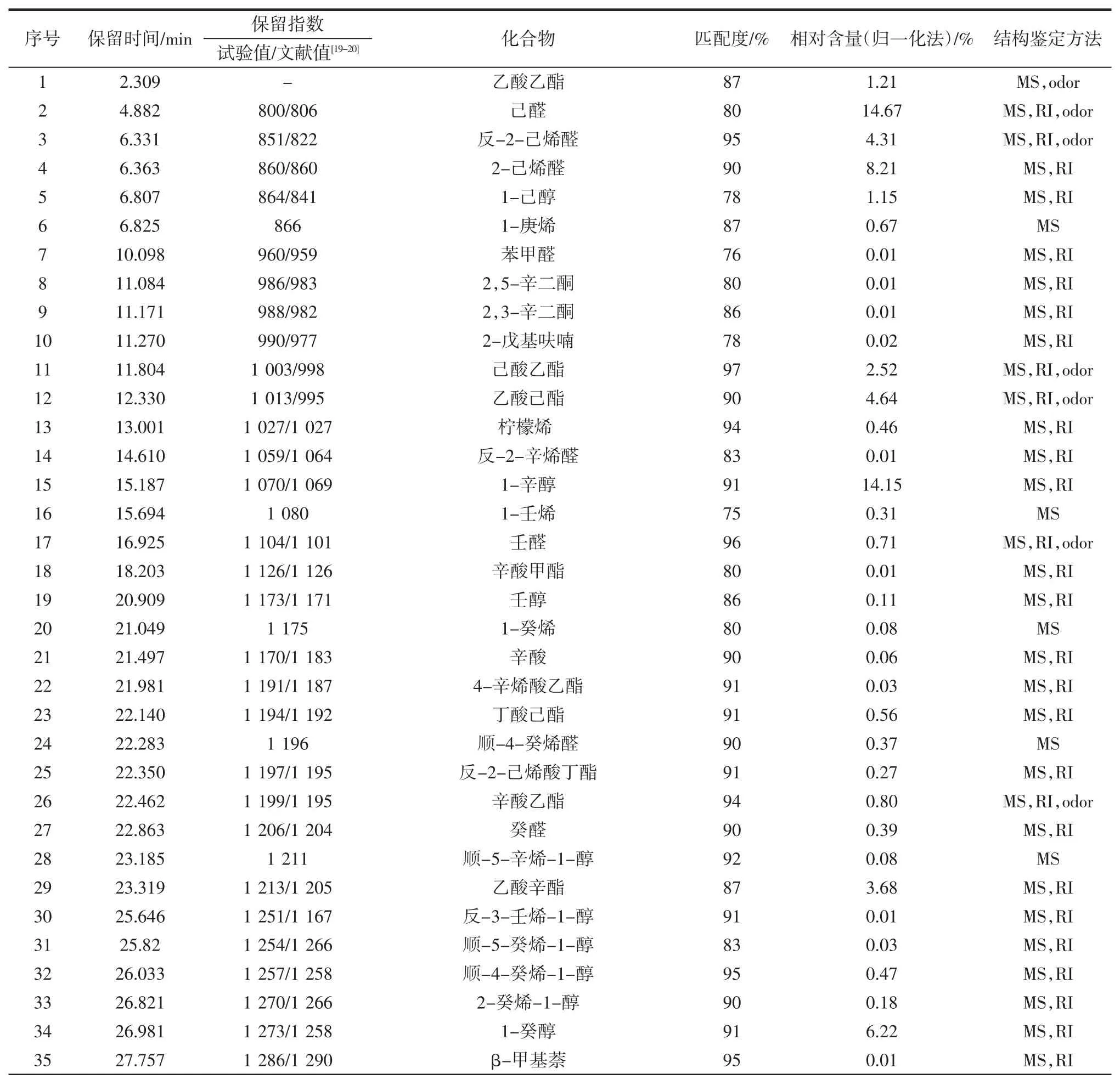
表5 HS-SPME-GC-MS 分析红香酥梨香气成分的结果Table 5 HS-SPME-GC-MS analytical results of aroma components of red fragrant pear

续表5 HS-SPME-GC-MS 分析红香酥梨香气成分的结果Continue table 5 HS-SPME-GC-MS analytical results of aroma components of red fragrant pear
由表5 可知,经GC-MS 分析从红香酥梨中共分离出127 种化合物,确定结构的有76 种,占总峰面积的97.36 %,且酯类、醛类、醇类和萜烯类化合物所占比例较大,其中酯类化合物有18 种(相对含量为29.14%)、醛类化合物有9 种(相对含量为28.87%)、醇类化合物有13 种(相对含量为22.62%)、萜烯类化合物有12 种(相对含量为14.14 %)、酮类化合物有4种(相对含量为0.32%)、烃类化合物有11 种(相对含量为1.37%)、其他类化合物有9 种(相对含量为0.9%)。这些香气成分中所占比例大于1%的化合物有乙酸乙酯(1.21 %)、己醛(14.67 %)、反-2-己烯醛(4.31%)、2-己烯醛(8.21%)、1-己醇(1.15%)、己酸乙酯(2.52%)、乙酸己酯(4.64%)、1-辛醇(14.15%)、乙酸辛酯(3.68 %)、1-癸醇(6.22 %)、(E,Z)-2,4-癸二烯酸乙酯(8.75 %)、癸酸乙酯(2.98 %)、ɑ-法尼烯(11.97%)、己酸辛酯(1.42%)、丁酸辛酯(1.44%)。
在红香酥梨中,酯类化合物共鉴定出18 种,所占比例较大,酯类化合物是以氨基酸作为前体物质,在氨基酸代谢过程中产生的[32],它对水果的宜人香气起到重要贡献。本试验鉴定出的酯类主要有乙酸乙酯、乙酸己酯、己酸乙酯、乙酸辛酯、癸酸乙酯、己酸辛酯、丁酸辛酯、(E,Z)-2,4-癸二烯酸乙酯,这些酯类均呈现水果香味,从而可以看出酯类化合物对红香酥梨香味起着非常重要的作用,陈计峦[26]文章中也曾指出酯类化合物存在于水果果皮和果肉中,因此它赋于梨果皮、果肉特有的甜香味。
醛类、醇类和酮类化合物主要来源于脂肪酸的代谢,本试验共鉴定出9 种醛类化合物,主要为己醛、反-2-己烯醛、2-己烯醛等,醇类化合物13 种,主要是己醇、辛醇和癸醇等,其中己醛、反-2-己烯醛和2-己烯醛呈青草香味,己醇、辛醇和癸醇均呈水果香味,且己醛、反-2-己烯醛和己烯醛是使水果产生青香香气的重要成分[32],水果中青香香气的产生主要来自C6 和C9 的醛类和醇类物质,它们是以脂肪酸为前体物质经脂氧合酶(lipoxygenase,LOX)途径生成氢过氧化物后经氧化、裂解及脱氢作用转化生成的[33]。
萜烯类化合物是构成果实香气的重要成分,植物合成的萜烯类挥发性化合物有半萜、单萜、倍半萜、二萜等[26],本试验共鉴定出萜烯类化合物13 种,其主要成分是ɑ-法尼烯,ɑ-法尼烯是一类具有较强香气的天然化合物[25],构成了梨的新鲜萜烯类花香香韵[27]。
2.4 红香酥梨特征香气成分分析
根据嗅闻结果所得的红香酥梨香气成分与文献[23-27]的描述进行对比,并利用各物质香气成分特征及强度绘制红香酥梨特征香气成分雷达图见图9,同时结合各香气成分的相对强度值和ROAV 值确定红香酥梨特征香气成分,结果见表6。
由表6 和图9 可知,利用气相-嗅闻共检测到11种风味物质,包括酯类7 种,醛类3 种,萜烯类1 种,从嗅闻口闻到的香气特点包括果香、青草香、花香、梨香和甜香。由表6 的强度数据(强度为3 或4)可知,气味强烈的有己醛(青草香)、己酸乙酯(水果香)、癸酸乙酯(果香、梨香)和(E,Z)-2,4-癸二烯酸乙酯(梨香),因此初步分析这些化合物对红香酥梨香气成分贡献最大,是起主要作用的风味成分。

图9 红香酥梨主要香气成分分布雷达图Fig.9 Radar diagram of the main aroma compounds of red fragrant pear

表6 红香酥梨香气成分闻香特点及ROAV 值Table 6 Aroma characteristics and ROAV of red fragrant pear
为进一步探究这11 种风味成分对红香酥梨香气的贡献,结合已有文献报道化合物的阈值计算其ROAV 值,当ROAV≥1 时说明该化合物是红香酥梨的关键风味化合物,当0.1≤ROAV≤1 时说明该化合物对红香酥梨的总体风味起到重要的修饰作用[22],由表6 和图9 可知,在检测到的11 种物质中有4 种化合物的ROAV 值大于1,分别为己醛、乙酸己酯、己酸乙酯和(E,Z)-2,4-癸二烯酸乙酯,说明他们对红香酥梨香气有关键性贡献作用,孙宝国[27]文章中也表明(E,Z)-2,4-癸二烯酸乙酯和乙酸己酯是梨特征性香味的重要挥发性成分。0.1≤ROAV≤1 的化合物有4 种,分别是乙酸乙酯(果香)、反-2-己烯醛(青草香)、壬醛(玫瑰花香)和癸酸乙酯(梨香),他们所呈现的果香、青草香和花香对红香酥梨香气起到一定的补充作用,ROAV≤0.01 的物质有辛酸乙酯,辛酸乙酯由于其阈值较高,因此对红香酥梨整体风味的贡献不大。而ɑ-法尼烯所呈现的花香味对红香酥梨香气也起到一定的修饰作用,研究表明ɑ-法尼烯是梨皮的主要挥发性物质[34],对梨的清新香味起主要作用。
3 结论
本研究通过采用HS-SPME-GC-O-MS 联用技术对红香酥梨香气成分的种类、含量进行了较全面的分析,并系统的建立了红香酥梨香气成分的分析方法:HP-5MS 色谱柱、样品用量 2.9 g、50/30 μm DVB/CAR/PDMS 固相微萃取头、萃取时间46 min、萃取温度64 ℃、平衡时间30 min、解吸时间4 min,在此条件下共检出127 种物质,确定结构的76 种,占总峰面积的97.36%。同时结合各香气物质的ROAV 值和相对强度值对红香酥梨香气物质的贡献进行了评价,结果显示红香酥梨的特征香气成分为乙酸乙酯、己酸乙酯、乙酸己酯、(E,Z)-2,4-癸二烯酸乙酯、壬醛、己醛、反-2-己烯醛、辛酸乙酯、癸酸乙酯、ɑ-法尼烯、邻苯二甲酸二异丁酯。本试验结果为红香酥梨香气成分研究及开发利用提供了一定的理论依据。
