人参茎叶多糖提取工艺的研究
2020-03-31孙晓玲
孙晓玲
(长春职业技术学院食品与生物技术分院,吉林长春130033)
人参为五加科人参属植物,具有安神、治劳伤虚损、食少、倦怠、补气固脱、健脾益肺、宁心益智、养血生津及久虚不复、气血津液不足之症的功效[1]。人参中含有人参皂苷、氨基酸和多肽、多糖类、维生素、挥发油和17 种以上微量元素等功能性成分[2]。有科学研究表明,人参可以调节中枢神经稳定、促进脑垂体对能量分子的吸收,提高心脏功能、降低血糖指标、增强人体的免疫力以及抗癌抗氧化的作用[3-4]。我国是世界上最重要的人参产出国和输出国之一,近年来,在有效成分分离与提纯、新产品的研发等方面都取得了较大进展。
人参多糖作为人参中重要的活性成分,不仅具有抗菌、抗肿瘤、抗衰老等功效,还具有降血糖、降血压、降脂、抗炎等生物活性[5]。为了实现对人参资源的综合利用,避免资源浪费,许多学者对人参茎叶的化学成分进行大量研究,尽管茎叶中多糖的含量与根部相比较低,但多糖成分及种类大致相同,所起到的药理作用也非常相似[6]。本试验对人参茎叶中的粗多糖的提取工艺进行研究,采用水提醇沉法分离提取人参茎叶中的粗多糖,确定最佳提取工艺参数,为人参茎叶多糖的提取方法提供科学依据。
1 材料与方法
1.1 材料与试剂
人参茎叶:吉林省长白山;硫酸亚铁铵、邻二氮菲、柠檬酸、柠檬酸钠:分析纯,天津科密欧化学试剂有限公司。
1.2 仪器与设备
754 紫外可见分光光度计:天益化工材料有限公司;FA2004W 电子天平:上海精密科学仪器有限公司;HH-6 数显恒温水浴锅:金坛市科析仪器有限公司;SC-3610 高速离心机:安徽中科中佳科学仪器有限公司;RB-552B 旋转蒸发仪:上海亚荣生化仪器厂。
1.3 方法
1.3.1 人参茎叶粗多糖制备工艺流程
人参茎叶→干燥→粉碎→过40 目筛→脱脂→水浴提取→浓缩→加乙醇→离心→取沉淀→真空干燥→人参茎叶多糖
1.3.2 水提醇沉淀法
称取20.0 g 人参粉末,加入10 倍量的蒸馏水,在90 ℃下提取5 h,过滤,残渣再加5 倍量的水提取1 h,把两次过滤的滤液合并,浓缩至50 mL,加入与浓缩后的药液同体积的石油醚萃取2 次脱脂,再加入一定浓度的乙醇,静置12 h,真空泵抽滤,将滤液于高速离心机中以3 000 r/min,离心30 min,得上清液待测。
1.3.3 溶液的制备
葡萄糖标准溶液的制备:准确称取在105 ℃下干燥至恒重的分析纯葡萄糖10.00 mg,用蒸馏水溶解后定容于100 mL 容量瓶中,配制成浓度为0.1 mg/mL 的葡萄糖标准溶液备用。
苯酚溶液的制备:将苯酚试剂放在60 ℃水浴中,待有少量液体出现时,吸取5 g 至100 mL 容量瓶中,加水溶解,定容,摇匀,再转入棕色瓶中,在4 ℃下保存备用。
1.3.4 标准曲线的绘制
用移液管准确量取葡萄糖标准溶液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分别置于 50 mL 容量瓶中,加蒸馏水至刻度。分别加入5%苯酚3 mL、15 mL 浓硫酸,摇匀,放置10 min 后于40 ℃水浴加热10 min,取出后冷水浴5 min,在波长490 m 下测定吸光度,同时做空白对照,以葡萄糖标准液质量浓度(mg/mL)为横坐标,相应的吸光度(A)为纵坐标绘制标准曲线。
1.3.5 多糖含量及提取率的测定
采用苯酚-硫酸法[7]。多糖提取率/%=多糖质量(g)/原料质量(g)×100
1.3.6 单因素试验设计
1.3.6.1 提取温度对人参茎叶多糖提取率的影响
以干燥粉碎后的人参茎叶为原料,料液比1∶20(g/mL),提取时间 4 h,pH6,提取温度 50、60、70、80、90、100 ℃,最后测定多糖的提取率。
1.3.6.2 提取时间对人参茎叶多糖提取率的影响
以干燥粉碎后的人参茎叶为原料,料液比1∶20(g/mL),提取温度 80 ℃,pH 6,提取时间 1、2、3、4、5、6、7 h,最后测定多糖的提取率。
1.3.6.3 料液比对人参茎叶多糖提取率的影响
以干燥粉碎后的人参茎叶为原料,选择提取温度80 ℃,提取时间 4 h,pH 6,料液比 1 ∶5、1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL),最后测定多糖的提取率。
1.3.6.4 pH 值对人参茎叶多糖提取率的影响
以干燥粉碎后的人参茎叶为原料,料液比1∶20(g/mL),提取温度 80 ℃,提取时间 4 h,pH3.0、4.0、5.0、6.0、7.0、8.0、9.0,最后测定多糖的提取率。
1.3.7 正交试验设计
根据单因素试验结果,以人参茎叶提取率为指标,分别考察提取温度、提取时间、料液比、pH 值对人参茎叶多糖提取率的影响,设计四因素三水平正交试验,确定最佳工艺参数,试验因素水平见表1。

表1 正交试验设计的因素与水平Table 1 Factor codes and levels of the orthogonal test
2 结果与分析
2.1 人参茎叶多糖提取的单因素试验
2.1.1 提取温度对人参茎叶多糖提取率的影响
提取温度对多糖提取率的影响见图1。
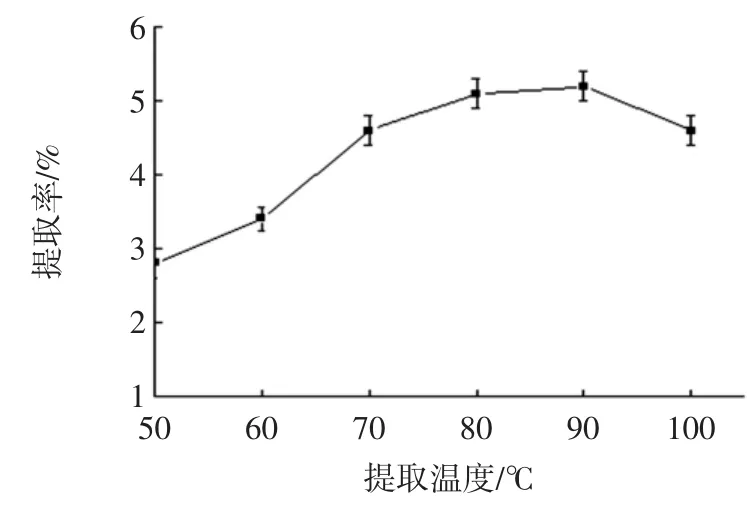
图1 提取温度对多糖提取率的影响Fig.1 Effects of extraction temperature on extraction rate of polysaccharide
由图1 可知,当提取温度在 50 ℃~90 ℃之间,多糖的提取率随着温度的升高而增加,温度超过90 ℃时,提取率出现下降。这是因为温度升高,溶剂的渗透能力和溶解能力提高,分子动能增加,使原料中的多糖更有效地溶出,提取率不断提高;但温度达到100 ℃后,料液中的多糖分子受到破坏,多糖含量减少[8]。因此,初步确定提取温度为90 ℃。
2.1.2 提取时间对人参茎叶多糖提取率的影响
提取时间对多糖提取率的影响见图2。
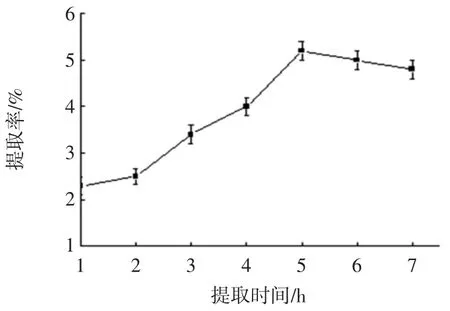
图2 提取时间对多糖提取率的影响Fig.2 Effects of extraction time on extraction rate of polysaccharide
由图2 可知,随着提取时间的延长,多糖的提取率逐渐增加,但是时间在5 h 后,提取率出现略微下降。提取时间较短时,产物不充分溶解;时间过长,大分子多糖容易发生断裂,在后期处理时出现损失现象,影响提取效果[9]。因此,提取时间以5 h 为宜。
2.1.3 料液比对人参茎叶多糖提取率的影响
料液比对多糖提取率的影响见图3。
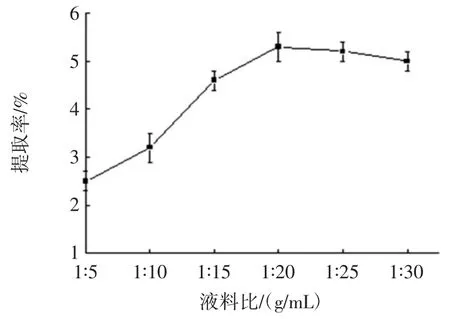
图3 料液比对多糖提取率的影响Fig.3 Effects of material-to-water ratio on extraction rate of polysaccharide
由图3 可以看出,随着溶剂的不断增加,多糖的提取率也不断升高,当料液比在 1 ∶20(g/mL)~1 ∶23(g/mL)之间时,提取率开始缓慢下降。这是因为在热量一定情况下,固相与液相之间存在浓度差,溶剂量越多,人参茎叶细胞内外的多糖浓度梯度就越大,使多糖扩散到溶剂里的含量增加,继续增大溶剂量,多糖提取率随之降低[9-10]。因此初步确定料液比的最适比例为1 ∶20(g/mL)。
2.1.4 pH 值对人参茎叶多糖提取率的影响
pH 值对多糖提取率的影响见图4。

图4 pH 对多糖提取率的影响Fig.4 Effects of pH on extraction rate of polysaccharide
从图4 可以看出,随着pH 值的增大,多糖提取率呈现出先上升后下降的趋势,当pH 值达到6.0 以后提取率开始下降,原因可能是提取液在弱酸条件下,有利于原料中多糖的溶出,当提取液呈碱性时,一些不利于多糖的成分被提出[11],进而影响了多糖的提取率,因此提取的pH 值选择6.0 为佳。
2.2 正交试验设计结果
根据单因素试验设计结果,选用L9(34)正交试验表进行试验,试验安排及结果见表2。

表2 正交试验结果与极差分析Table 2 Results of the orthogonal test
由表2 可知,各因素对人参茎叶多糖提取率影响程度的主次顺序为A>C>B>D,即提取温度为主要影响因素,其次为料液比,再次为提取时间,pH 值影响最小,最佳方案为A3B1C2D1,即提取温度90 ℃、提取时间 4 h、料液比 1 ∶25(g/mL)、pH5.0。方差分析结果见表3。

表3 方差分析结果Table 3 Analysis of variance
表3 可知,提取温度对人参茎叶多糖提取率有显著影响,其余因素影响不大。采用水提醇沉法提取人参茎叶多糖时,为达到最佳提取效果,需要重点控制提取温度。
2.3 验证试验
在最佳工艺条件下提取人参茎叶多糖工艺的验证试验,其结果见表4。

表4 最佳工艺验证试验Table 4 Verification test for the optimal processing
试验结果表明,在最佳工艺条件下,人参茎叶多糖的提取率为5.64%。
3 结论
本研究采用水提醇沉法提取人参茎叶多糖,通过单因素试验、正交试验及验证试验保证了试验的精确性。提取温度、提取时间、料液比、pH 值是提取多糖的主要因素,经过优化试验,测得最优工艺条件为:提取温度 90 ℃、提取时间 4 h、料液比 1 ∶25(g/mL)、pH5.0。本试验经过优化的工艺参数为人参资源得到合理的开发与利用提供了一定的理论依据。
