鹿角灵芝有效成分提取工艺研究
2020-03-30韦芳娥
韦芳娥


摘要 为了有效提取鹿角灵芝中的主要有效成分,本文研究了提取鹿角灵芝中多糖和三萜等主要活性成分的工艺技术,建立了灵芝提取生产线,以延长灵芝的产业链,提高灵芝的附加值,为灵芝有效成分的产业化生产提供科学参考。
关键词 鹿角灵芝;多糖;三萜;超声波提取
中图分类号 R284.2 文献标识码 A
文章编号 1007-5739(2020)03-0217-02 开放科学(资源服务)标识码(OSID)
鹿角灵芝(Ganoderma lucidum(Leyss.Ex Fr.)karst)作为灵芝属的一种,近年来备受重视,在化学、药理和临床等领域均有大量研究。有研究表明,鹿角灵芝具有调节免疫、保肝、抗肿瘤和抗衰老等多种活性[1-3]。鹿角灵芝的主要药效成分为多糖类和三萜类。有学者研究发现,鹿角灵芝中β-高分子蛋白多糖的含量较普通灵芝高2~5倍,并且含有能激活巨噬细胞活性,进一步增强免疫力的LPS,干燥品中LPS和β-高分子蛋白多糖的总量高达43%[2,4]。姜 旭等[5]研究发现,鹿角灵芝中含(1-3)-b-D葡糖基的多糖对ICR小鼠的S180有明显的抑制作用,其抗肿瘤活性受支链数目、分子量和构型的影响;刘研新等[6]通过建立小鼠Lewis肺癌模型,证明鹿角灵芝胶囊在试验小鼠体内、体外具有抗肿瘤活性,对顺铂所造成的肾损伤有拮抗作用。目前,国内关于鹿角灵芝有效成分提取的研究不多[7-9]。为了有效提取鹿角灵芝中的主要有效成分,本文研究了提取鹿角灵芝中的多糖和三萜等主要活性成分的工艺技术,以建立提取生产线、延长产业链、提高附加值,并为鹿角灵芝有效成分的产业化生产提供科学参考。
1 材料與方法
1.1 试验材料
1.1.1 试验仪器。TU-1901紫外可见分光光度计(北京普析通用仪器责任有限公司)、101A-2电热鼓风干燥箱(功率4 kW,300 ℃,上海实验仪器厂有限公司)、CP225D电子天平(d=0.01 mg,德国赛多利斯股份公司)、KQ5200B超声波清洗器(40 kHz,昆山市超声仪器有限公司)、HH-4数显恒温水浴锅(常州国华电器有限公司)、XW-80A微型旋涡混合仪(上海泸西分析仪器厂)、DFY-600摇摆式高速万能粉碎机(温岭市林大机械有限公司)、TDL-80-2B低速台式离心机(上海安亭科学仪器厂)、RE52AA型旋转蒸发器(上海亚荣生化仪器厂)。
1.1.2 药品与试剂。鹿角灵芝采自桂林大野领御生物科技有限公司种植基地,经广西中医药研究院何开家主任药师鉴定为Ganoderma lucidum(Leyss.Ex Fr.)karst。试剂包括无水葡萄糖对照品(批号110833-201205,中国食品药品检定研究院)、齐墩果酸对照品(批号100454-200501,中国食品药品检定研究院)、无水乙醇(分析纯,批号20160913,国药集团化学试剂有限公司)、乙醇(分析纯,批号20161111,广东光辉科技股份有限公司)、浓硫酸(分析纯,批号20120317,廉江市爱廉化试剂有限公司)、蔥酮(化学纯,批号20130426,国药集团化学试剂有限公司)、苯酚(化学纯,批号20110416,广州新建精细化工厂)、香草醛(化学纯,批号20160722,国药集团化学试剂有限公司)、冰乙酸(分析纯,批号20161108,天津福晨化学试剂厂)、高氯酸(分析纯,批号20110617,上海金鹿化工有限公司)、乙酸乙酯(分析纯,批号1601101上海申博化工有限公司),水为纯化水。
1.2 试验方法
1.2.1 灵芝多糖含量的测定方法。
(1)葡萄糖标准溶液的配制。精密称取适量于105 ℃干燥至恒重的无水葡萄糖对照品,精密称定,加水制成0.1 mg/mL的葡萄糖溶液,作为标准溶液。
(2)葡萄糖标准曲线的绘制。精密量取葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于10 mL具塞试管中,各加水至2.0 mL,迅速精密加入硫酸蔥酮溶液(精密称取蔥酮0.1 g,加硫酸100 mL使之溶解,摇匀)6 mL,立即摇匀,放置15 min后,立即置于冰浴中冷却15 min,取出,以相应的试剂为空白,采用紫外-可见分光光度法,在625 nm波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标,绘制标准曲线。结果表明,对照品浓度C在0~15.3 μg/mL范围内成良好的线性关系,回归方程为A=0.052C-0.017 6,相关系数r=0.999 1。
(3)供试品溶液的配制。取灵芝粉末2.0 g,精密称定,按不同条件分别进行超声、浸提方法提取灵芝多糖,趁热滤过。用少量热水洗涤滤器和滤渣,合并滤液及洗涤液,减压浓缩至5 mL,边搅拌边缓慢滴加乙醇75 mL,摇匀。在4 ℃条件下放置12 h,离心,弃去上清液,沉淀物用热水溶解并转移至50 mL量瓶中,放冷;加水至刻度线,摇匀,取溶液适量,离心;精密量取上清液3 mL置于25 mL量瓶中,加水至刻度线,摇匀,作为灵芝多糖供试品溶液。
(4)测定方法。精密量取供试品溶液2 mL,置于10 mL具塞试管中,按照标准曲线制备项下的方法,同法操作,以空白试剂作为参比,在波长625 nm处测定吸光度,按标准曲线回归方程计算样品中多糖的含量。
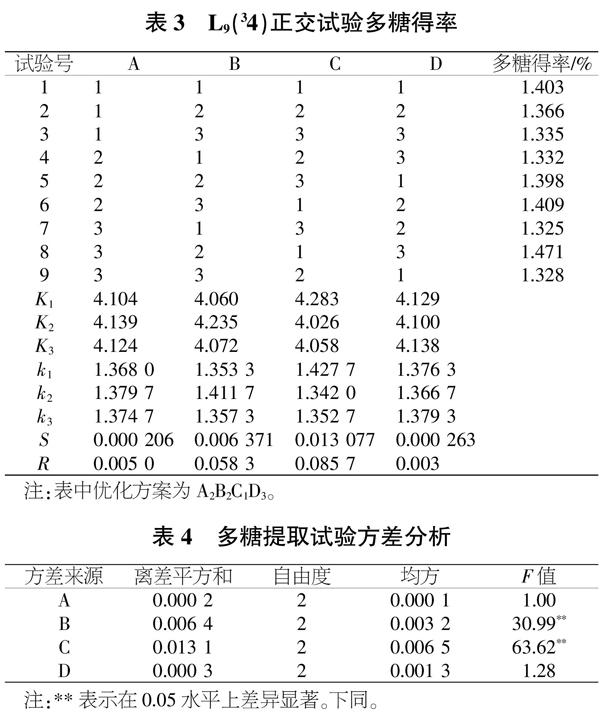
1.2.2 鹿角灵芝多糖提取正交试验。通过单因素试验结果考察可确定料液比、提取时间、提取温度、超声功率为超声法提取鹿角灵芝多糖的主要因素,以多糖得率为指标,对鹿角灵芝多糖的最佳提取方法进行优化。各试验因素的水平见表1。
1.2.3 灵芝三萜的含量测定方法。
(1)齐墩果酸对照样品溶液的制备。取齐墩果酸对照样品适量,精密称定,加甲醇制成0.2 mg/mL的溶液。
(2)齐墩果酸标准曲线的绘制。精密量取对照样品溶液 0.1、0.2、0.3、0.4、0.5 mL,分别置于15 mL具塞试管中,挥干,放冷。精密加入新配制的香草醛冰醋酸溶液(精密称取香草醛0.5 g,加冰醋酸使溶解成10 mL)和0.2 mol/L的高氯酸0.8 mL,摇匀,在70 ℃水浴中加热15 min,立即置冰浴中冷却5 min,取出。精密加入乙酸乙酯4 mL,摇匀,以相应试剂为空白,采用紫外-可见分光光度法,在546 nm波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线。结果对照品浓度C在0~20.2 μg/mL范围内成良好的线性关系,回归方程为A=0.050 7C-0.016 2,相关系数r=0.999 3。
(3)供试样品溶液的制备。取鹿角灵芝多糖提取后滤渣干燥物约2 g,精密称定。按不同条件分别进行超声、浸提方法提取灵芝三萜,过滤,用少量乙醇洗涤滤器和滤渣,合并滤液及洗涤液,置于100 mL量瓶中,加乙醇至刻度线,摇匀,作为灵芝三萜供试品溶液。
(4)测定法。精密量取供试品溶液0.2 mL,置于15 mL具塞试管中,按照标准曲线制备项下的方法操作,以空白试剂作为参比,于546 nm波长处测定吸光度,按标准曲线回归方程计算样品中三萜的含量。
1.2.4 鹿角灵芝三萜提取正交试验。通过单因素试验结果考察确定乙醇浓度、料液比、提取时间、提取温度为超声法提取鹿角多糖提取后滤渣中灵芝三萜的主要因素,以三萜得率为指标,设计4因素3水平的正交试验,考察上述4个因素的用量水平,对灵芝三萜的最佳提取方法进行优化。各试验因素的水平见表2。
2 结果与分析
2.1 鹿角灵芝多糖提取正交试验
由表3可知,鹿角灵芝多糖得率最佳配比条件为A2B2C1D3。由表4可知,正交试验分析结果为RC>RB>RD>RA,即影响鹿角灵芝多糖得率的因素顺序为提取温度(C)>提取时间(B)>超声功率(D)>料液比(A)。料液比、提取时间、提取温度和超声功率对试验结果均有影响,其中提取温度(C)、提取时间(B)显著影响鹿角灵芝多糖得率。为了证实最优配比条件的可靠性,进行3次重复对比试验,以验证结果的稳定性。3次重复试验中鹿角灵芝多糖得率的平均值为1.483%,相对标准偏差为0.98%。
2.2 鹿角靈芝三萜提取正交试验
由表5可知,鹿角灵芝三萜得率最佳配比条件为A2B2C3D1。由表6可知,正交试验分析结果为RA>RC>RD>RB,即影响鹿角灵芝三萜得率的因素顺序为乙醇浓度(A)>提取时间(C)>提取温度(D)>料液比(B)。乙醇浓度、料液比、提取时间和提取温度对试验结果均有影响,其中乙醇浓度(A)、提取时间(C)显著影响鹿角灵芝三萜得率。为了证实最优配比条件的可靠性,进行3次重复对比试验,以验证结果的稳定性。3次重复试验中鹿角灵芝三萜得率平均为0.884%,相对标准偏差为0.89%。
3 结论与讨论
本研究分别以多糖得率、三萜得率为指标,通过单因素试验研究了超声波法提取灵芝有效成分的因素,并采用正交试验法对提取方法进行了优化。根据最优化分析,鹿角灵芝中多糖最佳提取工艺条件为灵芝粉碎度为60目、料液比为1∶30,超声功率为400 W、提取温度65 ℃、提取时间为50 min。此提取工艺条件下,鹿角灵芝中多糖提取得率为1.483%。鹿角灵芝中三萜最佳提取工艺条件为乙醇浓度75%、料液比为1∶25、提取温度50 ℃、提取时间为40 min。此提取工艺条件下,多糖提取后滤渣中三萜得率为0.884%。对最佳工艺进行了重复性验证,工艺条件可靠,稳定性较好。本试验中,多糖提取采用的原料为药材鹿角灵芝,三萜提取采用的原料为多糖提取后所剩滤渣。根据试验数据分析,多糖提取后所剩下的滤渣中仍有60%以上的三萜类化合物可以利用。按设计的最佳工艺方法,可将鹿角灵芝药材中多糖的大部分成分提取出来,且可将滤渣中的三萜类化合物完全提取出来,三萜提取转移率达到63.38%。该提取方案合理可行,灵芝利用度较高,为今后灵芝有效成分的连续产业化生产提供了一条合理、高效的工艺路线,实现了药材资源综合全面且有效的利用。
鹿角灵芝有效成分生产工艺为采用超声法连续提取灵芝多糖和灵芝三萜,先水提灵芝多糖,后醇提灵芝三萜。鹿角灵芝采用优化的超声提取方法进行灵芝多糖干膏的制备,干膏得率均在10%以上,干膏中多糖的含量均在14%以上,较原药材提取的多糖提高了9.5%左右;采用鹿角灵芝多糖提取后滤渣作为原料,按优化的超声提取方法进行灵芝三萜干膏的制备,干膏得率均在4.0%以上,干膏中三萜的含量均在18.0%以上,较原药材提取的三萜提高了15.0%左右。此提取方法生产的灵芝提取物含量稳定,设计的提取工艺可为今后的产业化生产提供科学参考。
采用超声法提取灵芝有效成分具有提取温度低、时间短、效率高、工艺简单等特点,适合工业化生产,可作为灵芝多糖和灵芝三萜工业化生产提取的一种高效方法,具有一定的应用前景。
4 参考文献
[1] 刘研新,余彦,王蓓,等.鹿角灵芝胶囊的抗肿瘤活性及对顺铂所致肾损伤的保护作用[J].华西药学杂志,2008,23(5):564-566.
[2] 松本大吾.鹿角灵芝的抗癌作用及放射线防护作用[J].国外医学,2005(4):245-246.
[3] 崔潇瑜.鹿角灵芝超微粉与细粉主要成分的溶出及对小鼠免疫调节作用的研究[D].福州:福建农林大学,2012:10.
[4] 河野武平.药用きのとβ-グルカン含有量鹿角芝の栽培程かり检する[J].シリズ「健康の科」芝健康本,2002(2):101-103.
[5] 姜旭.对灵芝未成熟和成熟的鹿角型子实体的化学和生物评价[J].国外医学,2005,27(2):111-112.
[6] 刘研新,余彦,王蓓,等.鹿角灵芝胶囊的抗肿瘤活性及对顺铂所致肾损伤的保护作用[J].华西药学杂,2008,23(5):564-566.
[7] 李静,邓毛程,王瑶,等.鹿角灵芝提取三萜酸的研究[J].四川理工学院学报(自然科学版),2014,27(6):9-12.
[8] 覃海元,潘嫣丽,覃梅珍.热水与超声波提取鹿角灵芝多糖工艺比较研究[J].中国食品添加剂,2011(3):91-95.
[9] 王友芳,纪莎,何丹鸿,等.星点设计-效应面法优化鹿角灵芝微乳超声提取工艺[J].中国现代应用药学,2015,32(10):1198-1202.
