益生菌发酵对红枣汁抗氧化活性、营养品质及香气的影响
2020-03-28胡贝多刘鑫磊战相君张一帆雷宏杰
胡贝多,刘鑫磊,战相君,张一帆,姜 甜,雷宏杰*
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.江南大学 食品学院,江苏 无锡 214000;3.江苏微康生物科技有限公司,江苏 苏州 215200)
生物转化是利用生物体系作用于外源性底物,在适宜的培养条件下,通过生物体系对底物进行特异性结构修饰,从而产生结构改变,其实质为酶催化反应[1-2]。在众多生物转化菌株中,乳酸菌被视作最传统且最安全的微生物。乳酸菌不仅可以对黄酮糖苷进行生物转化,还可通过降低原料中的不良气味来提高发酵底物的风味。同时,乳酸菌发酵还能将大分子蛋白质、糖和脂肪等分解为机体更容易吸收的小分子物质,从而提升营养物质的消化吸收性能和营养价值[3]。菌种是发酵制品的关键依托,其发酵形式可以是单一菌种的发酵,也可是多菌种混合发酵[4]。果蔬除了本身含有必需营养素,还富含抗氧化物质、矿物质、维生素和膳食纤维,一直以来都被认为是理想的益生菌载体。益生菌在果蔬加工中的作用涉及以下几个方面:增加果蔬产品的营养价值[5]、改善果蔬产品的风味、改善果蔬产品的贮藏性[6]、提高果蔬产品的保健功效[7-8]、丰富产品的种类,以满足消费者的需求。
国内有关果蔬汁乳酸菌发酵的研究较多,而益生菌发酵红枣汁则相对较少。红枣(Ziziphus jujubeMill.)又名大枣,是鼠李科枣属植物枣树的果实,原产我国。红枣营养保健价值高,是果品中的“补品王”[9]。大枣味甘无毒,安中养脾,平胃气,通九窍,是药食同源的典型[10]。我国现有红枣栽培面积2 300余万亩,产量900余万t。近年来,陕西省榆林市清涧县红枣的裁培面积和产量逐年增长。截至2017年底,全县有枣林90万亩,年产鲜红枣20万t,是沿黄枣区农民收入的主要来源。但是,近年来红枣成熟期出现连阴雨天气,大量成熟红枣出现裂果、霉变等情况,导致全县红枣产量锐减,甚至出现大面积绝收现象,加之市场价格一直走低,严重伤害了枣农种植的积极性。而且,红枣加工品种单一,经济效益低,不能满足陕北乃至我国红枣产业的发展需求。因此,在我国大健康产业发展环境及趋势下,红枣健康产品的研究迫在眉睫。
本研究以陕北木枣(Ziziphus jujubeMill.)为原料,选用瑞士乳杆菌(Lactobacillius helveticus)、干酪乳杆菌(Lactobacillius casei)、嗜酸乳杆菌(Lactobacillius acidophilus)、植物乳杆菌(Lactobacillius plantarum)、果201复合菌、果321复合菌为发酵菌株制备益生菌发酵红枣汁,比较6种益生菌发酵对红枣汁抗氧化活性、理化指标、色值和香气的影响,旨在为益生菌发酵红枣汁优质菌种的筛选提供理论依据和方法指导。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌种
陕北木枣(Ziziphus jujubeMill.):由西北农林科技大学红枣试验站(陕西省榆林市清涧县)提供;植物乳杆菌(Lactobacillius plantarum)、嗜酸乳杆菌(Lactobacillius acidophilus)、干酪乳杆菌(Lactobacillius casei)、瑞士乳杆菌(Lactobacillius helveticus)、果复合菌201、果复合菌321:江苏微康生物科技有限公司。
1.1.2 化学试剂
葡萄糖、铁氰化钾、三氯乙酸、三氯化铁、亚硝酸钠、硝酸铝、无水乙醇、甲醇、抗坏血酸、过硫酸钾、氢氧化钠、没食子酸、无水碳酸钠、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):国药集团化学试剂有限公司;芦丁(纯度>98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、福林酚试剂、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS):北京索莱宝科技有限公司。实验所用化学试剂均为分析纯。
1.2 仪器与设备
UV1780紫外可见分光光度计:日本京岛公司;XP6电子天平:瑞士梅特勒-托利多仪器有限公司;CM-5色差计:科电贸易(上海)有限公司;PEN3电子鼻:德国Airsense公司。
1.3 方法
1.3.1 红枣汁制备及发酵
称取一定量的红枣,破碎后按料液比1∶5(g∶mL)加入饮用水,于50 ℃浸提90 min,滤去红枣渣,将浸提得到的红枣汁加水调整至可溶性固形物为10%。分装于7个1 000 mL的锥形瓶中,每瓶装600 mL。在85 ℃条件下灭菌10 min,冷却至室温。按产品说明进行菌种活化,MRS培养液中接入一定量的乳酸菌,37 ℃条件下活化24 h,离心得菌泥(4 000 r/min,10 min,4 ℃),分别接入6种已活化的益生菌,接种量为0.2%,发酵温度37 ℃,发酵时间48 h,测量发酵液pH,当发酵液pH维持稳定时表明发酵结束。
1.3.2 还原糖含量的测定
采用3,5-二硝基比色法测定还原糖含量,以葡萄糖溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线,得到标准曲线回归方程为y=0.495 6x-0.010 1(相关系数R2=0.999 1)。
1.3.3 可滴定酸含量的测定
依据国际化标准组织(internationalstandardorganization,ISO)750—1998《水果和蔬菜制品可滴定酸度的测定》中的方法测定。
1.3.4 总酚含量的测定
采用福林-酚法测定:量取待测样品溶液1 mL于具塞试管中,加入1 mL福林酚试剂,3 mL 7.5%碳酸钠溶液,和5 mL蒸馏水混合均匀,避光放置30 min,于波长720 nm处测定吸光度值。以没食子酸为标样,其质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制没食子酸标准曲线,得到没食子酸标准曲线回归方程为y=18.40x+0.091(相关系数R2=0.999 6)。
1.3.5 总黄酮含量的测定
将样品液1 mL置于10 mL具塞试管中,加5%NaNO2溶液和10%Al(NO3)3溶液各0.3 mL,摇匀,放置6 min,加4%NaOH溶液4 mL,用体积分数60%的乙醇溶液定容至10 mL,摇匀,静置15 min,在波长510 nm处测定溶液吸光度值,以试剂空白为对照。根据芦丁标准曲线方程计算样品液中总黄酮的含量,结果以芦丁作为当量表示。以芦丁溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制芦丁标准曲线,得到标准曲线回归方程为y=15.748x-0.011 3(相关系数R2=0.999 0)
1.3.6 体外抗氧化活性的测定
(1)DPPH自由基清除率
称取0.625 mg的DPPH标准溶液,用甲醇溶解定容至25 mL,得0.025 mg/mL DPPH甲醇溶液。吸取0.12 mL样品至试管中,加入4 mL DPPH溶液,摇匀放置在黑暗中45 min,4 000 r/min离心10 min后,以甲醇为空白对照,于波长517 nm处测定吸光度值。DPPH自由基清除率计算公式如下:

式中:A0为空白组吸光度值;A1为样品吸光度值。
样品的DPPH自由基清除率以VC抗氧化当量(vitamin C equivalent antioxidant capacity,VCEAC)表示。
(2)ABTS清除率
将5 mL 7 mmol/L的ABTS溶液和88 μL 140 mmol/L的K2S2O8水溶液避光反应24 h后生成ABTS自由基。分别取稀释一定倍数的样品溶液200 μL,与4.8 mL ABTS稀释液混匀,避光反应15 min,以无水乙醇为对照,在波长为734 nm处测定吸光度值,空白以相同体积甲醇代替样品反应,ABTS自由基清除率计算公式如下:
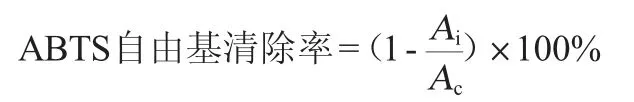
式中:Ac为同体积甲醇代替样品反应的吸光度值;Ai为样品反应的吸光度值。
以VC溶液为标准对照,测定不同质量浓度VC对ABTS的清除率,样品的ABTS清除率用VC抗氧化当量(VCEAC)表示。
(3)铁离子还原力
吸取红枣汁样品200 μL,加入pH 6.6浓度为0.2 mol/L磷酸盐缓冲溶液1.8 mL,然后加入1 mL 1%的铁氰化钾溶液,置于50 ℃恒温水浴中反应20 min,然后加入10%三氯乙酸1 mL,混匀,取上清液2 mL,再加入2 mL蒸馏水、40 μL 0.1%三氯化铁溶液,室温条件下反应10 min,在波长700 nm处测其吸光度值。用VC溶液为标准对照,测定不同质量浓度VC反应所得吸光度值,以VC质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线,得到标准曲线方程为y=1.054 4x+0.132(相关系数R2=0.9996)。样品铁离子还原能力(Ferric ionreducing antioxidant power,FRAP)用VC抗氧化当量VCEAC表示。FRAP值越大,表明其抗氧化性能力越强。
1.3.7 色值的测定
将发酵后的红枣汁样品置于透明比色皿中进行检测色值,获得L*值、a*值、b*值,以未发酵的红枣汁为对照,发酵红枣汁与未发酵红枣汁的色差ΔE计算公式如下:

1.3.8 挥发性香气成分的测定
准确吸取10 mL乳酸菌发酵红枣汁样品置于50 mL顶空瓶中,瓶盖上用聚四氟乙烯隔垫密封,常温下静置5 min后立刻进行电子鼻香气检测。每个样品10个平行试验。对7个样品进行电子鼻检测,每个重复10次。取10 mL样品,注入到30 mL的上样瓶中,瓶盖封住瓶口在室温条件下富集15 min后,采用顶空上样法对样品进行电子鼻检测。10个金属传感器信息见表1。电子鼻检测参数设置:预进样时间5 s,自动归零时间5 s,采样时间60 s,清洗时间300 s,内部空气流量0.3 L/min,进样流量0.3 L/min。

表1 电子鼻不同传感器对应香气种类Table 1 Aroma types corresponding to different sensors of electronic-nose
1.3.9 数据分析
每个数据均为3次测定的平均值,采用SPSS 18.0进行数据分析,结果以均值±标准差表示,多重比较采用Duncan法,显著水平P<0.05。电子鼻所测得的数据分析使用软件Winmuster。
2 结果与分析
2.1 不同菌种发酵对红枣汁还原糖和可滴定酸含量的影响

图1 不同乳酸菌发酵对红枣汁中还原糖和可滴定酸含量的影响Fig.1 Effect of different lactic acid bacteria fermentation on reducing sugar and titratable acid contents in jujube juice
如图1所示,与发酵前相比,除瑞士乳杆菌和果201复合菌外,其余4种乳酸菌发酵后红枣汁中还原糖的浓度均显著下降(P<0.05)。6种乳酸菌利用还原糖能力的高低顺序为果321复合菌>植物乳杆菌>嗜酸乳杆菌>干酪乳杆菌>果201复合菌>瑞士乳杆菌。其中果321复合菌使其还原糖含量下降最多,与发酵前相比,下降0.20 g/L。红枣含有丰富的多糖,其中还原糖含量占总糖含量的70%以上[11]。研究证明,植物乳杆菌降解还原糖的能力要显著强于瑞士乳杆菌(P<0.05),而瑞士乳杆菌半乳糖甘酶的活性较强,能够使总糖降解,还原糖含量增加。以乳酸菌为主的益生菌能在红枣汁发酵过程中将糖类成分转化产生乳酸,使样品酸度升高。经乳酸菌发酵后,红枣汁可滴定酸含量显著高于对照组(P<0.05)。可滴定酸生成量由高到低依次为瑞士乳杆菌>干酪乳杆菌>果201复合菌>嗜酸乳杆菌>果321复合菌>植物乳杆菌>对照组。
2.2 不同菌种发酵对红枣汁总多酚和总黄酮含量的影响

图2 不同乳酸菌发酵对红枣汁中总多酚和总黄酮含量的影响Fig.2 Effect of different lactic acid bacteria fermentation on total polyphenol and total flavonoids contents in jujube juice
如图2所示,与发酵前相比,只有瑞士乳杆菌发酵的红枣汁总酚含量上升,其余5种益生菌发酵后均导致总多酚含量呈现不同程度的下降,下降范围为27.3%~50%。郑欣等[12]研究结果表明,由于果汁中的多酚很容易被氧化,乳酸菌发酵过程中对氧气的利用很少,因此在果汁乳酸菌发酵过程中,总多酚呈下降趋势,且不同菌种导致多酚下降趋势有显著差异。本研究中乳酸菌发酵的红枣汁中总多酚含量普遍有所下降,可能因为红枣汁一些结合态的多酚被乳酸菌产生的一些糖苷酶或酯酶水解,导致总多酚含量的增加,但又因为红枣汁中结合态酚类物质数量有限,因此总多酚的氧化减少的速率较快[12]。6种乳酸菌发酵对总多酚含量的影响能力由大到小依次为植物乳杆菌>果321复合菌>干酪乳杆菌>嗜酸乳杆菌>果201复合菌>瑞士乳杆菌,其中植物乳杆菌使总酚含量下降最多,约50%,这主要是由于红枣汁中酚类物质氧化减少造成的[13]。
如图2所示,与发酵前相比,瑞士乳杆菌发酵后的红枣汁中总黄酮含量显著升高(P<0.05),其余5种乳酸菌发酵后的红枣汁中的总黄酮含量均有所下降。6种乳酸菌发酵对总黄酮含量的影响力由大到小依次为:果321复合菌>植物乳杆菌>嗜酸乳杆菌>干酪乳杆菌>果201复合菌>瑞士乳杆菌。其中植物乳杆菌发酵红枣汁使其总黄酮含量下降较多,这与赖婷等[14]对桂圆肉浆使用7种乳酸菌进行发酵,发现不同菌种转化能力不同,且植物乳杆菌的生物转化能力最强,总黄酮显著下降的结论一致。
2.3 不同菌种发酵对红枣汁抗氧化性的影响
如表2所示,不同乳酸菌发酵红枣汁的DPPH自由基清除能力存在显著差异(P<0.05)。7种样品的DPPH自由基清除能力由强到弱顺序为:果321复合菌>干酪乳杆菌>植物乳杆菌>嗜酸乳杆菌>果201复合菌>红枣汁原液>瑞士乳杆菌。除瑞士乳杆菌,经其余5种益生菌发酵后,红枣汁DPPH自由基清除率均显著升高(P<0.05),高于对照组。这可能是乳酸菌产生的如阿魏酸酯酶[15]等酚酸酯酶水解了红枣汁中的结合酚,释放游离酚的同时释放有机酸,酸性环境能防止酚类物质的降解,从而使DPPH自由基清除能力提高。

表2 不同乳酸菌发酵红枣汁中抗氧化能力的比较Table 2 Comparison of antioxidant activity in jujube juice fermented by different lactic acid bacteria
不同乳酸菌发酵红枣汁的ABTS自由基清除能力存在显著差异(P<0.05)。7种样品的ABTS自由基清除能力由强到弱顺序为植物乳杆菌>瑞士乳杆菌>嗜酸乳杆菌>红枣汁原液>果321复合菌>果201复合菌>干酪乳杆菌。植物乳杆菌发酵红枣汁的ABTS自由基清除能力显著高于其余5种红枣发酵汁(P<0.05)。
不同乳酸菌发酵红枣汁的Fe3+还原能力存在显著差异(P<0.05),7种枣饮品的Fe3+还原能力由强到弱依次为瑞士乳杆菌>果201复合菌>红枣汁原液>干酪乳杆菌>嗜酸乳杆菌>果321复合菌>植物乳杆菌,说明红枣汁经瑞士乳杆菌、果蔬201复合益生菌发酵后其铁还原力显著增加。瑞士乳杆菌发酵红枣汁的Fe3+还原能力显著高于其余5种红枣发酵汁(P<0.05)。
因为酚类物质的差异会对抗氧化性产生不同影响,且发酵后的红枣汁中的水杨酸与4-羟基苯甲酸对DPPH自由基清除率有很大贡献,发酵后红枣汁的FRAP值与红枣中4-羟基苯甲酸和香豆酸有关[16],故不同益生菌发酵红枣汁抗氧化能力差异可能与发酵产生不同新的酚类化合物有关。
2.4 不同菌种发酵对红枣汁色值的影响
红枣汁色泽呈褐红色,较易发生非酶褐变,导致色泽逐渐加深[17]。由表3可知,除嗜酸乳杆菌和瑞士乳杆菌发酵的红枣汁明亮度(L*值)较原红枣汁低之外,其余发酵红枣汁的明亮度(L*值)均比原红枣汁高。其中果201复合菌发酵枣汁的L*值显著高于其余五组(P<0.05),表明果201复合菌发酵可获得色泽最透亮的红枣汁。与原红枣汁相比,果201复合菌在所有菌种中对红枣汁的红色值(a*值)提高最大,果321复合菌次之,表明复合菌种发酵比单一菌种发酵更能明显提高发酵红枣汁的红色。6组乳酸菌发酵红枣汁的黄色值(b*值)也较对照组均有所降低,表明乳酸菌发酵对红枣汁的黄色有较好的抑制作用。且上述结果表明嗜酸乳杆菌和植物乳杆菌发酵红枣汁的黄色值较其余4组产品有显著差异(P<0.05),而这两者与原红枣汁的黄色值差值无显著差异(P>0.05),这可能与多酚类物质氧化等有关。植物乳杆菌发酵红枣汁的ΔE最小,说明其与原红枣汁的色泽差异最小)。果复合菌201发酵枣汁的ΔE最大,说明其与原红枣汁的色泽差异最大。

表3 不同发酵菌种对红枣发酵汁色值的影响Table 3 Effects of different lactic acid bacteria on color values of fermented jujube juice
2.5 不同菌种发酵对红枣汁香气的影响
2.5.1 不同传感器对不同菌种发酵的红枣汁挥发性气味响应值的影响
本实验提取10个传感器的特征值,采用主成分分析法(principal component analysis,PCA)、线性判别法(linear discriminant analysis,LDA)和传感器区别贡献率分析法(Loadings)作为主要区别分析方法。各传感器响应值在初始10 s内快速增加,到52 s后趋于平缓,因此选择时间终端值52 s处各传感器响应值进行分析结果见图3。

图3 不同传感器对不同菌种发酵的红枣汁挥发性气味响应值变化Fig.3 Changes of response of different sensors towards fermented jujube juice by different lactic acid bacteria
由图3可知,传感器S2(氮氧化物)、S6(广谱甲基类)、S7(硫化物、萜烯类)、S8(乙醇、芳香型化合物)对发酵红枣汁的香气响应显著,发酵红枣汁的香气与原红枣汁对传感器响应程度明显不同,说明发酵红枣汁的特征风味主要来源于氮氧化物、广谱甲基类、硫化物、萜烯类、乙醇和芳香化合物。
2.5.2 主成分分析
PCA是将多提取的传感器多指标的信息进行数据转换和降维,并提取降维后的特征值大于1的特征向量进行线性分类,最后在PCA的散点图上显示主要的两维或三维的散点图[18]。如图4所示,第一主成分方差贡献率为91.38%,第二主成分方差贡献率为7.58%,两个主成分区分方差贡献率和为98.96%>95%,表明这两个主成分可代表样品的主要信息特征。植物乳杆菌、瑞士乳杆菌、果321复合菌发酵红枣汁分属不同区域且界限清晰,表明电子鼻可以有效地区别这三种益生菌发酵红枣汁的香气差异;尽管干酪乳杆菌、嗜酸乳杆菌、果201复合菌发酵红枣汁出现重叠,但红枣汁与另外6种乳酸菌发酵红枣汁可以被明显地区别开来,说明乳酸菌发酵可显著改变红枣汁的香气成分。

图4 不同乳酸菌发酵红枣汁的主成分分析Fig.4 Principal component analysis of fermented jujube juice with different lactic acid bacteria
2.5.3 线性判别分析
LDA相比于PCA来说更加注重样品在空间的分布规律及各样品间的距离分析[19]。如图5所示,判别式1和判别式2的总方差贡献率达70.25%,判别式1方差贡献率为52.65%,判别式2方差贡献率为17.60%。不同的乳酸菌发酵红枣汁与原红枣汁之间主要是由判别式1(横坐标跨度)来识别。从各椭圆的距离来看,干酪乳杆菌发酵红枣汁与其余品种的距离较大,且在纵坐标跨度与其余品种显著区分,这可能是由于其具有某种特殊香气物质而不同于其余6个样品。与PCA结果相同,LDA也可判别原红枣汁与乳酸菌发酵红枣汁的香气差异。不同的是LDA图中还可清楚地识别出不同乳酸菌发酵红枣汁处于不同的区域中,说明LDA法可对不同乳酸菌发酵的红枣汁香气成分进行判别区分。

图5 不同乳酸菌发酵红枣汁的线性判别分析Fig.5 Linear discriminant analysis of fermented jujube juice with different lactic acid bacteria
综上分析,不同乳酸菌发酵的红枣汁香气成分组成不同。虽然PCA可用于香气识别成分分析,但PCA注重的是样本描述特征。本试验中LDA对红枣汁香气物质的区分和识别效果好于PCA。
2.5.4 载荷分析
载荷分析(loading analysis,LA)是反应主成分与相应的原始指标变量的相关系数,用来表示不同主成分和各变量之间的密切程度。不同传感器在负荷加载分析图中的位置可以反映传感器对于样品挥发性气味贡献率的大小。距离原点越远,表示此传感器对于挥发性成分的分析中所起的作用越大,反之,则说明该传感器作用较小[20]。

图6 不同乳酸菌发酵红枣汁的载荷分析Fig.6 Loadings analysis of fermented jujube juice with different lactic acid bacteria
由图6可知,第一主成分的方差贡献率是91.38%,第二主成分的方差贡献率是7.58%,且S1、S3、S4、S5、S9、S10号传感器分布接近于(0,0),并且位置接近,说明其信号变化较弱,贡献率较小,即芳香苯类、芳香胺类、氢化物、短链烷烃、有机硫氯类、长链烷烃类物质对PCA贡献率较小。S2、S6、S7、S8号传感器在当前条件下贡献率较大,即氮氧化合物、广谱甲基类、无机硫化物、广谱醇类物质对PCA贡献率较大。其中,S2号传感器对第一主成分区分方差贡献率最大,S6号传感器对第二主成分区分方差贡献率最大。因此,主成分1所代表的香气大类即为乳酸菌发酵红枣汁的特征香气,可用于鉴别和评价乳酸菌发酵红枣汁。
2.6 乳酸菌发酵红枣汁香气成分因子分析
通过对6个不同发酵红枣汁香气的传感器响应值进行主成分分析,得到主成分分析的解释总方差结果见表4。由表4可知,提取特征值大于1的主成分,只有第一个主成分的特征值>1,所以提取一个主成分,第一个主成分特征值为5.413,占到总方差的90.221%。

表4 主成分分析的解释总方差Table 4 Total variance of interpretation of principal component analysis
对采集的六个益生菌发酵红枣汁样品电子鼻数据进行因子分析,因子得分函数为:
F1=0.294×ZW1C-0.026×ZW5S+0.326×ZW3C+0.077×ZW6S+0.343×ZW5C-0.132×ZW1S-0.091×ZW1W-0.062×ZW2S-0.097×ZW2W+0.229×ZW5S;
F2=-0.048×ZW1C+0.323×ZW5S-0.038×ZW3C-0.054×ZW6S-0.044×ZW5C+0.076×ZW1S+0.36×ZW1W+0.061×ZW2S+0.367×ZW2W-0.013×ZW5S;
F3=0.054×ZW1C-0.016×ZW5S+0.122×ZW3C+0.32×ZW6S+0.151×ZW5C+0.175×ZW1S-0.014×ZW1W+0.251×ZW2S-0.001×ZW2W+0.458×ZW5S,
其中ZW1C、ZW5S等分别是电子鼻传感器响应值的标准化数据。各样品因子得分及排名见表5。

表5 各样品因子得分及排名Table 5 Factor score and ranking of samples
综合因子得分是电子鼻传感器对样品香气物质反映出的一个综合评价,可以进一步解释不同样品中氮氧化物、醇类、芳香烷烃等香气物质的不同含量及强度,从而达到客观评价不同发酵红枣汁品质的目的[21]。杨智等[22]研究表明,对香气成分检测结果的因子分析可以客观评价样品的品质。大量研究证实,酯类、醛类、酸类和酚类是影响红枣香气品质的主要成分[23-26]。由表5可知,果321复合菌、植物乳杆菌发酵饮料的因子得分高,而嗜酸乳杆菌因子得分较差。表明益生菌品种是影响乳酸菌发酵饮品香气品质的重要因素,且复合益生菌发酵效果优于单菌发酵。
3 结论
红枣汁经益生菌发酵后营养价值有显著提升,并且产生令人愉悦的香气,不同益生菌发酵红枣汁特性不同,本研究对比了6种商业益生菌(瑞士乳杆菌、植物乳杆菌、干酪乳杆菌、嗜酸乳杆菌、果201复合菌、果321复合菌)的发酵性能,与其它益生菌相比,瑞士乳杆菌的产酸效果尤其显著。经瑞士乳杆菌发酵的红枣汁总酚、黄酮含量升高,抗氧化能力有显著提升。利用电子鼻方法能较好地区分发酵红枣汁的香气,原枣汁与不同益生菌发酵红枣汁香气区分明显,LDA对益生菌发酵红枣汁的区分效果要优于PCA。分析比较不同菌种发酵红枣汁香气主要成分的差异,并提取出了3组主成分,其累计方差贡献率达到了99.991%,发酵红枣汁的特征风味主要来源于硫化物、萜烯类、广谱甲基类、氮氧化物、乙醇和芳香型化合物。益生菌发酵红枣汁提高其抗氧化活性及香气成分的形成机理仍需进一步探究。
