人肠道微生物中抗菌活性菌株的筛选及其代谢产物研究△
2020-03-28李德利丁鹏敏刘双月杨秀伟王如峰
李德利,丁鹏敏,刘双月,杨秀伟,王如峰*
1.北京中医药大学 生命科学学院,北京 102488;2.北京大学 药学院,北京 100083
肠道微生物是指一群生活在动物肠道内的微生物群落,其体系庞大,种类和数量繁多,在进化过程中一直维持着动态平衡。肠道微生物主要由厚壁菌门和拟杆菌门的种类组成,另有少量变形菌门、放线菌门、疣微菌门和梭杆菌门的种类[1]。肠道微生物动态平衡的维持是微生物之间、微生物与宿主之间相互作用的结果。已有研究表明,定植抗性是肠道内部维持稳态的关键[2]。作为不同的生物体系,微生物与微生物之间,以及微生物与人体之间的相互作用应该通过分泌和接受化学介质来实现。与高等生物一样,肠道微生物也存在初生代谢和次生代谢,其代谢产物分泌到肠道中会对周围的微生物产生影响,这应该是实现微生物定植抗性的关键因素。通过分泌这些代谢产物,特别是具有生物活性的代谢产物,某种肠道微生物影响其他微生物的生存和发展,使自身在生存竞争中处于有利地位,这些活性代谢产物被人体吸收后也应该对人体的健康产生影响。
有研究报道奇异变形杆菌Proteusmirabilis对病原菌如白色念珠菌Candidaalbicans和鳗弧菌Vibrioanguillarum具有较强抑制活性[3],从而有助于其生存并对其宿主有一定的保护作用。奇异变形杆菌属于肠杆菌科的变形杆菌属(Proteus),该属主要包括普通变形杆菌P.vulgaris、奇异变形杆菌P.mirabilis、彭氏变形杆菌P.penneri、黏液变形杆菌P.myxofaciens、豪氏变形杆菌P.huuseri和3个未命名的基因种[4]。变形杆菌是肠道内常见的条件致病菌,正常情况下与宿主共生,参与调节菌群稳定,只在菌群紊乱时才具有致病性。在海洋动物的肠道中分离出的普通变形杆菌、奇异变形杆菌和彭氏变形杆菌体现出益生菌特性,这主要与细菌素的产生及其对致病菌的拮抗作用有关[5]。
既然肠道微生物可能通过分泌化学物质对其周围的微生物和宿主产生影响,这些化学物质到底是什么?它们通过什么机制来实现?这些问题的答案可能是揭示肠道菌群与人体健康关系的金钥匙。因此,开展肠道微生物的代谢产物研究,对于阐明肠道微生物与人体疾病发生机制和药物作用机制相关性的物质基础具有重要意义。鉴于此,笔者以变形杆菌为例,开展了此类研究。
1 材料与方法
1.1 材料与试剂
粪便样品来源于健康成年志愿者。指示菌株为本实验室冻存菌株:金黄色葡萄球菌Staphylococcusaureus、铜绿假单胞菌Pseudomonasaeruginosa、奇异变形杆菌Proteusmirabilis、肺炎克雷伯菌Klebsiellapneumoniae、大肠埃希菌Escherichiacoli、肠炎沙门氏菌Salmonellaenteritidis。
DNA-marker、细菌DNA提取试剂盒、PCR扩增试剂盒购自博迈德科技发展有限公司;成套变形杆菌生化鉴定管购自青岛海博生物技术有限公司;细菌通用引物由生工生物工程(上海)股份有限公司合成;培养基成分购自北京奥博星生物科技有限公司;化学试剂正丁醇、甲醇、乙酸乙酯、石油醚等购自北京化工厂;其他实验耗材如牛津杯、96孔板、微孔滤膜等由北京兰博利德商贸有限公司提供。
1.2 仪器
MLS-3780高压灭菌锅(日本Sanyo公司);JB-CJ-1500超净工作台(北京昌平长城空气净化设备有限公司);EPOCH全波长酶标仪(美国伯腾仪器有限公司);PCR反应扩增仪(加拿大BBI公司);DK-8D型稳压温流电泳仪(上海斯特分析仪器有限公司);恒温振荡培养箱(北京东联哈尔仪器制造有限公司)。
1.3 培养基
营养肉汤培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1000 mL,调节pH至7.2~7.4,121 ℃灭菌25 min。
营养琼脂培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,蒸馏水1000 mL,调节pH至7.2~7.4,121 ℃灭菌25 min。
改良高氏一号培养基:可溶性淀粉20.0 g,KNO31.0 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂20.0 g,重铬酸钾50.0 mg,蒸馏水1000 mL,调节pH至7.2~7.4,121 ℃灭菌25 min。
发酵培养基:大豆蛋白胨10.0 g,蛋白胨2.0 g,葡萄糖20.0 g,可溶性淀粉5.0 g,酵母膏2.0 g,NaCl 4.0 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,CaCO32.0 g,蒸馏水1000 mL,调节pH至7.2~7.4,121 ℃灭菌25 min。
1.4 活性菌株分离
取志愿者粪便适量置于无菌0.9%氯化钠溶液中,150 r·min-1振荡1 h,使粪便充分分散,静置,上清液即为混合菌液。采用梯度稀释法将混合菌液稀释至10-4、10-5、10-6、10-7,分别吸取各梯度稀释液接种于改良高氏一号液体培养基中,37 ℃、150 r·min-1振荡培养12~24 h,获得混合菌群。将所得混合菌群用稀释涂布法接种于营养琼脂培养基中,待菌落长成后,用接种环挑取优势单菌落,划线法接种于营养琼脂培养基中。将长成的菌落进一步纯化,得到单菌株。
1.5 活性菌株筛选
1.5.1样品预处理 将纯化得到的单菌株用营养肉汤培养基培养活化且培养至稳定后,分别以2%的接种量接种于5 mL发酵培养基中,于37 ℃、150 r·min-1摇床培养3~7 d。吸取各单菌株发酵液,5000 r·min-1(离心半径为6.60 cm)离心10 min,取上清液,经0.22 μm无菌滤膜过滤后,于4 ℃保存。
1.5.2抗菌活性筛选 采用牛津杯法验证发酵液活性:指示菌(金黄色葡萄球菌、铜绿假单胞菌、奇异变形杆菌、肺炎克雷伯菌、大肠埃希菌、肠炎沙门氏菌)菌液浓度分别调至1.5×108CFU·mL-1,吸取100 μL接种至固体培养基,表面放置牛津杯,管内加150 μL待测样品,以空白培养基为实验对照组,每组设置3个重复。平皿37 ℃静置8~16 h,通过观察牛津杯周围有无透明圈确定发酵液样品有无抗菌活性,用直尺测量透明圈的直径并记录,结果取平均值。
1.6 活性菌株分类鉴定
1.6.1生理生化鉴定 参考文献[6]变形杆菌的鉴定方法,采用成套变形杆菌生化鉴定管进行鉴定。
1.6.216S rDNA鉴定 用细菌基因组DNA提取试剂盒提取菌液DNA,采用35 μL反应体系进行16S rDNA序列全长扩增,所用引物为细菌通用引物(27F:5′ AGAGT TTGAT CCTGG CTCAG 3′;1492R:5′ TACGG YTACC TTGTT ACGAC TT 3′)。反应体系:模板3 μL,上下游引物各1 μL,5×fast Pfu Buffer 7 μL,2.5 mol·L-1dNTP 3 μL,FastPfu DNA Polymerase 1 μL,ddH2O 19 μL。反应条件:95 ℃预变性2 min,95 ℃变性1 min,51 ℃退火15 s,72 ℃延伸1 min,循环35次,72 ℃延伸5 min,反应结束后于4 ℃保存。
PCR产物经1%琼脂糖凝胶电泳,观察凝胶成像系统的扩增效果并拍照,将扩增成功的PCR产物送至生工生物工程(上海)股份有限公司进行双向测序。测序结果与GenBank中已知的核酸序列比对,从中选取同源性较高的序列,再用DNAMAN软件比对,并用MEGA 5.0软件构建系统发育树。
1.7 活性物质提纯及结构鉴定
1.7.1活性物质定位 取预处理后的发酵上清液和空白培养基,分别加至3 kD的超滤管中,以离心半径6.60 cm、7000 r·min-1离心25 min,取下层滤液即为除蛋白后样品和空白培养基。采用微量稀释法,测定添加不同体积的样品后对铜绿假单胞菌指示菌的生长抑制率。具体操作如下:用营养肉汤培养基将活化后的铜绿假单胞菌菌液调整浓度至1.5×107CFU·mL-1,取96孔板,分别加入20、30、40、50、60 μL待测样品,对照组加同量的空白培养基,再加入菌液20 μL。用培养基补足体积至200 μL,每组设置4个重复孔。将96孔板置于微量振荡器上振荡几分钟以充分混匀,37 ℃培养8~12 h。培养结束后将孔板取出,用酶标仪测定各组在600 nm处的吸光度值(A)。将实验结果与相同条件下不除蛋白的发酵液和空白培养基的抑制率进行比较,分析发酵液去除蛋白前后抗菌活性的变化。按公式(1)计算抑制率。
(1)
1.7.2活性物质提取 采用有机溶剂萃取法提取发酵液中的活性物质,运用1.5.2中所述的牛津杯法比较不同极性溶剂(石油醚、乙酸乙酯、正丁醇)依次萃取和直接萃取得到的萃取相和萃余相活性,确定最佳提取溶剂。
1.7.3活性物质纯化与结构鉴定 以铜绿假单胞菌为活性追踪指示菌,运用大孔树脂吸附柱色谱法、薄层色谱法、硅胶柱色谱法、凝胶柱色谱法和高效液相色谱法,对发酵液中的活性物质进行分离纯化。利用质谱技术、核磁共振技术对所得纯化合物进行结构鉴定。
1.8 化合物抗菌活性测试
将各化合物用DMSO溶解后,加水稀释至适宜浓度,以铜绿假单胞菌为指示菌,采用微量稀释法测定化合物的最低抑菌浓度(MIC),96孔板内化合物的终质量浓度为500、250、125、……0.98 mg·L-1,DMSO的终质量分数为5% ,以无菌生长的最低浓度为单体化合物的MIC,实验重复3次。
2 结果与分析
2.1 活性菌株分离筛选
通过改良高氏一号培养基直接培养法缩减肠道微生物的种类,剔除了大部分对重铬酸钾敏感的肠道菌,最终从人源粪便中筛选得到1株具有广谱抗菌活性的菌株,编号为HA-3151。该菌株发酵液能抑制金黄色葡萄球菌和铜绿假单胞菌的生长,在牛津杯周围能看见清晰的透明圈,对金黄色葡萄球菌的抑菌圈直径约为15.9 mm(见图1,A、B),对铜绿假单胞菌的抑菌圈直径约为16.4 mm(见图1,C、D)。此外对奇异变形杆菌、肺炎克雷伯菌、大肠埃希菌、肠炎沙门氏菌的生长也有抑制作用,其抑菌圈直径大小见表1。

注:A、B.金黄色葡萄球菌;C、D.铜绿假单胞菌。图1 菌株HA-3151发酵液的抑菌圈展示图

表1 菌株HA-3151对指示菌的抑菌结果
2.2 活性菌株鉴定
2.2.1生理生化鉴定 结合菌落形态和革兰氏染色阴性结果,对菌株HA-3151的生理生化实验结果(表2)进行分析,初步判定HA-3151为肠杆菌科变形杆菌属普通变形杆菌P.vulgaris。

表2 菌株HA-3151生理生化鉴定结果
注:+为阳性;-为阴性。
2.2.216S rDNA鉴定 PCR产物的1%琼脂糖凝胶电泳成像结果见图2,各样品在1500 bp左右有明亮单一条带,无杂带污染。测序后发现其16S rDNA序列全长为1476 bp。

注:M. DNA Marker; 1~6. PCR产物。图2 PCR产物的琼脂糖凝胶电泳图
通过与GenBank数据库的同源性比较,结果显示菌株HA-3151与变形杆菌属同源性最高。根据Blast比对结果,下载了有文献报道的变形杆菌属的代表菌株序列,采用MEGA 5.0软件进行1000次相似重复度计算,构建系统发育树见图3。从图3可知,HA-3151与普通变形杆菌P.vulgaris聚在同一分支,可信度值为100。

图3 菌株HA-3151的系统发育树
2.3 活性物质提纯及结构鉴定
2.3.1活性物质定位 超滤法除去蛋白质的发酵液与未除蛋白质的发酵液对铜绿假单胞菌生长的抑制率见图4,两者差异无统计学意义。在加入体积为60 μL(终体积为200 μL)时,两者都完全抑制铜绿假单胞菌的生长。

图4 发酵液去除蛋白质前后抑菌活性对比
2.3.2活性物质提取 发酵液经不同极性溶剂依次萃取和直接萃取后,各有机萃取相和萃余相的物质活性用牛津杯法进行检测,结果见表3。直接用正丁醇萃取的正丁醇相的抑菌活性最好,且在萃余相中活性很弱,因此正丁醇是发酵液中活性物质萃取的最佳溶剂,并通过增加萃取次数来减弱萃余相中的活性物质残余,提高萃取得率。
2.3.3活性物质纯化与结构鉴定 从变形杆菌HA-3151发酵液中分离得到了13个化合物,包括有机酸类3个(D-3-苯基乳酸、丁香酸、3-甲氧基没食子酸),二肽类4个[环(丙-苯丙)二肽、环(酪-酪)二肽、环(酪-亮)二肽、环(酪-异亮)二肽],黄酮类6个(黄豆黄苷、大豆苷、大豆苷元、染料木苷、5-甲氧基大豆苷元、染料木黄酮)。各化合物的结构式见图5,鉴定结果如下:
D-3-苯基乳酸(D-3-phenyllactic acid),白色结晶;[α]+19.80°;ESI-MSm/z165.056 2[M-H]-;1H-NMR(400 MHz,DMSO-d6):δ 7.23 (m,5H,H-Phe),4.13 (t,1H,J=3.6 Hz,H-2),2.95 (d,1H,J=13.6 Hz,H-3a),2.78 (dd,1H,J=13.6,8.4 Hz,H-3b);13C-NMR(100 MHz,DMSO-d6):δ 40.33 (C-3),71.25 (C-2),126.29 (C-7),128.15(C-5,9),129.58 (C-6, 8),138.35 (C-4),175.34 (COOH)。以上数据与文献报道的D-3-苯基乳酸数据一致[7-8]。
丁香酸(syringic acid),无色结晶;ESI-MSm/z197.046 3[M-H]-;1H-NMR (400 MHz,MeOD-d4):δ 7.33 (s,2H,H-3,5),3.88 (s,6H,2OCH3);13C-NMR (100 MHz,MeOD-d4):δ 57.08 (OCH3),108.65 (C-3,5),122.20 (C-4),142.06 (C-2,6),149.14 (C-1),170.22 (COOH)。以上数据与文献报道的丁香酸数据一致[9]。
3-甲氧基没食子酸(3-methoxygallic acid),白色结晶;1H-NMR (400 MHz,DMSO-d6):δ 7.07 (s,1H,H-6),7.02 (s,1H,H-4),3.77 (s,3H,OCH3);13C-NMR (100 MHz,DMSO-d6):δ 56.00 (OCH3),104.96 (C-6),110.87 (C-4),120.67 (C-5),139.11 (C-2),145.35 (C-3),147.93 (C-1),167.58 (COOH)。以上数据与文献报道的3-甲氧基没食子酸数据一致[10]。
环(丙-苯丙)二肽[cyclo (L-Ala-L-Phe)],无定形粉末;[α]+10.00°;1H-NMR (400 MHz,MeOD-d4):δ 7.14-7.26 (m,5H,-Phe),4.22 (s,1H,H-5),3.42 (m,1H,H-3),3.00 (d,1H,J=14.0 Hz,H-8a),2.64 (d,1H,J=17.6 Hz,H-8b),0.51 (d,3H,J=6.4 Hz,CH3);13C-NMR (100 MHz,MeOD-d4):δ 21.10 (C-7),41.56 (C-6),45.35 (C-8),58.22 (C-3),129.16 (C-4),130.30 (C-11,13),132.18 (C-10,14),137.07 (C-9),169.37 (C-5),170.73 (C-2)。以上数据与文献报道的环(丙-苯丙)二肽数据一致[11]。
环(酪-酪)二肽[cyclo (L-Tyr-L-Tyr)],无定形粉末;[α]+39.39°;ESI-MSm/z327.135 5[M+H]+;1H-NMR (400 MHz,DMSO-d6):δ 9.18 (s,2H,H-1),7.74 (s,2H,OH),6.83 (d,4H,J=7.6 Hz,H-2′,2″,6′,6″),6.66 (d,4H,J=7.6 Hz,H-3′,3″,5′,5″),3.84 (s,2H,H-3,6),2.52 (dd,2H,J=13.6,6.0 Hz,H-7,7′a),2.10 (dd,2H,J=13.6,6.0 Hz,H-7,7′b);13C-NMR (100 MHz,DMSO-d6):δ 38.8 (C-7,7′),56.22 (C-3,6),115.51 (C-2′,2″,6′,6″),127.03 (C-4′,4″),131.22 (C-1′,1″),156.55 (C-3′,3″,5′,5″),166.73 (C-2,5)。以上数据与文献报道的环(酪-酪)二肽数据一致[12]。
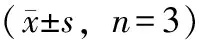
表3 不同萃取方法活性对比 mm
注:—表示无抑菌圈。
环(酪-亮)二肽[cyclo (L-Tyr-L-Leu)],无定形粉末;[α]+10.00°;1H-NMR (400 MHz,MeOD-d4):δ 6.93 (d,2H,J=8.4 Hz,H-13,17),6.64 (d,2H,J=8.4 Hz,H-14,16),4.16 (s,2H,H-1,4),3.69 (dd,1H,J=10.0,4.0 Hz,H-6),3.13 (dd,1H,J=14.0,4.8 Hz,H-11a),2.76 (dd,1H,J=14.0,4.8 Hz,H-11b),1.37 (m,1H,H-8),0.82 (m,3H,CH3);13C-NMR (100 MHz,MeOD-d4):δ 21.67 (C-10),23.69 (C-9),24.98 (C-8),39.72 (C-11),45.55 (C-7),54.42 (C-6),57.93 (C-3),116.74 (C-14),127.33 (C-12),132.74 (C-13),133.07 (C-17),158.49 (C-15),169.44 (C-2),170.97 (C-5)。以上数据与文献报道的环(酪-亮)二肽数据一致[13-14]。
环(酪-异亮)二肽[cyclo (L-Tyr-L-Ile)],无定形粉末;[α]-32.56°;1H-NMR (400 MHz,MeOD-d4):δ 6.93 (d,2H,J=8.4 Hz,H-13,17),6.69 (d,2H,J=8.4 Hz,H-14,16),4.26 (s,2H,H-1,4),3.70 (dd,1H,J=4.4,1.6 Hz,H-6),3.19 (dd,1H,J=14.0,4.4 Hz,H-11a),2.89 (dd,1H,J=14.0,4.4 Hz,H-11b),0.79~0.67 (m,6H,CH3);13C-NMR (100 MHz,MeOD-d4):δ 12.20 (C-10),15.66 (C-9),24.98 (C-8),39.20 (C-11),40.14 (C-7),57.70 (C-5),61.22 (C-2),116.59 (C-14,16),127.80 (C-12),132.93 (C-13,15),158.23 (C-15),169.64 (C-2,5)。以上数据与文献报道的环(酪-异亮)二肽数据一致[15]。
黄豆黄苷(glycitin),白色粉末;1H-NMR (400 MHz,DMSO-d6):δ 8.38 (s,1H,H-2),7.48 (s,1H,H-5),7.33 (s,1H,H-8),7.41 (d,2H,J=7.6 Hz,H-2′,6′),6.81 (d,2H,J=7.6 Hz,H-3′,5′),5.19 (d,1H,J=4.0 Hz,H-1″),3.46 (m,1H,H-2″),3.48 (m,1H,H-3″),3.16 (m,1H,H-4″),3.46 (m,1H,H-5″),5.18 (d,1H,J=4.0 Hz,OH-1″),5.14 (d,1H,J=4.0 Hz,OH-2″),5.41 (d,1H,J=4.0 Hz,OH-3″),5.08 (d,1H,J=4.0 Hz,OH-4″),4.64 (m,1H,OH-6″),3.88 (s,3H,CH3),9.54 (s,1H,OH-4′);13C-NMR (100 MHz,DMSO-d6):δ 153.22 (C-2),123.31 (C-3),174.56 (C-4),104.91 (C-5),147.64 (C-6),151.72 (C-7),103.61 (C-8),151.40 (C-9),118.00 (C-10),122.77 (C-1′),130.25 (C-2′),115.16 (C-3′),157.37 (C-4′),115.16 (C-5′),130.2 (C-6′),99.79 (C-1″),73.20 (C-2″),76.94 (C-3″),69.76 (C-4″),77.39 (C-5″),60.81 (C-6″),56.01 (OCH3)。上述数据与文献报道的黄豆黄苷一致[16]。
大豆苷(daidzin),白色粉末;1H-NMR (400 MHz,DMSO-d6):δ 9.55 (s,1H,OH-4′),8.39 (s,1H,H-2),8.05 (d,1H,J=9.2 Hz,H-1),7.41 (d,2H,J=7.6 Hz,H-2′,6′),7.23 (s,1H,H-8),7.14 (d,1H,J=8.8 Hz,H-6),6.81 (d,2H,J=8.0 Hz,H-3′,5′),5.18 (d,1H,J=4.0 Hz,OH-1″),5.14 (d,1H,J=4.0 Hz,OH-2″),5.41 (d,1H,J=4.0 Hz,OH-3″),5.08 (d,1H,J=4.0 Hz,OH-4″),4.64 (m,1H,OH-6″);13C-NMR (100 MHz,DMSO-d6):δ 60.82 (C-6″),69.80 (C-4″),73.31 (C-2″),76.66 (C-3″),77.39 (C-5″),100.16 (C-8),103.56 (C-1″),115.16 (C-3′,5′),115.76 (C-6),118.64 (C-10),122.49 (C-1′),123.88 (C-3),127.13 (C-5),130.26 (C-2′,6′),153.51 (C-2),157.21 (C-4′),157.44 (C-9),161.58 (C-7),174.92 (C-4)。以上数据与文献报道的大豆苷数据[16]一致。
大豆苷元(daidzein),白色粉末;1H-NMR(400 MHz,DMSO-d6):δ 10.77 (s,1H,OH-7),9.53 (s,1H,OH-4′),8.27 (s,1H,H-2),7.95 (d,1H,J=8.4 Hz,H-5),7.37 (d,2H,J=8.4 Hz,H-2′,6′),6.92 (d,1H,J=8.8 Hz,H-6),6.85 (s,1H,H-8),6.80 (d,2H,J=8.4 Hz,H-3′,5′);13C-NMR (100 MHz,DMSO-d6):δ 102.57 (C-8),115.42 (C-3′,5′),115.59 (C-6),117.10 (C-10),123.01 (C-3),123.95 (C-1′),127.76 (C-5),130.54 (C-2′,6′),153.28 (C-2),157.64 (C-4′),157.90 (C-9),162.98 (C-7),175.16 (C-4)。以上数据与文献报道的大豆苷元数据[16]一致。
染料木苷(genistin),白色粉末;1H-NMR (400 MHz,DMSO-d6):δ 12.93 (s,1H,OH-5),9.60 (s,1H,OH-4′),8.42 (s,1H,H-2),7.39 (d,2H,J=8.4 Hz,H-2′,6′),6.81 (d,2H,J=8.4 Hz,H-3′,5′),6.71 (s,1H,H-8),6.46 (s,1H,H-6),5.19 (d,1H,J=4.0 Hz,H-1″),3.46 (m,1H,H-2″),3.48 (m,1H,H-3″),3.16 (m,1H,H-4″),3.46 (m,1H,H-5″),5.18 (d,1H,J=4.0 Hz,OH-1″),5.14 (d,1H,J=4.0 Hz,OH-2″),5.41 (d,1H,J=4.0 Hz,OH-3″),5.08 (d,1H,J=4.0 Hz,OH-4″),4.64 (m,1H,OH-6″);13C-NMR (100 MHz,DMSO-d6):δ 60.81 (C-6″),69.77 (C-4″),73.26 (C-2″),76.59 (C-3″),77.38 (C-5″),94.71 (C-8),99.76 (C-1″),100.02 (C-6),106.27 (C-10),115.28 (C-3′,5′),121.18 (C-1′),122.74 (C-3),130.36 (C-2′,6′),154.79 (C-2),157.41 (C-4′),157.69 (C-9),161.82 (C-5),163.20 (C-7),180.70 (C-4)。以上数据与文献报道的染料木苷数据[16]一致。
5-甲氧基大豆苷元(5-methoxydaidzein),淡黄色粉末;1H-NMR (400 MHz,DMSO-d6):δ 10.59 (s,1H,OH-7),9.52 (s,1H,OH-4′),8.29 (s,1H,H-2),7.44 (s,1H,H-5),7.39 (d,2H,J=8.4 Hz,H-2′,6′),6.95 (s,1H,H-8),6.81 (d,2H,J=8.4 Hz,H-3′,5′),3.89 (s,3H,CH3);13C-NMR (100 MHz,DMSO-d6):δ 56.01 (OCH3),103.00 (C-8),104.89 (C-6),115.12 (C-3′,5′),115.13 (C-10),122.96 (C-3),123.13 (C-1′),130.24 (C-2′,6′),147.11 (C-4′),151.90 (C-7),152.68 (C-9),157.29 (C-5),174.50 (C-4)。以上数据与文献报道的5-甲氧基大豆苷元数据一致[17]。
染料木黄酮(genistein),白色粉末;1H-NMR (400 MHz,DMSO-d6):δ 12.94 (s,1H,OH-5),9.57 (s,1H,OH-4′),8.31(s,1H,H-2),7.39(d,2H,J=8.4 Hz,H-2′,6′),6.81 (d,2H,J=8.4 Hz,H-3′,5′),6.37 (s,1H,OH-8),6.21 (s,1H,OH-6);13C-NMR (100 MHz,DMSO-d6):δ 93.85 (C-8),99.15 (C-6),104.64 (C-10),115.24 (C-3′,5′),121.39 (C-1′),122.46 (C-3),130.34 (C-2′,6′),154.17 (C-2),157.60 (C-4′),157.77 (C-9),162.18 (C-5),164.47 (C-5),180.40 (C-4)。以上数据与文献报道的染料木黄酮数据[16]一致。
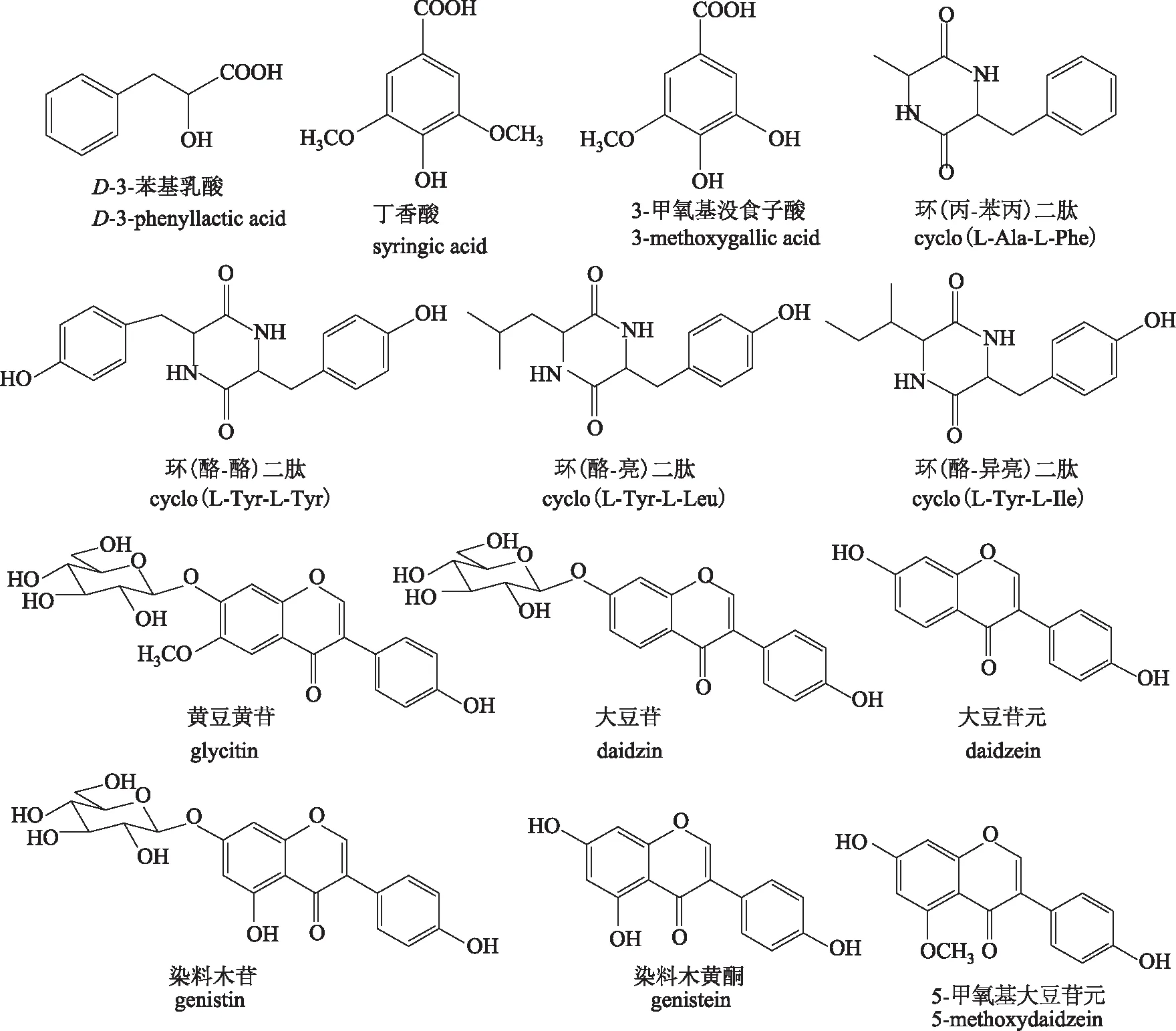
图5 从普通变形杆菌HA-3151发酵液分离的化合物的结构式
2.4 化合物抗菌活性研究
经微量稀释法测定各化合物对铜绿假单胞菌的MIC结果见表4;其他化合物无抗菌活性。

表4 单体化合物抗铜绿假单胞菌实验结果(n=3)
3 结论与讨论
本研究从人源肠道菌群中得到1株能产生抗菌活性物质的普通变形杆菌Proteusvulgaris菌株,并从其培养液中分离纯化了一系列具有抗菌活性的有机酸、黄酮和二肽类化合物。这是普通变形杆菌代谢产物具有抗菌活性的首次报道,也是肠道菌通过分泌次生代谢产物产生定植优势进而影响人体的有力证据。
根据我们的实验结果,结合文献报道,分离得到的这些代谢产物普遍具有抗菌活性。3-苯基乳酸和丁香酸最早发现于蜂蜜中,是其最主要的抗菌物质[18]。3-苯基乳酸是天然存在的抗菌剂,对人和动物安全无毒,有望作为一种新型防腐剂运用于食品、医药及化妆品行业。目前报道3-苯基乳酸主要由乳酸杆菌属菌株产生,它参与苯丙氨酸代谢途径。由于乳酸脱氢酶的种类不同,生成的苯基乳酸构型也不相同[19],D-苯基乳酸的抗菌活性大于L-苯基乳酸[20],本研究中变形杆菌HA-3151所产生的苯基乳酸即为D型。丁香酸为常见的药用植物代谢产物,是白蒿的主要抗菌成分,对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌均有抑制作用[21-22]。本研究证明环(丙-苯丙)二肽、环(酪-酪)二肽具有抗菌活性,另有文献报道环(酪-亮)二肽对犬小孢菌有抑制作用(MIC为50 mg·L-1)[23],环(酪-异亮)二肽对多种海洋细菌有抑制作用(MIC为200 mg·L-1)[24]。黄酮类化合物的抗菌活性多有报道,本研究中分离得到的大豆苷元、染料木苷和染料木黄酮经检测有抗菌作用,推测这些成分均为普通变形杆菌的抗菌活性组成成分。
本研究确认了普通变形杆菌通过分泌代谢产物对其他细菌的抑制作用,这证明肠道内确实存在微生物间相互制衡的物质基础。这些抗菌活性代谢产物被人体吸收后会进入血液循环,对人体其他部位的感染疾病起到干预作用。然而,抗菌活性物质只是肠道菌分泌的代谢产物的一部分,其他代谢产物包括活性物质和毒性物质也同样会对人体健康产生有利或不利影响。越来越多的研究证实,肠道菌群的紊乱与疾病的发生发展密切相关[25-27],这是因为紊乱的菌群表现为有益菌减少,有害菌增多。我们认为,菌群的结构改变只是表象,而致病的根源应该归因于两者分泌的化学介质的差异。药物通过调节菌群的结构治疗疾病也应该是由于不同的菌群结构释放的化学介质不同而造成的。因此,开展不同种类的肠道菌的代谢产物研究,应该能为揭秘肠道菌群与人体健康的相关性问题提供科学依据。
