肺微小结节的CT影像学表现及诊断价值
2020-03-28李丽刘周杨倩文洁钟贻洪王云飞李天然钱银姝罗德红
李丽刘周杨倩文洁钟贻洪王云飞李天然钱银姝罗德红,2
作者单位:518116深圳 1国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院放射科;100021北京2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院放射科
肺结节是指直径≤3 cm的类圆形或不规则形病灶,根据结节大小分为小结节(直径≤2 cm)和微小结节(直径≤1 cm)。研究发现肺结节恶性比例逐年升高[1-2],其中认为直径<2 cm的肺结节性质多为良性。但有研究显示超过40%的恶性结节直径<2 cm,甚至有15%的恶性结节直径<1 cm[3]。肺微小结节缺乏典型的临床表现,且由于直径较小,病理学检查难度大,常规胸片检查也易漏诊。此外,大多病灶呈磨玻璃样改变,缺乏实性成分,PET-CT检查亦不敏感。CT不仅能发现病灶,也能清晰显示病灶的部位、大小、密度、边缘及内部特征,可能是判断肺微小结节较理想的检查手段。本研究回顾性分析经手术病理证实的87例共102个不同病变性质肺微小结节的CT表现,探讨CT在肺微小结节诊断中的价值,以期提高肺微小结节的影像学诊断水平。
1 资料与方法
1.1 研究对象
回顾性收集2017年3月至2018年11月于中国医学科学院北京协和医学院肿瘤医院深圳医院经手术病理检查确诊的肺微小结节患者87例。纳入标准:⑴肺结节直径≤1cm的初诊患者;⑵未经放化疗患者;⑶行低剂量扫描、常规平扫或平扫+增强扫描,影像学资料完整。排除伴肺弥漫性疾病对观察影像学图像有影响的患者。共87例肺微小结节患者(共102个微小结节)纳入研究,其中男性42例,女性45例,平均年龄(54.74±10.75)岁(范围为30~77岁);根据病理检查结果分为良性组、癌前病变组和恶性组。
1.2 检查方法
采用GE Optimal 64层螺旋CT扫描。扫描范围:胸廓入口至膈下。低剂量扫描12例,常规平扫22例,平扫+增强扫描53例。低剂量扫描参数:螺距1.375∶1,转速0.6 s,层厚5 mm,电压120 kV,电流(自动毫安)30~60 mA,噪声系数28.28。常规剂量扫描参数:螺距1.375∶1,转速0.6 s,层厚5 mm,电压120 kV,电流(自动毫安)30~350 mA,噪声系数9.99~10.99。重建层厚、间距为0.625 mm,FOV<15 cm,重建算法:bone plus,asir-V30%。增强扫描采用双筒高压注射器以双流速法(药物流速2.5 mL/s+生理盐水流速3.0 mL/s)注射非离子型对比剂碘佛醇(320 mg I/mL)1.2 mL/kg。
1.3 图像处理及分析
图像后处理采用GE后处理工作站,图像重建层厚为1.25 mm,采用mpr重建方式进行冠状位及矢状位三维重建。
由两名主治以上职称的医师独立阅片,判断结节的CT表现,意见一致则纳入研究,意见不一致由第3位主任医师复阅判断。主要观察结节密度、结节边缘特征及结节内部特征等影像学表现。根据密度将肺结节分为3类:纯磨玻璃样结节、混合性结节(mGGO)、实性结节。结节的边缘特征主要有毛刺征、分叶征、血管集束征、胸膜凹陷征。结节的内部特征主要观察空泡征,在CT上表现为孤立结节中夹有小的低密度透亮泡影,多呈圆形、卵圆或小条状影,形态不规则,轮廓清晰或隐约可见,可单发或多发,大小约2.0 mm。
1.4 统计学方法
采用Microsoft Excel软件计算平均值,数据分析用SPSS 20.0软件,计数数据采用χ2检验或Fisher确切概率法进行分析,整体差异有统计学意义,则进一步行Bonferroni检验进行多重比较,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 102个肺微小结节的性质及分布
102个肺微小结节中,良性组25个,其中炎性结节21个、错构瘤3个、结核1个。癌前病变组27个,其中不典型腺瘤样增生10个、原位腺癌17个。恶性组50个,其中微浸润癌9个,肺腺癌40个,鳞状细胞癌1个。3组结节平均直径分别为(7.48±1.25)mm、(6.69±1.72)mm、(7.59±1.96)mm。恶性结节在左右肺及肺叶间(1个结节位于右主支气管内未纳入统计)的分布差异无统计学意义(P=0.935,0.936)。见表1。
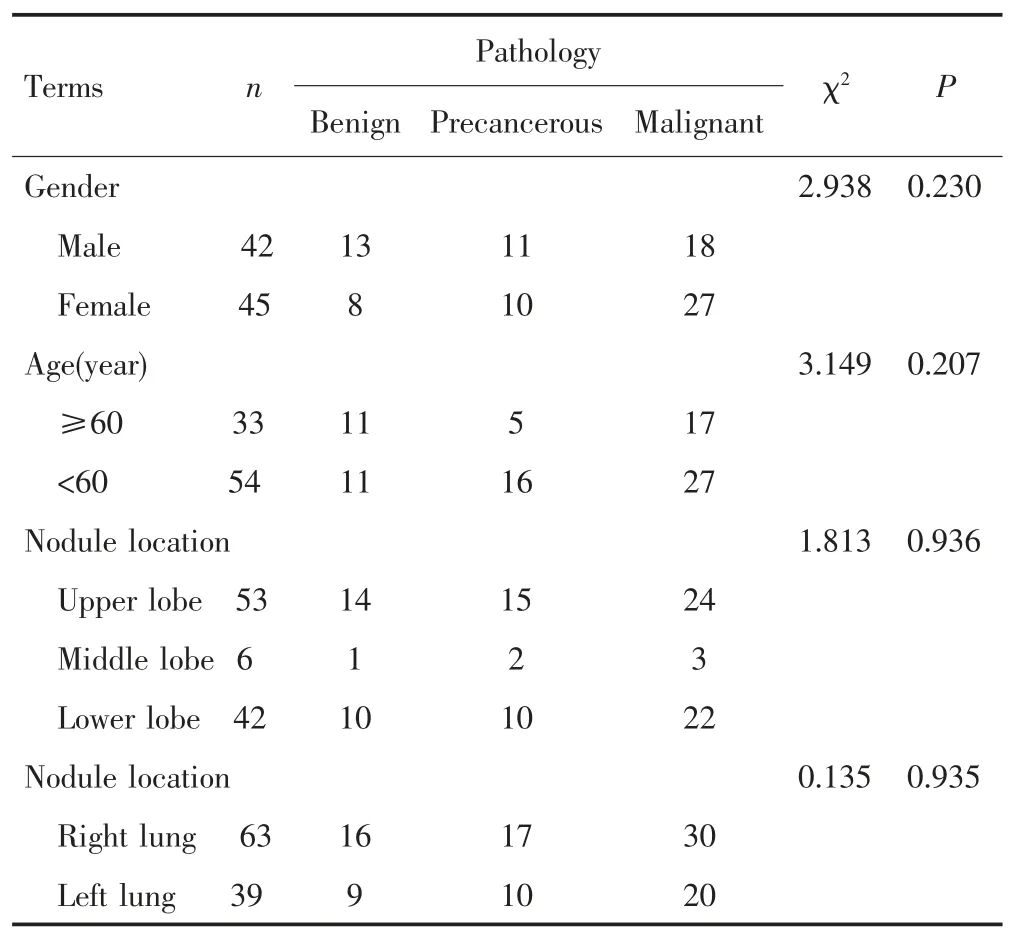
表1 102个肺微小结节的性质及分布Tab.1 Properties and distribution of 102 pulmonary micro-nodules
2.2 肺微小结节的密度
良性组、癌前病变组和恶性组结节密度组间差异有统计学意义(P<0.001),其中恶性组分别与良性组和癌前病变组比较差异均有统计学意义(P<0.001),而癌前病变组与恶性组差异无统计学意义(P>0.05),见表2,图1。
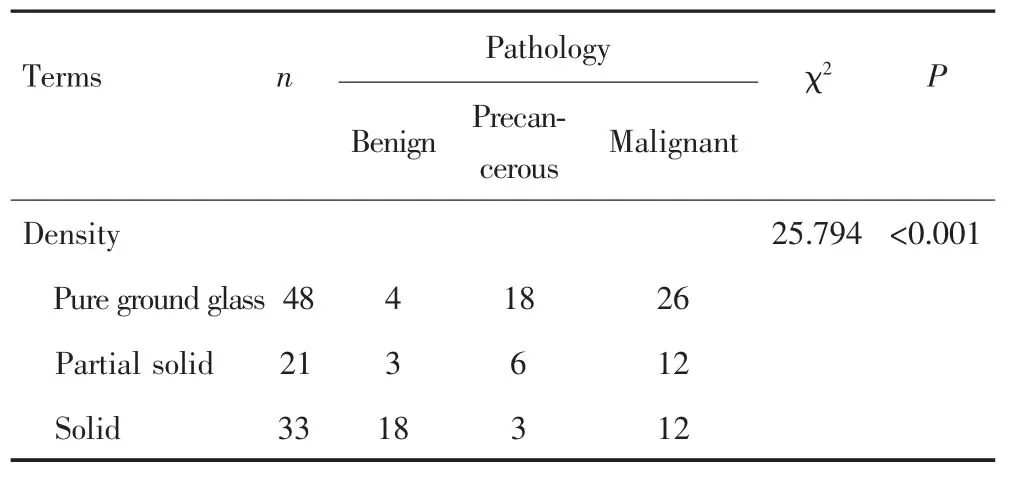
表2 结节密度与结节性质的关系Tab.2 The relationship between nodal density and nodule properties
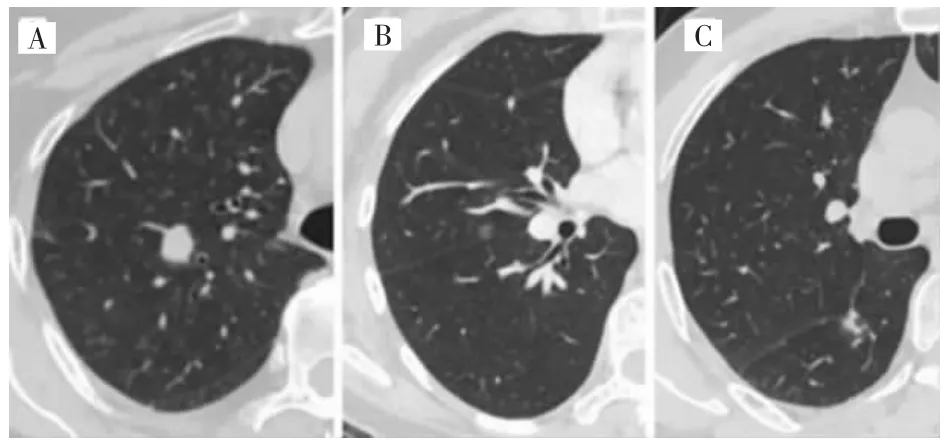
图1 不同密度的肺微小结节Fig.1 Pulmonary micro-nodules of different densities
2.3 肺微小结节的CT形态学征象
102个肺微小结节中出现毛刺征53个,其中良性组、癌前病变组、恶性组发生率分别44.0%、33.0%、66.0%,差异有统计学意义(P=0.015);恶性组毛刺征发生率明显高于其余两组(均P<0.05)。53个毛刺征结节中,长毛刺5个(良性组2个、癌前病变组和恶性组各1个),短毛刺49个(良性组9个、癌前病变组8个、恶性组32个),见表3。
出现分叶征结节38个,良性组、癌前病变组、恶性组发生率分别为18.0%、28.5%、52.0%,差异有统计学意义(P=0.008)。恶性组出现分叶征的发生率明显高于其余两组(均P<0.05),见表3。38个分叶征结节中,仅癌前病变组有深分叶1个,其余37个均为浅分叶,浅分叶在3组的占比分别为18.9%、10.8%、70.3%。
伴有血管集束征结节共60个,良性组、癌前病变组、恶性组发生率分别为28.0%、66.7%、70.0%,差异有统计学意义(P=0.001);恶性组明显高于其余两组(均P<0.05),见表3。60个伴有血管集束征结节中,31个结节表现为血管增粗且走形,29个结节表现为血管增粗或走形;其中良性组7个结节表现为贴边走形或穿行,无血管增粗扭曲;癌前病变组13个结节表现为贴边走形或穿行但无增粗扭曲,5个表现为穿行并血管增粗、扭曲;恶性组26个结节表现为穿行并血管增粗扭曲,9个表现为贴边走形或穿行但无血管增粗扭曲,见图2。
有胸膜凹陷征结节共20个,良性组、癌前病变组、恶性组发生率分别为8.0%、11.1%、30.0%,差异有统计学意义(P=0.033);恶性组明显高于其余两组(均P<0.05),见表3。其中良性组均表现为邻近胸膜局限性增厚;癌前病变组2例表现为邻近胸膜局限性增厚,1例表现为与胸膜相连的细线影;恶性组1例表现为邻近胸膜局限性增厚,14例表现为与胸膜呈宽基底的三角形影或细线影。
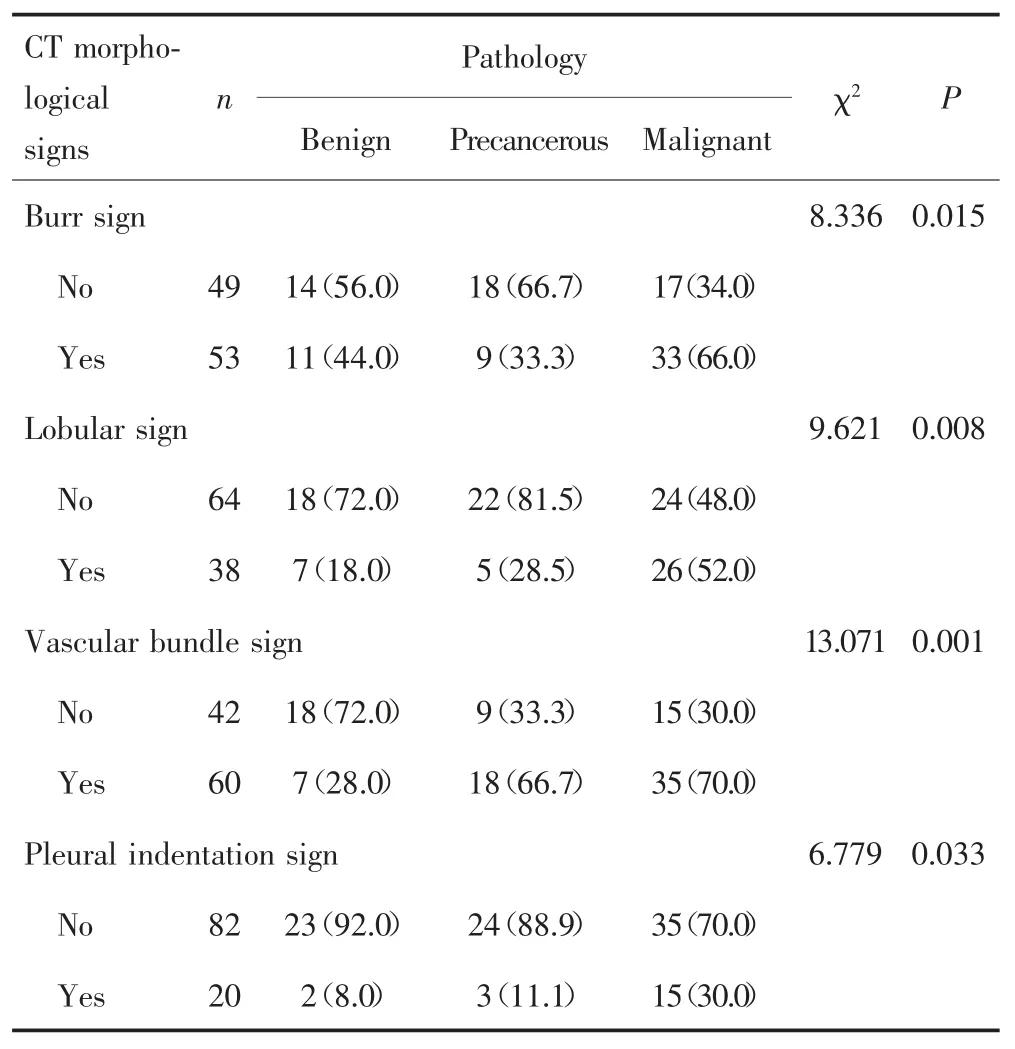
表3 不同性质肺微小结节的CT形态学征象[n(%)]Tab.3 CT morphological signs of different properties pulmonary micro-nodules[n(%)]
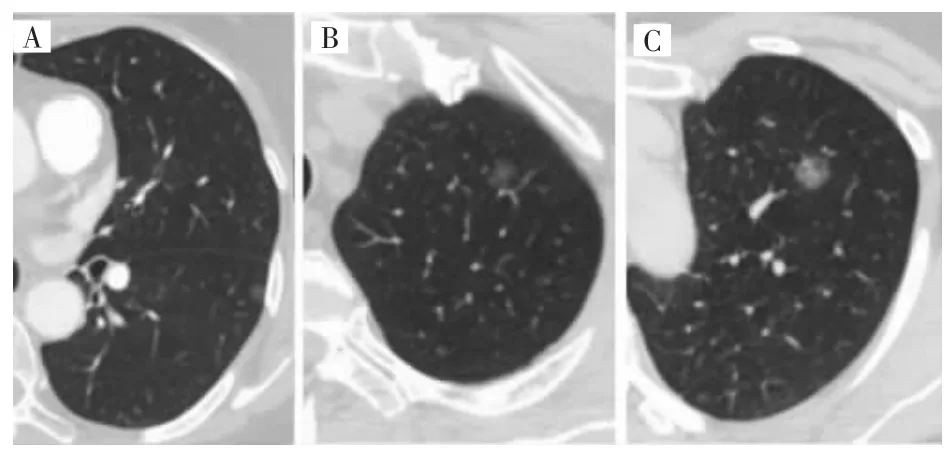
图2 不同性质肺微小结节的血管集束征表现Fig.2 Vascular bundle sign manifestation of different properties pulmonary micro-nodules
2.4 肺微小结节的内部特征
102个肺微小结节中伴空泡征共25个,良性组、癌前病变组、恶性组发生率分别为16.0%、25.9%、30.0%,差异无统计学意义(P=0.433)。3组空泡分布情况(图3):良性组位于中央及边缘各2个;癌前病变组位于中央及边缘各3个;恶性组位于中央2个,位于边缘13个。102个结节中87个瘤-肺界面清晰,15个结节瘤-肺界面不清,其中良性组、癌前病变组、恶性组发生率分别为16.0%、22.2%、10.0%,差异无统计学意义(P=0.341)。

图3 不同性质肺微小结节的空泡分布Fig.3 Vacuolar distribution of different properties pulmonary micro-nodules
3 讨论
肺部结节可由多种疾病引起,如良性炎症、出血、结核、真菌感染等,包括良性病变、癌前病变及恶性病变。其中不典型腺瘤样增生和原位癌根治术后无症状生存率几乎为100%,故2011年肺腺瘤新分类将两者归为癌前病变;恶性病变包括微浸润癌、原发性肺癌、转移瘤等[4]。肺微小结节的影像学特点不明显,难以诊断。多层螺旋CT密度、空间分辨率高,可多角度全面观察肺部结节位置、形态、大小、内部以及边缘情况,有利于肺部结节鉴别诊断[5-6]。
恶性结节毛刺形成的病理基础为癌细胞浸润邻近的支气管血管鞘或局部淋巴管,毛刺大多短而细密;而良性结节毛刺的形成多为纤维结缔组织增生所致,毛刺大多长而柔软。本组病例中出现毛刺征的肺微小结节共53个,其中恶性结节33个,恶性组中32例均表现为短毛刺,仅1例表现为长毛刺,符合病变的病理基础,亦与徐峰等[7]研究结果相符。说明毛刺征在恶性病变发生率较高,是判断恶性肺微小结节的重要CT征象。
本组病例表现为分叶征的结节共38个,其中浅分叶37个,且浅分叶中26个为恶性结节。微小结节一般生长较缓慢,尤其是表现为磨玻璃密度的结节,肿瘤细胞多以附壁生长为主,瘤体向肺小叶内扩散过程中未受血供或支气管限制,导致恶性微小结节的分叶征多表现为浅分叶。因此,对于微小结节,浅分叶亦不容忽视,可作鉴别良恶性及癌前病变的一个重要征象。但本组病例仅1个结节表现为深分叶(病理检查证实为原位腺癌),与目前认为深分叶为肺癌的特异性征象的观点不一致[8],可能是由本研究纳入病例均为微小结节所致。
本研究还发现血管集束征在恶性组发生率较高,且良恶性血管集束征的CT表现也有差异,主要表现为良性结节与癌前病变结节大多表现为血管贴边走形或穿行,无血管增粗扭曲,而恶性结节主要表现为穿行且增粗扭曲。可能是由于良性结节由炎症刺激小支气管血管增生,相应支气管血管不进入病灶内部而紧贴附于包膜外,因此不影响良性病变的外形轮廓;而恶性结节主要是由于瘤体内部瘢痕纤维收缩,通过外周肺支架系统将邻近的小血管、支气管向瘤体方向牵拉,同时肿瘤生长破坏血管并形成新生血管,而新生血管缺乏肌层,因此易增粗扭曲。此外,当出现胸膜凹陷征时也应警惕恶性结节可能性,本组病例中恶性组胸膜凹陷征的发生率明显高于其余两组,且恶性组胸膜凹陷征大多数表现为以宽基底紧贴胸膜并尖端指向肺内三角形影或细线影,而良性组主要表现为胸膜增厚,这对判断结节性质亦有一定参考价值。
空泡征的病理基础一部分为结节中正常或(和)气肿的肺组织由于结节内瘢痕组织收缩使残留的肺组织发生泡性肺气肿,故而局部出现低密度泡状影;一部分为肺组织坏死少量排出或坏死组织脱水,体积缩小而形成小空泡[9]。空泡征被认为是恶性肿瘤特有的征象,在鉴别肺癌和良性结节中有重要价值[10]。本研究中恶性组空泡征的发生率虽然高于良性组和癌前病变组,但差异无统计学意义。有研究[11]报道,伴有空泡的肺癌病理类型可包括腺癌、支气管肺泡癌、鳞癌、小细胞癌等,但主要以腺癌为主。本研究亦发现23个恶性肺微小结节中出现空泡征的7个结节均为肺腺癌。此外,还发现空泡位置对判断肺微小结节性质有一定提示作用,当空泡发生于结节边缘时恶性可能性大。
本研究发现,肺微小结节在CT征象上具有一定特征性,应综合结节分布、结节密度、分叶征、毛刺征、血管集束征、胸膜凹陷征及空泡征等特点进行鉴别诊断,尤其当结节内出现增粗、扭曲的血管时应进一步警惕恶性结节诊断。
