基于梯度稀释法分析细菌多样性对土壤碳代谢的影响
2020-03-27张秀娟安丽芸李君剑
张秀娟,安丽芸,刘 勇,刘 菊,李君剑,*
1 山西大学黄土高原研究所, 太原 030006 2 山西省林业科学院, 太原 030012
微生物对于许多生态系统而言是必不可少的一部分,作为土壤的重要组成部分,土壤微生物在土壤的元素循环中发挥着重要作用[1]。虽然生物多样性目前已被确定为推动生态系统循环过程的一个重要驱动力,但土壤微生物群落丰富的多样性使我们对其物种多样性功能的了解甚少,并且有学者提出,不同土壤微生物间存在着功能冗余[2]。功能冗余观点认为,在生态系统中,微生物多样性的减少几乎不会对生态系统造成影响,其他微生物可以承担丧失物种的功能,一个物种的丧失可以由另一物种来替代。但Pierre等[3]通过研究,发现微生物群落组成的变化改变了群落在不同时空尺度上的整体功能属性,从而提出了不同观点。
土壤的碳循环是生态系统碳循环的重要组成部分,该过程中有极其丰富的微生物参与,但目前国内外学者对影响土壤碳代谢过程因素的研究多集中于土壤的水温,土地利用方式和土壤碳氮含量等方面[4- 8],而关于土壤微生物多样性在土壤碳循环过程中是否存在功能冗余尚未存在明确的结论。因此开展土壤微生物多样性对土壤碳代谢影响的研究对我们了解土壤固碳微生物的功能及土壤的碳循环过程具有重要意义。本研究采集山西省庞泉沟自然保护区阔叶混交林0—10 cm 处表层土壤为土壤样品,通过浓度梯度稀释法改变土壤中原始细菌群落的多样性,该方法与传统的人工配置方法相比,可更加真实反映自然土壤生态系统中微生物多样性减少对土壤碳代谢的影响。经过6周预培养后测定不同稀释处理下土壤样本中细菌的丰度及基因多样性指数(ACE、Chao1、Shannon)。于各土壤样品中加入等量葡萄糖(0.5 g/100 g干土)继续培养,期间采用碱式滴定法测定土壤碳矿化速率,利用Biolog Eco板实验分析不同稀释处理下土壤样本中细菌的功能多样性指数(Shannon指数(H)、Simpson 指数(D)、McIntosh指数(U))及碳源利用模式,通过以上指数综合分析土壤微生物多样性对土壤碳代谢过程的影响。
1 材料与方法
1.1 样品采集及稀释处理
于山西省庞泉沟自然保护区阔叶混交林(111°22′—111°33′E、37°45′—37°55′N),清除表面覆盖物,采集0—10 cm 处表层土壤。该样品土壤类型为褐土,土壤有机碳含量为(26.27 ± 1.87) g/kg,全氮含量为(1.79 ± 0.09) g/kg,pH 为7.26 ± 0.04。将所得的土壤样品分为两份放入袋中,一份于4 ℃冰箱保存,一份风干后过 2 mm 孔径土壤筛。
取已过2 mm 土壤筛的风干土样进行高压蒸汽锅灭菌处理。同时配置不同稀释梯度的土壤悬浊液:将100 g 新鲜土样加入盛有300 mL 无菌蒸馏水的三角瓶中,放于恒温床震荡摇匀20 min,使土样与水充分混合,分散菌体,得到100 mL土壤悬浮液,通过梯度稀释将土壤悬浮液稀释为10-1、10-3和10-5倍数的土壤悬浮液(D1、D3和D5处理)。将3种稀释处理的土壤悬浊液接种于灭菌的土壤样品中,共3个稀释梯度,每个梯度3个重复,20℃条件下预培养6周,为细菌群落定殖提供时间。
1.2 DNA提取、定量PCR及高通量测序
预培养6周结束后,测定3种处理下土壤样品中细菌群落的丰度及其基因多样性。使用Ultra-clean TM土壤DNA分离试剂盒(MoBio Laboratory,USA)从0.25 g土壤中提取各稀释条件下土壤DNA。通过定量PCR测定土壤细菌丰度,定量PCR的引物、反应体系和条件如下:引物为338F(5′-ACTCCTACGAGGAGCA- 3′)和534R(5′-TTACCGCGGCTGCTGGCAC- 3′),反应体系为20 μL:7.6 μL ddH2O,10.0 μL SYBR®Premix Ex TaqTMⅡ,2.0 μL样本DNA,PCR条件为:95℃变性10 min;95℃变性30 s,53℃退火45 s,72℃延伸90 s,35个循环。
利用引物341F (5′-CAGACAT (barcode)ACTCCTACGGGAGGCAGCA- 3′)和806R(5′-GGACTACHVGGG TWTCTAAT- 3′)对16S rRNA的V3—V4区进行PCR扩增,并使用Illumina MiSeq平台对细菌16S rDNA进行双端测序,随后在Greengenes数据库(Release 13.8, http://greengenes.secondgenome.com/)进行基因比对,获得各稀释样品中细菌群落的基因多样性指数(ACE、Chao1、Shannon)。此处的多样性指数是指基于分类学的多样性指标(taxonomic diversity),这些指标在一定程度上反映了群落或生态系统的某些特性,其中,Chao1和ACE指数反应细菌群落的丰富度,指数越大,群落的丰富度越高;Shannon指数综合反应细菌群落的丰富度和均匀度,Shannon指数越大,群落的多样性越高[9]。
1.3 碳矿化速率及土壤微生物功能多样性的测定
由于预培养期间各土壤样品碳源大量消耗,为进一步探究各细菌多样性梯度下土壤样品的碳代谢情况,预培养结束后,于不同稀释梯度的土壤样本中加入等量碳源(本实验选用葡萄糖为碳源),葡萄糖加入量为每100 g干土0.5 g。20 ℃下继续培养。期间采用碱式滴定法测定3种处理下土壤样品的碳矿化速率(每隔2 d 测定一次),直到培养期第30 d为止。
Biolog 是一种通过测定微生物对不同碳源利用程度的差异来反映微生物群落的总体活性和代谢功能的方法,该方法在研究空间及时间尺度上微生物群落变化有较好的应用[10-11],故本研究利用该方法进一步研究不同稀释处理下土壤样品的碳的代谢强度和代谢活性。将接种好培养期第14天时D1、D3、D5稀释处理下土壤样品溶液的测试板加盖,并于25℃下恒温培养7 d,每隔24 h在590 nm 下读取各孔的吸光度值,并根据吸光度数值分析计算3种不同多样性梯度的土壤细菌群落的孔平均颜色变化率(AWCD)及功能多样性指数(Shannon指数(H)、Simpson 指数(D)、McIntosh指数(U))以研究土壤微生物多样性对土壤碳代谢的影响,具体实验步骤和指数计算公式详见文献[11-12]。与上文提到的基因多样性指数不同,此处的多样性指数是通过Biolog ECO平板技术测定的孔平均颜色变化率(AWCD)经过计算所得,Biolog ECO平板技术的是利用不同种类的微生物或不同微生物类群对碳源的利用能力不同而产生的不同碳源利用模式来表征微生物群落差异,故用以上3种指数表征细菌群落的功能多样性。
Biolog ECO平板技术测定的群落功能多样性指数是利用不同种类的微生物或不同微生物类群对碳源的利用能力不同而产生的不同碳源利用模式来表征微生物群落差异[11]。其中,Shannon 指数(H)可反映土壤微生物群落的种类和均匀度;Simpson 指数(D)可以反应群落中的优势物种,评估土壤中微生物群落优势度;McIntosh 指数(U)可用来区分不同的碳源利用程度[13]。
1.4 数据处理
采用Excel 2010 软件对数据进行初步统计分析;用SPSS 23.0软件对3种处理下土壤样品的细菌拷贝数、基因多样性指数、累积碳矿化量、孔平均颜色变化率(AWCD)、功能多样性指数进行单因素方差分析(One-way ANOVA)分析,并采用最小显著差数(Least significant difference,LSD)进行差异显著性检验;用Canoco 4.5 软件对土壤生物群落31种碳源的AWCD值进行主成分分析(Principal component analysis, PCA),并作图;用Origin9.0软件制作文中所有统计图表。
2 结果
2.1 稀释处理对土壤细菌群落的影响
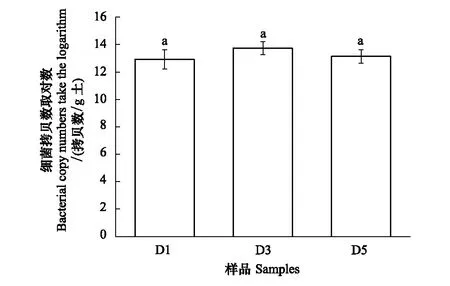
图1 不同处理下土壤细菌丰度Fig.1 The bacterial abundance in different treatment 相同字母表示无显著差异(P<0.05); D1:稀释倍数为 10-1的土壤悬浮液 Dilution1; D3: 稀释倍数为10-3的土壤悬浮液 Dilution3; D5: 稀释倍数为10-5的土壤悬浮液 Dilution5
本研究为探明预培养实验对3种稀释处理下土壤细菌群落的影响,在预培养6周后,采用定量PCR来定量不同稀释梯度样本土壤中细菌群落的DNA拷贝数,用其表征3种处理下土壤样品中的细菌丰度。结果如图1所示,预培养结束后,不同土壤样本中细菌的DNA拷贝数相似,且没有显著性差异(P<0.05),这表明经预培养6周后,梯度稀释处理对微生物丰度的影响基本消除。
通过高通量测序分析不同稀释浓度下土壤细菌群落的基因多样性,以探究梯度稀释处理和预培养实验对土壤样品中细菌群落多样性的影响。采用多种多样性指数表示不同稀释处理中土壤细菌物种的丰富度和多样性的变化,结果如表1所示:除ACE指数外,D1样本中微生物群落Chao1指数与Shannon指数均高于D3和D5处理,且D1处理显著高于D5处理(P<0.05)。3种处理下的ACE多样性指数之间虽无显著差异(P<0.05),但稀释倍数最大的D5处理土壤样品中微生物群落ACE指数最低。由此可以断定,不同稀释处理下土壤样品中微生物多样性不同,稀释处理改变细菌群落的多样性,且预培养实验并未消除稀释处理对各样本土壤中细菌群落多样性的影响。由此,得到含有有显著基因多样性差异但无明显丰度差异细菌群落的3种土壤样品(P<0.05),为后期研究提供实验基础。

表1 不同土壤样本基因多样性指数
不同字母表示有显著差异(P<0.05);D1:稀释倍数为 10-1的土壤悬浮液 Dilution1; D3: 稀释倍数为10-3的土壤悬浮液 Dilution3; D5: 稀释倍数为10-5的土壤悬浮液 Dilution5
2.2 微生物群落多样性对土壤碳矿化速率及碳矿化量的影响
为探究3种细菌多样性条件下土壤碳代谢情况,本研究在预培养实验结束后,于3种土壤样品加入等量葡萄糖继续培养,期间测定并计算培养期0—30 d各土壤样品的碳矿化速率(图2)。由图2可知,整个测量期间,3种稀释处理下土壤样品的碳矿化速率总体大小排序为:D1 > D3 > D5,且各处理下每个测量时间点的土壤的碳矿化速率均不同,由此可见各土壤样品中细菌群落的多样性持续影响土壤的碳矿化速率。3种稀释处理下土壤样品的碳矿化速率变化存在阶段性特征,即,D1、D3、D5处理下土壤样品的碳矿化速率在培养期第2 —4天急剧增长,且出现第一个峰值(约0.4 g mg-1d-1),之后平稳增长;培养期第8 —10天,除D5处理,D1、D3处理下土壤样品的碳矿化速率开始急剧增长,并出现第二个峰值(约0.8 g mg-1d-1)之后趋于平稳,直到培养期第26 d,D1、D3、D5处理下土壤的碳矿化速率开始下降。
测量结束后,对D1、D3 和D5处理下土壤样本中30 d的累积碳矿化量做单因素方差分析并做差异性检验,结果如图2。D3、D5处理下土壤样品累积碳矿化量较D1处理分别降低了3.43 mg/g(17.77%)和1.94 mg/g(10.04%),且D1 处理累积碳矿化量显著高于D3 和D5 处理(P<0.05);D5处理较D3处理累积碳矿化量降低了1.49 mg/g(8.59%),且D3处理累积碳矿化量显著高于D5处理(P<0.05)。综上,土壤微生物多样性的减少会降低土壤的碳矿化速率及其累积碳矿化量。

图2 培养期间土壤碳矿化速率分析 Fig.2 Analysis of Cumulative amount of soil carbon mineralization rate during cultivation不同字母表示有显著差异(P<0.05)
2.3 土壤微生物利用31种碳源特征分析
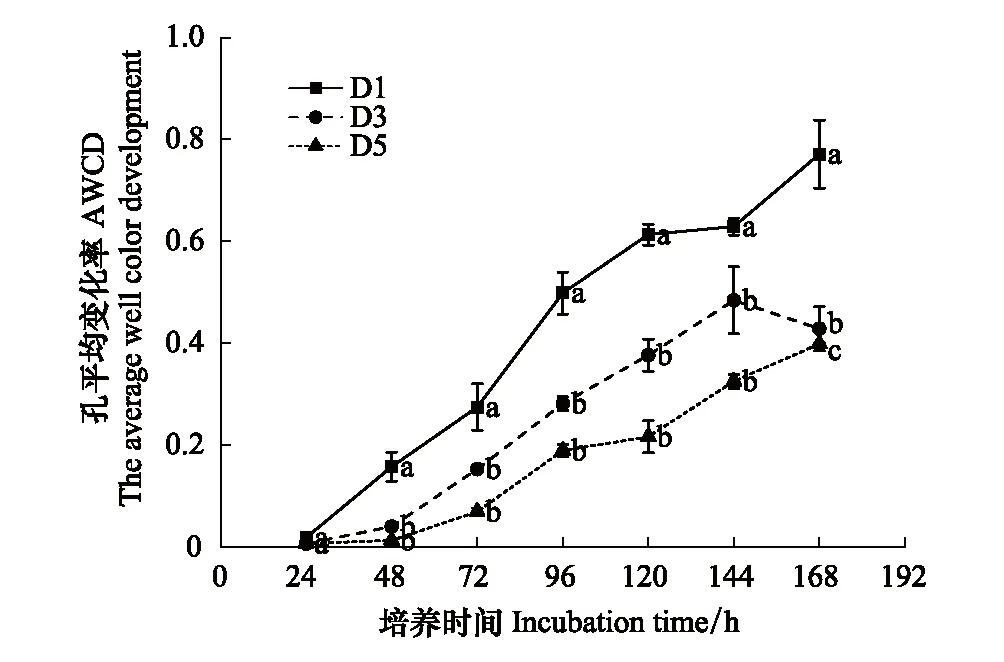
图3 各稀释处理下土壤微生物培养过程中平均颜色变化率(AWCD)Fig3 AWCD changes of soil microbial communities in three tested soils不同字母表示有显著差异(P<0.05)
平均颜色变化率(AWCD) 是表征土壤微生物活性的重要指标,其值的变化可以反映土壤微生物对某一碳源的利用能力,AWCD 值越大,表明土壤中微生物活性越高,对碳源的利用能力越强[14]。对培养期第14天整个测量时间段每隔24 h测定计算的AWCD进行分析,结果如图3。每一个微板在接种培养期第14天的土壤细菌悬浊液后,随着时间的延长,其平均吸光值(AWCD)逐渐增加,说明随着培养时间的延长3种处理下土壤细菌对碳源的利用强度逐渐增强。且D1处理的AWCD值显著高于D3、D5处理(P<0.05),说明D1处理下的土壤中细菌群落的微生物活性最大,碳源利用效率最高。第14天测量时间段内3种稀释处理下的AWCD值在24—96 h的斜率最大,表明在该时间段,样品中微生物生长最为迅速,碳源代谢强度迅速增强;之后各处理的AWCD 增长速率均有所降低且趋于稳定,可见在第14天时采用96 h的吸光值分析更能真实地反映实际情况。
群落功能多样性指数可以反映土壤微生物群落对不同类型碳源的利用差异,各稀释条件下培养期第14天时土壤样品中细菌群落功能多样性指数如表2所示。与AWCD 相似,D1处理的Shannon指数、McIntosh 指数均最大,且与D3、D5处理均有显著差异(P<0.05),表明稀释10-1处理下土壤样品中细菌群落的物种多样性、分布的均匀程度及其对源利用强度较10-3、10-5处理高。D3处理的McIntosh 指数和Shannon指数均显著高于D5处理(P<0.05),但D1、D3、D5处理下的土壤微生物Simpson 指数无显著性差异(P<0.05),说明10-1、10-3、10-5稀释处理对土壤样品细菌群落中的优势种影响不大。

表2 土壤微生物功能多样性指数和AWCD
不同字母表示有显著差异(P<0.05)
2.4 土壤微生物生理碳代谢指纹图谱分析
研究微生物对微平板上不同碳源利用能力的图被定义为Biolog 代谢指纹图谱,其有助于较为全面地了解微生物群落代谢功能特征[12]。测定培养第14天,96 h 3种稀释处理下土壤微生物对31 种单一碳源的代谢能力(AWCDi值),得到土壤微生物生理碳代谢指纹图谱(图4)。由图4可知,D1处理下的土壤样品中土壤微生物对31种碳源的利用能力高于D3、D5处理,且3种稀释处理下的土壤微生物对酯类、碳水化合物类、氨基酸类和胺类碳源的利用能力较强。培养期第14天,土壤代谢指纹图谱中D1处理下AWCDi≥ 0.8的碳源有8种(酯类3种,醇类1种,酸类1种,氨基酸类2种,胺类1种),占总碳源的64.41%;D3处理下AWCDi≥ 0.8的碳源有1种(酯类1种),占总碳源的9.61%;D5处理下AWCDi≥ 0.8的碳源有1种(氨基酸类1种),占总碳源的11.54%。此外,除碳水化合物类碳源,D1处理下的土壤微生物对其他五类碳源的利用强度远高于D3、D5处理。D3处理下土壤微生物碳源利用代谢功能与D1相比差异显著的碳源分别有13种(P<0.05);D5处理下土壤微生物碳源利用代谢功能与D1相比差异显著的碳源分别有14种(P<0.05);D3与D5处理下土壤微生物对31种碳源的利用代谢功能差异不十分显著(P<0.05),碳源利用代谢功能有显著性差异的碳源仅有1种(P<0.05)。说明10-1稀释处理使土壤微生物对单一碳源的利用能力发生改变,而10-3、10-5浓度的稀释处理对土壤微生物对单一碳源的利用能力影响较10-1稀释处理小。

图4 土壤微生物生理碳代谢指纹图谱Fig.4 Metabolic fingerprint of carbon level physiological profiles of microbial community B1—A3:酯类;E1—G2:碳水化合物类;H2—D2:醇类;F2—H3:酸类;A4—F4:氨基酸类;G4—E2:胺类;AWCDi值为Biolog板上3次重复的平均值;*标注显著差异性,P<0.05,“*”代表与D1处理显著性差异,“**”代表与D1、D3处理均有显著性差异
2.5 土壤微生物对碳源利用多样性的主成分分析
采用第14天,96 h的吸光值对土壤微生物群落碳源利用情况进行主成分分析,分析不同稀释处理下土壤微生物群落功能的综合差异和相似状况,结果见表3。从31个因子中共提取了6个主成分因子,累积方差贡献率达到了95.79%,从中选取累积方差贡献率达到72.71% 的前两个主成分PC1 和PC2(特征根分别为15.87和6.67) 来分析微生物群落功能多样性。
从图5可以看出,不同稀释处理在PC 轴出现了明显的分异,整体可分为3大类,D1处理,D3处理,D5处理各为一类,D1处理分布于Ⅲ区,D3处理分布于Ⅰ区,D5处理分分布于Ⅱ区。可见PC1 和PC2 能区分不同稀释处理土壤微生物的群落特征。
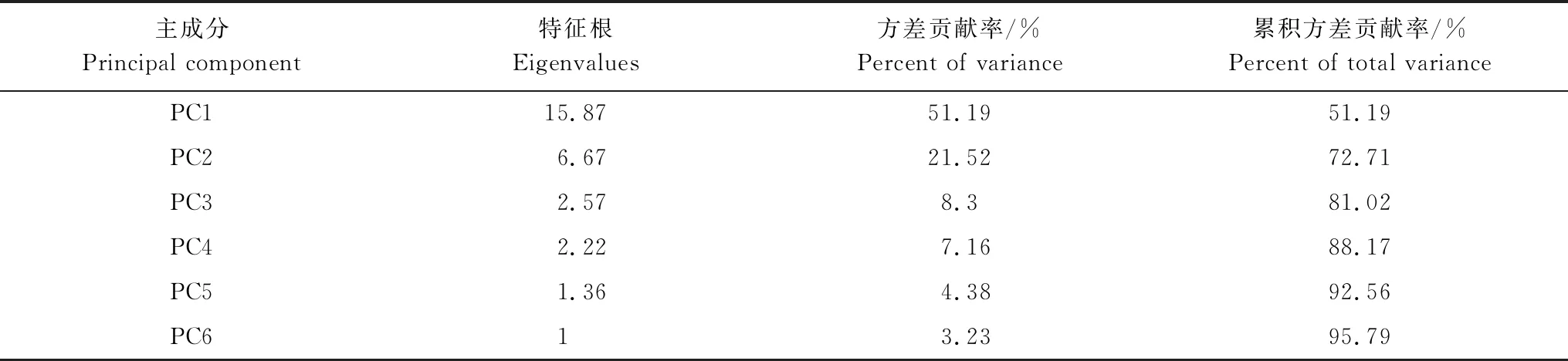
表3 主成分特征根
考虑到各个主成分反应的变异问题,本研究进一步计算了PC1与PC2的综合得分,结果见表4。不同处理在PC1 和PC2 上得分系数出现显著差异(P<0.05)。在PC1轴上,D1处理、D3、D5处理均有显著性差异(P<0.05);在PC2轴上,D1与D5处理无显著性差异,D3处理与D1、D5处理均有显著差异(P<0.05);从第一主成分第二主成分的综合得分来看,D1、D3、D5处理均有显著性差异(P<0.05)。说明这3种稀释处理下的土壤样品中土壤细菌群落具有不同的碳源利用模式,土壤细菌群落代谢功能不同。
考察PCA 的相关性矩阵可知,对前3个主成分贡献的特征向量系数大于0.60的碳源类型进行分析,结果见表4。培养时间为第14天时,对PC1贡献大的碳源有19种,其中,碳水化合物类,酯类和酸类均占21.10%,氨基酸类占15.79%。可见影响PC1的主要为碳水化合物,酯类和酸类,其次是氨基酸类;对PC2贡献最大的碳源为碳水化合物类,占37.50%;其次是氨基酸类,占25%。

表4 各时间不同处理下主成分得分
不同字母表示有显著差异(P<0.05)
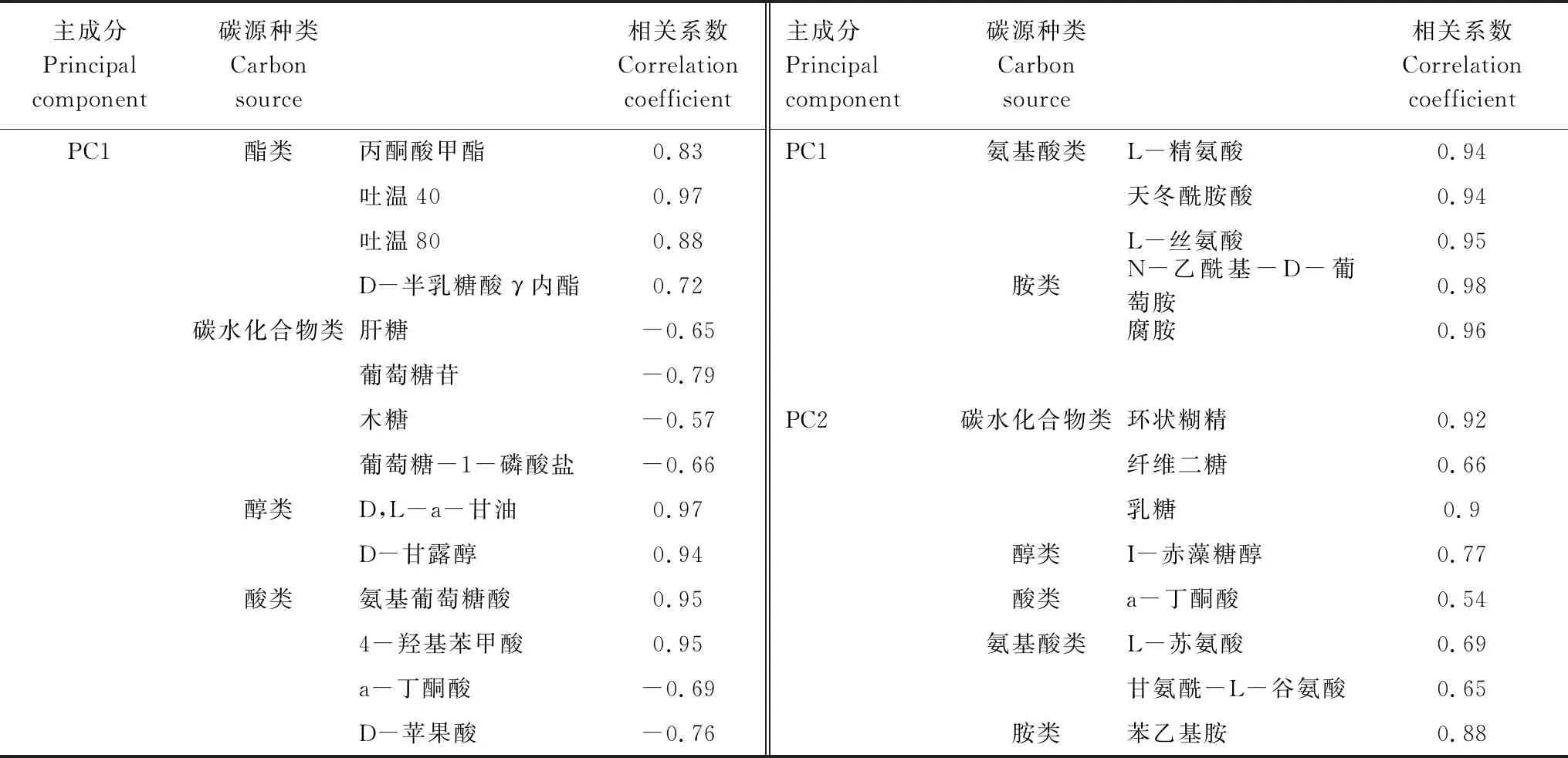
表5 主成分贡献的特征向量≥0.60 的碳源数目

图5 土壤微生物碳源利用特性的主成分分析(PCA) Fig.5 Principal component analysis (PCA) of carbon utilization of microbial communityD1:1—3,D3:4—5,D5:7—9
3 讨论
3.1 微生物群落多样性对土壤有机碳矿化速率的影响
梯度稀释的方法经常被用来做微生物分离计数和改变微生物多样性,该方法理论上可以通过稀释来减少微生物的丰度和多样性,移除稀有的微生物类群[15]。Davis等[16]通过梯度稀释法获得不同浓度接种物,并且从土壤中分离了许多新微生物种类,由此证实了梯度稀释法的作用。本研究为了消除因梯度稀释法接种微生物而造成的微生物丰度差异对后来实验中土壤碳矿化进程的影响,进行了为期6周的预培养实验,结果如图1,培养结束后D1、D3、D5处理下的土壤样品中细菌丰度无显著性差异(P<0.05),此结果与Philippot等[17]的实验结果一致,由此推断,预培养实验基本消除了梯度稀释处理造成的细菌丰度差异。为了评估预培养实验对D1、D3、D5处理下土壤样品中细菌多样性的影响,对预培养结束后3种稀释处理下土壤样品中的PCR扩增片段进行高通量测序,结果正如预期的一样,稀释处理导致土壤样品中微生物多样性整体下降。因此,我们基本可以确定之后实验中使土壤碳矿化速率变化的原因是由于由梯度稀释处理造成的土壤微生物多样性改变而非丰度差异。
土壤微生物作为参与土壤碳循环过程中的至关重要的一部分,其多样性对土壤碳代谢过程的影响是一个重要课题。为了探究该影响,本研究以土壤碳矿化速率为指标,对土壤微生物多样性对土壤碳矿化过程的影响进行说明。实验结果发现,加入碳源以后,3种处理下土壤样品碳矿化速率大小排序为:D1 > D3 > D5。且3种处理下土壤样品的碳矿化速率均有其特有变化趋势,培养前期D1、D3、D5处理下的土壤碳矿化速率均会出现一个峰值,当稳定增长一段时间之后D1、D3处理再次出现矿化速率峰值,D5处理继续稳定增长,之后时间段3种处理的土壤矿化速率变化基本稳定,直至培养后期开始降低。培养期前的峰值可能是由于,前期碳源的加入产生了激发效应,使易降解可利用的碳迅速释放,促进了微生物的活性,从而使土壤中的矿化作用显著增强;培养中期出现的又一峰值可能是因为:在培养中期,土壤中的有机碳得到活化且微生物对较难分解的有机碳及代谢产物利用能力增强,因此出现另一个呼吸小高峰[17- 20]。培养后期可能是由于加入的碳源中,易分解和较难分解的有机碳已被微生物利用,开始转向难分解部分,微生物对碳源的利用率降低,从而导致土壤的碳矿化速率开始下降。综上可得,土壤微生物群落多样性的减少会对土壤的碳矿化速率降低造成影响。另外,在测量结束后,对30 d D1、D3、D5处理下土壤样品中的累积碳矿化量做差异性分析,结果发现D1 处理显著高于D3、D5处理,D3处理显著高于D5处理(P<0.05)。因此,土壤微生物多样性的减少会降低土壤的碳矿化强度,减少土壤的累积碳矿化量,对土壤的碳矿化作用造成不利影响。
3.2 微生物多样性对碳源利用特征的影响
AWCD值用以衡量微生物利用不同碳源的整体能力,表征的是样品中微生物整体碳源代谢利用强度,其值越大表明样品具有较高的碳源利用能力, 往往也具有较高的微生物丰度[21]。在整个Biolog实验测量过程中,D1处理下土壤样品中的AWCD值与D3、D5处理存在显著性差异,而D3、D5处理之间并无显著差异(P<0.05)。造成该结果的原因可能是在一定限度内,微生物多样性的大小会对土壤碳矿化作用产生影响,而当多样性低于某一程度时,其多样性的大小对土壤的碳矿化强度影响较为微弱。3种稀释处理下土壤样品AWCD值的大小排序为:D1 > D3 > D5,可见与微生物多样性较低的土壤样品相比,微生物多样性较大的土壤样品碳代谢强度更大。造成该结果的原因可能是因为在许多不同物种的存在下,土壤微生物丰富的多样性增强了生态位互补效应并促进了微生物之间的相互作用,促使微生物对碳源的利用能力提高,最终使土壤的碳代谢强度增强[22]。由此可见,微生物多样性减少会降低土壤中微生物对碳源的利用能力,进而减弱土壤的碳代谢强度,影响土壤的碳代谢过程。
功能多样性指数是综合反映群落功能的指标,不同的功能多样性指数可以反映土壤微生物群落组成的不同方面,故将所有的指数结合起来可以综合全面的分析土壤微生物群落的功能多样性。从结果看(表2),梯度稀释处理改变了土壤样品中微生物群落的McIntash 指数(U)和Shannon指数(H),D1显著大于D3、D5处理,D3处理显著大于D5处理(P<0.05),由此可得D1土壤中的微生物群落功能多样性优于D3、D5处理,D3处理优于D5处理。但对于土壤样品中微生物的Simpson 指数(D),3种处理之间并无显著性差异(P<0.05),且3种处理的Simpson 指数(D)大小排序为:D5 > D3 > D1。产生该结果的原因可能是因为多样性的减少不仅不会影响土壤微生物群落当中的优势种,反而会降低种间竞争,使优势种因更加有竞争力而迅速增长,同时优势物种的定殖会加剧种群中其他微生物物种的生境位置丧失,导致次要物种种群流失,这对微生物群落的物种多样性减少也有一定的影响,且该影响产生的结果与本实验结果一致[23]。
主成分分析的结果表明,不同梯度稀释处理下土壤样品中的微生物群落功能多样性差异显著(P<0.05),PC1 和PC2 可以把D1、D3、D5处理很好地区分开来,其中与PC1 显著相关的碳源有19种,主要为酯类,碳水化合物类和酸类;与PC2 显著相关的碳源有6种,主要为氨基酸类和碳水化合物类。从碳代谢指纹图谱也可发现,D1处理下土壤样品中的土壤微生物对31 种碳源的利用能力几乎均大于D3、D5处理,其中D1处理下土壤微生物对酯类(吐温40、吐温80)、醇类(D-甘露醇)、酸类(氨基葡萄糖酸、半乳糖醛酸)、氨基酸类(L-精氨酸、天冬酰胺酸、L-丝氨酸)和胺类(腐胺、N-乙酰基-D-葡萄胺)的代谢利用能力显著高于D3、D5处理,而对碳水化合物类(环状糊精、肝糖)的代谢利用能力显著低于D3、D5处理(P<0.05)。造成该结果的原因可能是:稀释处理过后,D3、D5处理土壤样品当中利用碳水化合物类碳源的优势种群迅速定殖,使该土壤样品中微生物群落对碳水化合物类碳源的利用强度大大增强。由此D3、D5处理下土壤样品中的细菌群落对碳水化合物类碳源利用强度显著高于D1处理(P<0.05)。总体说来,D1处理下的土壤微生物群落对31种碳源的总体代谢功能大于D3、D5处理下土壤微生物群落,土壤微生物群落的多样性减少会对土壤中微生物对碳源的利用强度造成影响。
综上所述,土壤微生物多样性的减少会减弱土壤碳矿化过程,降低土壤对碳源的利用强度,进而减弱土壤的碳代谢强度,土壤的微生物多样性对土壤碳代谢过程有十分重要的影响。
4 结论
(1)梯度稀释处理可以改变土壤微生物群落的多样性,并且预培养时间可以基本消除梯度稀释处理造成的样本间生物量的差异而不影响其多样性。
(2)土壤微生物多样性的降低会使土壤的碳矿化速率减弱,碳源利用强度降低,进而影响土壤的碳代谢过程。
