小麦材料CH1532 抗白粉病基因的染色体定位
2020-03-26孔佳茜郭慧娟乔麟轶贾举庆张树伟常利芳阎晓涛任永康畅志坚张晓军
孔佳茜,郭慧娟,乔麟轶,李 欣,贾举庆,张树伟,常利芳,阎晓涛,任永康,畅志坚,张晓军
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院经济作物研究所,山西汾阳032200;3.山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西省主要农作物种质创新与分子育种重点科技创新平台,山西太原030031;4.山西农业大学农学院,山西太谷030801)
白粉病是普遍发生于小麦各个生育阶段的一种世界性病害,可造成小麦减产及品质下降[1]。随着矮秆品种的普遍种植及氮肥的大量使用,白粉病的危害日趋严重[2]。推广品种中抗源狭窄、抗病基因单一的生产现状,极易引起白粉菌生理小种的变异,使抗病品种丧失抗性,是小麦生产的重大安全隐患[3]。
迄今为止,国内外已从65 个位点上鉴定出85 个抗白粉病基因(Pm1~Pm65)[4-5],但在生产上应用的非常有限,大多数抗病基因已随着白粉菌的变异与扩展而失去抗性。因此,持续发掘与利用抗病资源,鉴定新的抗白粉病基因,并利用分子标记等技术进行抗白粉病基因聚合育种,增强现有品种的抗性,是小麦品种抗性改良的重大需求[6-7]。
CH1532 是通过远缘杂交选育的一个小麦新品系,系谱为:中8701//TAP8430/冀麦26,其中,TAP8430 为来源于长穗偃麦草的八倍体小偃麦[8],中8701 和冀麦26 为普通小麦。CH1532 成株期对白粉病具有优良抗性,苗期对多个小种表现为免疫或高抗,对小麦品种的抗病改良具有重要价值。
本试验对CH1532 的白粉病抗性进行了遗传分析,并利用SNP 芯片对其抗病基因进行了初步定位,旨在为研究与利用该抗源提供理论依据。
1 材料和方法
1.1 试验材料
抗病亲本CH1532、感病亲本台长29 及其F1、F2、BC1和374 个F2∶3家系用于白粉病抗性鉴定。所用的白粉菌菌株为E09,来自中国农业科学院植物保护研究所,以幼苗活体繁殖的方法保存。感病对照为台长29。
1.2 抗病鉴定
试验材料的抗病鉴定采用苗期接种鉴定的方法。将用于苗期抗病鉴定的小麦材料播种于72 孔育苗盘中,每孔播5 粒种子,重复4 次。感病对照台长29 播种于育苗盘四角及中心位置。种植约7 d后,小麦幼苗长至一叶一心,采用扫抹的方法人工接种白粉菌,且控制温度为16~21 ℃,湿度65%左右,利于白粉菌生长。待对照台长29 完全感病时,即可进行抗病调查。采用0~4 级分级标准[9]进行记录,IT=0,为免疫;IT=0;为近免疫;IT=1,为高抗;IT=2,为中抗;IT=3,为中感;IT=4,为高感。
1.3 抗、感病池的构建及SNP 芯片扫描
取少量台长29/CH1532 的F2群体单株及亲本叶片置于2 mL 离心管中,液氮冷冻后在Scientz-48型高通量组织研磨器上将叶片打碎,利用CTAB 法[10]提取基因组DNA。根据F2及F2∶3家系抗病鉴定结果,采用分离群体分组分析法[11]分别选取25 株极抗(反应型为0 或0;)或极感(反应型为4)F2纯合单株,每株取等量DNA 混合成抗病池和感病池,进行iSelect 90K SNP 芯片扫描。
1.4 SNP 结果分析及染色体定位
根据SNP 芯片扫描结果,筛选出抗亲和感亲间具有多态性的SNP 标记,进一步筛选出在抗、感病池间具有多态性的SNP 标记,去除信号缺失的标记和等位位点为杂合型SNP 的标记。对获得的SNP标记进行分析,根据SNP 侧翼序列,在中国春小麦全基因组序列(IWGSC RefSeq v2.0)中进行Blast N比对,获得筛选到的多态性SNP 位点的染色体位置信息,并利用染色体画图软件MapInspect 进行作图,根据SNP 标记的富集区域确定抗病基因所在染色体位置。
2 结果与分析
2.1 抗病性遗传分析
利用国内白粉病优势菌株E09 对台长29、CH1532 及其F1、BC1、F2及F2∶3家系进行接种鉴定,结果表明,CH1532 对E09 表现为免疫,台长29 表现为高感,其正反交F1全部表现为免疫,与抗病亲本CH1532 表现一致;与台长29 回交的45 株BC1中有25 株表现为免疫或近免疫,20 株表现为高感,抗感比例符合1∶1(χ2=0.556,P=0.456),说明CH1532 中的抗白粉病基因为显性核基因。374 个F2单株中有289 个单株表现为抗病(IT=0~2),85 个单株表现为感病(IT=3~4),抗感分离比例符合3∶1(χ2=1.030,P=0.310)(表1)。374 个F2∶3家系中,纯合抗病的有96 个,抗、感分离的有190 个,纯合感病的有88 个,抗感分离比例符合1∶2∶1(χ2=0.439,P=0.803)。因此推断,CH1532 的白粉病抗性受1 对显性核基因控制,暂命名为PmCH1532。
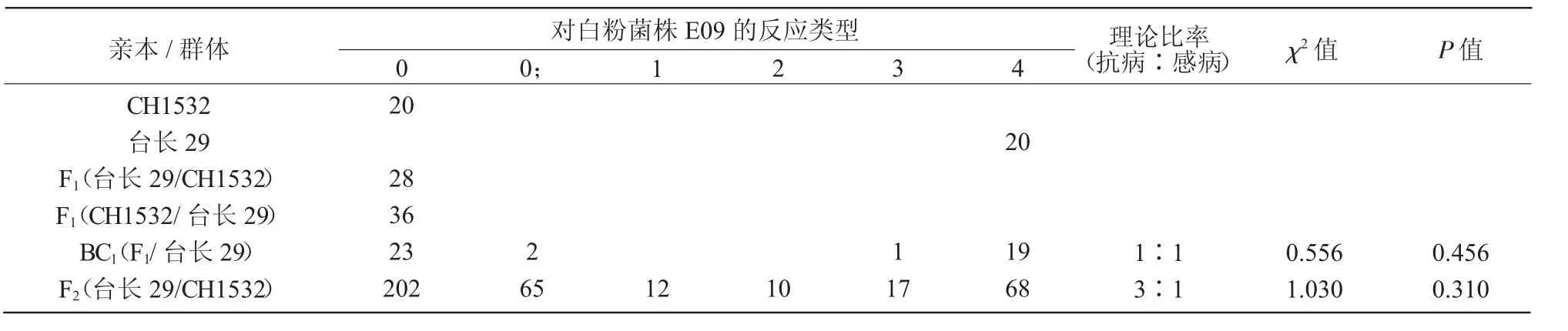
表1 台长29/CH1532 组合对白粉菌株E09 的抗性反应
2.2 SNP 结果分析及抗病基因的染色体定位
SNP 芯片扫描结果表明,在iSelect 90K SNP 芯片的81 587 个标记位点中,有7 870 个SNP 在抗、感亲本间具有多态性,占总标记数的9.65%;其中,有358 个SNP 在抗、感病池间具有多态性,占总标记数的0.44%;进一步去除信号缺失或等位位点为杂合型SNP 的标记,共获得89 个多态性SNP 标记。
根据NCBI(https://blast.ncbi.nlm.nih.gov/)公布的中国春小麦全基因组序列(IWGSC RefSeq v2.0),对89 个多态性SNP 标记的侧翼序列进行Blast N比对,获得其所在染色体位置信息。从图1 可以看出,多态性SNP 分布于小麦的14 条染色体上,其中,69 个位于小麦第2 同源群的3 条染色体上,占总数的77.5%,其余染色体上均为零星分布。而位于2A、2B、2D 染色体上的标记分别为14、11、44 个,分别占总数的15.7%、12.4%和49.4%。根据MapInspect 软件进行染色体作图,可以看出,SNP 标记在2A 和2B 染色体上分布较少,而在2D 染色体上多且分布集中(图2)。因此,推测抗白粉病基因Pm-CH1532 位于2D 染色体长臂的末端。
3 结论与讨论
单碱基多态性标记(Single nucleotide polymorphism,SNP),是随着测序技术和基因芯片技术发展起来的第3 代分子标记[12],具有密度高、位点丰富、遗传稳定性好及分析自动化等优势,已在生物、农学、医学、进化等领域得到了广泛应用[13-14]。目前,已开发出多款小麦SNP 芯片,包括9K、35K、55K、90K、660K 和820K 等,用于小麦连锁图谱构建、QTL 定位、遗传变异检测等研究[15-17],但在小麦新基因发掘与定位上应用较少。吴秋红等[18]利用90K SNP 芯片对河南省36 个小麦新品系进行了抗白粉病基因的规模化批量定位,证实了90K SNP 芯片在小麦基因分子标记定位方面的应用潜力。本研究采用其方法对小麦新品系CH1532 的抗白粉病基因进行了定位,结果表明,多态性SNP 富集于小麦第2 同源群的3 条染色体上,其中,位于Chr.2A 的有14 个,位于Chr.2B 的有11 个,位于Chr.2D 的有44 个。位于Chr.2D 的多态性SNP 显著多于Chr.2A 和Chr.2B,且在染色体上的分布更为集中,主要富集于2D 染色体635.60~650.32 Mb 区间。根据台长29/CH1532 遗传群体对白粉菌株E09 反应型的分离规律,CH1532 中仅含有1 对抗白粉病基因,因此,推测其所含有的抗白粉病基因PmCH1532 位于2D 染色体长臂的末端。有部分多态性SNP 分布于Chr.2A 和Chr.2B 上,可能是因为小麦的A、B、D 基因组之间存在较高的同源性[19],其序列也较为相似,导致该SNP 的识别序列存在于在2 个或3 个基因组中,这些SNP 侧翼序列的Blast N 比对结果也证明了这一点。
小麦白粉病是一种小种专化型真菌病害[20],由于白粉菌繁殖、适应能力强,变异快,小种复杂多样,极易引起抗病基因失效[21],因此,持续挖掘新的抗病基因是防治白粉病危害的一项长期任务。迄今,小麦上已定位了85 个抗白粉病基因,分布于除3D、4D、5A 之外的其他18 条染色体上[22]。2D 染色体上存在2 个抗白粉病基因Pm43[23]和Pm58[24],而Pm43 与本研究定位的PmCH1532 都位于2D 染色体长臂上,Pm58 则位于2D 染色体短臂上。根据对PmCH1532 与Pm43 进行的分小种接种鉴定结果,13 个白粉菌株中,它们对5 个菌株的抗性反应明显不同,因此,推测PmCH1532 是一个与Pm43 不同的新基因。本研究的下一步工作就是在SNP 芯片染色体定位的基础上,开发SSR 或KASP 标记,对PmCH1532 进行精确定位,获得该基因的精细图谱和连锁标记,以期为该基因在分子育种上的高效利用提供技术支撑。
