鹰嘴豆短肽的分步酶解法制备及其营养价值评价
2020-03-26叶健明石宁蕙杨群慧苏丽明周建中杨海燕
叶健明,石宁蕙,杨群慧,苏丽明,周建中,杨海燕
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
鹰嘴豆(Cicer arietinumL.)是世界第二大消费豆类,产量居世界豆类第三,是目前世界上栽培面积较广的食用豆类作物之一[1]。目前,中国对鹰嘴豆的食用主要以干制和鲜食为主,对鹰嘴豆蛋白的利用较少。蛋白质是核心营养素之一,可提供能量和氨基酸[2],因而氨基酸的组成、含量及其消化吸收后的生物利用率是营养质量评价的重要性指标[3]。鹰嘴豆富含人体所需的18种氨基酸[4],8种必需氨基酸种类齐全、组成均衡,是一种优质植物蛋白源[5]。Newman等[6]研究发现,鹰嘴豆蛋白的蛋白功效比值(PER)在2.8左右,消化率为79%~88%,对比试验表明鹰嘴豆蛋白质量与大豆蛋白相似。进一步开发、利用鹰嘴豆蛋白资源是解决蛋白质不足的办法之一,同时还能拓宽高附加值的鹰嘴豆产品。
近年来,功能性短肽的营养性、生理活性和应用价值已成为人们研究的热点,功能性短肽在体内比氨基酸更容易消化吸收[7-8],还具有多种功能,如抗菌肽可调节免疫功能和杀死癌细胞[9],抗氧化肽可以减少组织氧化[10],保护机体。在我国,小麦肽已经实现产业化,目前采用单酶作为工具酶水解蛋白很难在短时间内获得高水解度、高得率的功能性短肽,如何实现鹰嘴豆短肽产业化,已成为亟待解决的技术问题[11]。迟晓星等[12]采用A.S1398中性蛋白酶水解大豆分离蛋白,水解时间为360 min,所得酶解液水解度10%。马文鹏等[13]采用2709碱性蛋白酶水解鹰嘴豆分离蛋白,水解时间为360 min,所得酶解液水解度16.18%。周媛媛等[14]采用Protamex蛋白酶水解大豆分离蛋白,水解时间为240 min,所得酶解液水解度12.94%。刘冬等[15]采用菠萝蛋白酶水解花生蛋白,发现水解时间382.68 min时酶解液水解度达23.40%。吴建中[16]采用Alcalase水解大豆蛋白,水解时间为300 min,所得酶解液水解度为12.7%,短肽得率70%,采用Protamex酶继续水解Alcalase酶解物2 h,水解度可增至16%。可见,相比单酶水解,多酶分步酶解可提高短肽的得率和水解度。因此,本研究以碱溶酸沉得到的鹰嘴豆蛋白为原料,在鹰嘴豆蛋白碱性蛋白酶Alcalase水解研究的基础上,筛选合适的酶继续水解Alcalase水解物制备鹰嘴豆短肽,对进一步酶解工艺中的多种影响因素进行研究,利用氨基酸自动分析仪等测定鹰嘴豆短肽中的氨基酸组成及基本营养成分,评价鹰嘴豆短肽的营养价值,为鹰嘴豆短肽的产业化和进一步研究提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
鹰嘴豆蛋白,实验室自制。
风味蛋白酶(Flavorzyme,1.2×105U/g)、碱性蛋白酶(Alcalase 2.4 L,2.80×105U/g),丹麦 Novozymes公司产品;木瓜蛋白酶(Papain,5.02×105U/g)、复合蛋白酶(Protamex,1.653×105U/g)、中性蛋白酶(Neutrase,2.236×105U/g),广西南宁庞博生物工程有限公司产品;牛血清蛋白、福林酚试剂,购于北京市索莱宝科技有限公司;其他试剂均为国产分析纯。
1.1.2 仪器与设备
TU-1810型紫外分光光度计,HH-S4型数显恒温水浴锅,AL204型天平,TDL-5-A型离心机,PHS-3C型pH计,K1301型自动定氮仪,ALPHA 1-2LD Plus型冻干机,LC-3A型氨基酸自动分析仪,Waters 600型高效液相色谱仪,TSK-GEL 2000 SWXL色谱柱。
1.2 方法
1.2.1 鹰嘴豆蛋白的制备
脱脂鹰嘴豆粉→碱溶(料液比 1∶10(g/mL),温度 30℃,时间 90 min,pH 10.0)→离心(3 500 r/min,25min)→上层清液→酸沉(pH4.5)→离心(4000r/min,10 min)→真空冷冻干燥[17]。
1.2.2 蛋白酶的筛选
根据诺维信等公司提供各种蛋白酶最适作用范围,在各种蛋白酶的最佳条件下水解45 min(表1),分别测定各酶解物的得率和水解度。
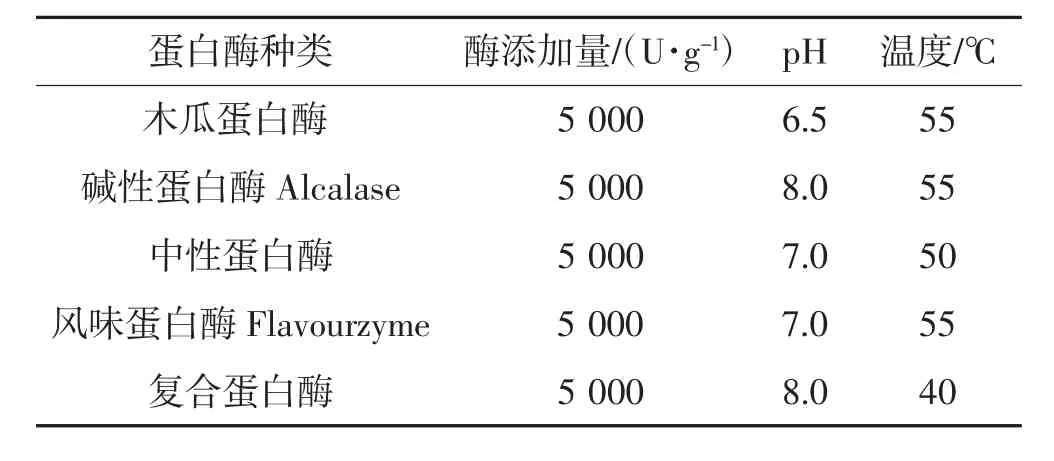
表1 蛋白酶酶解条件Table 1 Enzymolysis conditions of proteases
1.2.3 碱性蛋白酶Alcalase对鹰嘴豆蛋白的酶解
碱性蛋白酶Alcalase对鹰嘴豆蛋白的酶解条件为:水解温度50℃,酶与底物浓度比([E]/[S])为2%,pH 8.0反应时间40 min[18]。
1.2.4 复合蛋白酶制备鹰嘴豆短肽单因素试验设计
固定鹰嘴豆蛋白浓度为4%,在碱性蛋白酶Alcalase对鹰嘴豆蛋白酶解的条件上,其他因素基本条件为:中性蛋白酶和风味蛋白酶Flavourzyme用量比1∶1,酶总用量5 000 U/g,pH 7.0,反应温度55℃,水解时间210 min,在此基础之上考察复合酶用量(2 000、3 000、4 000、5 000、6 000、7 000 U/g)、pH(5.5、6.0、6.5、7.0、7.5、8.0)、酶解时间(90、120、150、180、210、240、270min)、酶解温度(40、45、50、55、60、65、70 ℃)对水解度(DH)和短肽得率(TCA-NSI)的影响。反应结束后90℃保温10 min灭酶,分别测定水解度和短肽得率。
1.2.5 响应面优化试验设计
采用Design-Expert 8.0.6软件进行响应面分析,以短肽得率(TCA-NSI)为响应值,对显著性影响因素进行优化,进而筛选出鹰嘴豆蛋白酶解的最优条件。依据Box-Behnken试验设计原理,对复合酶添加量、pH、酶解温度及酶解时间四个影响因素进行单因素试验。以单因素试验为基础,确定出响应面试验的因素和水平(表2)。

表2 响应面设计试验因素水平及编码表Table 2 Experimental factor level and coding table of response surface design
1.2.6 酶活力测定
采用改进的Folin-酚法进行测定[3]。
1.2.7 短肽得率测定
采用三氯乙酸(TCA)可溶性氮法[19]测定,短肽得率按下式计算:
式中:B为碱液体积,mL;Nb为碱液当量浓度,mol/L;∂为氨基的解离度;Mp为底物中蛋白质总量,g;Htot为底物蛋白质中肽键总数,mmol/g蛋白(鹰嘴豆分离蛋白Htot=7.22)。
1.2.9 鹰嘴豆酶解蛋白肽粉一般营养成分的测定
水分:参照GB 5009.3—2016[21]进行测定;蛋白质含量:参照GB 5009.5—2016[22]进行测定;脂肪含量:GB 5009.6—2016[23]进行测定;灰分:GB 5009.4—2016[24]进行测定;总糖:采用苯酚-硫酸法测定。
1.2.10 氨基酸组成测定
将鹰嘴豆短肽粉置于水解管中,加入6 mol/L的HCl溶液水解24 h,测定除色氨酸以外的氨基酸含量。其中色氨酸用NaOH碱水解后再测定。鹰嘴豆短肽粉营养价值评价[25-26]采用联合国粮食和农业组织(FAO)和联合国世界卫生组织(WHO)推荐的蛋白质模式,氨基酸分(AAS)=1 g受试蛋白质中氨基酸的毫克数×100/评分标准模式中相应必需氨基酸含量。
1.2.11 鹰嘴豆短肽分子质量分布的测定
在柱温30℃,流速0.5 mL/min,流动相(乙睛∶水∶二氟乙酸)=45∶55∶0.1(V∶V∶V),波长为 220 nm,色谱柱TSK-GEL 2000 SWXL(300 mm×7.8 mm)的条件下,采用高效液相色谱(HPLC)对酶解物的分子量分布进行分析。
1.2.12 数据处理
采用SPSS 21.0软件对数据进行统计分析,Tukey HSD检验进行数据多重比较,采用Origin Pro 8.0软件进行数据制图,Design Expert 8.0.6软件进行响应面设计及结果分析。
式中:TCA-NSI为三氯乙酸可溶性氮得率,%;N1为在15%TCA中的可溶性氮含量,mg;N2为原料中的总氮含量,mg。
1.2.8 水解度(DH)的测定
采用pH-Stat法测定[20],计算公式为:
2 结果与分析
2.1 鹰嘴豆短肽的一般营养成分
鹰嘴豆是一种脂肪含量较低、蛋白功效比值(PER)值较高、消化率较高的植物类食品,鹰嘴豆蛋白经酶解后得到短肽粉,其一般营养成分如表3所示。由表3可知,酶解后的鹰嘴豆短肽粉仍是一种高蛋白、低脂肪的产品,其蛋白质含量高达89.07%,脂肪低达0.86%,且水分和灰分都偏低。多糖是一种重要的生理活性物质,是人体内细胞进行代谢的能源,少量的多糖可以改善心脏和血液功能。

表3 鹰嘴豆短肽的一般营养成分(干基)Table 3 General nutrition components in the chickpea protein enzyme-hydrolysate powde(ron dry basis) 单位:%
2.2 蛋白酶的筛选
2.2.1 单一酶的筛选
酶种类是酶解过程中最重要的影响因素之一[27]。本试验以多肽得率和水解度为评价指标,分别选用5种蛋白酶水解鹰嘴豆蛋白。由图1可知,在各种蛋白酶的推荐使用条件下,复合蛋白酶、风味蛋白酶Flavourzyme、木瓜蛋白酶、中性蛋白酶水解鹰嘴豆蛋白的TCA-NSI在36%~42%之间,DH在9%~12%之间,而碱性蛋白酶Alcalase水解鹰嘴豆蛋白的TCA-NSI、DH分别为55.60%±0.47%和15.21%±0.78%。因此,选择碱性蛋白酶Alcalase为水解鹰嘴豆蛋白的工具酶进行第一步酶解。
2.2.2 复合酶的筛选
分别在各种酶的最适温度和pH条件下,将中性蛋白酶与其他蛋白酶按质量比1∶1两两复合,总用量为5 000 U/g,同时考察单独使用中性蛋白酶的效果。由表4可以看出,中性蛋白酶与风味蛋白酶Flavourzyme复合酶解的TCA-NSI和DH均高于单一中性蛋白酶和其他两种复合酶的酶解效果。因中性蛋白酶与风味蛋白酶Flavourzyme的最适pH相近,故试验采用中性蛋白酶与风味蛋白酶Flavourzyme复合进行第二步酶解来制备鹰嘴豆短肽。

表4 不同蛋白酶复合对鹰嘴豆蛋白的酶解效果Table 4 The hydrolysis effect of different complex proteases on chickpea protein 单位:%
2.3 复合酶解制备鹰嘴豆短肽单因素试验
2.3.1 酶添加量对水解的影响
由图2可以看出,随着酶添加量的增加,酶的水解作用加强,鹰嘴豆短肽的TCA-NSI与DH也随之增加。当酶添加量在2 000~5 000 U/g时,酶解液的TCA-NSI和DH均随酶添加量的增加而迅速升高,即酶解初期大分子蛋白迅速减少,小分子肽迅速增加,当酶添加量达到5 000 U/g时,短肽得率最高;若酶添加量继续增加,酶的抑制作用会导致短肽得率有所下降[28]。根据酶动力学原理,酶的用量过少不利于水解,过多不仅水解效果差,还会造成资源浪费[29]。综合考虑酶解效果和经济成本,选择酶添加量在5 000 U/g左右。
2.3.2 pH对水解的影响
由图3可知,体系pH在5.5~7.0范围内,水解物的TCA-NSI和DH的变化呈先增高后降低的趋势;随着pH的升高,TCA-NSI和DH迅速增加,当pH达到7.0时,体系的TCA-NSI和DH达到最高,当体系pH值在7.0以上时,TCA-NSI和DH呈现下降趋势,即体系过酸或过碱都会破坏酶分子的空间结构[30]。因中性蛋白酶和风味蛋白酶Flavourzyme在中性环境中酶解效果较好,故选择pH7.0作为复合酶解的最适pH。
2.3.3 酶解时间对水解的影响
由图4可知,在90~210 min范围内,短肽得率和水解度随酶解时间的延长不断升高,并于210 min后趋于平稳,在酶解210 min时,短肽得率达到最大;当继续延长水解时间,水解度趋于平缓,短肽得率呈下降趋势,体系的短肽得率略有降低;这可能是由产物和底物抑制现象所引起,以致水解速度不再继续升高,体系中的一些肽分子经酶作用而被水解为氨基酸[28]。综合考虑肽的得率和酶解时间成本,确定水解时间应控制在210 min左右。
2.3.4 酶解温度对水解的影响
由图5可知,在40~55℃时,随着酶解温度的升高短肽得率和水解度也随之增大,且均在55℃时达到最高,超过55℃后体系短肽得率和水解度则迅速下降。这是因为温度上升到一定程度会引起维持酶分子结构的次级键解离,导致酶蛋白变性,从而使得酶活性降低[31]。因此,确定最佳酶解温度为55℃左右。
2.4 响应面试验设计及结果
响应面优化试验设计及结果见表5,利用Design Expert 8.0.6软件对表5试验数据进行方差分析,结果见表6。
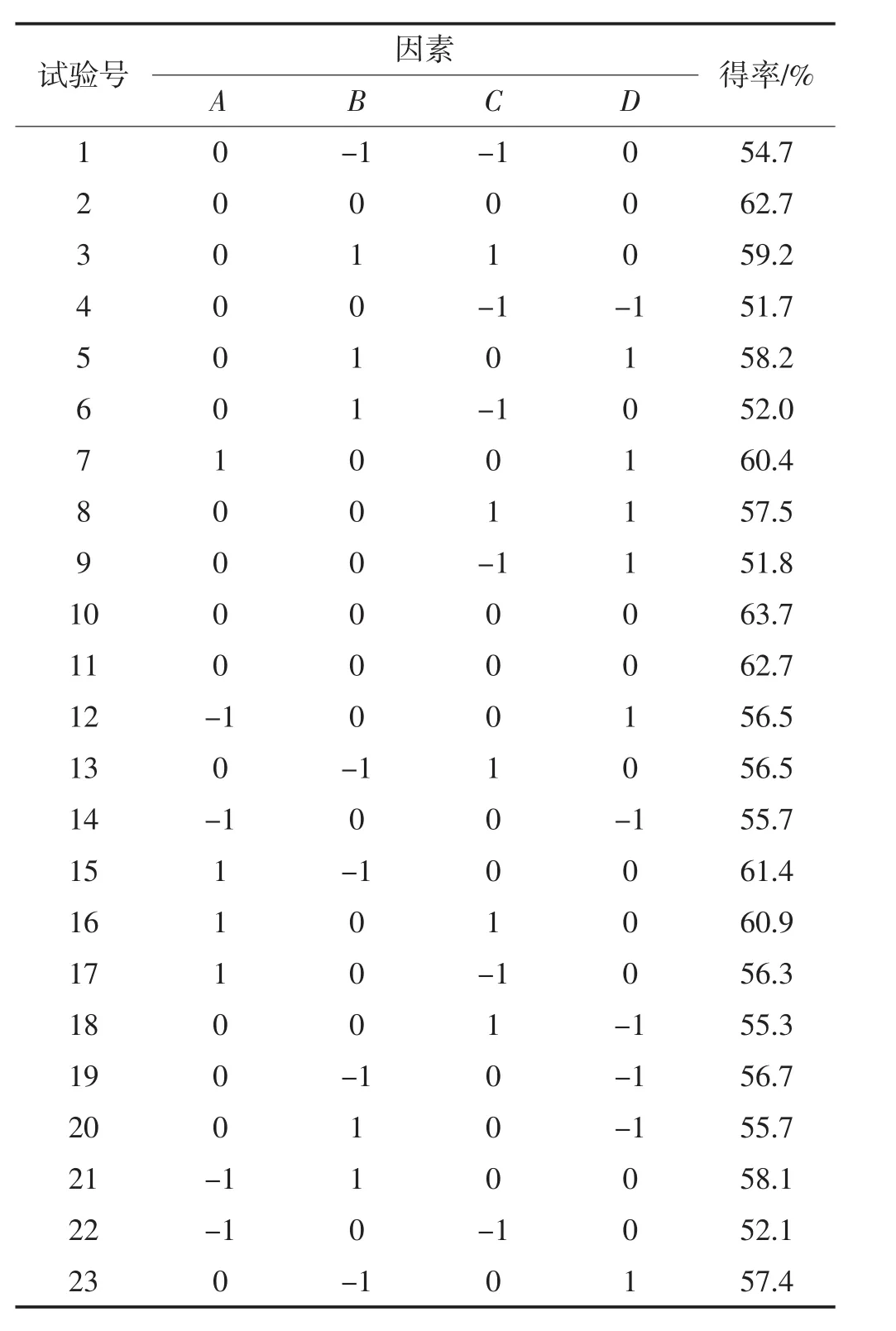
表5 响应面试验设计及结果Table 5 Response surface test design and results
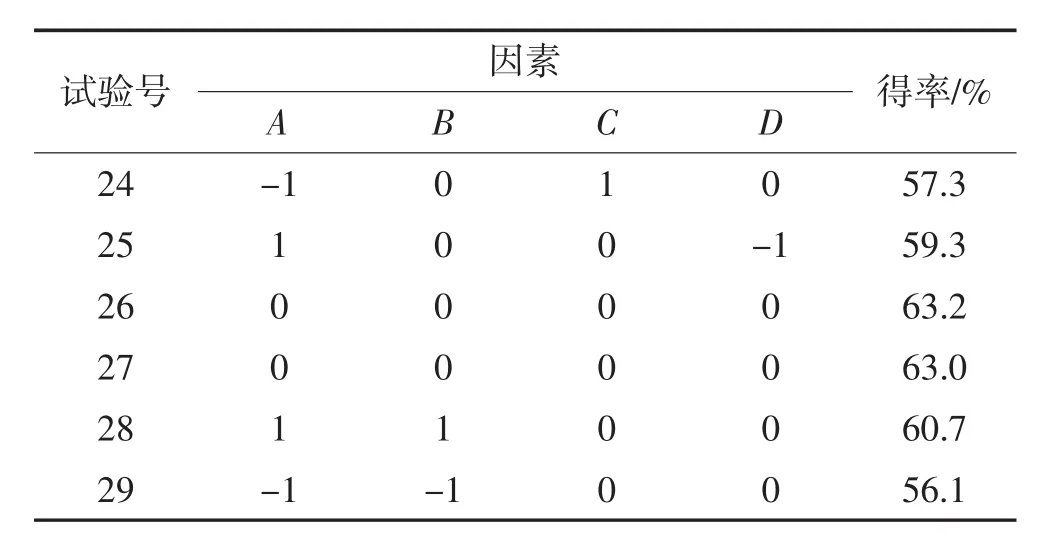
续表5 响应面试验设计及结果Continue table 5 Response surface test design and results

表6 响应面试验结果方差分析Table 6 Variance analysis of response surface test results
通过对表5试验数据进行多元回归拟合分析,得到以Y(得率)为目标函数与各因素变量酶添加量、pH、酶解时间、酶解温度的二次多项回归模型方程为:
Y=63.06+1.93A+0.092B+2.34C+0.62D-0.68AB-0.15AC+0.075AD+1.35BC+0.45BD+0.53D-1.41A2-2.42B2-5.10C2-3.73D2
由表6可知,建立的二次回归模型方程是极显著的(P<0.01),失拟项P=0.799 5>0.05,不显著,说明建立短肽得率模型的拟合程度好,能较好地预测短肽得率,因变量与所考察自变量之间的线性关系显著(R2=0.995 4),回归模型校正决定系数R2Adj=0.990 8,即模型可解释99.08%响应值的变化,表明模型拟合程度较好。0.59%的变异系数说明模型的重现性较好,说明本试验所得二次回归方程能很好地对响应值进行预测。在该模型中,回归系数的显著性检验显示,一次项B对短肽得率的影响不显著,一次项A、C、D极显著(P<0.01),一次项A显著(P<0.05),比较 4个因素(A、B、C、D)的F值大小可得,4个因素对短肽得率的影响依次为:酶解时间>酶添加量>酶解温度>pH。二次项(A2、B2、C2、D2)对试验结果的影响极显著(P<0.01);交互项(AB、BC、CD)对 TCA-NSI影响极显著(P<0.01)。所以,在以后的试验中要考虑到各个因素之间的交互作用。
2.5 最佳酶解条件的确定及验证
本试验在单因素试验的基础上,通过DesignExpert 8.0.6统计软件求解模型方程,试验结果进行数学模拟和预测,最终得出鹰嘴豆蛋白质的最佳酶解条件为:酶添加量5678.25U/g,pH7.0,酶解时间 216.75min,酶解温度55.53℃,此时短肽得率为64.010%,最优组合同单因素试验结果基本一致。根据实际操作和生产应用,将上述最优工艺条件调整为:复合酶添加量5 678 U/g,pH 7.0,酶解时间 216 min,酶解温度 55 ℃。在修正后的工艺条件下,进行验证性试验,所得的短肽得率的平均值为63.79%,实际值与预测值相比,其相对偏差为0.34%,与碱性蛋白酶Alcalase单独作用相比得率明显提高。
2.6 鹰嘴豆短肽的氨基酸组成及营养评价
鹰嘴豆短肽粉得率为63.79%,必需氨基酸占总氨基酸的42.08%,同时富含呈味氨基酸(包括呈鲜味的天冬氨酸(Asp)和谷氨酸(Glu),呈甜味的甘氨酸(Gly)和丙氨酸(Ala)及与甜味有关的丝氨酸(Ser)和脯氨酸(Pro)),其氨基酸组成见表7。
由表8可知,与FAO/WHO推荐的必需氨基酸模式比较[32],鹰嘴豆短肽粉中必需氨基酸种类齐全、含量丰富。对于鹰嘴豆短肽粉中必需氨基酸含量与成人需求量模式相比,其第一限制氨基酸是蛋氨酸(Met)和半胱氨酸(Cys),氨基酸分高达138.18;与学龄儿童需求量模式相比,其第一限制氨基酸是苏氨酸(Thr),氨基酸分也高达103.25。通常,赖氨酸(Lys)是谷类蛋白质的第一限制氨基酸,Met则是大多数非谷类植物蛋白质的第一限制氨基酸,鹰嘴豆短肽粉中的Lys含量较高,将其作为营养补充剂添加于食品中,通过氨基酸的互补作用,能大大提高食品中蛋白质的生物效价。因此,鹰嘴豆短肽粉对儿童、成人都是一种十分优良的营养补充剂。

表7 鹰嘴豆短肽的氨基酸组成Table 7 Composition of amino acids in the chickpea oligopeptide
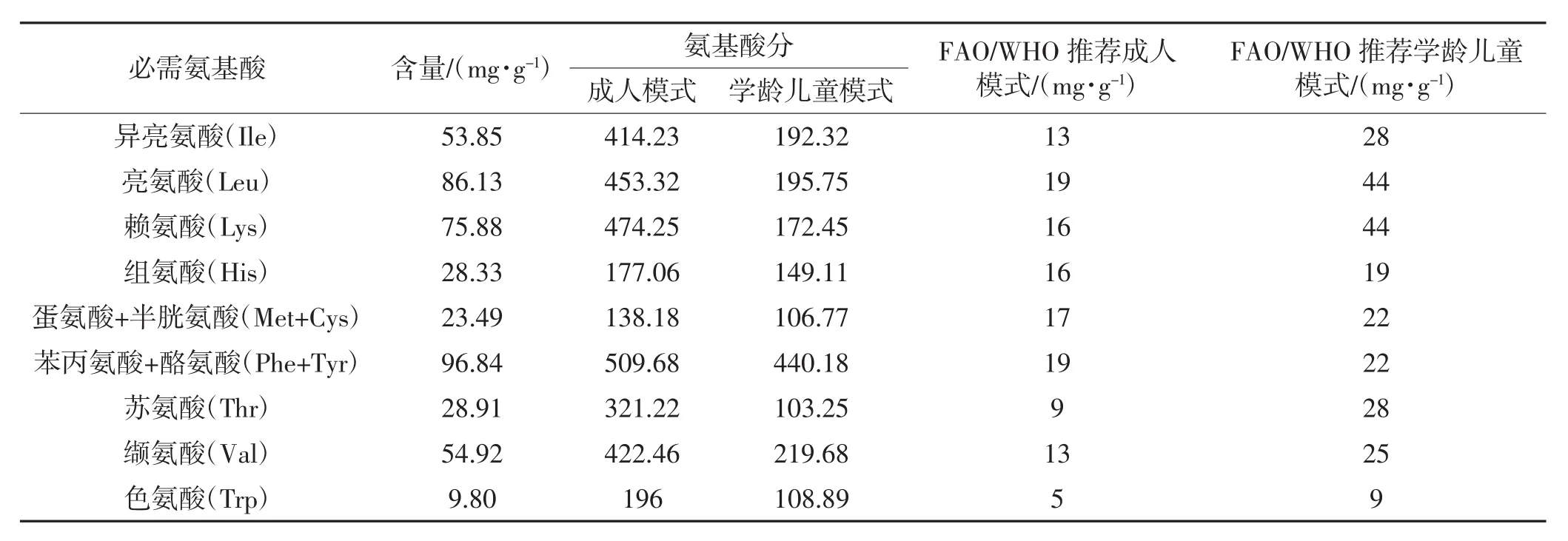
表8 鹰嘴豆酶解蛋白的必需氨基酸与FAO/WHO推荐模式比较Table 8 Comparison of essential amino acids of chickpea enzyme-hydrolysate and the FAO/WHO recommend pattern
2.7 鹰嘴豆短肽相对分子质量分布
由图6可知,鹰嘴豆短肽相对分子质量呈不连续分布,相对分子量范围在105~5 669 Da,且主要集中在1 000 Da以下。这表明鹰嘴豆蛋白在多种复合蛋白酶分步水解条件下酶解效果较好,根据肽类产品的等级评价,国际市场上相对分子质量主要分布在1 000 Da以下的高纯度大豆肽每吨高达到数十万元,即低相对分子质量分布的植物短肽具备极高的附加值。目前,国内市场上尚未见到相关鹰嘴豆短肽产品。因此,本研究为高质量鹰嘴豆短肽的产业化打下了良好的基础。
3 结论
在单因素试验的基础上,运用响应面法对鹰嘴豆蛋白酶解工艺进行优化,中性蛋白酶和风味蛋白酶Flavourzyme继续酶解鹰嘴豆蛋白碱性蛋白酶Alcalase的酶解产物,体系的TCA-NSI与酶添加量(A)、酶解时间(C)及酶解温度(D)极显著相关,建立的回归模型可信,确定了多酶分步酶解鹰嘴豆蛋白制备鹰嘴豆短肽的最佳工艺参数为:在碱性蛋白酶Alcalase水解鹰嘴豆蛋白40 min后加入中性蛋白酶和风味蛋白酶Flavourzyme继续酶解216 min,碱性蛋白酶Alcalase添加量为5 000 U/g,pH 8.0,酶解温度55℃,中性蛋白酶和风味蛋白酶Flavourzyme添加量为5 678 U/g,pH 7.0,酶解温度55℃,在此条件下,短肽得率为63.79%±0.05%,水解度为26.74%±0.12%。采用酶解法对碱溶酸沉制备的鹰嘴豆蛋白进行深加工,真空冷冻干燥后得鹰嘴豆短肽,其蛋白含量高、脂肪低、必需氨基酸种类齐全、含量丰富。与FAO/WHO推荐的成人需求量模式相比,其第一限制氨基酸是蛋氨酸和半胱氨酸;与学龄儿童需求量模式相比,其第一限制氨基酸是苏氨酸,氨基酸分分别高达138.18和103.25,必需氨基酸与非必需氨基酸比值(EAA/NEAA)为0.73,高于WHO和FAO参考标准值0.6。HPLC测定结果显示,通过分步酶解制备的鹰嘴豆短肽大部分分子量在1 000 Da以下。上述研究可为鹰嘴豆蛋白进一步研究提供理论依据和工业化生产鹰嘴豆短肽提供参考。
