FOXD1的表达与结肠癌患者临床病理特征及细胞生物学行为的关系研究
2020-03-25谢力皈燕
谢力,皈燕
川北医学院附属医院肿瘤科 四川南充 637000
结肠癌是一种常见的恶性肿瘤,多发于中年以上男性,早期无明显症状,随疾病发展表现为便血、腹泻、便秘等[1]。结肠癌的病因目前尚不清楚,临床主要采用外科手术治疗,具有一定的临床疗效,但对于中晚期病灶广泛伴随远处转移的患者尚缺乏有效的治疗手段[2]。寻找新的肿瘤标识物评估结肠癌的病情发展和预后,分析其在结肠癌发生发展中的作用机制,对结肠癌的治疗具有重要作用。人转录因子叉头框1(humanforkheadboxD1,FOXD1)是FOX家族成员之一,研究显示[3-5],FOXD1在乳腺癌、非小细胞肺癌、胶质瘤等多种肿瘤均存在异常高表达,但其在结肠癌中的表达意义及作用机制目前尚不清楚。因此,本研究拟分析FOXD1在结肠癌组织中的表达水平及与患者临床病理特征、预后的关系,并探讨其对结肠癌细胞增殖、侵袭、迁移的影响,现报告如下。
1 材料与方法
1.1 临床资料
收集2014年1月至2015年12月72例在本院行结肠癌手术患者的结肠癌组织和对应的癌旁正常组织(距离癌组织边缘约3 cm)各一份,癌旁组织经术后病理组织学诊断为正常黏膜组织。所纳入患者术前均未接受放化疗治疗,并对治疗内容知情同意,未合并其他恶性肿瘤,未合并严重心脑血管、免疫系统或血液系统疾病,均无严重肝肾功能不全,具有术后3年随访有效资料。72例患者中,男性42例,女性30例;年龄40~80岁,平均年龄(60.35±8.79)岁;肿瘤直径≤5 cm者40例,>5 cm者32例;肿瘤分化程度:高分化9例,中分化39例,低分化24例;TNM分期:Ⅰ期14例,Ⅱ期23例,Ⅲ期25例,Ⅳ期10例;合并淋巴结转移35例,无淋巴结转移37例。患者术后进入随访,采用门诊及电话形式进行,每3~6个月一次,随访截止时间为2019年1月,随访记录患者随访时状态(存活、死亡或其他)等,72例患者均具有完整的术后3年生存随访资料。
1.2 材料与仪器
7500 RT-PCR系统购自于美国Applied Biosystems公司;凝胶成像系统(型号Gel Doc XR)购自于美国Bio-Rad公司;人结肠癌细胞SW1116购自美国典型物种保藏中心;FOXD1 shRNA质粒及对照Control-shRNA购自上海吉凯生物有限公司;细胞培养基RPMI-1640、胎牛血清购自杭州四季青生物工程公司;MTT检测试剂盒购自北京中杉金桥生物技术公司;TUNEL检测试剂盒购自上海碧云天生物技术研究所;转染试剂、RT-PCR试剂盒均购自赛默飞世尔科技公司;Transwell小室、Matrigel基底膜,购自美国BD公司。FOXD1抗体、β-actin抗体购自美国Santa Cruz公司。荧光显微镜(BX-2,日本OLYMPUS公司);多功能酶标检测仪(iMark680,美国Bio-Rad公司)。
1.3 检测FOXD 1在结肠癌组织中的表达
取结肠癌组织和对应的癌旁组织匀浆后,采用RT-PCR测定两组细胞中FOXD1 mRNA的表达水平,循环阈值(Ct值)表示cDNA达到指数扩增所需的循环数,目的基因Ct值减去参照基因Ct值等于△Ct值,将△Ct值转化为表达量进行比较。Trizol法提取细胞总RNA,总RNA经反转录合成cDNA,进行实时定量PCR反应,以GAPDH作为内参,FOXD1 mRNA上游引物:5’-ACAACTAAGCCTTTTTGAGG-3’, 下 游 引 物 : 5’-AAAAGTACACCAGACAAGTG-3’;内参GAPDH上游引物:5’-GAAGGTGAAGGTCGGAGTCA-3’,下游引物:5’-TTGAGGTCAATGAAGGGGTC-3’。采用 Western blot检测组织中FOXD1蛋白的表达。使用细胞裂解液严格按照蛋白裂解步骤提取总蛋白,将50 μg提取的总蛋白样品经过SDS PAGE电泳转印至PVDF膜,随后加一抗(FOXD1,稀释比例为1:1 000)4℃下孵育过夜,最后加二抗(HRP标记的IgG,稀释比例为1:5 000)37℃下孵育2 h,ECL法显色。以β-actin为内参,采用凝胶成像分析软件分析蛋白条带灰度值。
1.4 沉默FOXD 1对SW1116细胞生物学行为的影响分析
1.4.1 细胞培养与转染 采用含10%热灭活胎牛血清的RPMI-1640培养液培养SW1116细胞,置于37℃、5%CO2培养箱中孵育。根据FOXD1序列设计siRNA FOXD1(siRNA序列:5’-GCGAGATCTGCGAGTTCATCA-3’,上海生工合成)和siRNA Control序列(序列:5’-GGCAATTACAAAATTTGATCA-3’,上海生工合成),并构建至pGLV3载体。将培养细胞分为沉默FOXD1组和对照组,分别将Lipofectamine 2000脂质体与FOXD1 shRNA质粒、对照Control-shRNA混匀,按照转染试剂操作步骤进行转染,以正常细胞为对照,采用RT-PCR检测沉默效率达到92.16%。
1.4.2 转染效率 转染后48 h,测定采用RT-PCR和Western blot检测FOXD1的表达情况。每组均设置6个重复。
1.4.3 MTT法测定SW1116细胞增殖情况 取各组对数生长期SW1116细胞,将单个细胞悬液接种于96孔培养板中,每孔体积200 μL含103个细胞,每组设6个复孔,于37℃、5%CO2培养箱中培养,于0 h、24 h、48 h、72 h和96 h分别加入20 μL 5 mg/mL的MTT溶液,培养4 h,弃MTT,150 μL DMSO作用30 min,采用酶标仪检测450 nm波长下的吸光度(OD值),绘制细胞增殖曲线。每组重复检测6次。
1.4.4 Transwell检测结肠癌SW1116细胞的侵袭力取100 μL稀释好的基质胶均匀覆盖于Transwell小室底部。取各组对数生长期SW1116细胞,用0.2%的胰蛋白酶进行消化,调整细胞浓度为2×105个/mL。取100 μL稀释好的细胞悬液加于上室,37℃、5%CO2条件下培养48 h,取出Transwell小室,甲醇固定30 min,质量分数为0.1%的结晶紫染色,显微镜下拍照、计数,共计数5个视野,取平均值。每组重复检测6次。
1.4.5 划痕实验检测结肠癌SW1116细胞的迁移力取各组对数生长期SW1116细胞接种到96孔板,常规培养,待细胞长满单层,弃去培养基,用灭菌的移液枪头在皿底划一直线,洗涤3次,常规培养,于显微镜下观察划痕处细胞生长情况,根据划痕宽度计算细胞迁移率。每组重复检测6次。
1.4.6 检测SW1116细胞的细胞凋亡情况 取各组对数生长期SW1116细胞,制作细胞涂片,严格按照TUNEL试剂盒说明操作染色。经4%多聚甲醛固定,加入含0.1%TritonX-100的PBS冰浴2 min,洗涤2次,加入50 μL TUNEL检测液,37℃避光孵育60 min,加入100 μL打孔液,室温避光孵育10 min,加入100 μL DAPI,室温避光孵育10 min,洗涤3次,封片后置于荧光显微镜下进行观察。每组重复检测6次。
1. 5 统计学处理
采用SPSS 17.0软件对所得数据进行分析。符合正态分布的计量资料以()表示,采用t检验进行组间比较,符合偏态分布的数据采用M(QL,QU)表示,采用非参数检验进行比较。采用Graphpad prism 5软件进行生存分析,采用Kaplan-Meier曲线描述生存情况,分别以3年总生存率和3年无病生存率作为观察终点,采用Log-rank检验进行组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 FOXD 1蛋白在结肠癌组织与癌旁正常组织中的表达
与癌旁正常组织相比,结肠癌组织中FOXD1蛋白和mRNA的表达量上调(均P<0.05)。见图1、表1。

图 1FOXD 1蛋白在结肠癌组织和癌旁正常组织中的表达

表 1FOXD 1在结肠癌组织和癌旁组织中的表达
2.2 FOXD 1 mRNA的表达与结肠癌患者临床病理特征之间的关系
FOXD1 mRNA的表达与结肠癌患者的年龄、性别、肿瘤直径无关(均P>0.05),与肿瘤分化程度、TNM分期和淋巴结转移有关(均P<0.05)。见表2。
2.3 FOXD 1 mRNA的表达对结肠癌患者预后生存的影响
FOXD1 mRNA在结肠癌癌组织中的表达量为1.51(1.29,1.76),将患者分为FOXD1 mRNA高表达组(≥1.51)和FOXD1 mRNA低表达组(<1.51),每组各36例。结肠癌癌组织中FOXD1 mRNA高表达患者3年总生存率和3年无病生存率均低于FOXD1 mRNA低表达患者(Log-rankχ2=4.385、4.567,P=0.036、0.033)。见图2。
2.4 结肠癌SW1116细胞的转染效果和增殖情况
细胞转染实验显示,与对照组相比,沉默FOXD1组SW1116细胞FOXD1的蛋白和mRNA表达量下降(P<0.05),转染成功。MTT实验显示,FOXD1组各时间点的SW1116细胞数量均少于对照组(均P<0.05)。见图3、表3。
2.5 各组SW1116细胞的侵袭力和迁移力情况
与对照组相比,沉默FOXD1组SW1116细胞的侵袭力和迁移率下降(均P<0.05)。见图4、表4。
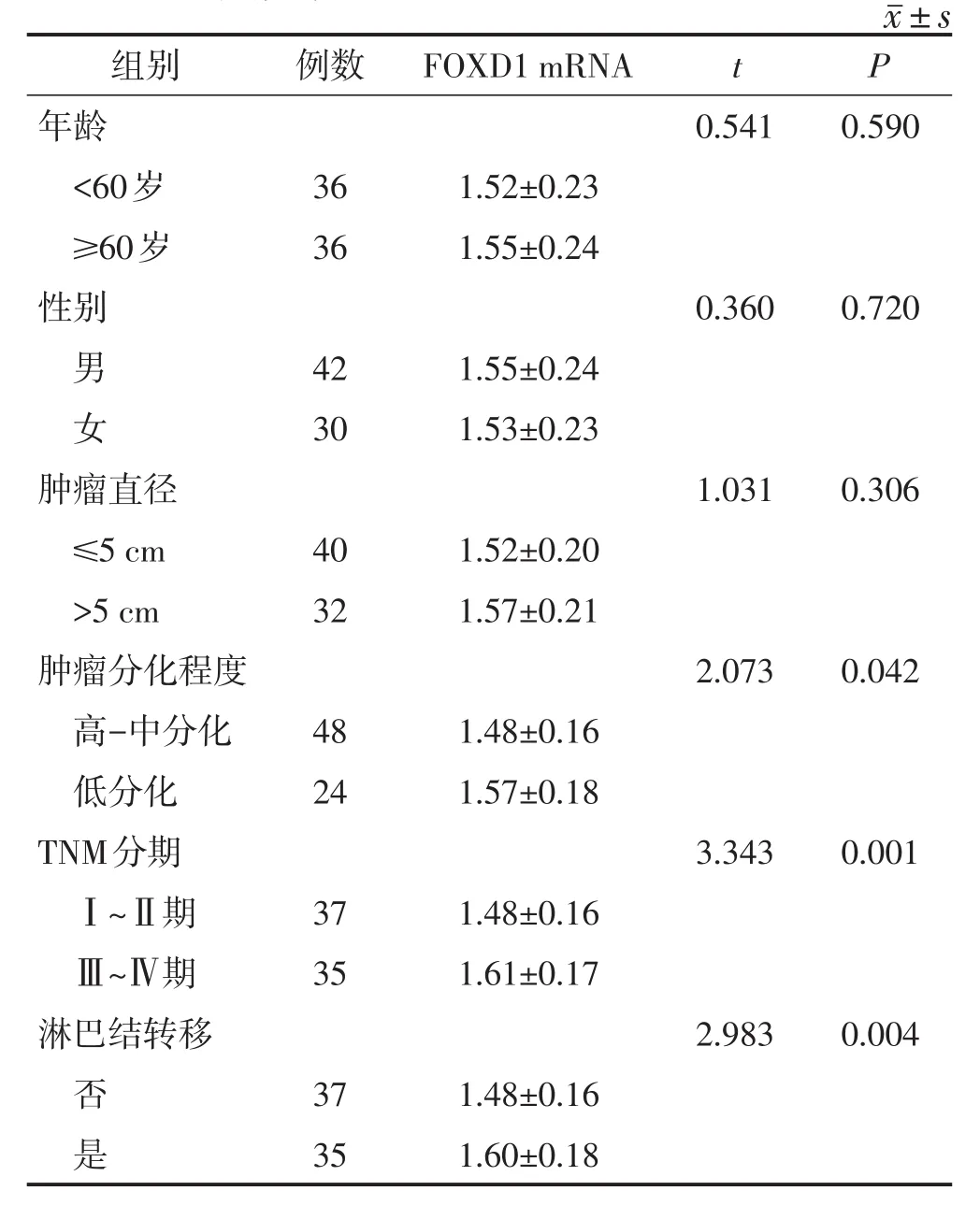
表 2 FOXD 1 mRNA的表达与结肠癌患者临床病理特征之间的关系

图 2 FOXD 1 mRNA的表达与结肠癌患者预后的关系
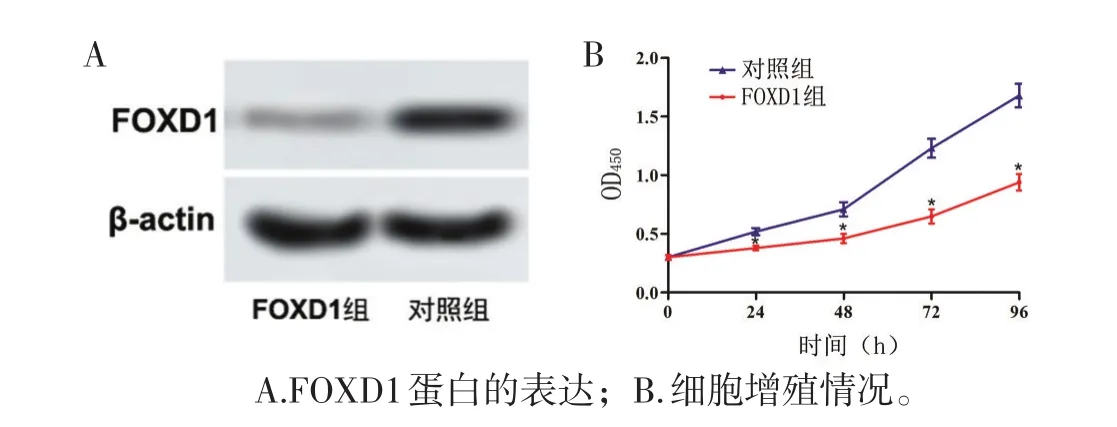
图 3SW1116细胞FOXD 1蛋白的表达和细胞增殖情况

表 3SW1116细胞转染效果
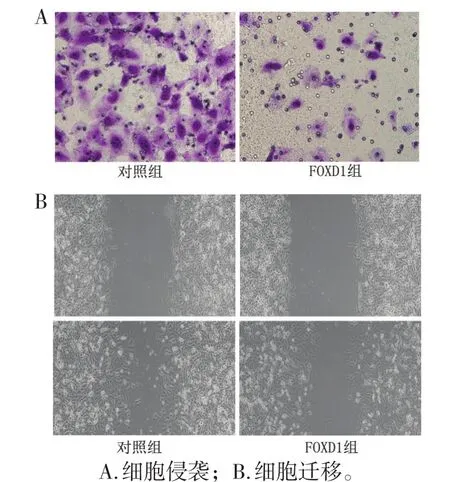
图 4 SW1116细胞的侵袭和迁移力(×400)

表 4 SW1116细胞的侵袭力和迁移率情况
2. 6 各组SW1116细胞的凋亡情况
沉默FOXD1组SW1116细胞凋亡率为(14.35±2.38)%,对照组为(5.76±0.76)%,两组比较,差异有统计学意义(t=8.422,P<0.001)。见图5。
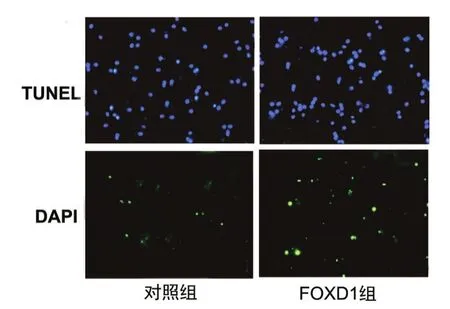
图 5SW1116细胞的凋亡情况(×400)
3 讨论
结肠癌治疗的关键在于早发现、早诊断和早期手术根治。寻找特异性的分子标识物用以辅助评估病情发展具有重要意义。FOXD1是近年来发现的与多种肿瘤的发生发展相关的转录因子,通过调控机体相关的信号通路,调节肿瘤细胞的增殖、分化、凋亡、侵袭等生物学行为[6]。肿瘤分化程度、TNM分期和淋巴结转移均为临床常用的评估结肠癌患者病情发展的指标,与患者的预后相关[7]。李恒爱等[8]分析了622例结直肠癌患者的生存资料,发现手术方式、TNM分期、肿瘤分化程度、淋巴结转移等均为影响患者预后生存的独立因素。Pan等[9]的研究显示,FOXD1的表达与结直肠癌患者的临床病理特征相关,其低表达患者具有更高的生存率。本研究中,FOXD1在结肠癌癌组织中表达量上调,且其mRNA表达量与结肠癌患者的肿瘤分化程度、TNM分期和淋巴结转移有关,提示FOXD1的异常高表达可能与结肠癌的发生发展有关,此外,FOXD1 mRNA高表达患者的3年总生存率和无病生存率下降,提示FOXD1可能对结直肠癌患者的预后评估具有一定的潜在指导价值。
研究显示,FOXD1同源蛋白FOXD3、FOXD4等均可通过多种信号通路调节大肠癌细胞的生物学行为,提示FOXD1可能通过某种机制参与调控结肠癌的发生发展[10-11]。肿瘤细胞的恶性增殖加速了癌症的发展,是影响患者预后的主要原因[12]。本研究中,沉默FOXD1后,结肠癌细胞的增殖活性下降,细胞凋亡率增加,提示FOXD1可能具有促进结肠癌细胞的增殖并抑制其凋亡的作用。肿瘤细胞的侵袭和迁移是肿瘤发生转移和扩散的基础,也是影响恶性肿瘤患者预后的主要原因[13]。Tao等[14]的研究显示,FOXD1可以促进骨肉瘤细胞的增殖和迁移,促进其恶性生物学行为。Wu等[15]的研究显示,FOXD1可能通过调节RAC1B基因的表达,促进胶质瘤细胞的侵袭和迁移。Gao等[16]的研究显示,FOXD1基因沉默后可以抑制胶质瘤细胞的增殖和迁移,诱导凋亡,有望作为胶质瘤靶向治疗的新基因。本研究中,沉默FOXD1后,结肠癌细胞的侵袭和迁移能力下降,提示FOXD1可能通过调节结肠癌细胞的相关信号通路,促进结肠癌细胞的侵袭和迁移能力,促进结肠癌的远处转移,影响患者预后,与前述文献[13-16]内容相符。
综上所述,FOXD1在结肠癌癌组织中表达量上调,且其表达量与患者肿瘤分化程度、TNM分期和淋巴结转移有关,FOXD1 mRNA高表达患者的3年总生存率和无病生存率下降,沉默FOXD1基因后结肠癌细胞的增殖、侵袭和迁移能力受到抑制,细胞凋亡程度升高。本研究为FOXD1在结肠癌中的应用提供了一定的理论支持,但FOXD1抑制结肠癌细胞的恶性生物学行为的具体机制尚不清楚,有待于进一步深入研究。
