中药复方提取物的抗兔球虫效果
2020-03-25罗艺晨朱买勋林春发刘仔睿曹茂雨
罗艺晨,朱买勋,林春发,刘仔睿,曹茂雨
中药复方提取物的抗兔球虫效果
罗艺晨1,朱买勋2*,林春发1,刘仔睿1,曹茂雨1
(1.西南大学动物科学学院,重庆 荣昌 402460;2.重庆市畜牧科学院,重庆 荣昌 402460)
将100只新西兰白兔随机分为5组,即对照组,模型组及中药提取物高、中、低剂量组,除对照组外,试验兔感染1×105个肠艾美耳球虫卵囊,再分别每天灌服0、0.500、0.250、0.125 g/kg的中药提取药物(白头翁、柴胡、半夏、黄芩、槟榔、甘草等组成),每天灌服1次,连续使用3 d,给药后连续观察21 d,每天记录试验兔的死亡和血便情况,隔7 d测量试验兔体质量,采集粪便计数粪便卵囊数(OPG);试验结束后剖杀动物,观察其盲肠病变情况。结果显示:经中药提取物高剂量和中剂量治疗的试验兔存活率分别达90%和85%,感染球虫的程度逐渐由严重转为轻度,模型组和低剂量组试验兔的存活率分别为25%和50%,且存活试验兔大部分感染严重;在给药后7、14、21 d,高剂量组和中剂量组试验兔的体质量显著高于模型组的(<0.05),OPG极显著低于模型组的(<0.01),血便记分显著低于模型组的(<0.05);给药后7、14 d,低剂量组试验兔的OPG极显著低于模型组的(<0.01);给药后14 d,低剂量组试验兔的体质量显著高于模型组的(<0.05);给药后21 d,高剂量组和中剂量组试验兔的增质量极显著高于模型组的(<0.01),显著高于低剂量组的(<0.05),相对增质量极显著高于模型组和低剂量组的(<0.01),OPG极显著低于低剂量组的(<0.01),血便消失。高、中、低剂量的中药提取物组试验兔的抗球虫指数极显著高于模型组的(<0.01),治疗效果分别为高效、中效、无效。可见,在本研究剂量范围内,治疗效果存在一定的量效关系,高剂量治疗效果最佳。
兔;中药复方提取物;球虫卵囊;治疗效果

兔球虫病是由艾美耳属的多种球虫寄生于家兔肝胆管及肠上皮细胞内引起的一种常见的寄生性、多发性原虫病,临床发病率、死亡率高,是家兔养殖中危害严重的传染病之一。据统计,在规模化养殖场中,兔球虫平均感染率高于70%,且多为混合感染[1–3]。感染球虫的家兔消化系统会受到严重损伤,降低肠道对营养物质的吸收,影响其生长性能[4],同时还能影响动物的繁殖能力[5]。目前,兔球虫主要以药物防治为主,临床中尚缺乏兔球虫专属的特效药物,养殖者常借鉴禽抗球虫药物或者使用复方药物进行防治。药物治疗对安全生产存在一定的风险,且易产生耐药性,影响防治效果[6–7]。
临床中,感染兔球虫的动物,表现出明显的精神沉郁、被毛松乱、食欲减退、逐渐消廋,前期出现咖啡色稀便,后期变为血便,死亡率不断提高。依据中兽医理论,该病症属于湿热郁结、化热生虫、热迫血行所致,应选择清热燥湿、凉血解毒、杀虫止痢的中药进行施治。本研究中,利用中药安全、高效、无毒的特点,在经方的基础上进行调整,从白头翁、柴胡、半夏等中药中提取有效成分,制备成中药复方提取物,人工模拟球虫感染试验兔模型,研究中药复方提取物对兔球虫病的治疗效果。
1 材料与方法
1.1 试验兔
100只35日龄新西兰白兔,雌雄各半,健康无病,体质量0.8~1.2 kg。试验分组前采集新鲜粪便,检测球虫均为阴性者才纳入试验分组。
1.2 供试球虫
肠艾美耳球虫(),前期从临床中分离保存。试验前按照1×105个/只的剂量经口服感染40日龄的试验兔2只,感染球虫后第2天开始多次收集粪便检测球虫,在检出有球虫时开始大量收集新鲜粪便,分离球虫,4 ℃保存、备用。
1.3 试验药物
按照4∶1∶1∶1∶1∶1的质量比称取中药白头翁(PULSATILLAE RADIX)、柴胡(BUPLEURI RADIX)、半夏(PINELLIAE RHIZOMA)、黄芩(SCUTELLARIAE RADIX)、槟榔(ARECAE SEMEN)、甘草(GLYCYRRHIZAE RADIX ET RHIZOMA),混合后经醇提、水提、浓缩、干燥,添加可溶性淀粉,制备成1 g中药提取物含有1 g的原生药。使用前将中药复方提取物加热水溶解,稀释成含药量0.500、0.250、0.125 g/mL 3个不同浓度。
1.4 动物分组及试验设计
1) 分组及饲养管理。试验采用单因子随机区组法将100只新西兰白兔随机分为5组,分别为对照组,模型组和中药提取物高、中、低剂量组。每组2个重复,每个重复10只,共20只。每组试验兔采用单笼饲养,按照正常免疫程序进行疫苗接种,饲喂不含抗生素和抗球虫药的基础日粮,自由饮水和采食。每组试验兔单独隔离饲养,饲养模式和饲养环境一致。试验期间观察试验兔只健康状况,包括精神状态、粪便性状、饮食等。
2) 攻虫。将临床分离的球虫进行计数,用0.9%氯化钠溶液将球虫卵囊稀释至10 000个/mL,参照文献[8],每只试验兔攻球虫5.0 mL,连续攻虫2 d,每天上午采集粪便并清洗粪槽。攻虫48 h后,根据动物球虫诊断技术国家标准(GB/T 18647—2002),采集兔粪,计数粪便卵囊数(oocysts per gram of feces,OPG),判定攻虫后球虫的感染程度:OPG>1×105为严重感染;1×104≤OPG≤1×105为中度感染;OPG<1×104,为轻度感染。
3) 给药。试验兔攻虫2 d后,确定攻虫成功者,模型组灌服0.9%氯化钠溶液,中药提取物高、中、低剂量组试验兔分别按照1 mL/kg体质量灌服0.500、0.250、0.125 g/mL的药液,每天灌服1次,连续灌服3 d。灌服后连续观察21 d。
1.5 项目测定
1) 存活率计算。在整个试验期间,观察试验兔的临床变化,称体质量,体质量下降25%的已经失去临床治疗价值,视为无效动物,并统计每天试验兔的死亡情况,计算每组试验兔的存活率()。

式中:为试验动物数;为死亡动物数;1为体重下降25%的动物数。
2) 体质量测定。在给药前和给药后7、14、21 d,分别称试验兔的体质量,比较药物治疗后试验兔的体质量变化。计算试验兔的相对增质量率(W)。
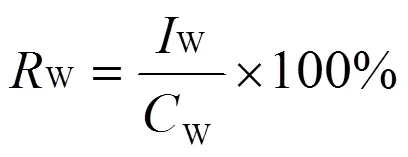
式中:W为感染组的平均增质量;W为对照组平均增质量。
3) 血便观察。在开始给药后连续观察试验兔的血便现象,若直接眼观不能判断是否有血便,则采用胶体金试剂盒检测粪便中是否有隐血。有血便视为阳性者,无血便视为阴性者。参照文献[9]的方法,统计每组试验兔的血便占比情况(bloody stool ratio,bs),若bs=0,则记0分;0<bs≤25%,记1分;25%<bs≤50%,记2分;50<bs≤75%,记3分;75<bs≤100%,记4分。
4) 盲肠病变观察。在试验结束后,剖杀试验兔,观察盲肠病变情况。参照文献[10]的方法,进行盲肠病变记分,盲肠未见病变,记0分;盲肠黏膜增厚,有极少量的点状出血,记1分;盲肠黏膜增厚,有明显出血和出血斑,记2分;盲肠内有大量的出血,盲肠壁肥厚且有明显的变形和萎缩,记3分;盲肠显著萎缩,病变直达肠部,肠壁极度肥厚,记4分;试验期间因球虫死亡兔,记4分。

式中:V为病变值;S为全组病变记分之和;1为全组观察动物数。
5) 卵囊值计算。在试验结束后,剖杀试验兔,采集盲肠粪便4~5 g,参照GB/T 18647—2002进行球虫卵囊计数,并计算卵囊值。OPG<1.0×103时,卵囊值为0;1.0×103≤OPG<1.0×104时,卵囊值为5;1.0×104≤OPG<2.0×104时,卵囊值为10;2.0×104≤OPG<6.0×104时,卵囊值为20;6.0×104≤OPG<1.1×105时,卵囊值为30;OPG≥1.1×105时,卵囊值为40[10]。
1.6 疗效判定
结合试验动物的存活率、相对增重率、血便情况、盲肠病变情况,若抗球虫指数(anticoccidial index,ACI)≥180,抗球虫高效;160≤ACI<180,抗球虫中效;120≤ACI<160,抗球虫低效;ACI<120,抗球虫无效[11]。
ACI=(W+)–(V+OPG)。
1.7 数据统计分析
采用SPSS 20.0中GLM模块进行试验数据方差分析;组间差异有统计学意义时,采用Duncan’s法进行多重比较。
2 结果与分析
2.1 试验兔攻虫效果
由表1可知,各组试验兔在攻虫后OPG差异无统计学意义(>0.05),OPG为8.71×103~ 1.54×105,平均值大于1×105,92.5%的试验兔处于中度和严重感染球虫的状态,说明试验攻虫成功。

表1 试验兔攻虫后感染程度
2.2 试验兔感染程度分析
由表2可知,在试验过程中,对照组的试验兔均未检测到球虫,说明对照成立。模型组和低剂量组试验兔的存活率分别为25%和50%,给药后21 d,模型组无轻度和中度感染的试验兔,低剂量组感染轻度和中度感染的试验兔分别为1只和2只;经中药提取物高剂量和中剂量治疗的试验兔存活率分别达90%和85%,且感染球虫的程度逐渐由严重转为轻度,表明高剂量和中剂量的中药提取物可以有效的驱除兔肠艾美耳球虫。

表2 试验兔的感染程度
2.3 试验兔的体质量变化
由表3可知,给药后0 d,模型组和低剂量组试验兔的体质量有下降的趋势,但差异无统计学意义(>0.05);模型组试验兔在给药后14 d前体质量有下降的趋势,给药后21 d,体质量有所升高,但其增质量只有0.05 kg;治疗组试验兔的体质量逐渐升高,在给药后7 d和21 d,高剂量组和中剂量组试验兔的体质量显著高于模型组的(<0.05);给药后14 d,3个剂量组试验兔的体质量均显著高于模型组的(<0.05)。在试验结束后,3个治疗组试验兔增质量和相对增质量均极显著高于模型组的(<0.01),高剂量组和中剂量组增质量显著高于低剂量组的(<0.05),相对增质量极显著高于低剂量组的(<0.01)。
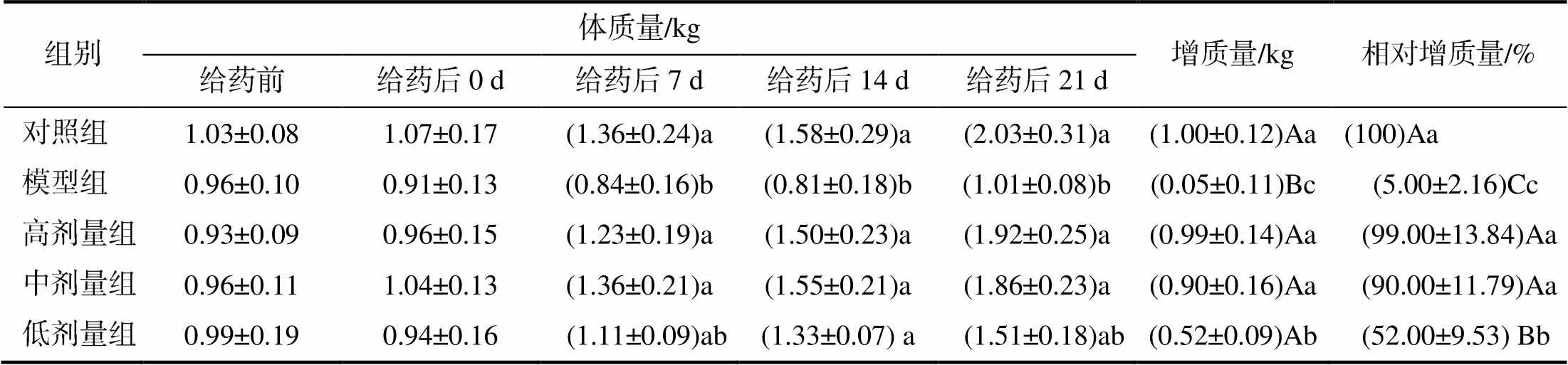
表3 试验兔的体质量
同列不同大写字母示组间差异极显著(<0.01);不同小写字母示组间差异显著(<0.05)。
2.4 试验兔的卵囊值变化
由表4可知,在给药后7、14 d,3个剂量组试验兔的OPG均极显著低于模型组的(<0.01),且在给药后14 d,高剂量组和中剂量组的OPG极显著低于低剂量组的(<0.01);给药后21 d,高剂量组和中剂量组的OPG极显著低于模型组和低剂量组的(<0.01);高剂量组和中剂量组卵囊值极显著低于模型组的(<0.01),显著低于低剂量组的(<0.05);给药后14、21 d,高剂量组、中剂量组和对照组的OPG和卵囊值间的差异无统计学意义。说明中药提取物高剂量和中剂量可以有效驱除球虫卵囊。

表4 治疗后试验兔的OPG
同列不同大写字母示组间差异极显著(<0.01);不同小写字母示组间差异显著(<0.05)。
2.5 试验兔的血便情况
由表5可知,对照组试验兔未出现血便现象;给药前各组试验兔均出现血便,但血便记分值间差异无统计学意义(>0.05);给药后7、14、21 d,高剂量组和中剂量组试验兔的血便记分值均显著低于模型组和低剂量组的(<0.05),其中在给药后21 d,高剂量组和中剂量组试验兔无血便现象,且治疗后均值显著低于模型组(<0.05)。
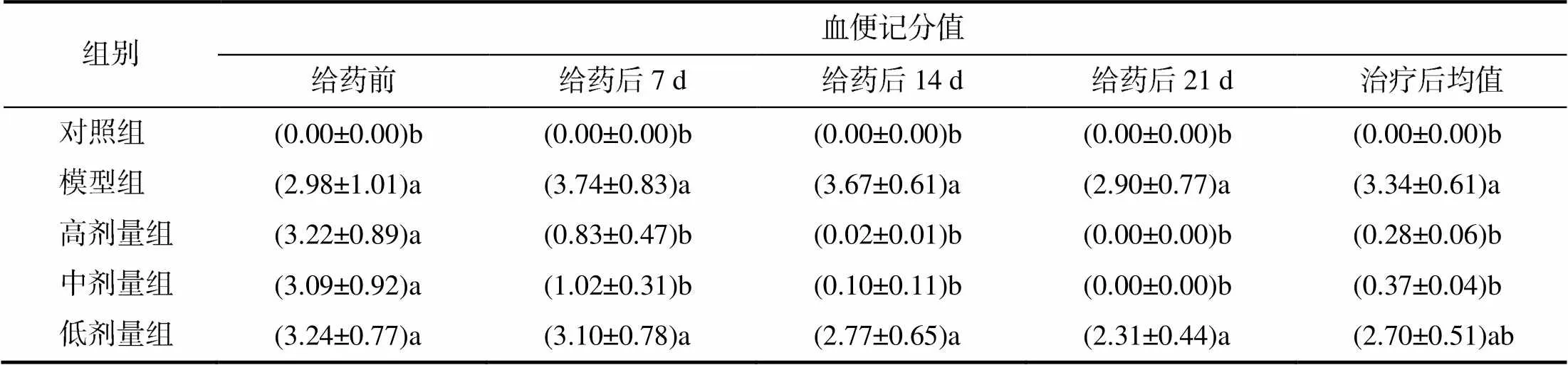
表5 试验兔的血便记分
不同小写字母示组间差异显著(<0.05)。
2.6 中药复方提取物对兔球虫的治疗效果
由表6可知,给药后,3个剂量组的病变值极显著低于模型组(<0.01),说明3个剂量的中药提取物均能有效促进组织的修复。综合试验兔的存活率、相对增质量值、OPG数和病变值,3个剂量的中药提取物组的ACI值均极显著高于模型组的(<0.01),高剂量组和中剂量组的ACI值极显著高于低剂量组的(<0.01);高、中、低剂量组的治疗效果分别为高效、中效、无效。表明中药提取物治疗兔球虫的效果存在一定的量效关系,且高剂量的治疗效果最好。

表6 治疗后试验兔的病变值及疗效
同列不同大写字母示组间差异极显著(<0.01)。
3 结论与讨论
本研究中,通过灌服球虫卵囊,建立兔球虫感染试验动物模型,OPG为8.71×103~1.54×105,平均值大于1×105,此时球虫能在试验兔肠道内大量繁殖,92.5%的试验兔处于中度和严重感染球虫的状态,这与景瑾等[12]报道的结果一致,说明试验攻虫是成功的。试验过程中,模型组试验兔在前2个时间段内体质量持续降低,OPG和血便记分均升高,而在最后一个时间段内,模型组的试验兔体质量有所提高,OPG和血便记分反而降低,其原因可能是试验兔在试验过程中出现大量的死亡,导致统计过程中的值出现非规律性变化,但符合试验规律,模型组对照是成功的。
球虫在持续感染兔的过程中,大量的球虫在肠道内寄生,损害了肠道组织结构,致使动物在感染3 d后开始死亡,之后会大量的排出卵囊,造成球虫在饲养环境中的大量污染,进而造成养兔场球虫病的暴发。中药复方提取物要达到较好的治疗效果,不仅要求中药具有驱除球虫的效果,还要能有效修复动物的组织结构,减少由球虫带来的损害。本研究中,用中药提取物对感染球虫的试验兔进行治疗,中药提取物高剂量和中剂量组试验兔的存活率分别达90%、85%,并且存活的试验兔感染球虫程度为轻度(OPG<1×104),表明中药复方提取物能驱除球虫,减少因球虫引起的死亡,提高存活率。在试验结束的时,与模型组相比,高剂量组和中剂量组试验兔的相对增质量极显著提高(<0.01),卵囊值极显著降低(<0.01),血便情况消失,病变值极显著降低(<0.01),表明中药复方提取物在综合治疗兔虫病中有明显的效果。综合考量动物的存活率、相对增质量、球虫卵囊数、病变值等评价抗球虫效果的主要指标,灌服0.500、0.250 g/mL的中药提取物,抗兔球虫效果分别为高效和中效;灌服0.125 g/mL的剂量的治疗效果为无效。说明在本研究剂量范围内,治疗效果存在一定的量效关系,高剂量疗效最佳。
[1] 姜英,闫文朝,王天奇,等.河南省兔球虫感染情况及种类调查研究[J].中国农学通报,2013,29(17):47–51.
JIANG Y,YAN W C,WANG T Q,et al.Epidemiological investigation andspecies identification of rabbit coccidiosis in Henan province[J].Chinese Agricultural Science Bulletin,2013,29(17):47–51.
[2] 任永军,邝良德,邓小东,等.西南地区肉兔场主要疫病流行病学调查研究[J].中国养兔,2013(9):18–19,21.
REN Y J,KUANG L D,DENG X D,et al. Epidemiological investigation of major diseases in rabbit farms in southwest China [J].Chinese Journal of Rabbit Farming,2013(9):18–19,21.
[3] MAZIZ-BETTAHAR S,AISSI M,AINBAZIZ H,et al. Prevalence of coccidian infection in rabbit farms in North Algeria[J].Veterinary World,2018,11(11):1569–1573.
[4] KIM D K,LILLEHOJ H S,LEE S H,et al.Dietary Curcuma longa enhances resistance against Eimeria maxima and Eimeria tenella infections in chickens[J]. Poultry Science,2013,92(10):2635–2643.
[5] 杨彦宾,杜寅,曹伊凡,等.艾美耳球虫对高原鼠兔繁殖的影响[J].兽类学报,2015,35(3):312–320.
YANG Y B,DU Y,CAO Y F,et al.Effects of coccidian parasites(Apicomplexa:Eimeriiade) on reproduction in plateau pika[J]. Acta Theriologica Sinica,2015,35(3):312–320.
[6] 石团员,鲍国连,索勋,等.妥曲珠利及其复方制剂对人工感染大型艾美耳球虫病兔的治疗[J].中国兽医学报,2014,34(12):1935–1939.
SHI T Y,BAO G L,SUO X,et al.The curative efficacy of toltrazuril and its compound preparations against artificial infection withrabbits [J].Chinese Journal of Veterinary Medicine,2014,34(12):1935–1939.
[7] OGOLLA K O,GATHUMBI P K,WARUIRU R M,et al. Efficacy of sulphachloropyrazine,amprolium hydrochloride,trimethoprim-sulphamethoxazole, and diclazuril against experimental and natural rabbit coccidiosis[J].Journal of Veterinary Medicine,2018,2018:5402469.
[8] GB/T 18647—2002动物球虫病诊断技术[S].
GB/T 18647—2002Diagnostic techniques of animal coccidiosis[S].
[9] MOREHOUSE N F,BARON R R.Coccidiosis: evaluation of coccidiostats by mortality,weight gains,and fecal scores [J].Experimental Parasitology,1970,28(1):25–29.
[10] JOHNSAN J,REID W M.Anticoccidial drugs:lesion scoring techniques in battery and floor-pen experiments with chickens[J].Experimental Parasitology,1970,28(1):30–36.
[11] CEDRIC Y, PAYNE V K, NADIA N A C,et al. In vitro anticoccidial,antioxidant activities and cytotoxicity ofextracts[J].Research Journal of Parasitology,2018,13(1):1–13.
[12] 景瑾,宋鸿雁,蒋荧梅,等.兔斯氏艾美耳球虫感染模型的建立及病理学初步研究[J].中国兽医学报,2017,37(3):461–465.
JING J,SONG H Y,JIANG Y M,et al.Establishment of-infected rabbits model and observation of pathology preliminary [J].Chinese Journal of Veterinary Science,2017,37(3):461–465.
Resistance effects of traditional Chinese medicine compound extract on the rabbit coccidian
LUO Yichen1, ZHU Maixun2*, LIN Chunfa1, LIU Zirui1, CAO Maoyu1
(1.College of Animal Science, Southwest University, Rongchang, Chongqing 402460, China; 2.Chongqing Academy of Animal Sciences, Rongchang, Chongqing 402460, China)
In the study, 100 New Zealand white rabbits were randomly grouped into 5 groups, control group, model group, Chinese herb extracts treated high, medium and low dose group. Except the control group, each group of experimental rabbits infected 1×105eggs ofintestinalis were treated with 0, 0.500, 0.250, 0.125 g/kg traditional Chinese medicine compound extract(composed of PULSATILLAE RADIX, BUPLEURI RADIX, PINELLIAE RHIZOMA, SCUTELLARIAE RADIX, ARECAE SEMEN and GLYCYRRHIZAE RADIX ET RHIZOMA) for 3 d with once per day, and 21 d continuous observation after the treatment. The observation included the every day deaths and bloody stool, the every 7 d body mass and collected dung as OPG, the caecal lesions of rabbits by dissection at the end of the test. The results showed that the survival rate of experimental rabbits treated with high-dose and medium-dose traditional Chinese medicine compound extract reached 90% and 85%, and the degree of coccidiosis infection gradually changed from severe to mild. While, the model group and low-dose group was at 25% and 50%, and most of the survival experimental rabbits were seriously infected. At 7, 14, and 21 d after the administration, the body weight of the experimental rabbits in the high-dose and middle-dose groups were significantly higher than the model group(<0.05), the OPG was significantly lower than the model group(<0.01), and the blood stool score was significantly lower than model group(<0.05). At the 7 d administration, only the OPG of the experimental rabbits in low-dose group was significantly lower than the model group(<0.01). At the 14 d administration, the body weight of the experimental rabbits in low-dose group was significantly higher than the model group(<0.05), the OPG was significantly lower than the model group(<0.01). At the 21 d administration, the body weight of the experimental rabbits in the high-dose and middle-dose groups were significantly higher than the model group(<0.01) and significantly lower than the low-dose group(<0.01), relative mass gain was significantly higher than the model group and low-dose group(<0.01), the OPG was significantly lower than the model group and low-dose group(<0.01), and blood disappeared. In addition, the ACI value of the high, middle and low-dose group were significantly higher than that of the model group(<0.01), and the treatment effects were high, medium, and ineffective. These results indicated that the traditional Chinese medicine compound extract had a good therapeutic effect on coccidian, and the higher dose treatment has the better effect.
rabbit; traditional Chinese medicine compound extract; coccidial oocyst; treatment effect
10.13,331/j.cnki.jhau.2020.01.014
S858.291;R285.5
A
1007-1032(2020)01-0093-06
2019–03–04
2019–05–05
重庆市科研机构绩效激励引导专项(cstc2018jxjl80039)
罗艺晨(1981—),女,重庆合川人,硕士,实验师,主要从事中兽药研发与药理毒理学研究,luojia_1016@163.com;*
,朱买勋,助理研究员,主要从事中兽药研发与药理毒理学研究,zmxmz0817@163.com
罗艺晨,朱买勋,林春发,刘仔睿,曹茂雨.中药复方提取物的抗兔球虫效果[J].湖南农业大学学报(自然科学版),2020,46(1):93–98.
LUO Y C, ZHU M X, LIN C F, LIU Z R, CAO M Y. Resistance effects of traditional Chinese medicine compound extract on the rabbit coccidian[J].Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(1): 93–98.
http://xb.hunau.edu.cn
责任编辑:邹慧玲
英文编辑:柳正
