玉米瘤黑粉菌SG200效应蛋白PEP1表达及生物信息学分析
2020-03-25刘云云李智敏程毅余永廷陈佳严准
刘云云,李智敏,程毅,余永廷,陈佳,严准
玉米瘤黑粉菌SG200效应蛋白PEP1表达及生物信息学分析
刘云云,李智敏,程毅,余永廷,陈佳,严准*
(中国农业科学院麻类研究所,湖南 长沙 410205)
运用生物信息学手段分析基因结构,并根据GenBank中玉米瘤黑粉菌DNA序列设计引物,从玉米瘤黑粉菌SG200的基因组中扩增得到了基因全长,构建了pET–28a–重组表达质粒,选用大肠埃希菌BL21(DE3)作为宿主菌,以1 mmol/L IPTG诱导表达。SDS–PAGE检测结果表明,诱导表达产物大小与理论值(20 800)一致,说明pET–28a–能够在大肠埃希菌BL21(DE3)中高效表达。
玉米瘤黑粉菌;SG200菌株;效应蛋白PEP1;生物信息学分析

玉米瘤黑粉菌()是引发玉米瘤黑粉病的病原真菌,属于担子菌门、黑粉菌目[1]。玉米黑粉菌能够侵染植株的各个部位,引起植株感病,一旦大面积发病就会引起玉米大量减产,造成严重的经济损失[2];因此,对玉米瘤黑粉菌的研究具有重要意义。玉米瘤黑粉菌的基因组在2006年被测序[3],本研究中的基因位于玉米黑粉菌的3号染色体上,PEP1蛋白由178个氨基酸组成,经预测,N端1~26个氨基酸肽段为分泌信号肽[4]。PEP1是玉米瘤黑粉菌分泌的一种效应蛋白[5],当被删除后,玉米瘤黑粉菌无法入侵植物细胞,也无法与宿主建立兼容的相互关系[6]。本试验中,在玉米瘤黑粉菌SG200中克隆了基因,与pET–28a连接,探索其在大肠埃希菌中是否高效表达,旨为进一步研究玉米瘤黑粉菌基因与其他因子的互作关系,寻求防治玉米瘤黑粉病的新方法提供依据。
1 材料与方法
1.1 材料
1.1.1菌种与质粒
玉米瘤黑粉菌() SG200、载体pET–28a由中国农业科学院麻类研究所南方经济作物保护实验室保藏;大肠埃希菌DH5α、大肠埃希菌BL21(DE3)感受态细胞购自北京博迈德基因技术有限公司。
1.1.2酶类与主要试剂
T4连接酶、限制性内切酶HⅠ和d Ⅲ均购自Thermo Fisher Scientific;PCR Mix、DNA Maker(DL5000)、DNA提取试剂盒由康为世纪生物科技公司提供;质粒提取试剂盒由Promega提供;DNA胶回收试剂盒购自OMEGA。蛋白粗提用溶液:1) Buffer A:0.05 mol/L Tris–HCl、0.15 mol/L NaCl、pH 7.5;2) Buffer B:Buffer A 中添加0.5% Triton X–100、0.5 mol/L urea;3) Buffer C:Buffer A 中添加0.5% Triton X–100;4) Buffer D:8 mol/L urea、100 mmol/L NaH2PO4、100 mmol/L Tris–HCl, pH调至8.0。以上溶液均用纯水配置,0.45 µm滤膜过滤除菌。
1.2 方法
1.2.1引物设计与合成
根据GenBank中玉米瘤黑粉菌DNA序列(Accession XM_011389599.1),利用Primer Premier 5.0设计上游引物(5–CGGATGCTGCGGG TGCGGTA–3)和下游引物(5–CCCCATG CCAAACATGCTACCGATT–3),正向和反向引物分别包含HⅠ和d Ⅲ酶切位点(下划线标出)。pET–28a载体测序引物为T7(5–TAATACGAC TCACTATAGGG–3)和T7t(5–GCTAGTTATTGCTC AGCGG–3)。引物均由北京擎科生物公司合成。
1.2.2玉米瘤黑粉菌基因克隆
玉米瘤黑粉菌SG200基因组DNA的提取按照真菌DNA提取试剂盒的说明进行。以玉米瘤黑粉菌SG200基因组DNA为模板,PCR扩增基因。扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸5 min。扩增产物用1.2%琼脂糖凝胶电泳检测后切胶,回收纯化。将纯化后的基因片段送擎科生物公司测序,测序结果与GenBank中玉米瘤黑粉菌DNA序列(Accession XM_0113895 99.1)完全一致。
1.2.3玉米瘤黑粉菌PEP1的生物信息学分析
为进一步分析PEP1的功能与结构的关系,通过以下几种在线工具对PEP1的理化性质及二级、三级结构进行预测分析。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测PEP1是否存在信号肽;运用ProtParam在线工具(https:// web.expasy.org/protparam/)预测PEP1编码蛋白质的理化性质;利用 Protscale (http://web.expasy.org/ protscale) 在线软件对PEP1进行亲水性/疏水性分析;利用Psipred (http://bioinf.cs.ucl.ac.uk/psipred/)进行二级结构预测;运用swiss–model (https:// swissmodel.expasy.org)进行三级结构预测[7]。
1.2.4重组表达质粒的构建
将重组质粒与纯化后的DNA片段用HⅠ和d Ⅲ进行双酶切(37 ℃水浴10 min,80 ℃ 水浴5 min)。酶切产物纯化回收后,将片段和载体连接(16 ℃金属浴,过夜),将连接产物用热激法转化大肠埃希菌DH5α,利用LB加卡那霉素(100 µg/mL)筛选阳性克隆。挑取阳性菌落,提取重组质粒,进行HⅠ和d Ⅲ双酶切鉴定,送擎科生物公司测序。将双酶切鉴定结果与测序结果正确的重组载体质粒转化大肠埃希菌BL21(DE3)。
1.2.5蛋白质诱导表达与检测
挑取重组菌株单菌落置于含有卡那霉素的1 mL LB培养基中,37 ℃摇床,225 r/min培养4 h,将1 mL菌液接种于10 mL 含有卡那霉素的LB培养基,37 ℃摇床,225 r/min培养至600达0.6,再加入10 µL 1 mol/L IPTG,使培养基中IPTG的终浓度为1 mmol/L,30 ℃、180 r/min诱导3 h。
以宿主菌BL21(DE3)和含有空载体pET–28a的重组BL21(DE3)菌株作为阴性对照,以含有pET–28a–表达载体的重组BL21(DE3)菌株为阳性对照。1E08是1个小分子抗体[8],在中国农业科学院麻类研究所南方经济作物保护实验室中已被熟练诱导表达;因此将它作为pET–28a–/BL21表达的阳性对照。取上述诱导后的10 mL菌液离心(12 000 r/min,5 min),收集菌体。用化学渗透法破碎细胞[9],具体步骤如下:用10 mL Buffer A重悬菌体,离心30 min(8 000 r/min),收集沉淀;加1 mL Buffer C重悬后,28 ℃静置过夜,离心30 min(8 000 r/min),收集沉淀;加1 mL Buffer B洗2次,Buffer A洗1次,加1 mL Buffer D溶解沉淀,即获得蛋白质粗提取液;取6 µL 5×上样缓冲液与24 µL蛋白粗提取液混匀,沸水浴10 min;取上述处理好的蛋白粗提液20 µL于 15%的聚丙烯酰胺变性胶中,进行电泳检测。
2 结果与分析
2.1 玉米瘤黑粉菌pep1基因克隆
以玉米瘤黑粉菌SG200基因组DNA为模板,PCR扩增基因,片段大小为456 bp(去除信号肽后),如图1。

M为DNA分子量大小标记;泳道1为pep1基因。
2.2 玉米瘤黑粉菌pep1的生物信息学分析
对基因序列进行信号肽分析,结果(图2)显示,编码的氨基酸在第26个氨基酸处值、值和值达到最高峰,分别为0.710、0.984和0.812,预测此处为信号肽剪切位点。第1~26个氨基酸平均值为0.930,值为0.876,预测第1~26个氨基酸为信号肽。对PEP1进行理化性质分析,发现编码的氨基酸为178个,相对分子质量为18 444.72,理论等电点为5.45。在组成蛋白质的20种氨基酸中,甘氨酸(Gly)所占比例最高,为11.2%,其中带有负电荷的氨基酸多于带有正电荷的氨基酸,蛋白质的不稳定系数为28.25,属于稳定蛋白。PEP1在蛋白的中心部分含有4个保守的半胱氨酸残基(第5、75、94、112位),猜测PEP1蛋白中间部分的4个半胱氨酸可能通过参与二硫桥的形成来影响PEP1的功能。亲水性/疏水性分析发现,整条肽链的亲水性氨基酸数量多于疏水性氨基酸数量(图3),推测PEP1是亲水性蛋白。利用Psipred在线工具对PEP1进行了二级结构预测,无规则卷曲比例为64.61%,α螺旋和β折叠分别为20.22%和15.17%,如图4所示;利用swiss–model预测其三级结构,结果如图5所示。模型中显示2个双链反平行的β–sheets,与纤维连接蛋白糖基化第二型模块相似[10],推测可能与蛋白糖基化相关。

图2 玉米瘤黑粉菌SG200 PEP1信号肽分析结果

图3 玉米瘤黑粉菌SG200 PEP1疏水性分析结果
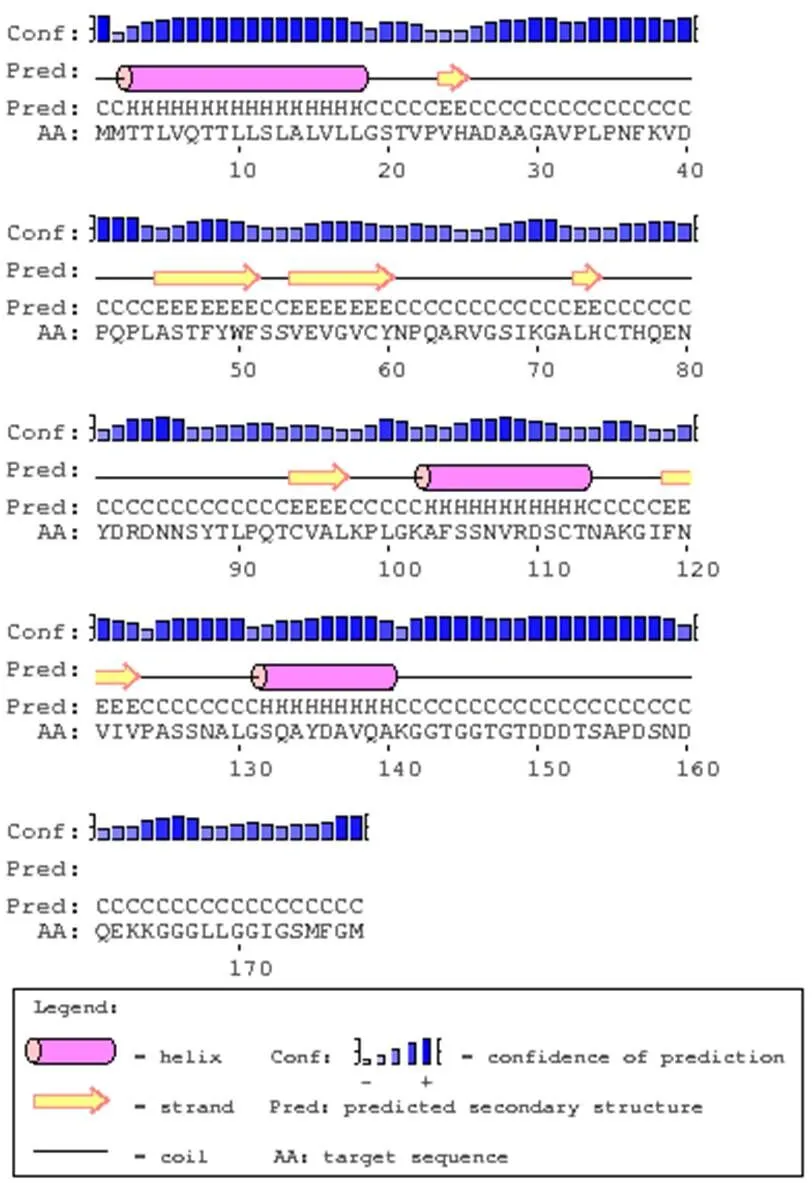
图4 玉米瘤黑粉菌SG200 PEP1二级结构预测结果

图5 玉米瘤黑粉菌SG200 PEP1三级结构预测结果
2.3 pET–28a–pep1原核表达载体的构建
将基因片段与载体pET–28a用相同的HⅠ和d Ⅲ内切酶双酶切后,连接转化大肠埃希菌DH5α,挑取单菌落,用载体测序引物进行PCR鉴定,大小符合预期之后,交由生物公司测序,测序结果与GenBank中玉米瘤黑粉菌DNA序列(Accession No.Um01987 )结果完全一致。选取测序结果正确的重组菌株,提取质粒,进行HⅠ和d Ⅲ内切酶双酶切鉴定,鉴定结果(图6)符合预期,表明重组质粒构建成功。将构建成功的pET–28a–转化至大肠埃希菌BL21(DE3)中,通过抗性平板筛选与PCR鉴定,成功构建了原核表达系统。

M为DNA分子量大小标记;泳道1为重组质粒pET–28a– pep1Bam HⅠ、Hind Ⅲ双酶切结果;泳道2为质粒pET–28a Bam HⅠ、Hind Ⅲ双酶切结果。
2.4 pep1基因的诱导表达及纯化
通过ProtParam在线工具预测插入载体后组氨酸标签融合蛋白大小为20 800。以BL21(DE3)菌株和重组菌株pET–28a/BL21为阴性对照,重组菌株pET–28a–/BL21为阳性对照诱导表达。利用化学渗透法破碎细胞,进行SDS–PAGE检测,发现重组表达质粒pET–28a–在15 000~25 000有明显的表达带,与预测的融合蛋白大小(20 800)大小相符,如图7所示,说明重组表达质粒pET–28a–能够在BL21(DE3)中表达。

M示DNA分子量大小标记;泳道1为诱导后大肠埃希菌BL21(DE3);泳道2为诱导后重组菌株pET–28a/BL21;泳道3为诱导后重组菌株pET–28a–1E08/BL21(阳性对照);泳道4为诱导后重组菌株 pET–28a–pep1/BL21。
3 结论与讨论
玉米瘤黑粉菌在玉米上的寄生过程可人为地分为7个步骤:1)形成致病性双核菌丝体;2)附着于植物表面;3)穿透寄主表皮;4)消减寄主防御反应;5)寄主体内菌丝增殖;6)使寄主瘤变;7)生成双倍体冬孢子[11]。基因参与了其中穿透寄主表皮和消减寄主防御反应2个过程。基因的缺失可显著降低病菌侵染率,减轻玉米病害[12–14]。鉴于基因的重要生物学作用,理论上PEP1效应子可作为防控玉米瘤黑粉病的关键靶标。
本试验通过构建原核表达载体pET–28a–后,在大肠埃希菌BL21(DE3)中诱导表达,方法如下:将重组菌株单菌落置于含有卡那霉素的1 mL LB液体培养基中,37 ℃摇床,225 r/min培养4 h之后,取上述菌液1 mL接种于10 mL 含有卡那霉素的LB液体培养基中,37 ℃摇床,225 r/min培养至菌液浓度600达0.6,再加入10 µL 1 mol/L IPTG,使培养基中IPTG的终浓度为1mmol/L,混匀后置于30 ℃摇床中,180 r/min培养,诱导3 h。利用化学方法破碎细胞之后进行SDS–PAGE检测,得到PEP1的特异条带,大小(20 800)符合预期,表明能够利用原核表达实现对玉米瘤黑粉菌PEP1蛋白的高效表达。
[1] VÁNKY K.European smut fungi[M].Stuttgart:Gustav Fischer Verlag, 1994.
[2] 边亚辉.玉米瘤黑粉病的危害与防治[J].河北农业,2016(1):39–40.
BIAN Y H.Harm and prevention of[J].Hebei Agriculture,2016(1):39–40.
[3] KAMPER J,KAHMANN R,BOLKER M,et al.Insights from the genome of the biotrophic fungal plant pathogen[J].Nature,2006,444:97–101.
[4] DONALDSON M E,SAVILLE B J.Bioinformatic identification ofmeiosis genes[J]. Fungal Genetics and Biology,2008,45:S47–S53.
[5] LADENDORF O,BRACHMANN A,KÄMPER J. Heterologous transposition in[J]. Molecular Genetics and Genomics,2003,269(3):395– 405.
[6] DOEHLEMANN G,VAN DER LINDE K,AßMANN D,et al.Pep1,a secreted effector protein of,is required for successful invasion of plant cells[J].PLoS Pathogens,2009,5(2):e1000290.
[7] 杨辉,杨晓娜,王翀,等.烟草NtGRAS基因的克隆与转录激活及表达特性分析[J].湖南农业大学学报(自然科学版),2018,44(3):271–277.
YANG H,YANG X N,WANG C,et al.Clone of NtGRAS gene in tobacco and its transcriptional activation and expression analysis[J].Journal of Hunan Agricultural University(Natural Sciences),2018,44(3):271–277.
[8] ACHOUR I,CAVELIER P,TICHIT M,et al.Tetrameric and homodimeric camelid IgGs originate from the same IgH locus[J].Journal of Immunology,2008,181(3):2001–2009.
[9] 刘建荣,王慧,赵晓瑜,等.化学渗透法破碎基因重组.提取重组人SOD包含体和复性[J].高校化学工程学报,2011,25(1):96–102.
LIU J R,WANG H,ZHAO X Y,et al.Study on chemical permeabilization agents disrupting the recombinant.cell to release rhSOD inclusion body and renaturation[J]. Journal of Chemical Engineering of Chinese Universities,2011,25(1):96–102.
[10] STICHT H,PICKFORD A R,POTTS J R,et al.Solution structure of the glycosylated second type 2 module of fibronectin[J].Journal of Molecular Biology,1998,276(1):177–187.
[11] 李智敏,严理,严准.玉米瘤黑粉菌的寄生策略及其调控机制[J].微生物学报,2016,56(9):1385–1397.
LI Z M,YAN L,YAN Z.Parasitic strategy and regulation mechanism of–A review[J].Acta Microbiologica Sinica,2016,56(9):1385–1397.
[12] O'CONNELL R J,PANSTRUGA R.Tete a tete inside a plant cell:establishing compatibility between plants and biotrophic fungi and oomycetes[J].New Phytologist,2006,171(4):699–718.
[13] DOEHLEMANN G,WAHL R,VRANES M,et al. Establishment of compatibility in the/ maize pathosystem[J].Journal of Plant Physiology,2008,165(1):29–40.
[14] SNETSELAAR K M.Infection of maize stigmas by:light and electronmicroscopy[J]. Phytopathology,1993,83(8):843–850.
Expression and bioinformatics analysis of effector protein PEP1 fromSG200
LIU Yunyun, LI Zhimin, CHENG Yi, YU Yongting, CHEN Jia, YAN Zhun*
(Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha, Hunan 410205, China)
PEP1 protein is one of the effector proteins of the. The study of PEP1 protein plays an important role for the new method development to combat the corn smut. In this study, the structure ofgene was expressed, the resulting proteins were purified and analyzed by bioinformatics method. The recombinant expression plasmid pET-28a-was constructed, andBL21 (DE3) was used as a host strain and induced with 1 mmol/L IPTG. The results of SDS-PAGE showed that the size of the induced expression product PEP1 was consistent with the theoretical value (20 800), indicating that pET-28a-is a capable strain to highly express the target protein inBL21 (DE3).
; SG200 strain; effector protein PEP1; bioinformatics analysis
10.13331/j.cnki.jhau.2020.01.005
Q786
A
1007-1032(2020)01-0028-05
2018–11–19
2019–02–15
湖南省重点研发计划项目(2016WK2030);中国农业科学院科技创新工程项目(CAAS–ASTIP–2015–IBFC09)
刘云云(1993—),女,河南信阳人,硕士研究生,主要从事微生物分子生物学与基因工程研究,m18503765307@163.com;
,严准,研究员,主要从事病原菌纳米抗体研发及其病害诊断和防治研究,yanzhuntoronto@gmail.com
刘云云,李智敏,程毅,余永廷,陈佳,严准.玉米瘤黑粉菌SG200效应蛋白PEP1表达及生物信息学分析[J].湖南农业大学学报(自然科学版),2020,46(1):28–32.
LIU Y Y, LI Z M, CHENG Y, YU Y T, CHEN J, YAN Z. Expression and bioinformatics analysis of effector protein PEP1 fromSG200[J].Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(1): 28–32.
http://xb.hunau.edu.cn
责任编辑:毛友纯
英文编辑:柳正
