甲状腺毒症周期性瘫痪与rs312691多态性关联的meta分析
2020-03-25钟晓卫傅徐泉李华琦刘宜东黄晓飞
严 同,钟晓卫,傅徐泉,李华琦,刘宜东,黄晓飞
(成都市第三人民医院 内分泌代谢病科,四川 成都 610031)
甲状腺毒症周期性瘫痪(thyrotoxic periodic paralysis, TPP)是甲状腺毒症的并发症之一,临床上以转移性低钾血症、肌肉迟缓性瘫痪为主要表现,严重者可累及呼吸肌威胁生命[1-3]。尽管多种原因导致的甲状腺毒症均可导致TPP,但导致本症的最常见原因还是Graves病[1, 4-5]。与Graves病发病全球性的分布不同,TPP主要发生在亚洲人,包括:中国人、日本人、越南人、菲律宾人和韩国人[1-2, 6]。其他人群虽然也有TPP的病例报道,但发病较亚洲人罕见[7-8]。TPP的常见诱因包括:高碳水化合物摄入、剧烈运动、高盐饮食、创伤、糖皮质激素应用和β-肾上腺能气管扩张剂使用[6]。
对于TPP的发病机制,目前比较清楚的是体内总钾不缺乏,是由于细胞外钾转移到细胞内所致。目前认为如下机制均可导致转移性低钾血症:(1)甲状腺激素通过作用于Na+-K+-ATP酶基因的甲状腺素反应元件(thyroid hormone response elements, TREs)上调该基因的表达,从而增加骨骼肌Na+-K+-ATP酶合成,这就导致细胞膜上有更多的Na+-K+-ATP酶;(2)甲状腺激素通过激动β2-肾上腺素能受体促进胞内环磷腺苷酸(cAMP)生成从而增强Na+-K+-ATP酶活性;(3)TPP发作期间有高胰岛素血症的现象,胰岛素有促进K+进入细胞内和增加细胞膜Na+-K+-ATP酶密度的作用[9]。上述机制虽然能部分解释甲状腺毒症时转移性低钾血症的机制,但无法解释为什么亚洲人群高发TPP这一人种发病不一致的现象。除了无甲状腺毒症以外,家族性低钾性周期性瘫痪(familial hypokalemia periodic paralysis,FHPP)和TPP在临床表现上有很多相似之处,故有学者推测TPP也属于一种离子通道病。Ryan等[10]发现TPP患者存在编码钾通道Kir2.6的KCNJ18基因突变。和Na+-K+-ATP酶作用相反,Kir2.6有促进K+外流的作用[9],这就可以解释尽管甲状腺毒症患者Na+-K+-ATP活性增强时尽管K+内流增多,只要Kir2.6能同时保存适当的K+外流,细胞外钾的水平可以保持恒定,这似乎就可以解释为什么不是所有的甲状腺毒症患者都发生TPP。但随后国内Li等[11]的研究发现仅有3.1%的TPP患者存在KCNJ18突变,这个现象说明除了Kir2.6以外,很可能还存在其他离子通道突变导致TPP的发生。
2012年,Jongjaroenprasert等[12]和Cheung等[13]先后利用全基因组关联分析(genome-wide association study, GWAS)的手段发现KCNJ2基因下游非编码序列rs312691单核苷酸多态性(single nucleotide polymorphism, SNP)是导致泰国和中国香港地区Graves病患者发生TPP的原因。rs312691位于KCNJ2基因下游150kb,该位点野生型的碱基为T,突变型为C。该位点碱基从野生型的T突变为C,Graves病患者更容易发生TPP。为此,本研究通过meta分析,系统评价rs312691 SNP与TPP易感性的关系。
1 资料与方法
1.1检索策略 检索PubMed、Embase、万方、中国知网(CNKI),时间为建库至2019年4月。英文检索词:rs312691, Graves disease, hyperthyroidism, hypokalemic periodic paralysis, thyrotoxic periodic paralysis, variant, mutation, polymorphism, single nucleotide polymorphism, SNP, KCNJ2。中文检索词:基因多态性、位点、低钾性周期性瘫痪、甲状腺毒症性周期性瘫痪、甲状腺功能亢进症、Graves病。根据检索到的参考文献,追溯查到引文,尽量增加查全率。
1.2文献纳入标准 (1)截至2019年4月公开发表的关于rs312691 T>C多态性与TPP关联性的病例对照研究;(2)病例组定义:发生TPP的Graves病或其他原因甲状腺毒症患者;对照组定义:没有TPP发生史的Graves病或其他原因甲状腺毒症患者;(3)对于重复研究的文献,本研究仅选择公开刊物已发表的涵盖人数最全的1篇纳入。
1.3文献排除标准 (1)重复报道的文献;(2)综述类文献;(3)动物实验;(4)非病例对照研究;(5)原始数据不完整,不能直接获取病例组和对照组的观察例数及rs312691基因型(CC、CT、TT)在病例组及对照组的具体分布情况的研究,且也无法通过电子邮件联系作者获取;(6)非rs312691位点的研究。
1.4资料提取与质量控制 检索完成后,由2名研究者按照纳入排除标准对文献摘要独立筛选并提取数据资料,存在判断分歧时由第3名研究者协助评价解决。对病例组和对照组分别进行哈-温遗传平衡(Hardy-Weinberg equilibrium, HWE)检验。各纳入文献均采用Newcastle-Ottawa量表进行质量评价,≥5分为高质量研究文献。
1.5统计学处理 本研究所用的统计学处理采用Stata 14.1进行。执行Q检验评价研究间的异质性,若P≥0.1,I2<50%采用固定效应模型计算合并OR值及其95%可信区间,反之则采用随机效应模型合并计算统计量,比较病例组和对照组rs312691等位基因和基因型的分布频率。本研究分别针对如下5种基因模型分别进行meta分析:(1)等位基因模型:C vs T;(2)隐性模型:CC vs CT+TT;(3)共显性模型:CC vs TT;(4)显性模型:CC+CT vs TT;(5)超显性模型:CC+TT vs CT。采用Egger检验和Begg检验分析纳入研究是否存在发表偏倚,Egger检验和Begg检验P>0.1认为无发表偏倚。最后使用敏感性分析评估meta分析结果的可靠性。
2 结 果
2.1检索结果及纳入文献的一般特征 共检索到相关文献104篇,其中PubMed数据库检索到英文文献41篇,Embase数据库检索到英文文献46篇,万方和CNKI数据库检索到中文文献17篇。查重后得到文献82篇,阅读题目和摘要后排除67篇无关文献,纳入15篇文献进行全文阅读,阅读全文后排除8篇文献(其中会议论文1篇,病例报道1篇,动物研究1篇,其他位点的研究5篇),最终纳入7篇文献进行meta分析,见图1。英文文献6篇,中文文献1篇。纳入文献来自亚洲的6篇(泰国1篇,中国香港2篇,中国内地2篇,韩国1篇),南美洲1篇(巴西)。所有对照组患者均来自医院就诊的病例。所有研究均阐明了甲状腺毒症(Graves病及其他原因)与TPP的诊断标准。除了Wang等[5]以外,其余研究均明确仅纳入Graves 病的患者[11-16],Wang等[5]研究纳入了Graves病和多结节性甲状腺肿伴甲状腺功能亢进症的患者,其中TPP组和对照组分别有32%和36%确诊为Graves病,但两组差异无统计学意义。Cheung等[13]和Jongjaroenprasert等[12]采用DNA测序法确认多态性,其他纳入的研究均采用PCR法确认多态性[5, 11, 14-16]。纳入文献经Newcastle-Ottawa量表评分后高质量研究6篇[11-16],低质量研究1篇[5]。
本研究共纳入TPP组患者610例,对照组351例。各纳入研究TPP组和对照组基因型分布见表1。按等位基因模型(OR=3.072,95%CI2.590-3.643,P<0.01)、隐性模型(OR=6.050,95%CI4.616-7.929,P<0.01)、共显性模型(OR=10.585,95%CI7.150-15.670,P<0.01)、显性模型(OR=4.005,95%CI2.874-5.580,P<0.01)和超显性模型(OR=1.985,95%CI1.298-3.035,P=0.002),合并OR值均显示rs312691 T>C多态性是Graves病患者发生TPP的危险因素,见表2。
2.2亚组分析结果 由于Li等[11]和Park等[16]研究纳入对照组基因频率不符合HWE,P值分别为0.0026和0.0076。进一步根据对照组基因频率是否符合HWE进行分层分析。对照组符合HWE,meta分析结果显示:等位基因模型OR=2.804(95%CI2.304-3.413,P<0.01)、隐性模型OR=4.969(95%CI3.658-6.750,P<0.01)、共显性模型OR=9.348(95%CI6.045-14.456,P<0.001)、显性模型OR=4.168(95%CI2.857-6.081,P<0.01)和超显性模型OR=1.647(95%CI1.263-2.149,P<0.01)。可见,剔除对照组不符合HWE的研究后再次进行meta分析仍然显示,rs312691 T>C多态性是导致Graves病患者发生TPP的危险因素。

表1 纳入研究的基本特征
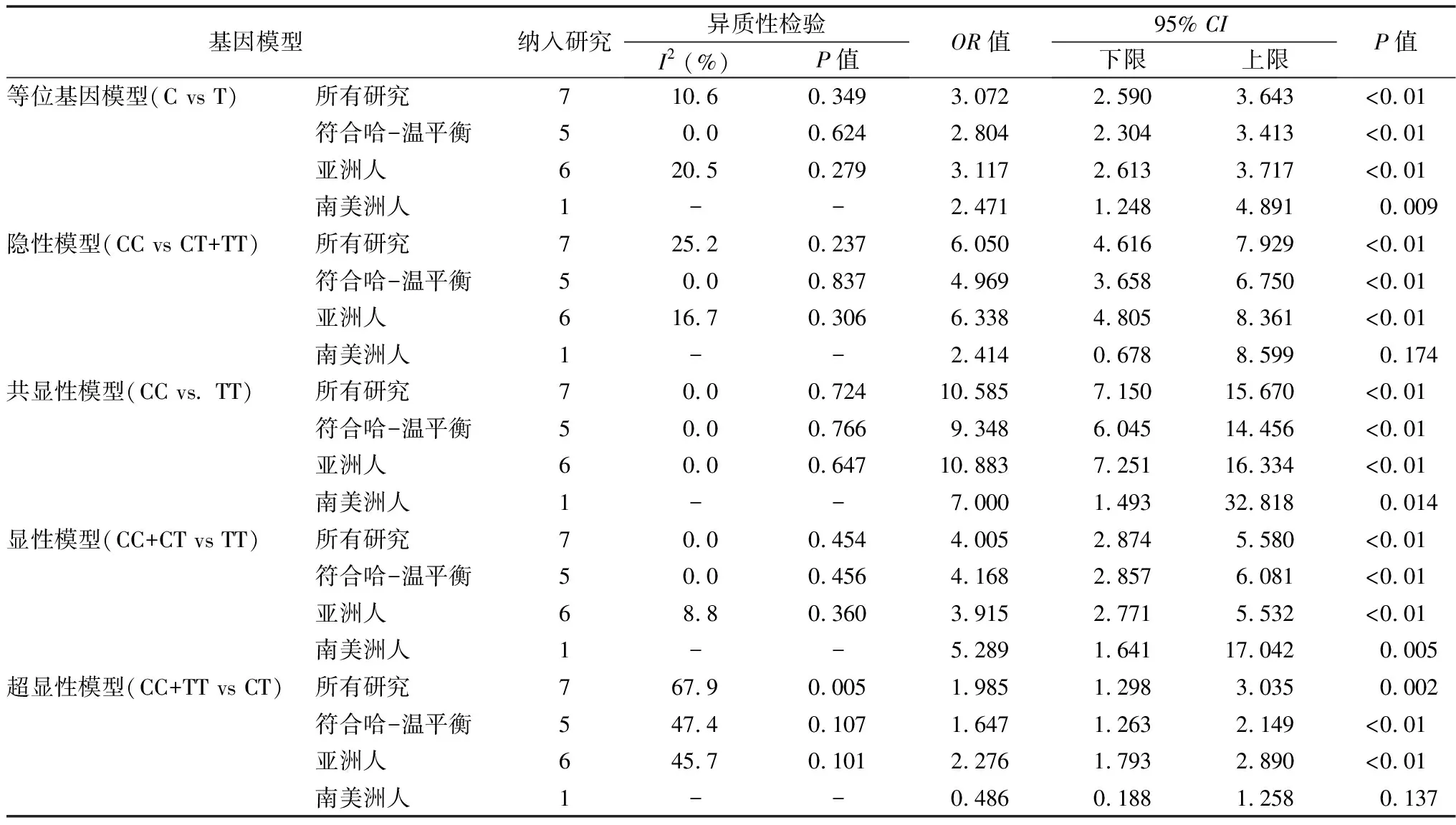
表2 rs312691多态性与甲状腺毒症周期性瘫痪关联性的meta分析
TPP常见于亚洲男性,其他地区本病相对少见[1]。进一步根据病例来自地区不同进行分层分析,结果显示:亚洲人群等位基因模型OR=3.117(95%CI2.613-3.717,P<0.01)、隐性模型OR=6.338(95%CI4.805-8.361,P<0.01)、共显性模型OR=10.883(95%CI7.251-16.334,P<0.01)、显性模型OR=3.915(95%CI2.771-5.532,P<0.01)和超显性模型OR=2.276(95%CI1.793-2.890,P<0.01)。南美洲人群等位基因模型OR=2.471(95%CI1.248-4.891,P=0.009)、隐性模型OR=2.414(95%CI0.678-8.599,P=0.174)、共显性模型OR=7.000(95%CI1.493-32.818,P=0.014)、显性模型OR=5.829(95%CI1.641-17.042,P=0.005)和超显性模型OR=0.486(95%CI0.188-1.258,P=0.137)。可见,亚洲患者所有遗传模型meta分析差异均有统计学意义,但南美洲患者隐性模型和超显性模型meta分析显示差异无统计学意义。
2.3发表偏倚与敏感性分析 Egger检验P值介于0.303~0.822之间,Begg检验P值介于0.293~0.881之间,可见纳入的研究不存在发表偏倚,见表3。敏感性分析依次剔除纳入研究后关联性结论均不受影响,这显示本研究的结果具有可靠性。
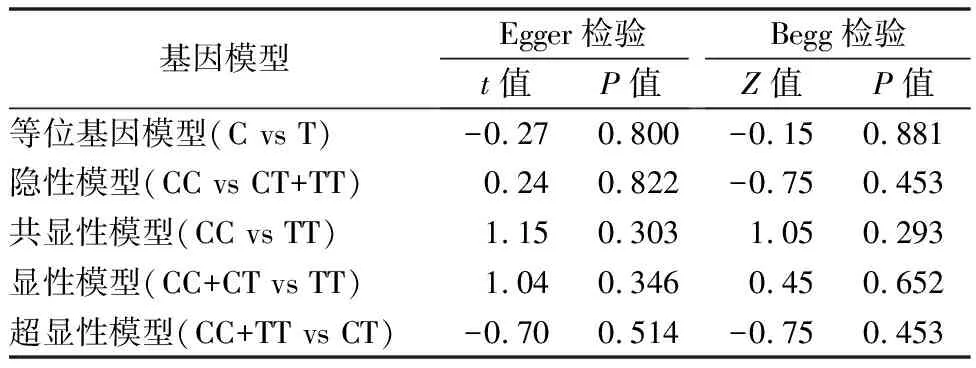
表3 各基因模型发表偏倚的Egger检验和Begg检验
3 讨 论
本研究通过meta分析的方法探讨了rs312691多态性和TPP发病之间的关系。结果显示该位点碱基由T突变为C会导致TPP发病风险升高2.072倍,若该位点两个等位基因均突变(CC),和野生型纯合子(TT)相比,TPP风险升高9.585倍。其他基因模型也有相同的发现。可见rs312691多态性和TPP发病有关。
由于本研究纳入的Li等[11]和Park等[16]研究对照组基因频率不符合HWE,为了排除这两项研究对meta分析结果的影响,排除这两项研究后再次进行meta分析仍然显示rs312691多态性和TPP发病有相关性( 等位基因模型OR=2.804,95%CI2.304-3.413,P<0.001)。前面提到Wang等[5]的研究纳入了Graves病和多结节性甲状腺肿伴甲状腺功能亢进症的患者,其他纳入meta分析的研究均仅纳入了Graves病的患者[11-16],为排除纳入人群不一致对meta分析结果的可能影响,进一步排除该研究的敏感性分析显示等位基因模型OR=3.071(95%CI2.539-3.713,P<0.01),这与排除前的合并结果基本一致(OR=3.072,95%CI2.590-3.643,P<0.01)。可见排除Wang等[5]的研究对meta分析结论无影响。既往有学者提出TPP是否发生与甲状腺毒症类型无关[5],本研究进行的敏感性分析也说明这一观点,无论是Graves病还是多结节性甲状腺肿伴甲亢导致的甲状腺毒症,只要出现rs312691位点由野生型的T突变为C,就会导致TPP发生风险增加。由于TPP主要发生在亚洲人群,本研究的亚组分析显示Melo等[15]针对巴西患者TPP发生危险因素R 研究结果也和亚洲患者一致。综合以上,经过纳入上述7项研究共961例患者的meta分析显示rs312691多态性和TPP发生有关联。
尽管meta分析显示rs312691和TPP的发病有关,但是由于该位点本身位于17q24.3的非编码区[13],该位点很可能是通过间接途径而不是直接影响K+细胞内外平衡导致TPP发生。rs312691位于KCNJ2基因(编码钾通道Kir2.1)下游150kb和KCNJ16基因(编码钾通道Kir5.1)下游195 kb[13],故推测rs312691可能通过调控上述基因表达促发TPP的发生。KCNJ16编码的Kir5.1主要在肾脏、胰腺和甲状腺表达,主要作用为调节液体和pH平衡[17],故KCNJ16和TPP发生关系不大。与KCNJ16不同,编码Kir2.1的KCNJ2基因在骨骼肌和心肌有表达[18],该基因的功能失活突变(loss-of-function mutation)会导致1型Andersen-Tawil综合征(Andersen-Tawil syndrome,ATS)[19]。1型ATS一个特征性表现就是发作性的周期性瘫痪和肌无力,且多数情况下在症状发生时会伴随低钾血症,运动为发作的常见诱因[19],1型ATS的这些特征和TPP的临床表现非常类似。简要来讲,1型ATS上述症状发生的机制为Kir2.1表达下降导致的K+外流受限,结果就是K+在细胞内蓄积从而出现转移性低钾血症和瘫痪。上述证据显示rs312691很可能是通过调控KCNJ2基因而不是KNCJ16基因促进TPP的发生。Li等[11]对中国大陆TPP患者进行研究无一例患者存在KCNJ2基因突变,这也说明尽管TPP和1型ATS有类似的临床表现,但TPP患者发病并不是因为KCNJ2基因本身所致。
Meta分析可以说明rs312691多态性和TPP的发生有关,但却无法解释为何该突变位点携带者只在甲状腺毒症期间才会发生TPP,甲状腺毒症一旦解除,即使是突变位点携带者患者也不会再次出现TPP,这是TPP和1型ATS临床表现的区别之处。对于这一现象的原因,学界推测可能是rs312691对KCNJ2基因调控作用需要在血液中甲状腺激素浓度升高的情况下才能体现出来[13]。为了验证这一假说,Melo等[15]研究观察到rs312691位点TC杂合子患者在TPP发作期间有长链非编码RNA(long intergenic noncoding RNA,lincRNA)CTD-2378E21.1、反义KCNJ2基因(antisense KCNJ2,AS-KCNJ2)表达升高和KCNJ2表达下调的现象;另一方面,rs312691位点TC杂合子患者甲状腺毒症恢复以后lincRNA CTD-2378E21.1以及AS-KCNJ2又与rs312691位点TT纯合子患者表达水平一致。在排除KCNJ2基因突变的情况下,Song等[20]一项针对台湾TPP患者的研究也显示lincRNA CTD-2378E21.1和KCNJ2基因表达有负相关的关系。上述证据显示在甲状腺激素水平升高的情况下,rs312691位点一旦由野生型的T突变为C,lincRNA CTD-2378E21.1和AS-KCNJ2基因上调会导致KCNJ2基因下调,从而导致Kir2.1表达下降,影响K+外流。前面已经提到,甲状腺毒症本身由于Na+-K+-ATP酶活性增加,会有K+内流增多的现象。综合以上,在体内甲状腺素增多的情况下,rs312691位点突变型的甲状腺毒症患者不仅存在K+流入增多,还存在K+流出减少,两方面的综合影响下,就会导致低钾血症和瘫痪的出现。甲状腺毒症一旦缓解,上述对K+影响的因素被去除,从而不再出现转移性低钾血症和瘫痪。
亚洲人群有更高的发生TPP的风险,既往数据显示中国男性甲状腺毒症患者发生TPP的比例高达13%,女性也有0.17%[1]。本研究显示rs312691位点碱基由T突变为C会导致TPP风险升高,以目前的分子生物学技术水平,rs312691突变检测结果已经可以非常快速的得到[5]。因此,对于国内甲状腺毒症患者,尤其是男性Graves病患者进行rs312691多态性检测有助于提前发现TPP高风险人群,对于筛查该位点C基因型携带者进行针对性的预防和患者教育可能会有助于避免发生TPP。
由于既往TPP的病例多发生在亚洲地区,其他地区纳入人群较少,如果有更多人群该位点多态性的数据,就能够知道该位点在不同人群中的变异是否有差异。此外,本次meta分析纳入的研究都是病例对照研究,未来如果能对Graves病或其他原因甲状腺毒症携带rs312691位点突变和野生型的患者进行前瞻性的随访,比较两组发生TPP的差异,这样的研究就能更进一步提高结论的说服力。
总之,本研究显示rs312691位点的碱基由野生型T突变为C以后会导致甲状腺毒症患者发生TPP风险升高。其机制可能为在过多甲状腺激素存在的情况下,该位点能上调lincRNA CTD-2378E21.1和AS-KCNJ2的表达,下调KCNJ2的表达,从而导致细胞膜钾通道Kir2.1减少,K+外流减少。上述机制与甲状腺毒症伴随存在的Na+-K+-ATP酶活性增强所导致K+内流增加共同作用的结果就是细胞外K+水平下降和TPP的发生。
