间充质干细胞来源外泌体在运动调节骨关节炎中的作用
2020-03-25董贵俊田雪文李可峰
董贵俊,闫 前,吴 燕,田雪文,李可峰
(山东体育学院,山东 济南250102)
0 前言
骨性关节炎(Osteoarthritis,OA)影响全球3 亿人口生活质量,其发病率以每年高达33.5%的增长率快速升高,预计2020年,其发病率将升为全球第4(GBD 2017 Disease and Injury Incidence and Prevalence Collaborators.,2018)。关节疼痛和僵硬是OA 的主要症状,主要病理学特征是进行性关节退化伴软骨损失,异常重塑和糜烂,关节边缘处形成骨赘,肌肉及韧带退化等(Li et al.,2013);除导致慢性疼痛和运动障碍等之外,副作用还包括诱发心理疾病,增加患肥胖和心血管疾病的风险等,从而影响患者寿命及生活质量(Sarzi-Puttini et al.,2005)。OA 的发病原因较为复杂,与年龄、肥胖、缺乏运动、遗传易感性、性别差异、创伤等诸多因素相关(Heidari,2011)。
OA 临床治疗主要以药物治疗、物理治疗等手段来缓解患者疼痛、延缓病程进展、保护关节功能、改善患者生活质量,但效果并不理想(Hochberg et al.,2001)。近年来,运动疗法逐渐被临床应用并取得出乎意料的预防和治疗效果(刘洋 等,2018;Brismée,2014),因此运动疗法已经成为近年来研究OA 的新热点。OA 的病发机理并未随着多年的实验研究而被揭开,如何结合新的科学技术手段尽快找到其病发机理和新型治疗手段是关乎OA 预防及治疗的关键。间充质干细胞(Mesenchymal stem cells,MSCs)是一种能自我更新的干细胞,并在诱导下进行多谱系的分化,能够分化、成熟形成为骨、软骨、脂肪等器官或组织(Bianco et al.,2014),而间充质干细胞来源的外泌体(MSCs-Exosome,MSCs-Exo)有相同的功能,并具有性质稳定、方便保存、利于提取且容易改造等的应用优势,逐渐成为治疗骨关节炎的新的研究方向。本文就MSCs-Exo 对骨关节炎的修复作用进行探讨,并阐述运动与二者的调节关系。
1 间充质干细胞及其来源的外泌体
MSCs 具有多谱系分化潜能,能够自我更新并分化成谱系细胞(如肌肉、骨骼、脂肪和软骨等)及非谱系的细胞(如神经元细胞等)。再生医学研究证实,临床治疗疾病时MSCs 在48 h 内会迅速从体内清除(Timmers et al.,2007);进一步研究发现,MSCs 治疗过程中通过细胞分化直接对组织修复的作用最小(Aslam et al.,2009),而旁分泌、免疫调节途径是其体内治疗的主要机制(Cheng et al.,2013)。因此,MSCs 的稳定性和生物学效应是影响其临床效用的关键要素。近期,一种几乎所有细胞类型都可释放和胞吞的细胞外囊泡——外泌体(Théry et al.,2009)受到人们越来越多的关注。外泌体(exosomes)是直径为30~100 nm,由磷脂双分子层包裹的微囊泡,其内含有大量蛋白质、脂质以及DNA、mRNA、微小RNA(miRNA)和非编码RNA 形式的核酸材料(Théry et al.,2009)。外泌体始于早期内吞体的出现,即膜表面内吞形成的内吞体,其在高尔基体作用下成熟发育为晚期内吞体,并向内出芽,形成包裹来自高尔基体的蛋白质、DNA、mRNA 和miRNA的腔内囊泡组成的多胞体(multivesicular body,MVB)(Théry et al.,2002;Trams et al.,1981)。最后,MVB 与质膜融合,将外泌体通过胞吐作用释放,或将其送至溶酶体进行降解。外泌体从细胞内被释放后,与相邻细胞或远处细胞通过内分泌和旁分泌的方式进行信号传递。信号的传递方式一般分为3 种:1)外泌体直接作用于细胞膜;2)与细胞表面受体相结合;3)通过内吞作用传递等多种途径(图1)。因此,外泌体既可作为重要的信号传递信使和载体,将信号传递给相应的靶细胞,改变它们原有的生理功能和状态;也可作为细胞排泄的主要途径,以解决未利用或有害的RNA 和蛋白质(Raposo et al.,2004)。随着研究的深入,发现将MSCs-Exo 注入软骨损伤处,可见其状态稳定并对软骨有修复作用,因此,一旦其表征和生物学得到进一步的认知,其将具有临床治疗应用潜力(Zhang et al.,2016b)。
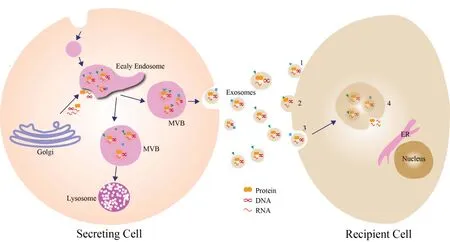
图1 外泌体的形成及分泌蛋白质和RNA及作用于靶细胞(修改自Raposo et al.,2013)Figure 1.Exosome Formation and Secretion of Proteins and RNA and their Effects on Target Cells
外泌体内含有mRNA、miRNA、tRNA 这些调节受体细胞活动的主要RNA(Ana et al.,2016)。其中,miRNA 是细胞间信息交互的主要物质,利用其自体的降解和再表达来调节受体细胞的基因表达。细胞中RNA 的表达并不具有供体和组织特异性等表达特性,但外泌体中所含的RNA 却较大水平上受细胞的具体类型和分化的影响。MSCs-Exo 来源于不同的组织也具备不同的功能,其所含的RNA 或蛋白能够发挥其细胞应有的作用并调节细胞的增殖与分化,可以避免损伤,调节免疫反应以及促进细胞损伤后的自我修复和组织重建(Liang et al.,2013;Lopez-Verrilli et al.,2016)。
2 MSCs分泌作用与软骨损伤修复的关系
MSCs 可以直接分泌营养因子,也具有旁分泌作用,两种机制协同作用改善组织器官局部微环境,促进组织修复。Wu 等(2011)通过将人的骨髓间充质干细胞和人(或者牛)的原代软骨细胞进行共培养,发现MSCs 会促进软骨细胞增殖和细胞外基质(Extracellular matrix,ECM)的营养作用,促进了软骨的形成,表明共培养过程中MSCs营养分泌促进软骨细胞的生长。其后,Wu 等(2012)从脂肪、滑膜组织中分离出MSCs,将其进行相同培养,发现软骨基质同样增加,证实了对于软骨细胞,MSCs 的营养作用与来源无关,是一种普遍现象。另一方面,MSCs 会借助旁分泌机制,调控抗炎和免疫调节机制来改善再生环境修复损伤(Murphy et al.,2013)。研究表明,人脂肪组织来源的间充质干细胞(Human adipose tissue-derived mesenchymal stem cells,hAd-MSCs)可用于发炎或受损组织的再生。为了鉴定发炎期间hAd-MSCs 分泌的蛋白,将hAd-MSCs 暴露于肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)的环境之中。在TNF-α 环境诱导下,118 种蛋白质得以更高水平分泌,包括多种细胞因子和趋化因子,如白介素-6(IL-6)、IL-8、趋化因子(C-X-C 基序)配体6 和单核细胞趋化蛋白-1(MCP-1)等。这些因子释放降低了炎症反应,改善了局部环境(Lee et al.,2010)。此外,旁分泌机制也是MSCs 发挥其功能必不可少的一个环节。关节表面会在注射MSCs 后得到相应的修复,MSCs 从中协调和增强了修复应答,其自身的细胞才是修复损伤的主要细胞(Barry et al.,2013)。大鼠实验发现,MSCs 作为干细胞的修复作用体现在改变细胞信号传导途径,上调Ihh 以及BMP-2 的表达,促进Ⅱ型胶原蛋白分泌增加,进而改善软骨损伤(Horie et al.,2012)。MSCs-Exo 内富含有大量的miRNA(Sheng et al.,2010),通过其特有的分泌功能,使miRNA 更好的发挥调控多种重要信号转导的能力。miRNA 是一些单链非编码RNA 小分子,由19~25 个核苷酸构成,通过与互补的mRNA 结合来调节细胞中许多蛋白质的产生(He et al.,2004)。miRNA 参与细胞的许多进程,包括发育、分化、增殖、凋亡、应激反应、脂肪代谢和胰岛素分泌(Ambros et al.,2004),且在控制干细胞的分裂过程中起着重要功效(Hatfield et al.,2005)。miRNA 可以影响炎症反应的发展过程,如抑制致炎相关的靶基因,减少靶基因的蛋白产物的生成(Wijnhoven et al.,2007)。这些miRNA 在介导OA 在内的一些损伤和相关疾病中产生关键作用。软骨发育和体内环境的平衡受MSCs 分泌的microRNA-320(miR-320)的影响,miR-320 直接靶向基质金属蛋白酶-13(Matrix metalloproteinase-13,MMP-13)并下调其表达,降低IL-1β 对软骨的刺激,来调节小鼠软骨细胞的分解代谢,保护小鼠软骨(Meng et al.,2016)。MicroRNA-92a(miR-92a)的直接靶标是Bmp 拮抗剂基因noggin3(nog3),mir92a 的失活会使nog3 mRNA 的稳定性增加,抑制Bmp 信号传导,导致软骨前体细胞不能正常增殖、分化(Ning et al.,2013)。miR-125b 在正常人群和OA 患者的软骨细胞中均表达,但在OA 患者软骨细胞中的表达明显不及正常人群。此外,IL-1β 诱导的ADAMTS-4 上调可以被人体OA 软骨细胞中miR-125b 的过表达所抑制(Matsukawa et al.,2013)。在微团培养中,人类脂肪来源的间充质干细胞在ATDC5 细胞诱导软骨形成的过程中会分泌miR-92a 参与并促进软骨形成(Hou et al.,2015)。
3 MSCs免疫调节与OA预防
机体促炎细胞因子的快速上调会导致关节软骨基质降解和关节损害,如何调节受损软骨或OA 中的炎症环境是软骨治疗中的重要一环(Utomo et al.,2016)。MSCs 通过旁分泌的细胞因子来调控细胞的免疫功能,发挥其免疫潜能(Marigo et al.,2011),如干扰素γ(Interferon-γ,IFNγ)(Kang et al.,2005)、转化生长因子β 1(Transforming growth factor-β1,TGF-β1)(Liu et al.,2012)、白介素6(Interleukin 6,IL-6)(Djouad et al.,2007)等,通过介导免疫调节,降低炎症因子的表达。研究发现,在MSCs 移植修复受损组织的情况下,IFN-γ 对CTL 反应起促进作用,保护宿主免受病毒攻击,从而保护其免受免疫抑制作用(Kang et al.,2005)。MSCs也可以通过分泌转化生长因子TGF-β1和诱导IL-10 的高表达来表现出强大的免疫抑制作用,且分泌抗炎因子TGF-β1的水平在延长培养过程中保持不变(Liu et al.,2012)。另一方面,MSCs 会通过IL-6 的分泌来减少促炎介质的产生,从而达到免疫调节作用(Djouad et al.,2007)。可以看出,MSCs 的免疫调节活性需要多种细胞因子共同作用产生(Ghannam et al.,2010;Kang et al.,2005;Liu et al.,2012)。MSCs-Exo 同样可以诱导IL-10 和TGF-β1的高表达,降低IL-1、IL-6、TNF-α 的表达,来减少炎症反应以保护关节软骨。MSCs-Exo 在异体皮肤移植小鼠中会产生主动免疫反应,诱导调节T细胞,但未移植的小鼠中并未发现此现象,表明MSCs-Exo 具有免疫调节和免疫抑制的作用(Zhang et al.,2014)。长期炎症环境的特征是辅助性T 细胞和巨噬细胞的持续失衡(Grivennikov et al.,2010)。MSCs 通过调节树突状细胞(Dendritic cells,DCs)、效应T 细胞(TH1 和TH2)、自然杀伤细胞(NK)等来减少IFN-γ 的表达和增加IL 的分泌;另一方面,人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells,hBMSCs)会促使DC1 成熟从而降 低TNF-α 分泌,促进DC2 成熟从 而 增 加IL-10分泌,间接促使TH1 向TH2 细胞转变,随着IL-4 和IL-10 的表达增强,恢复了TH1/TH2 平衡,减轻了自身免疫性疾病的症状(Aggarwal,2005;Parekkadan et al.,2010)。同样,IFN-γ的表达被抑制后,随着IL-4 分泌会诱使巨噬细胞从M1 型(促炎,抗血管生成和组织生长抑制)转变为M2 型(抗炎,促重组和组织愈合),从而促进骨髓、肌肉和神经的愈合和再生(Tidball et al.,2010)。MSCs 通过影响免疫细胞的分泌能力来调节宿主免疫系统机制。实验印证MSCs-Exo对T 细胞的免疫调节作用时发现,MSCs-Exo 具有和MSCs相同的功能,可以减少IFN-γ 和TNF-α 的分泌,增加IL-4、IL-10 和TGF-β 的产生;当与免疫细胞共培养时,MSCs 通过增强前列腺素E2 的产生来调节免疫系统(Blazquez et al.,2014;Zhang et al.,2014)。另外,MSCs-Exo 抑制自身免疫性淋巴细胞增殖,诱导调节性T 细胞来调节免疫反应(Mokarizadeh et al.,2012;Zhang et al.,2014)。进一步研究发现,MSCs-Exo 不直接对T 淋巴细胞起免疫抑制作用,而是通过巨噬细胞与MSCs-Exo 的相互作用后,巨噬细胞被诱导为分泌抗炎细胞因子的M2 样表型,并为调节性T细胞群提供生存环境(Zhang et al.,2014)。
4 MSCs对骨损失的修复作用
伴随着OA 病情的进展,逐渐坏死脱落的关节软骨细胞导致潮线向软骨层推进,破裂崩坏,引发囊腔样空洞的产生(Bonde et al.,2015)。MSCs 具备成骨能力,通过对骨和软骨受损组织进行修复和再生来改善膝骨性关节炎。体内外泌体分泌水平较低的CD92/2 小鼠,其股骨骨折后愈合能力较野生型小鼠显著下降;随后将从MSCs 培养基中分离的外泌体注射入CD92/2 小鼠骨折处,能显著促进骨折愈合,并诱导血管的生成(Furuta et al.,2016)。此外,临床上将源自人诱导的多能干细胞的间充质干细胞来源的外泌体(Exosomes derived from human-induced pluripotent stem cell-derived mesenchymal stem cells,hiPS-MSC Exos)与β-磷酸三钙(β-Tricalcium phosphate,β-TCP)联合应用,促进了小鼠颅骨缺损处的骨再生(Zhang et al.,2016a)。体外细胞实验也发现,人骨髓间充质干细胞可以胞吞hiPS-MSC-Exos,并促进细胞的迁移、增殖分化和成骨潜能(Zhang et al.,2016a)。在股骨滑车软骨损伤的小鼠关节内注入人胚胎诱导的间充质干细胞来源外泌体,透明软骨层和软骨下骨的再生会在12 周后的关节表面明显看出,而关节内注射磷酸盐缓冲盐水的对照组只发现了纤维组织的修复(Raposo et al.,2004)。体外将脂肪间充质干细胞(Adipose-derived mesenchymal stem cells,Ad-MSCs)与富含血小板的血浆结合,并植入骨矿物质基质载体共同培养,8 周后发现了骨钙素阳性的愈伤组织样组织和骨细胞的增加,印证了Ad-MSCs 具有同样的成骨潜能(Vladimir et al.,2015)。另一组实验中,BMSCs 在成骨表现上,从细胞分离速度、新骨成型速度以及成骨量上都明显优于Ad-MSCs(Zhang et al.,2013)。在ECM 扩增的hBMSCs 具有良好的向成骨分化的潜能,较低的向成脂分化的能力,因此,可将ECM 扩增的hBMSCs 用于软骨内骨的修复和治疗(Ming et al.,2011)。
OA 的发病和恶化受多种因素影响,具体机理尚不清楚。外泌体通过自身携带的miRNA、细胞因子、信号因子参与OA 的进展来修复和治疗OA,逐渐成为揭示OA 发病机制和治疗手段的新的研究热点(Furuta et al.,2016;Qin et al.,2016)。骨折愈合的时间会在MSCs-Exo 注射入小鼠骨折处后明显缩短,测序后发现此过程中有与成骨相关的miR-196a、miR-27a、miR-206 及细胞因子单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)、MCP-3、基质细胞衍生因子-1 在BMSC-exosomes 中显著高表达,且这些细胞因子及miRNA 的高表达会促使骨愈合加速(Furuta et al.,2016;Qin et al.,2016)。体外实验表明,外泌体可以从β-TCP 释放并被hBMSCs 内化,并激活hBMSCs 的PI3K/Akt 信号通路来增强β-TCP 的骨生成(Zhang et al.,2016a)。研究发现,SMSC-140-Exo 带有的Wnt5a 和Wnt5b 通过替代Wnt 信号通路激活YAP,并增强软骨细胞的增殖和迁移,同时不损害ECM 的分泌(Shi-Cong et al.,2017)。通过miR-140-5p 转染SMSCs 后,高表达的miR-140-5p 通过RalA 阻断了这种减少SOX9 和细胞外基质分泌的副作用。在MSCs 的其他研究中,MSCs 会在IGF-1 或BMP-6 与TGF-β3 共同作用下促进向软骨的分化和生成,但单独的BMP-6 不能诱导软骨形成(Indrawattana et al.,2004;Shi-Cong et al.,2017)。此外,骨软骨祖细胞置于成年兔内侧股骨髁全层软骨缺损处24 周后,软骨下骨完全修复,而不损害覆盖的关节软骨(Wakitani et al.,1994)。自体注射BMSCs 后观察山羊膝关节OA 软骨组织的修复及再生,发现BMSCs 会显著延缓软骨下骨进一步的硬化、骨赘生长的速度,促进半月板组织的再生修复(Murphy et al.,2003)。此外,将透明质酸中培养的MSCs 注射入猪股骨内侧髁的软骨缺损处,发现软骨注射后第6 周和第12周,组织学和形态学上的修复得到明显改善(Lee et al.,2007)。通过绿色荧光蛋白标记MSCs 并注射入动物体内发现,MSCs 在临床和放射学上均具有显著软骨修复作用(Mokbel et al.,2011)。随着研究的深入,从人体髂嵴的骨髓抽吸并分离出MSCs 进行体外离体培养,注射到OA 患者的膝盖中24 周后,退行性OA 受试者的软骨和半月板生长明显,疼痛减轻,关节活动度增加(Centeno et al.,2008)。 Emadedin 等(2012)在膝关节OA 患者关节内注射BMSCs 后6 个月,患者在疼痛,膝关节功能状态和行走能力方面均有改善,并可以在磁共振图像(MRI)中明显看出软骨厚度的增加(Emadedin et al.,2012)。
5 运动对外泌体、骨性关节炎的影响
关节软骨退行性变化是由多因素造成的,其中就包括营养缺乏(Zhuo et al.,2012)。软骨细胞的营养有赖于关节的粘弹性和关节的运动,通过承重压缩和释放期间的滑膜液扩散来滋养软骨(Vanwanseele et al.,2002)。研究发现,兔髌骨关节面骨膜移植术重建后,进行持续被动活动的治疗效果优于间歇性活动运动治疗,证明持续被动活动由于连续的关节运动更具有益处(Moran et al.,1992)。关节负荷对于维持正常关节软骨的生物学和功能特性具有重要的作用,在非正常负荷情况下,关节运动不能保持正常的关节软骨形态(Palmoski et al.,1980)。由此,运动强度可能是软骨修复的重要影响因素(Galois et al.,2004)。有研究表明,对Wistar 大鼠进行为期6 周的高强度运动训练之后,糖胺聚糖(Glycosaminoglycan,GAG)和胶原蛋白含量显著降低,增加了软骨退变的速度,而低或中等强度运动则对关节软骨的病变产生有益影响(Kiviranta et al.,1988;Ni et al.,2011)。适度的跑步运动可改善关节软骨的周围环境、生理结构和关节力学特性(Ni et al.,2011),防止关节软骨进一步的退变(Carver et al.,1999)。体外实验发现,两种间歇压力水平下,来自幼年细胞实验组中的GAG 浓度比对非加压幼年细胞和成体细胞中的浓度高10 倍,并且在1 000 psi 下的间歇性加压中促进了胶原蛋白的产生。上述结果表明,较高水平的间歇性压力可能会对胶原蛋白产生更大的刺激,促进其生成(Carver et al.,1999),且软骨细胞可以在发育期间及整个成年期内转导和响应各种机械刺激(Christopher et al.,2013)。
运动强度、运动类型及运动时间都会对关节内软骨蛋白多糖(Proteoglycan,PG)或GAG 产生迥异的影响。大强度关节活动后,关节软骨所含的PG 含量会降低(Arokoski et al.,2000)。研究表明,犬股骨髁上端的骨内GAG 会在高负荷跑步后下降多达11%(Kiviranta et al.,1992)。其他动物实验表明,软骨组织中PG 的合成数量会在中等强度运动后增长(Murray et al.,1999)。5 个月大的马驹膝软骨的GAG 数量会在适量的锻炼后增加,但当锻炼中止6 个月后,GAG 的数量逐渐稳定(Firth et al.,2006),说明软骨内的GAG 受运动影响的这一现象是可逆转的。在研究运动对软骨关节组成的影响后发现,GAG 的数量会在适度的关节活动后得到增长(Eckstein et al.,2006;Jones et al.,2003)。中等强度的运动会改善半月板摘除后病人的关节症状及功能,使之适应关节负荷的改变,增加软骨中GAG的量,降低患OA的风险(Andersson et al.,2006;Roos et al.,2005)。
外泌体广泛存在于包括外周血在内的所有体液中,但目前有关运动和外泌体的研究较少。在单次运动研究中,对个体进行单车和跑台两种运动模式,分别采集运动前、运动后和运动后第90 min 的血浆样品,从中分离外泌体,发现运动后血液所含外泌体的数量显著增加;且相较于跑台运动,单车运动后外泌体的数量在休息90 min 后会再次下降,证明外泌体的分泌会受运动方式的影响,这可能与跑台运动需要调动更多的肌肉有关(Frühbeis et al.,2015)。为了更好揭示外泌体释放动力学,在单车运动方案的每个阶段另外采集血浆样品,发现运动的早期阶段,在个体达到无氧阈值(以乳酸的增加为特征)之前,已经开始释放外泌体,说明在运动的有氧阶段,外泌体已经发挥作用,并且在运动参与的适应过程中参与细胞通信(Frühbeis et al.,2015)。对小鼠进行单一运动训练后,对其血液进行测试发现了蛋白质ALIX 和Hsp70,它们是典型的外泌体标记物,说明运动会诱导血液中携带Hsp60的外泌体释放,从而促进能量代谢(Barone et al.,2016)。运动中的压力会使体内血液中的外泌体快速增加。Bei等(2017)研究发现,小鼠在游泳3 周后,血液中外泌体增加了1.85 倍,随后用IGF-1 处理H9C2 细胞以模拟体外运动刺激,发现与ALIX 和RAB35 活化相关的心肌细胞中外泌体的释放增加,表明运动引起循环系统内的外泌体增加,保护和避免了心肌I/R 损伤。Krüppel 样转录因子2(Kruppel-like factor 2,KLF2)是动脉粥样硬化保护机制中血管内皮生理表达的关键因子。在体外培养的平滑肌细胞(Smooth muscle cell,SMC)中用KLF2 转导或剪切应力刺激内皮细胞,会增加富含miR-143/145 的外泌体分泌,并控制靶基因表达,减少小鼠主动脉中的动脉粥样硬化病变的形成,表明miRNA 和外泌体的分泌可以促进内皮细胞和SMC 之间的通讯(Hergenreider et al.,2012)。与非运动组相比,运动可以增加外泌体的分泌量,降低2 型糖尿病患者的基质金属蛋白酶9(MMP9)活性,从而减轻糖尿病的症状(Chaturvedi et al.,2015)。综上所述,运动通过促进外泌体的分泌和流动速度来调节内环境的稳态。体内、外环境的改变会影响外泌体的分泌(Müller,2012),运动可能会对MSCs 的迁移和分化产生影响。体外实验证明,细胞在受到缺氧刺激后会改变它分泌的外泌体成分,从而修复损伤组织(Tetta et al.,2011)。

图2 运动影响OA发病的可能机制Figure 2.Possible Mechanisms of Exercise Affecting the OA Pathogenesis
运动可以发挥直接保护关节软骨的作用,也可以间接激活MSCs 及MSCs-Exo 来保护和改善OA(图2)。通过加载的同种异体的BMSCs 比无加载的同种异体移植和自体移植的BMSCs 产生更多的新骨(Hernigou et al.,2016)。加压运动可加重骨髓的低氧代谢状态,与非加压运动条件下相比,长期处于加压运动条件下的BMSCs 的形态更接近于形态上小而圆的原代细胞,更倾向于增殖,但分化能力受到抑制;在未加压的常氧状态下,BMSCs 多呈梭状,会在诱导后分化为心肌样细胞,表明常氧状态下的BMSCs 比其在缺氧后更趋向于进行分化(杨玉辉等,2016)。Zhang 等(2017)的实验表明,中等水平的运动可能会增加成骨MSCs 的数量,而低或者高水平的对照组没有显著变化。运动可以促使参与骨形成的原代BMSCs 的增殖和分化,使之有助于骨形成。机械拉伸可以增强体外BMSCs 向成骨细胞的分化,减少向脂肪的转化(Liu et al.,2017)。
6 小结与展望
MSCs-Exo 通过分泌作用、免疫调节、成骨能力等途径在骨性关节炎的修复过程中起到重要作用,但MSCs-Exo对膝骨关节炎修复的作用机制还不明确,在临床实验领域应用较少;在软骨修复中,仍然存在关于治疗功效、生物安全性、动力学和生物分布等重要问题,需要在大型动物研究中验证。外泌体为临床OA 治疗提供了一种全新的思路,特别是MSCs-Exo 的体外注射,有可能成为OA 治疗的一种新途径。科学运动对于MSCs 的分泌及软骨再生具有积极的促进作用。如何通过科学运动促进MSCs及MSCs-Exo 的分泌,促进关节软骨机械力学变化,从而避免OA 发生或者缓解OA 病灶进一步蔓延,成为运动干预OA 的一种潜在干预机制。下一步应对运动改善外泌体的分泌和功效及临床康复过程中通过运动与外泌体的结合治疗骨关节炎等,在临床实验中进行验证,使之有可能成为临床康复治疗OA 的一种全新手段,也可为OA 和外泌体的干预途径研究提供崭新的视角。
