抗阻运动通过刺激骨骼肌FSTL1分泌抑制心梗大鼠心肌细胞凋亡及其机制探讨
2020-03-25郝美丽田振军
郝美丽,席 悦,田振军*
(1.陕西师范大学 体育学院 暨运动生物学研究所 运动与心血管健康研究室,陕西 西安710119;2.洛阳师范学院 体育学院,河南 洛阳471934)
心肌梗死(myocardial infarction,MI)导致心肌缺血缺氧产生氧化应激和炎症反应,心肌细胞发生坏死或凋亡,心功能显著下降(Bao et al.,2018;Ma et al.,2018),最终导致心力衰竭(Yang et al.,2019)。因此,减少氧化应激和炎症反应,抑制心肌细胞凋亡,降低心肌纤维化,改善MI 后心功能至关重要。
卵泡抑素样蛋白1(Follistatin-like protein 1,FSTL1)属于分泌型糖蛋白,可由骨骼肌和心肌产生并分泌(Oshima et al.,2008;Ouchi et al.,2008)。增 加MI 小鼠心外膜FSTL1 表达,可显著降低心肌纤维化水平(Wei et al.,2015)。心脏缺血/再灌注(ischemia/ reperfusion,I/R)小鼠静脉注射rhFSTL1 蛋白,可显著降低心肌细胞凋亡,抑制炎症反应,减少心肌梗死面积(Ogura et al.,2012)。小鼠经醛固酮诱导心衰后,给予静脉注射rhFSTL1 腺病毒载体可显著降低病理性心肌肥大,相反,特异性敲除心肌fstl1后心脏的心肌肥大显著增加(Tanaka et al.,2016)。表明,FSTL1 在病理性心脏保护中发挥重要作用。
运动锻炼是心血管疾病预防和康复的安全有效手段之一,适宜的运动训练可改善氧化应激,降低MI 心脏的炎症反应,抑制心肌细胞凋亡,促进心肌的血管生成(Bei et al.,2017;Lu et al.,2015;Rodrigues et al.,2014),改善MI 心脏的左室病理性重构(Haykowsky et al.,2011),提高MI 患者的生存率(Jorge et al.,2011)。抗阻运动可降低心衰大鼠或病人心脏的胶原沉积和炎症反应,改善骨骼肌和心脏的功能(Alves et al.,2014;Toth et al.,2012),是MI 后安全有效的康复方式之一。骨骼肌目前被视为分泌样器官,可合成和分泌多种生物活性物质,并通过旁分泌和内分泌方式对周边及远隔器官发挥生物学作用(Pedersen et al.,2012)。文献表明,运动可刺激骨骼肌细胞因子的表达和释放(Peake et al.,2015)。但关于抗阻运动是否通过刺激骨骼肌源性FSTL1 分泌,提高MI 大鼠心肌FSTL1 表达,抑制心肌细胞凋亡及其机制的研究,尚缺少文献报道。本文拟采用心梗大鼠抗阻运动或胫骨前肌注射FSTL1 腺相关病毒载体干预,LPS 干预构建H9C2 细胞凋亡模型,rhFSTL1、AMPK 激动剂AICAR 和PI3K 抑制剂LY294002 干预H9C2 心肌细胞,对上述问题进行探讨,为MI 心脏的运动康复手段和靶点筛选提供实验依据。
1 材料与方法
1.1 主要仪器和试剂
主要仪器:ALC-V8 小动物呼吸机、Power-Lab/8ST 生物信号采集系统、ZH-PT 动物实验跑台、匀浆机、蛋白定量仪、Bio-Rad 水平电泳仪和转移槽、凝胶成像系统、BMII 型病理组织包埋机、LEICA-RM2126 切片机、YT-6C 生物组织摊烤片机、Olympus BX51 光学显微镜、Nikon Eclipse 55i 荧光显微镜等。
主要试剂:兔多克隆抗体FSTL1(Proteintech 公司),DIP2A(Biorbyt 公司),山羊抗兔二抗(西安晶彩),p-Akt、Akt、p-mTOR、mTOR(美国Cell Signaling Technology),小鼠单克隆抗体Bcl2、Bax、兔多克隆抗体cTnT(北京博奥森),FITC 标记的山羊抗兔二抗、TUNEL 试剂盒(碧云天),BCA 蛋白定量试剂盒(西安晶彩),LPS、rhFSTL1、AMPK 激动剂AICAR、PI3K 抑制剂LY294002(selleck)。
1.2 实验动物分组和MI模型制备
实验动物分组:雄性SD 大鼠60 只,购于西安交通大学实验动物管理中心,动物编号:SCXK(陕)2012-003,体重180-220 g,适应性喂养1 周后,采用左冠状动脉前降支结扎手术制备MI 模型。术后存活40 只,随机分为心梗安静对照组(MI)、心梗+抗阻运动组(MR)、心梗+腺相关病毒空载体组(MV)、心梗+FSTL1 腺相关病毒载体组(MF),每组10 只。另选取10 只,只穿线不结扎,作为假手术组(S)。所有大鼠自由饮食饮水,室温21℃~28℃,湿度50%~60%。
MI 模型制备:大鼠称重后,腹腔注射5%戊巴比妥钠溶液(30 mg/kg),麻醉后,大鼠仰卧固定,小动物呼吸机呼吸面罩辅助呼吸,全程连接心电进行监测。开胸,暴露心脏,于左心耳与肺动脉圆锥交界点下2 mm 处进针结扎,以心电图ST 段抬高或T 波倒置,结扎处下方心肌颜色变浅或变白为造模成功的标志,造模成功后逐层缝合,排气关胸。
1.3 抗阻运动方案和腺相关病毒载体构建及注射方案
抗阻运动方案:依据参考文献和预实验确定抗阻运动方案(Alves et al.,2012;Grans et al.,2014)。术后1周,MR 组开始进行爬梯运动,爬梯高1.1 m,间隔2 cm,倾斜角度85°。第1 周为无负重适应性抗阻运动,第2~4 周为负荷递增的抗阻运动,每天递增负荷为体重的10%,当负荷达到75% 体重后,保持该负荷直到训练结束,5 天/周×4 周。
腺相关病毒载体构建及注射方案:委托赛业公司采用AAV8 构建骨骼肌特异性高表达fstl1载体dMCK- Prom-Hfstl1-3xflag-IRES-EGFP,以无Hfstl1 序列的AAV8 载体作为空载体对照。腺相关病毒载体注射方案:依据参考文献和预实验确定注射方案(Arruda et al.,2003;Tanaka et al.,2016)。术后1周,MF组于左后肢胫骨前肌注射FSTL1 腺相关病毒载体,MV 组在相同部位注射腺相关病毒空载体,注射量均为1×1010PFU。
1.4 细胞实验分组及激动剂、重组蛋白和抑制剂干预方案
细胞实验分组:H9C2 细胞分为8 组,即H9C2 空白对照组、H9C2+LPS 组、H9C2+LPS+LY294002 组、H9C2+LPS+rhFSTL1+AICAR 组、H9C2+LPS+rhFSTL1 组、H9C2+LPS+rhFSTL1+LY294002 组、H9C2+LPS+AICAR 组 和H9C2+LPS+AICAR+LY294002 组。除H9C2 空白对照组外,其余各组经LPS、激动剂、重组蛋白和抑制剂干预刺激。
LPS、激动剂、重组蛋白和抑制剂干预方案:10%FBS完全培养基常规培养H9C2 心肌细胞,隔天换液。细胞传代贴壁后,用10 μM 浓度的PI3K 抑制剂LY294002 进行干预,然后更换培养基为2%FBS 完全培养基,再用100 ng/ml浓度的rhFSTL1 蛋白和1 mM 浓度的AMPK 激动剂AICAR 干预48 h,10 μg/ml 浓度的LPS 干预4 h,提取蛋白和固定细胞。
1.5 大鼠心功能检测
4 周训练结束后次日,称重,腹腔麻醉,分离右颈总动脉,将导管从右颈总动脉逆行送入至左心室。生物信号采集系统记录左室收缩压(left ventricular systolic pressure,LVSP)、左室舒张压(left ventricular end- diastolic pressure,LVEDP)和左室压力最大升/降速率(±dp/dtmax)等血流动力学参数,评定心功能。
1.6 Masson染色
经腹主动脉取血后立即摘取心脏和左后肢胫骨前肌,用于组织学和分子相关实验。心脏经4%多聚甲醛固定48 h 后,流水冲洗,梯度酒精脱水,三氯甲烷透明,石蜡包埋,5 μm 连续切片并制片。常规Masson 染色。光镜下观察拍片,Image-ProPlus 5.1 软件分析测定心肌胶原面积百分比(CVF%)。
1.7 Western Blotting实验
取MI 大鼠边缘区心肌组织和左后肢胫骨前肌50 mg左右,加入蛋白提取试剂,低温下匀浆,离心并取上清,进行蛋白定量,血清直接进行蛋白定量;细胞实验各组将干预刺激后的6 孔板从培养箱中取出,弃去培养基,PBS 清洗2 次,每 孔 加 入100 μl 的RIPA 裂解液、PMSF 和磷酸酶抑制剂各1 μl,刮取细胞移入EP 管中超声破碎,低温离心,取上清,进行蛋白定量。
常规Western Blotting 实验,FSTL1、p-Akt、Akt、p-mTOR、mTOR、Bcl2 和Bax 稀释浓度均为1:1 000、DIP2A 稀释 浓度为1:200,GAPDH 稀释浓度为1:8 000。ECL 发光,凝胶成像系统成像。
1.8 RT-qPCR实验
TRIzol 提取心梗边缘区心肌组织总RNA,用TaKaRa反转录试剂盒反转录合成cDNA,参照TaKaRa PCR 试剂盒说明书进行Real Time PCR。引物序列:fstl1-F:5'-GCCTCTCTCTCCTCCTCTCTCT-3';fstl1-R:5'-GCATAGGGTTTGTTGGTTT-3';gapdh-F:5'- CAGTGCCAGCCTCGTCTCAT -3';gapdh-R:5'-AGGGGCC ATCCACAGTCTTC-3'(上海生工)。采用比较Ct 法(2-△△Ct)进行mRNA 定量统计。
1.9 TUNEL检测
切片脱蜡至水,微波抗原修复,BSA 封闭,滴加兔多克隆抗体cTnT(1:100),4℃过夜。次日,蛋白酶K(去DNase,20 μg/ml)37℃孵育,TUNEL 检测液和FITC 标记的山羊抗兔二抗(1:100)和DAPI(1:800)混合抗体37℃避光孵育,荧光显微镜下观察拍片。
4%的多聚甲醛固定H9C2 细胞30 min 后,取细胞悬液15 ul 滴于载玻片上,贴片干燥,PBS 洗涤5 min/次×1 次,加入含0.3%Triton X-100 的PBS,室温孵育5 min,避光滴加TUNEL 检测液(TdT 酶:荧光标记液=1:9),37℃避光孵育1 h,PBS 洗涤3 min/次×2 次,荧光封片剂封片,荧光显微镜下观察拍片。
1.10 CCK8检测
将H9C2 细胞悬液配制成5 000 个/100 μl,取100 μl/孔接种于96 孔板,细胞贴壁后在96 孔板内加入相应激动剂、重组蛋白、抑制剂和LPS 干预。每孔加入10 μl CCK8溶液,放回培养箱,孵育1 h 后,酶标仪检测,测定450 nm吸光度,计算细胞存活率。
1.11 数据处理
Western Blotting 实验结果用Image Lab 5.2 进行处理分析,显微镜图像用Image-Pro Plus 5.1 软件进行分析,实验数据采用SPSS 17.0 软件进行单因素方差分析(one-way ANOVA)和相关分析,GraphPad Prism 5.0 软件作图,组间差异显著性水平选择P<0.05 或P<0.01。
2 实验结果
2.1 骨骼肌FSTL1在抗阻运动保护MI大鼠心脏中发挥重要作用
2.1.1 抗阻运动显著升高MI 大鼠骨骼肌、血清和心肌FSTL1蛋白水平
Western Blotting 和RT-qPCR 结果显示,骨骼肌中,与S组比较,MI 组FSTL1 基因表达下降但无统计学意义,蛋白表达显著下降(P<0.05);与MI 组比较,MR 组FSTL1 基因和蛋白表达均显著升高(P<0.01)(图1A、B)。心肌中,与S 组比较,MI 组FSTL1 基因表达增加但无统计学意义,蛋白表达显著增加(P<0.01);与MI 组比较,MR 组FSTL1 基因表达稍有减少但无显著性差异,蛋白表达显著升高(P<0.01)(图1C、D)。血清中,与S 组比较,MI 组FSTL1蛋白水平显著增加(P<0.01);与MI 组比较,MR 组FSTL1蛋白水平显著升高(P<0.05)(图1E)。表明,抗阻运动显著升高MI 大鼠骨骼肌、血清、心肌FSTL1 蛋白水平,显著增加骨骼肌FSTL1 基因表达,但对心肌FSTL1 基因表达无显著影响。
相关分析结果显示,血清FSTL1 蛋白浓度与骨骼肌和心肌FSTL1 蛋白表达均呈显著正相关(r=0.863,P<0.01;r=0.875,P<0.01);骨骼肌FSTL1 与心肌FSTL1 蛋白表达呈显著正相关(r=0.857,P<0.01)(图1F-H)。表明,心肌FSTL1 蛋白表达和血清FSTL1 含量随骨骼肌FSTL1 蛋白表达的增加而增加。提示,抗阻运动上调MI 大鼠心肌FSTL1 蛋白表达,可能是骨骼肌FSTL1 蛋白通过循环到达心脏。
2.1.2 骨骼肌高表达fstl1可升高MI 大鼠骨骼肌和心肌FSTL1蛋白表达和血清FSTL1水平
Western Blotting 结果显示,与MV 组比较,MF 组的骨骼肌和心肌FSTL1 蛋白表达和血清FSTL1 含量均显著升高(P<0.01,P<0.05,P<0.01)(图2A-C)。表明,骨骼肌FSTL1 可通过循环到达MI 大鼠心脏。
2.1.3 抗阻运动或骨骼肌高表达fstl1抑制MI 大鼠心肌细胞凋亡
TUNEL 检测结果显 示,与S 组比较,MI 组TUNEL 阳性细胞显著增加(P<0.01);与MI 组比较,MR 组TUNEL阳性细胞显著减少(P<0.05);与MV 组比较,MF 组TUNEL 阳性细胞显著下降(P<0.05)。相关分析结果显示,MI 后大鼠心肌FSTL1 蛋白表达与心肌凋亡数目呈显著负相关(r= -0.634,P<0.01)(图3A-B)。
Western Blotting 结果显示,与S组比较,MI组Bcl2/Bax 比值显著降低(P<0.01);与MI 组比较,MR 组Bcl2/Bax 比值显著升高(P<0.05);与MV 组比较,MF 组Bcl2/Bax 比值显著增加(P<0.01)(图3C)。
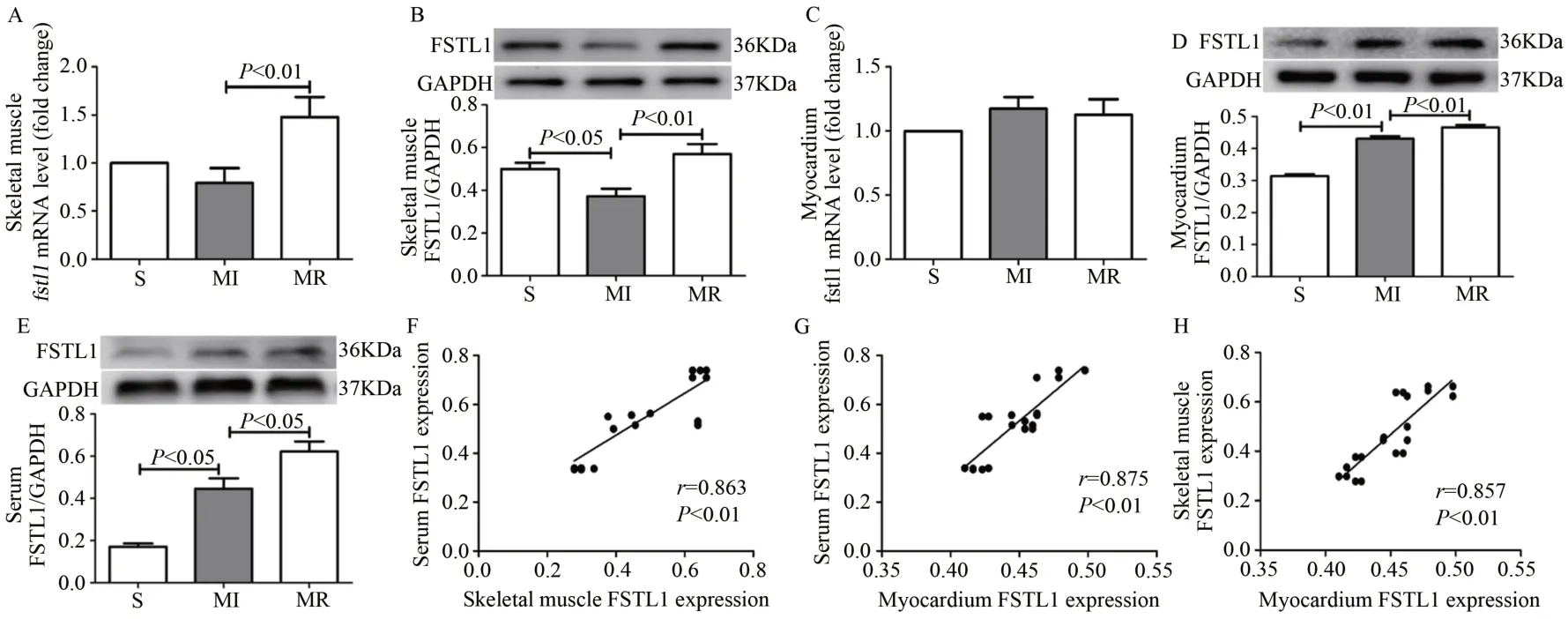
图1 抗阻运动显著升高MI大鼠骨骼肌、血清和心肌FSTL1蛋白水平且三者显著正相关Figure 1.Resistance Exercise Significantly Increased the Protein Level of FSTL1 in MI Rats’Skeletal Muscle,Serum and Myocardium and a Positive Correlation was Observed between Them
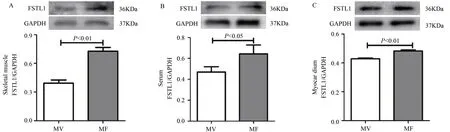
图2 骨骼肌高表达fstl1显著升高MI大鼠骨骼肌和心肌FSTL1蛋白表达及血清FSTL1水平Figure 2. fstl1 Overexpression in Skeletal Muscle Significantly Increased the Protein Level of FSTL1 in MI Rats’Skeletal Muscle,Serum and Myocardium
表明,MI 后心肌细胞凋亡显著增加,抗阻运动或骨骼肌高表达fstl1可显著抑制MI 大鼠心肌细胞凋亡。
2.1.4 抗阻运动或骨骼肌高表达fstl1激活MI 心肌Akt/mTOR信号通路
Western Blotting 结果显示,与S 组比较,DIP2A、p-Akt/Akt、p-mTOR/mTOR 比值MI 组均升高(P<0.01,p-Akt/Akt无显著性差异);与MI 组比较,MR 组均显著升高(P<0.01,P<0.05);与MV 组比较,MF 组均显著升高(P<0.01)(图4A-C)。表明,MI 后抗阻运动或骨骼肌高表达fstl1可激活Akt/mTOR 信号通路。
2.1.5 抗阻运动或骨骼肌高表达fstl1降低MI 大鼠心肌纤维化并改善心功能
Masson 染色结果显示,光镜下,心肌细胞核呈蓝紫色,心肌细胞呈红色,胶原纤维呈蓝色。与S 组比较,MI组胶原纤维过度增生,CVF %显著增加(P<0.01);与MI组比较,MR 组心肌组织纤维化有所减少,CVF %显著降低(P<0.05);与MV 组比较,MF 组纤维化水平下降,CVF%显著下降(P<0.05)(图5A-B)。相关分析结果显示,MI 后大鼠心肌FSTL1 蛋白表达与CVF%呈显著负相关(r= -0.759,P<0.01)。表明,MI 后胶原纤维过度增生,抗阻运动或骨骼肌高表达fstl1均可抑制胶原纤维进一步扩大,减小MI 心肌纤维化扩散面积。
心功能检测结果显示,与S 组比较,LVSP、+dp/dtmax、-dp/dtmax指标MI 组均显著降低(P<0.01),LVEDP 显著升高(P<0.01);与MI 组比较,MR 组均显著上升(P<0.01,P<0.05),LVEDP 显著下降(P<0.05);与MV 组比较,MF组均显著升高(P<0.05,P<0.01),LVEDP 显著降低(P<0.01)(图5C-F)。表明,抗阻运动或骨骼肌高表达fstl1均可显著改善MI 大鼠心功能。
2.2 FSTL1在抗阻运动抑制MI大鼠心肌细胞凋亡的机制探讨
2.2.1 AICAR可促进H9C2细胞FSTL1及其受体的表达
H9C2细胞的Western Blotting结果显示,与对照组比较,LPS 干预后FSTL1 及其受体DIP2A 表达显著下降(P<0.01);与LPS 干 预 比 较,LPS+AICAR、LPS+rhFSTL1 和LPS+AICAR+rhFSTL1 干 预后FSTL1 及其受体DIP2A 表达均显著升高(P<0.01)(图6A-B)。表明,AICAR 促进H9C2 细胞FSTL1 及其受体表达。
2.2.2 rhFSTL1 可激活Akt-mTOR 信号通路,抑制LPS 诱导的H9C2细胞凋亡
H9C2 细胞的TUNEL 和CCK8 检测结果显示,与对照组比较,LPS 干预后细胞凋亡率显著增加(P<0.01),存活率显著减少(P<0.01);与LPS 组比较,LPS+rhFSTL1 干预后细胞凋亡率显著减少(P<0.01),存活率显著增加(P<0.01),LPS+LY294002 干预后细胞凋亡率显著升高(P<0.05),存活率显著降低(P<0.05);与LPS+rhFSTL1 组比较,LPS+rhFSTL1+LY294002 干预后细胞凋亡率显著增加(P<0.01),存活率显著下降(P<0.01);与LPS+LY294002组比较,LPS+rhFSTL1+LY294002 干预后细胞凋亡率显著减少(P<0.01),存活率显著增加(P<0.05)(图7A-C)。
PI3K 抑制剂LY294002 可有效抑制Akt 的磷酸化水平,H9C2 细 胞Western Blotting 结果显示,p-Akt/Akt、pmTOR/mTOR、Bcl2/Bax 比值,与对照组比较,LPS 干预后显著下降(P<0.01);与LPS 组比较,LPS+rhFSTL1 干预后显著增加(P<0.01),LPS+LY294002 干预后p-Akt/Akt 比值显著下降(P<0.01);与LPS+rhFSTL1 组比较,LPS+rhFSTL1+LY294002 干预后显著下降(P<0.01);与LPS+LY2-94002 组比较,LPS+rhFSTL1+LY294002 干预后显著增加(P<0.01,P<0.05,P<0.01)(图7D-F)。表明,rhFSTL1激活Akt/mTOR 信号通路,抑制LPS 诱导的H9C2 细胞凋亡,增加H9C2 细胞存活率。
2.2.3 AICAR 激活Akt-mTOR 信号通路,抑制LPS 诱导的H9C2细胞凋亡
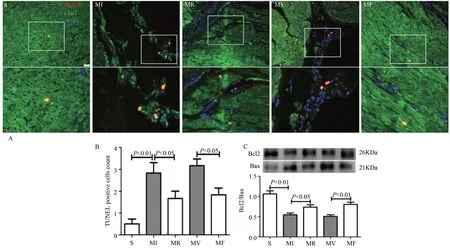
图3 抗阻运动或骨骼肌高表达fstl1显著抑制MI大鼠心肌细胞凋亡Figure 3.Resistance Exercise or fstl1 Overexpression in Skeletal Muscle Significantly Inhibited Cardiomyocyte Apoptosis in MI Rats

图4 抗阻运动或骨骼肌高表达fstl1激活MI心肌Akt/mTOR信号通路Figure 4.Resistance Exercise or fstl1 Overexpression in Skeletal Muscle Significantly Activated Akt/mTOR Signaling Pathway in MI Rats’Heart
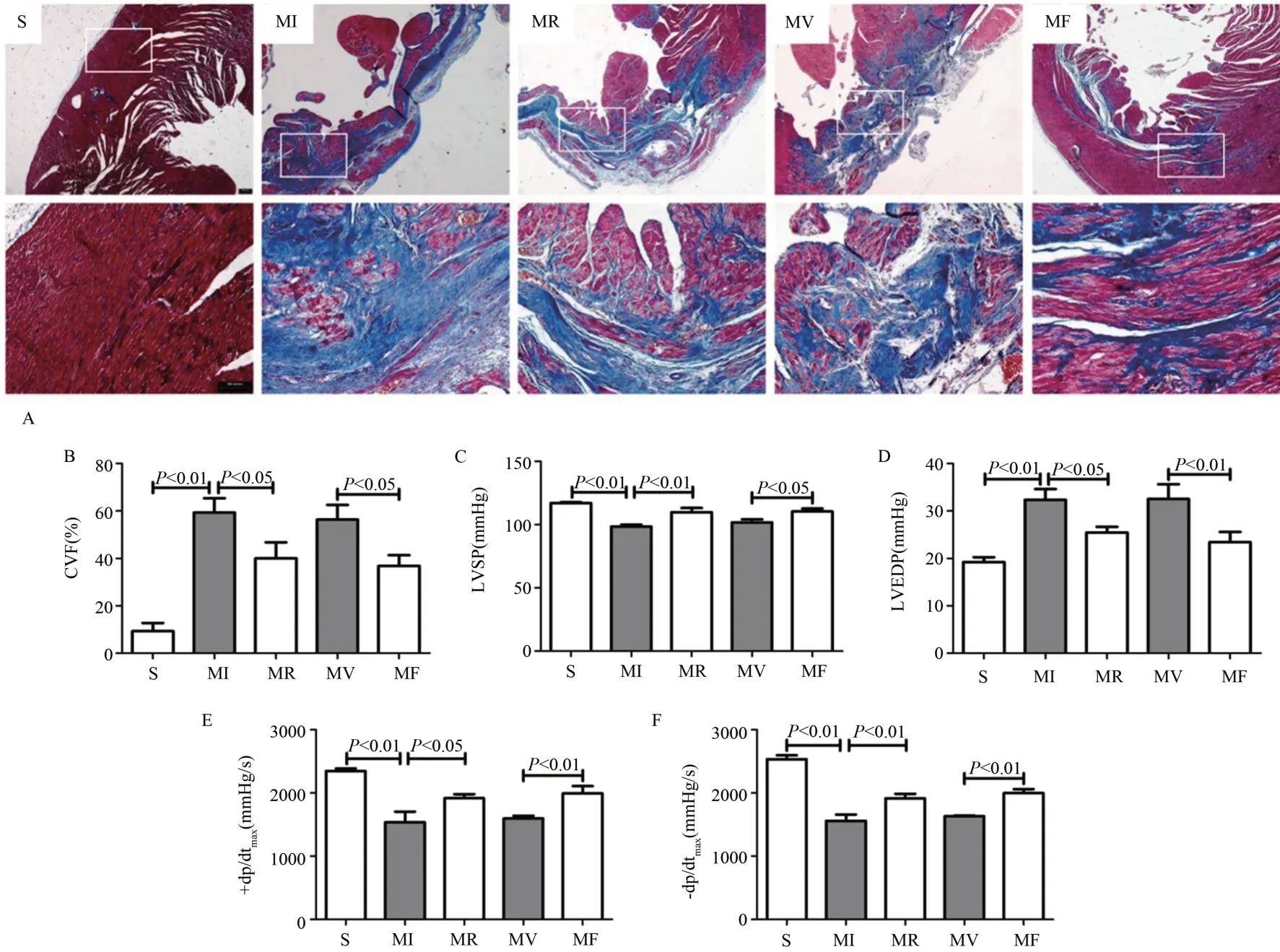
图5 抗阻运动或骨骼肌高表达fstl1抑制MI心脏纤维化且改善心功能Figure 5.Resistance Exercise or fstl1 Overexpression in Skeletal Muscle Reduced Myocardium Fibrosisand Improved Heart Function in MI Rats

图6 H9C2细胞FSTLI及其受体DIP2A蛋白表达结果Figure 6.The Protein Expression of FSTL1 and its Receptor of DIP2A in H9C2 Cells
H9C2 细胞TUNEL 和CCK8 检测结果显示,与对照组比较,LPS 干预后细胞凋亡率显著增加(P<0.01),存活率显著减少(P<0.01);与LPS 组比较,LPS+AICAR 干预后细胞凋亡率显著减少(P<0.01),存活率显著增加(P<0.01),LPS+LY294002 干预后细胞凋亡率显著升高(P<0.01),存活率显著降低(P<0.05);与LPS+AICAR 组比较,LPS+AICAR+LY294002 干预后细胞凋亡率显著增加(P<0.01),存活率显著下降(P<0.05);与LPS+LY294002组比较,LPS+AICAR+LY294002 干预后细胞凋亡率显著减少(P<0.01),存活率显著增加(P<0.05)(图8A-C)。
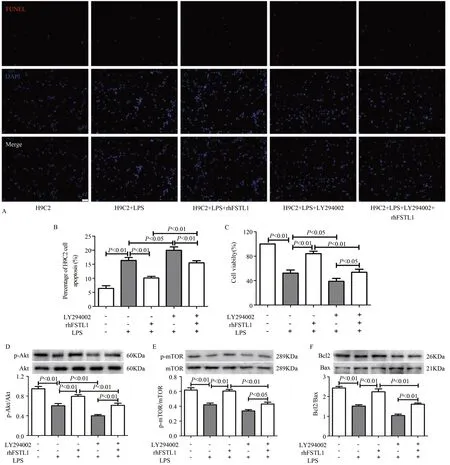
图7 rhFSTL1激活Akt-mTOR信号通路,抑制LPS诱导的H9C2细胞凋亡Figure 7.rhFSTL1 Activated the Akt/mTOR Signaling Pathway and Inhibited LPS-induced H9C2 Cells Apoptosis
H9C2 细 胞Western Blotting 结果显示,p-Akt/Akt、pmTOR/mTOR、Bcl2/Bax 比值,与对照组比较,LPS 干预后显著下降(P<0.05,P<0.05,P<0.01);与LPS 组比较,LPS+AICAR干预后显著增加(P<0.05,P<0.05,P<0.01),LPS+LY294002 干预后p-Akt/Akt 比值显著下降(P<0.05);与LPS+AICAR 组比较,LPS+AICAR+LY294002干预后显著下降(P<0.05,P<0.05,P<0.01);与LPS+LY294002 组比 较,LPS+AICAR+LY294002 干 预后 显 著增加(P<0.05,P<0.05,P<0.01)(图8D-F)。表明,AICAR激活Akt/mTOR 信号通路,抑制LPS 诱导的H9C2 细胞凋亡,增加H9C2 细胞存活率。
3 分析与讨论
适宜运动可对机体产生有利影响已得到证实。文献表明,跑台运动可显著抑制MI 大鼠心肌细胞凋亡和氧化应激反应,促进心肌血管再生,改善心功能,提高运动能力(Lu et al.,2015;Shen et al.,2017);游泳运动可促进I/R 小鼠心肌细胞增殖(Bei et al.,2017),抑制I/R 大鼠心肌细胞凋亡,改善心功能(Zhang et al.,2007);抗阻运动可显著提高MI 大鼠最大摄氧量,减少心肌胶原蛋白沉积,改善左室心功能(Alves et al.,2017;Cai et al.,2018;Hentschke et al.,2017),增加中老年冠状动脉疾病患者的活动能力和肌肉力量(Yamamoto et al.,2016)。另有文献报道,跑台运动、机械振动、抗阻运动均可增加MI 大鼠心肌FSTL1 表达,促进心肌血管再生,降低心肌纤维化,改善心功能,其中,抗阻运动的效果较为显著(席悦 等,2016)。表明,运动在病理性心脏改善过程中发挥重要作用,且抗阻运动的作用更为显著。此外,抗阻运动对骨骼肌也可产生影响。研究报道,抗阻运动可抑制肌肉抑制素的表达,抑制蛋白质降解,促进蛋白质合成,诱导骨骼肌肥大,提高新陈代谢水平(Damas et al.,2015;Schwarz et al.,2016)。抗阻运动或有氧运动等可刺激骨骼肌产生分泌多种细胞因子或肌肉因子(myokines),且可到达肝脏、骨骼、脂肪组织和免疫系统等发挥作用(Ost et al.,2016;Pedersen et al.,2012)。另有文献报道,横纹肌产生的肌肉因子可释放进入血液对远隔器官发挥作用(Stránská et al.,2015)。因此认为,运动上调骨骼肌细胞因子的表达且可通过内分泌方式与其他组织或器官进行交叉对话。据此推测,抗阻运动可促进骨骼肌肌肉因子的表达与分泌,且可通过血液循环到达心脏发挥作用。
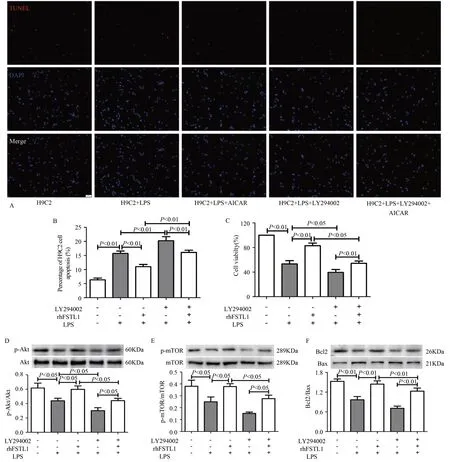
图8 AICAR激活Akt-mTOR信号通路,抑制LPS诱导的H9C2细胞凋亡Figure 8.AICAR Activated the Akt/mTOR Signaling Pathway and Inhibited LPS-induced H9C2 Cells Apoptosis
研究发现,骨骼肌注射FGF21 腺病毒载体或注射LIF载体对MI 小鼠心脏具有保护效应(Arruda et al.,2003;Joki et al.,2015),但有关骨骼肌高表达fstl1是否可对MI心脏产生保护效应鲜有报道。文献表明,11 周的力量训练后骨骼肌中fstl1mRNA 表达增加(Norheim et al.,2011),1 h 的骑自行车运动后人类循环FSTL1 水平上升(Görgens et al.,2013)。循环FSTL1 的改变可影响心脏功能和全身物质能量代谢过程(Seki et al.,2018)。左股动脉损伤的小鼠,骨骼肌特异性fstl1敲除后,血清中FSTL1蛋白减少52%;骨骼肌特异性fstl1高表达后,血清中FSTL1 蛋白增加6.9 倍。表明,骨骼肌可能是循环FSTL1的主要来源(Miyabe et al.,2014)。推测,骨骼肌源性FSTL1 可由骨骼肌分泌进入血液循环,进而到达远隔器官或组织发挥作用。本研究结果显示,抗阻运动显著升高心肌、血清和骨骼肌FSTL1 蛋白水平,心肌fstl1mRNA 表达无显著变化,骨骼肌fstl1mRNA 表达显著增加,且血清与骨骼肌和心肌FSTL1 蛋白水平均呈显著正相关,骨骼肌与心肌FSTL1 蛋白表达呈显著正相关。因此认为,抗阻运动或胫骨前肌注射FSTL1 腺相关病毒载体后骨骼肌产生的FSTL1 经血液循环到达心脏。
研究报道,I/R 小鼠静脉注射FSTL1 腺病毒载体可使心肌细胞凋亡减少70.9%,心肌梗死面积减少66.0%(Oshima et al.,2008)。MI 小鼠心外膜FSTL1 表达增加可促进心肌细胞增殖,降低心肌纤维化(Wei et al.,2015)。主动脉缩窄(transverse aortic constriction,TAC)小鼠心肌和血清FSTL1 蛋白表达显著增加,心肌fstl1特异性敲除后可加剧TAC 导致的心肌肥大和功能紊乱;fstl1转基因小鼠可抑制TAC 导致的心肌肥大和重塑(Shimano et al.,2011)。表明,FSTL1 在病理性心脏中具有重要的保护作用。本研究结果显示,抗阻运动或胫骨前肌注射FSTL1腺相关病毒载体干预MI 大鼠后,LVSP、+dp/dtmax、-dp/dtmax均显著升高,LVEDP 和CVF%显著降低,心肌细胞凋亡显著减少。心肌FSTL1 蛋白表达与心肌细胞凋亡、心肌纤维化呈显著负相关。因此认为,抗阻运动或胫骨前肌注射FSTL1 腺相关病毒载体后骨骼肌源性FSTL1 经血液循环到达心脏,抑制心肌细胞凋亡,降低心肌纤维化,改善MI 大鼠心功能,发挥心脏保护作用。运动可刺激骨骼肌细胞因子的分泌,也可动员全身其他器官或组织细胞因子分泌。关于抗阻运动诱导的骨骼肌和其他器官或组织分泌FSTL1 经血液到达心脏是否发挥不同的保护作用,本研究未进行比较。
Akt 是心脏应对外界刺激时的关键调节因子之一,PI3K/Akt 信号通路在心脏的生长发育中发挥十分重要的作用(Shiojima et al.,2006)。研究报道,PI3K/Akt 信号通路激活后可改善心脏氧化应激水平,抑制心肌细胞凋亡,促进心肌细胞增殖,降低病理性心肌肥大(Ke et al.,2015;Lin et al.,2015;Sun et al.,2016)。DIP2A 是FSTL1体内的细胞表面受体(Tanaka et al.,2010),FSTL1 腺病毒载体分别转染人脐静脉内皮细胞和心室肌细胞后,小RNA 干扰其受体DIP2A,人脐静脉内皮细胞和心室肌细胞Akt 的磷酸化水平显著降低,凋亡显著增加(Ouchi et al.,2010)。FSTL1 腺病毒载体转染心室肌细胞可激活Akt/mTOR 信号通路,抑制缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的心室肌细胞凋亡;小RNA 介导的常氧和H/R 干预的心室肌细胞中FSTL1 沉默,可导致凋亡显著增加,Akt 的磷酸化水平显著下降(Oshima et al.,2008)。FSTL1 蛋白可通过激活Akt 信号通路和抑制Smad1/5/9 信号通路减少H9C2 细胞凋亡(Chen et al.,2016b)。表明,PI3K/Akt 信号通路在FSTL1 发挥心脏保护的过程中具有十分重要的作用。研究报道,Bcl2 和Bax 是调控细胞凋亡的关键蛋白(Shirali et al.,2013),PI3K/Akt 信号通路激活后可增加凋亡相关蛋白Bcl2/Bax 的比值抑制细胞凋亡(Chen et al.,2016a)。表明,PI3K/Akt 信号通路可调节细胞凋亡相关蛋白的表达,进而抑制细胞凋亡。本研究结果显示,抗阻运动或胫骨前肌注射FSTL1 腺相关病毒载体后,MI 大鼠心DIP2A 的蛋白表达及p-Akt/Akt、p-mTOR/mTOR 和Bcl2/Bax 的比值均显著增加。表明,FSTL1 可与其受体DIP2A 结合激活下游Akt/mTOR 信号通路,调控细胞凋亡相关蛋白,抑制心肌细胞凋亡。运动产生的积极影响大部分是由AMPK 激活引起的(Grochowska et al.,2014),因此,AMPK 的活化可作为运动的靶向效应。本研究结果显示,rhFSTL1 和AICAR 可激活Akt/mTOR 信号通路,上调Bcl2/Bax 比值,抑制LPS 诱导的H9C2 细胞凋亡,增加细胞存活率。以上结果共同表明,抗阻运动或胫骨前肌注射FSTL1 腺相关病毒载体上调心肌FSTL1 表达,心肌FSTL1 与其受体DIP2A 结合,激活下游PI3K/Akt信号通路,抑制心肌细胞凋亡,降低心肌纤维化,改善MI大鼠心功能(图9)。但关于FSTL1 降低MI 大鼠心肌纤维化的具体信号机制本研究未进行探讨,在后续实验中将会进一步研究。

图9 抗阻运动通过刺激骨骼肌FSTL1分泌抑制心梗大鼠心肌细胞凋亡的机制Figure 9.The Mechanism of Resistance Exercise Inhibits Cardio‐myocyte Apoptosis Through Stimulating the Skeletal Muscle FSTL1 Secretion in MI Rats
4 结论
在抗阻运动上调MI 大鼠心肌FSTL1 表达抑制心肌细胞凋亡过程中,骨骼肌源性FSTL1 发挥重要作用,骨骼肌源性FSTL1 可通过血液循环到达心脏,与其受体DIP2A结合,激活下游Akt-mTOR 信号通路,抑制心肌细胞凋亡,降低心肌纤维化,改善MI 大鼠心功能。
