聚乙烯醇-聚丙烯酰胺互穿网络水凝胶的制备及吸附性能
2020-03-24祖国晶卢合欢武利顺童庆松
祖国晶,卢合欢,武利顺,童庆松
(1.福建师范大学 化学与材料学院,福建 福州 350007;2.荆门市格林美新材料有限公司,湖北 荆门 448000;3.菏泽学院 化学与化工学院,山东 菏泽 274009)
水凝胶是一种具有三维网状结构的新型功能高分子材料,可以在水中溶胀而不溶解,在物理、生物和化工方面有广泛的研究应用[1].互穿网络(IPN)是由两种或两种以上的聚合物网络相互穿透或缠结所构成的一类具有合金性质的化学共混网络体系,其中一种网络在另一种网络的直接存在下交联形成,各网络之间为物理贯穿.因此,具有IPN结构的水凝胶因其独特的贯穿缠结结构,可以提高高分子链的相容性、增加网络密度等特性而被广泛研究[2].
聚乙烯醇(PVA)具有与其他材料的相容性极好、化学稳定性好、无毒、可生物降解等优点,其分子中的大量羟基可与戊二醛发生羟醛缩合反应,而形成交联点,常用来制备机械性能优良的水凝胶[3].聚丙烯酰胺(PAM)是由丙烯酰胺单体聚合而成的具有良好水溶性的高分子聚合物,无毒副作用且具有良好的絮凝性和增稠性,被广泛用于水凝胶的制备[4].考虑到PAM分子链上含有大量的酰胺基团,可与PVA相互作用,使两种材料优势互补,提高对金属离子(铜(Ⅱ))的吸附性能,拓宽材料的应用范围.本工作对比研究PVA与PVA-PAM IPN水凝胶对铜(Ⅱ)离子的吸附性能,并探讨PAM的加入量、交联剂用量、pH、温度对水凝胶吸附性能的影响,以及PVA-PAM IPN水凝胶吸附铜(Ⅱ)离子的动力学特性.
1 实验部分
1.1 实验仪器与试剂
试剂:聚乙烯醇(CP,平均聚合度1 750±50,国药集团化学试剂有限公司);聚丙烯酰胺(AR,天津市科密欧化学试剂有限公司);戊二醛(AR,50%)和二乙基二硫代氨基甲酸钠(AR)购置于上海麦克林生化科技有限公司;冰乙酸、五水硫酸铜、甲醇、浓硫酸和氨水(均为AR,国药集团化学试剂有限公司).
仪器:原子发射光谱仪(Thermo Scientific iCAP 7000 Plus);电热鼓风干燥箱(101-2A型)和真空干燥箱(DZ-1BCⅡ型)购置于天津市泰斯特仪器有限公司;数控超级恒温槽(SC-15,宁波新芝生物科技股份有限公司);电磁搅拌器(C-MAG HS7 DS25型,德国IKA公司);傅立叶红外光谱仪(FTIR-370,NICOLET);扫描电子显微镜(JSM-7500F,Japan).
1.2 凝胶的制备
混合交联剂(记为溶液A):2.5% 戊二醛溶液、50% (v/v)甲醇水溶液、10% (v/v)乙酸水溶液、20% (v/v) 硫酸稀溶液的混合溶液.吸附液:50 mg/L的Cu2+溶液.
PVA水凝胶制备:称取10 g PVA于90 mL去离子水中常温溶胀2h,然后90 ℃恒温水浴搅拌溶解2 h,自然冷却至常温后,得到10wt.% PVA溶液(记为溶液B).将溶液A与交联剂充分混合搅拌(配比见表1),转移至模具静置30 min,脱泡定型成膜,40 ℃真空干燥24 h得到干凝胶膜.将干凝胶膜粉碎为5 mm×5 mm大小放入去离子水洗涤浸泡3 d,每天换水,于40 ℃真空干燥至恒重,得到干凝胶样品.
PVA-PAM IPN水凝胶的制备:称取一定质量PAM在50 ℃恒温水浴溶解,PVA在90 ℃溶解为溶液后冷却至常温后再同PAM溶液混合搅拌1h,PVA和PAM按不同配比混合,制备一系列样品.其具体原料用量见表1.
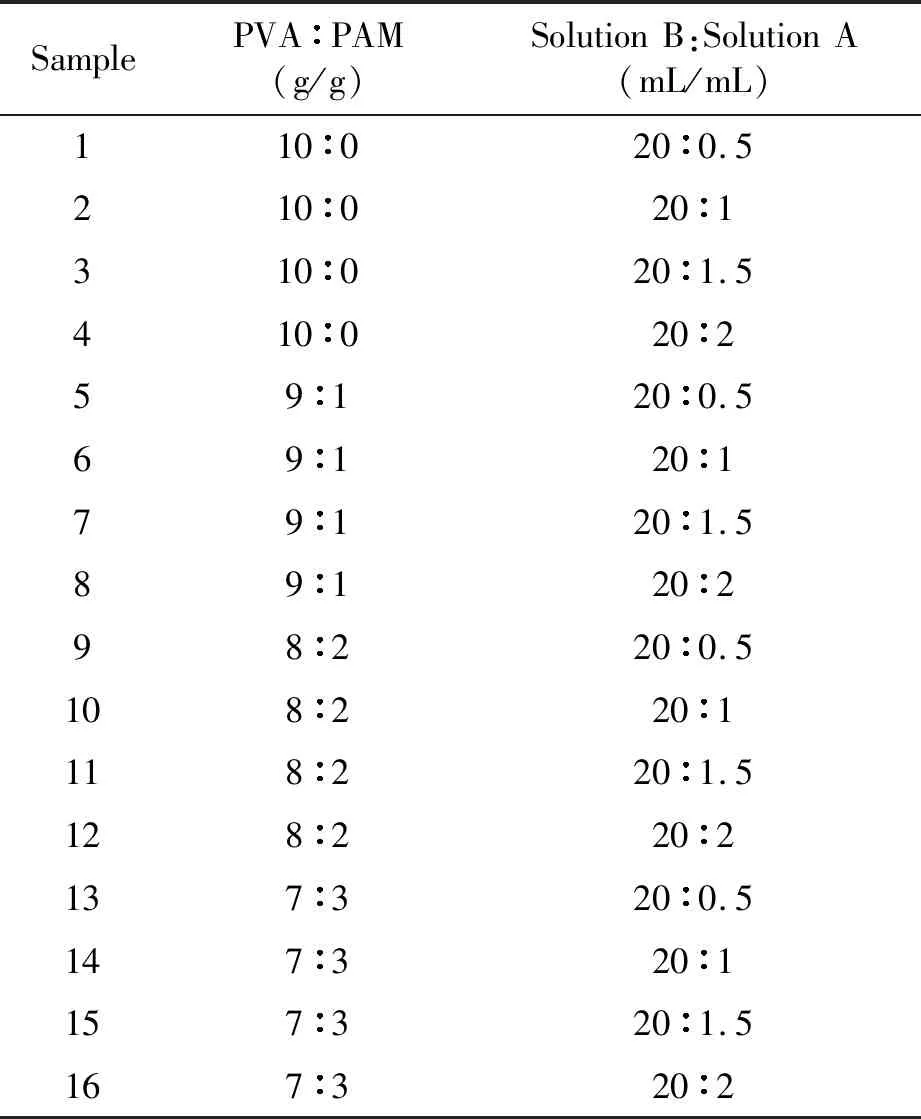
表1 水凝胶样品制备的原料配比
1.3 样品的吸附性能测试
将一定质量干凝胶样品加入到Cu2+吸附液中,测定吸附时间与吸附量的关系,确定平衡吸附量,考查pH、温度对平衡吸附量的影响.将达到平衡吸附量的PVA-PAM IPN水凝胶在真空干燥至恒重,放入乙酸溶液中,在25 ℃条件下脱附,计算脱附量.样品对Cu2+的吸附量按下式计算:
q=(C0-Ct)V/M,
(1)
式中:q为Cu2+吸附量(mg/g);C0为吸附前Cu2+质量浓度(mg/L);Ct为不同吸附时间时Cu2+的质量浓度(mg/L);V为吸附液体积(L);M为水凝胶样品质量(g).
1.4 吸附动力学和机理分析
(1)准一级动力学模型:只适用于吸附初始阶段的动力学描述,不能精确地描述吸附的整个过程[5].其方程式为:
lg(qe-qt)=lgqe-k1t,
(2)
式中:qe为吸附平衡时刻的吸附量(mg/g);qt为t时刻的吸附量(mg/g);t为吸附时间(min);k1为吸附速率常数(min-1).
(2)准二级动力学模型:假定吸附速率受化学吸附机理的控制,涉及到吸附质与吸附剂之间的电子转移或电子共用,能揭示整个吸附过程的行为[5],包含吸附的所有过程,如外部液膜扩散、表面吸附和颗粒内扩散等.其方程式为:
(3)
式中:K2为吸附速率常数(g·mg-1·min-1);qe为吸附平衡时刻的吸附量(mg/g);qt为t时刻的吸附量(mg/g);t为吸附时间(min).
(3)Webber-Morris扩散模型:准一级和准二级动力学模型都不能全面解释吸附机理,颗粒内扩散模型可以对Cu2+吸附扩散现象进行解释[6],Webber-Morris扩散模型方程为:
qt=Kintt1/2+C,
(4)
式中:qt为t时刻的吸附量(mg/g);t为吸附时间(min);Kint为颗粒内扩散速率常数(mg·g-1· min-0.5);C与扩散层的厚度有关.
(4)表观活化能根据Arrhenius方程计算:
lnK=lnA-Ea/RT,
(5)
式中:K为二级吸附速率常数;R为气体摩尔常数,8.314 J·mol-1·K-1;T为绝对温度(K);Ea为吸附活化能(kJ/mol)
2 结果与分析
2.1 样品的结构表征
为了研究PVA-PAM IPN水凝胶的结构,即PVA与PAM的相互作用机理,比较PVA(2号样)与PVA-PAM IPN水凝胶(PAM 30wt.%,14号样)的红外谱光谱图,结果如图1所示.
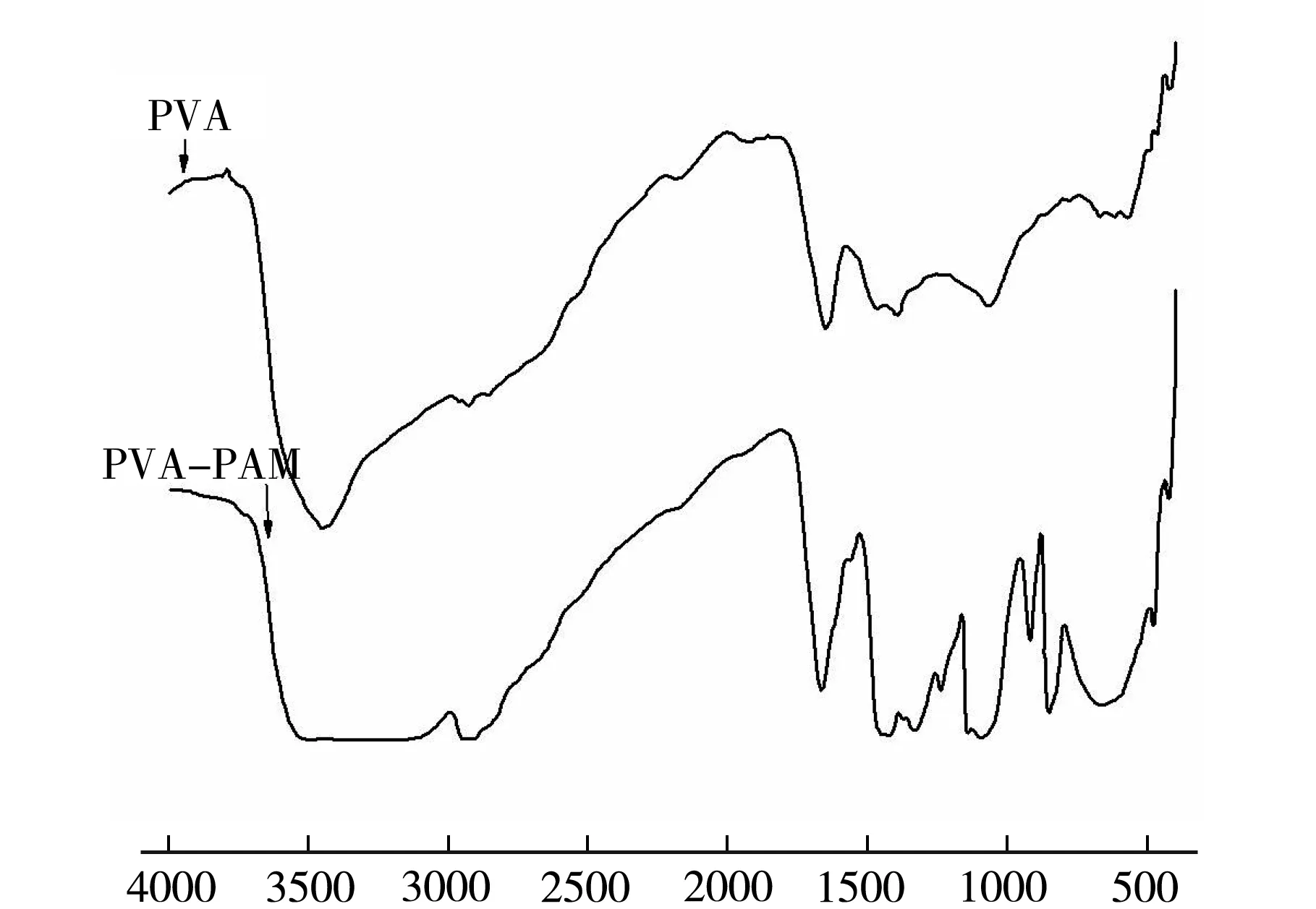
Wavenumbers/cm-1图1 PVA与PVA-PAM IPN水凝胶样品红外光谱图
PVA水凝胶中3 446 cm-1处峰位为O—H及其氢键作用产生的强而宽的吸收峰;1 390 cm-1处峰位由O—H,C—H及—CH2—弯曲振动引起,1 646 cm-1处峰位表明基团—CO—的存在;1 065 cm-1峰位为C—C骨架振动[7]、C—O(多缔和体)单键伸缩和O—H弯曲振动吸收峰[8].在PVA-PAM IPN水凝胶中,PVA水凝胶3 446 cm-1O—H的伸缩振动吸收峰移向高频区的3 265 cm-1处,与—NH2的吸收峰混合重叠,变得宽而大,表明PVA与PAM之间形成了大量的氢键,实现了分子间缔合;2 940 cm-1吸收峰是脂肪族—CH2—的伸缩振动峰;PVA水凝胶中1 390 cm-1峰位在IPN中衍生出1 422 cm-1,1 331 cm-1两个弱峰;1 065 cm-1处峰位移向低频区至1 094 cm-1,说明发生了交联[9-10];PVA-PAM IPN中无新的特征吸收峰生成,表明PVA与PAM之间无新的化学键生成,这为IPN的形成提供了可能性[11].以上分析可知,PVA与PAM之间并未发生共聚或缩聚反应,而是通过分子间氢键形成互穿网络结构.PVA-PAM IPN水凝胶样品的微观形貌如图2所示.

图2 PVA-PAM IPN水凝胶样品的微观形貌图
从图2中可以看出,水凝胶样品的互穿网络结构与红外分析得到的结论相吻合.
2.2 样品的吸附性能分析
选取交联剂用量相同的PVA水凝胶(2号样)和PVA-PAM IPN水凝胶(PAM 30wt.%,14号样)进行比较,在pH为5,25 ℃条件下其吸附量随时间的变化曲线如图3(a)所示.两个样品对Cu2+的吸附量随时间的延长不断增大,其中PVA凝胶样品在30 min时基本达到吸附平衡,30 min以后吸附量增加不明显.而PAM 30wt.%样品在最初的30 min内吸附量增加迅速,30~90 min增长率明显减小,90~120 min时基本达到吸附平衡.
表明在吸附初始阶段,Cu2+迅速到达水凝胶的传质边界层,吸附较快;在吸附中期,Cu2+缓慢沿水凝胶微孔向内部扩散,吸附质浓度逐渐变小,扩散阻力变大,吸附速率主要受扩散控制,从而吸附速率变慢;最后阶段,Cu2+扩散到水凝胶的网络结构内,浓度推动力越来越小,吸附基本上达到平衡.
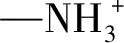
在25 ℃,pH=5的条件下,研究了样品交联剂用量和PAM含量与平衡吸附量关系.结果如图3(c)和(d)所示.在交联剂用量相同的情况下,样品PAM含量越高,对Cu2+的平衡吸附量越大.其原因可能是PAM含量的增多使水凝胶中胺基的数量增多,较多的胺基与Cu2+发生螯合作用[5],从而Cu2+吸附量逐渐增大.因而,与PVA水凝胶相比,PVA-PAM IPN水凝胶对Cu2+有更好的吸附效果.在PAM含量相同的情况下,随着交联剂用量的增多,样品对Cu2+的平衡吸附量呈现减小的趋势.其原因可能是交联剂用量的增多,体系交联密度增大,样品IPN结构更加紧密,可吸附Cu2+的吸附位点减少,吸附量降低.

Time/mina 吸附量与吸附时间关系图
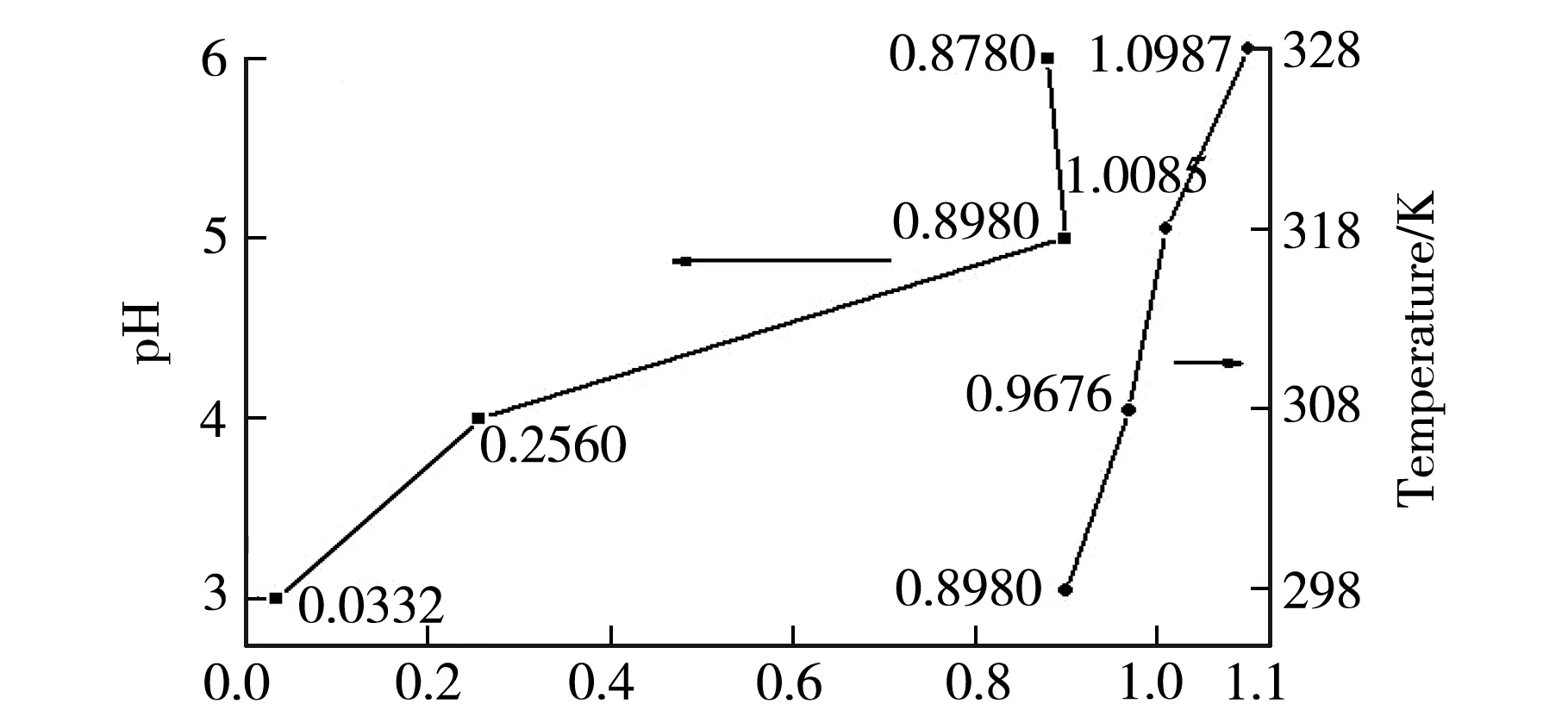
Equilibrium adsorption capacity/(mg/g)b pH和温度对平衡吸附量影响图
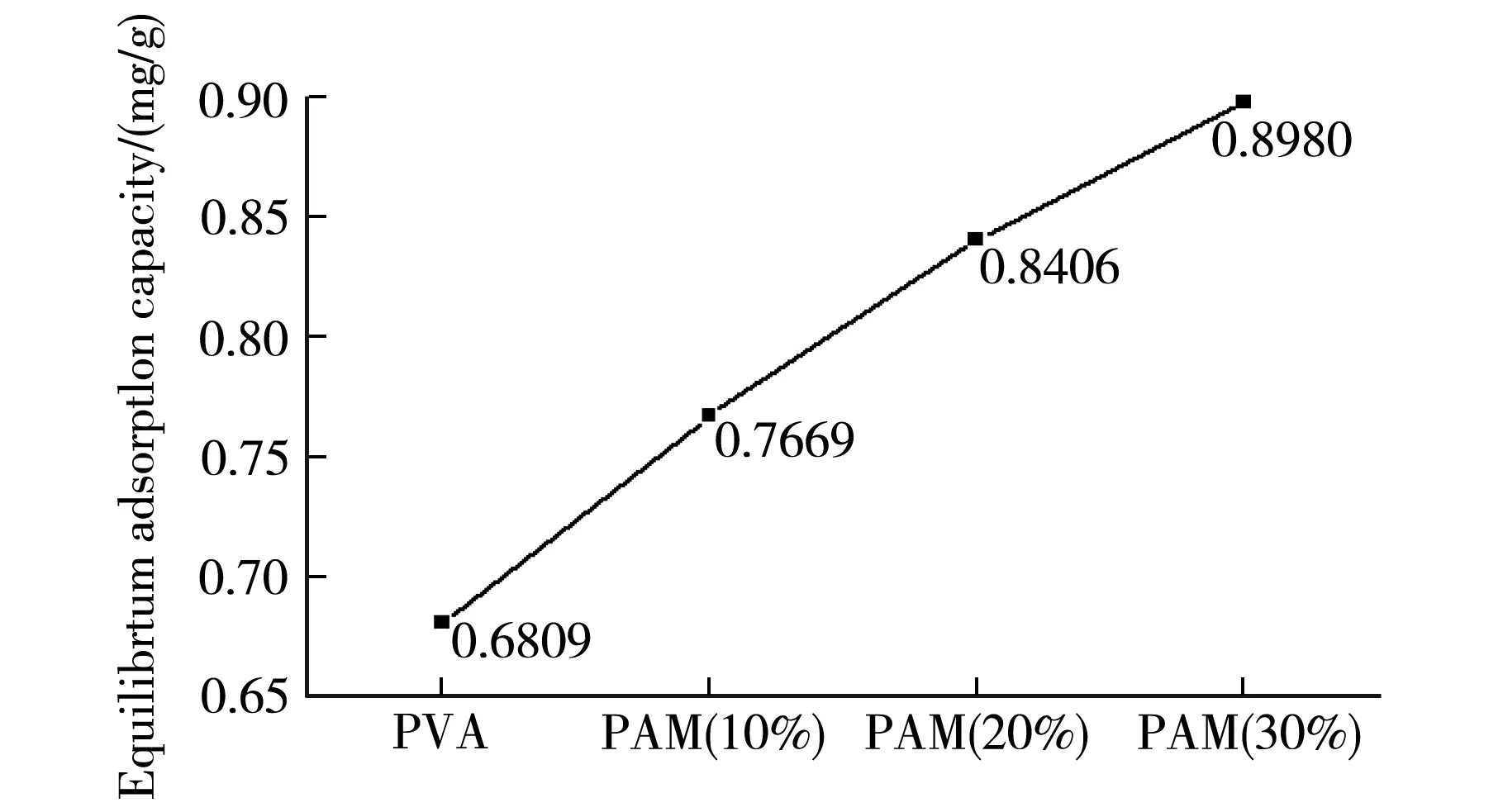
PAM Content/%c PAM不同含量样品与平衡吸附量的关系图
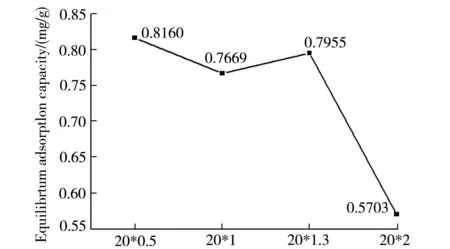
Content of crosslinking solution/mLd 交联剂不同用量样品与平衡吸附量的关系图图3 平衡吸附量的关系图
2.3 吸附动力学和机理分析
溶液中,吸附过程是一个比较复杂的过程,液相中的吸附质被吸附到颗粒内,可分为吸附质在流体界膜的外扩散、在吸附剂内扩散(颗粒内扩散)和在吸附剂内的吸附反应等几个过程,而颗粒内扩散又分为吸附质在吸附剂细孔内的扩散和细孔表面进行的二次扩散[6].
分别采用准一级动力学模型和准二级动力学模型对交联剂用量1 mL,PAM 30wt.%的水凝胶(14号样)吸附行为进行拟合.结果如图4(a)和(b)所示,表2为拟合方程及其参数.
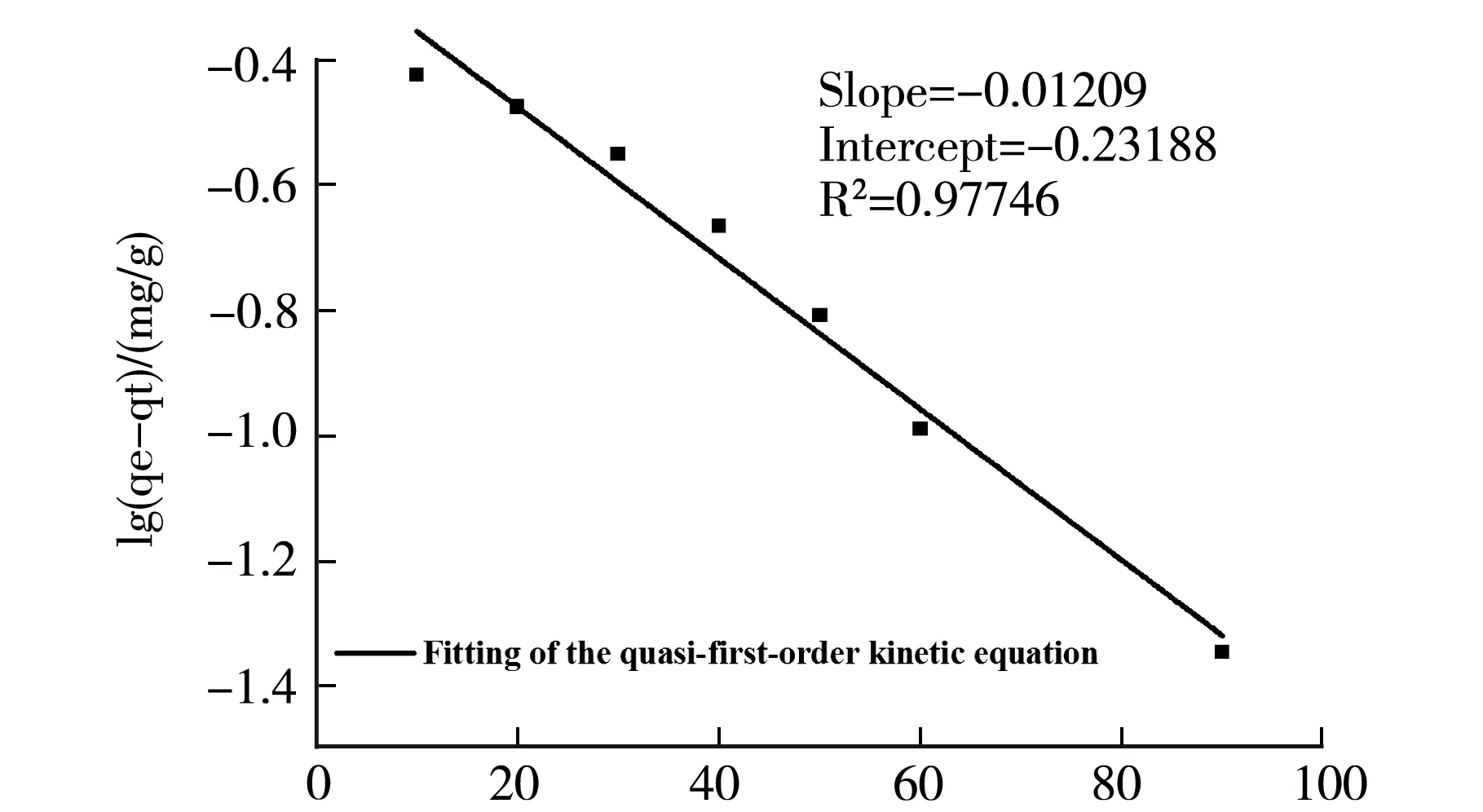
t/mina 准一级动力学拟合方程
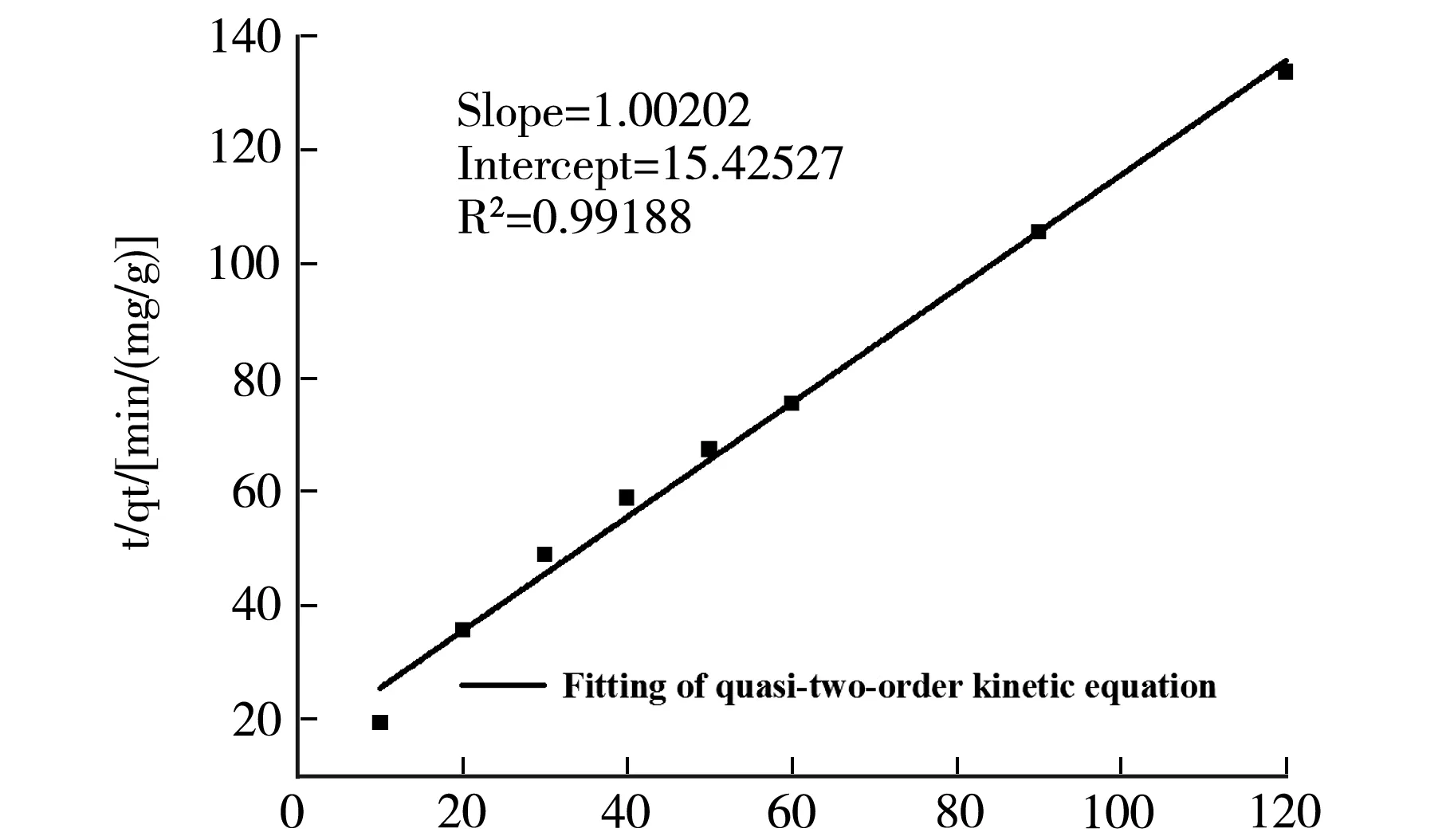
t/minb 准二级动力学拟合方程图4 动力学拟合曲线图
两种模型都很好的描述了该吸附过程,说明PVA-PAM IPN水凝胶对Cu2+的吸附具有较好的动力学性能,从拟合参数来看,准二级模型能更精确的描述整个吸附过程.
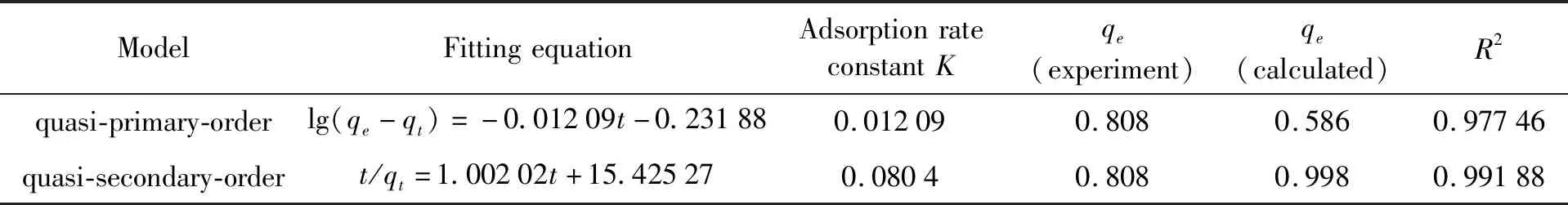
表2 准一级和准二级动力学拟合方程参数
根据Webber-Morris扩散模型方程得到的拟合曲线如图5所示.
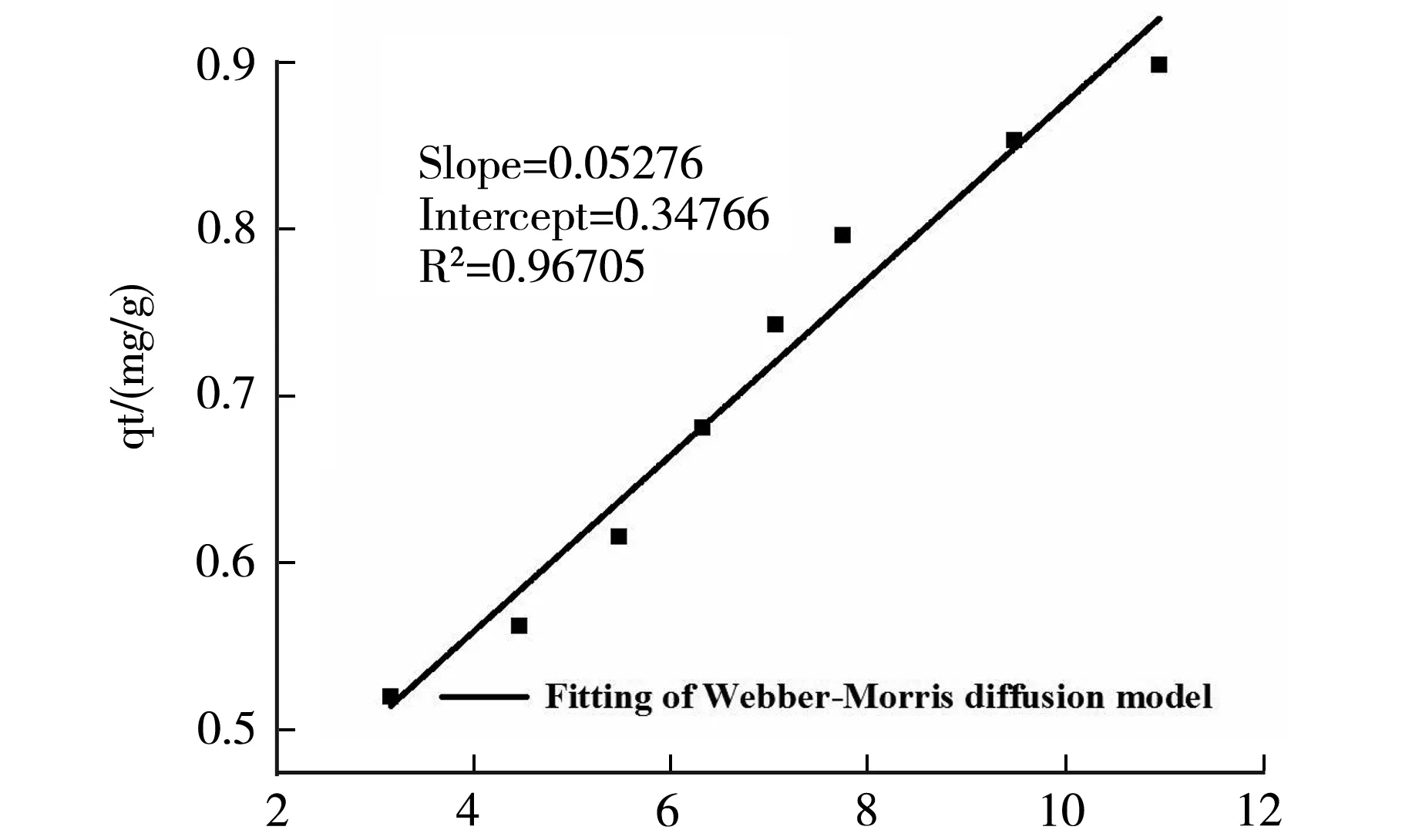
t1/2/(min1/2)图5 Webber-Morris扩散模型拟合方程
颗粒内扩散模型可以较好的描述吸附过程,外推拟合直线到t=0,发现它并没有经过原点,表明颗粒内扩散控制并不是唯一的速控步骤,吸附速率也受颗粒外扩散(如液膜扩散和表面吸附)过程的控制,所以,PVA-PAM IPN水凝胶对Cu2+的吸附过程是由颗粒内扩散和膜扩散联合控制的[6],即多种动力学机理共同作用.但在吸附中期,该吸附过程符合Webber-Morris扩散模型方程,而吸附中期所经历的时间与初期和后期相比是最长的,因此颗粒内扩散机理在整个吸附过程中占有主导地位.
2.4 吸附表观活化能
不同温度下交联剂用量1 mL,PAM 30wt.%的水凝胶(14号样)对Cu2+的准二级动力学方程拟合曲线如图6(a)所示,其参数如表3所示.
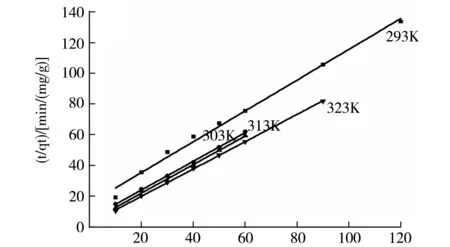
t/mina
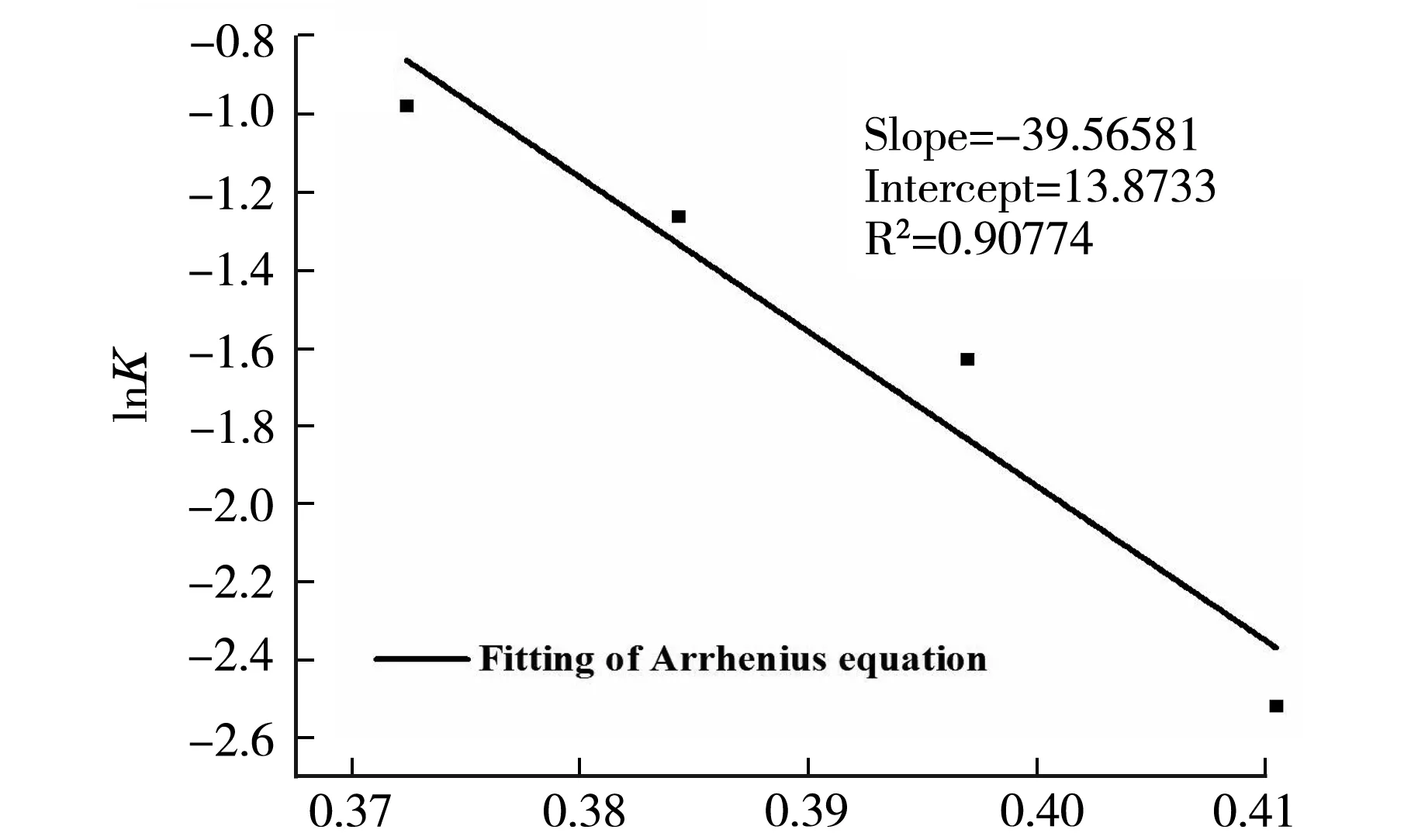
103/(8.314T)b图6 不同温度下PVA-PAM IPN水凝胶的准二级动力学拟合方程(a)和PVA-PAM IPN水凝胶的Arrhenius方程拟合(b)
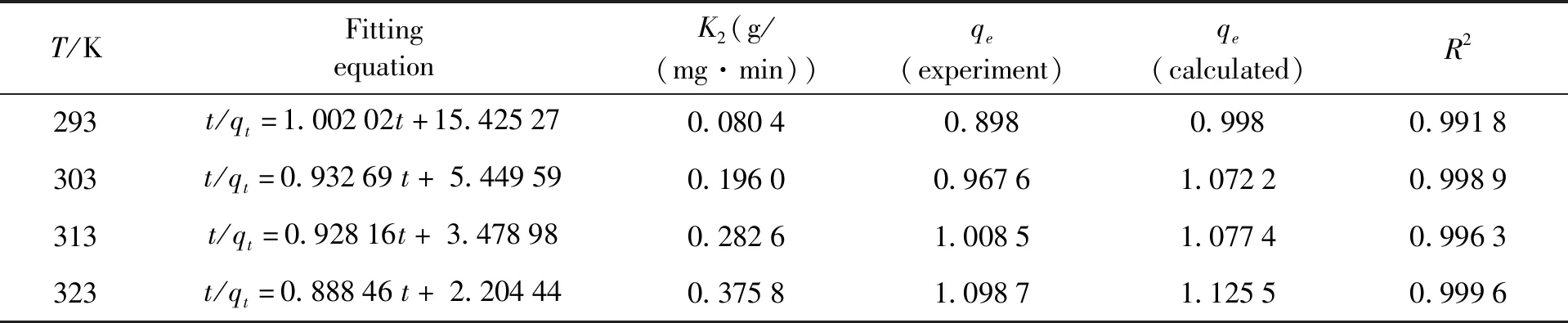
表3 不同温度下PVA-PAM IPN水凝胶的准二级动力学拟合方程参数
由表3可得,不同温度下,准二级动力学方程中的速率常数K2和饱和吸附量qe随温度升高不断增加,说明此反应为吸热反应,温度对吸附过程有较大的影响,实验中测定的吸附量和拟合得到的结果相差不大.
图6(b)是lnK对1/T作图得到的Arrhenius方程拟合曲线.一般来说,表观活化能在5~40 kJ/mol范围内为物理吸附,在40~800 kJ/mol范围内为化学吸附,由拟合方程求得PVA-PAM IPN水凝胶对Cu2+的表观活化能为39.566 3 kJ/mol,说明此吸附过程具有物理吸附的属性,且当Ea<100 kJ/mol时,可以认为该吸附反应对温度变化是稍微敏感的[13],与前文讨论的温度对平衡吸附量的影响得出的结论相一致.另外,该吸附反应的表观活化能较小,说明PVA-PAM IPN水凝胶对Cu2+吸附反应是比较容易进行的.
3 结 论
PVA-PAM IPN水凝胶在吸附性能上相比于PVA水凝胶得到了很大的提高,其IPN结构也由红外光谱图上得到了验证.在本实验研究范围内,30wt.% PAM的PVA-PAM IPN水凝胶样品对Cu2+有较好的吸附效果,在初始浓度为50 mg/L的Cu2+的溶液中,其平衡吸附量可达到0.898 mg/g,而PVA水凝胶的平衡吸附量为0.585 3 mg/g,可见,加入PAM的水凝胶有利于吸附Cu2+;在一定温度范围内,PVA-PAM IPN水凝胶对Cu2+的平衡吸附量随温度升高而增大;在pH=5时有最高的吸附量;吸附行为符合准二级动力学方程,扩散机制为颗粒内扩散为主.
