基于转录组测序的不同光学分光膜下生菜叶片的基因表达差异分析
2020-03-23周念念高洁丁明珠安玉兰翟克清史加银甘德芳刘文
周念念 高洁 丁明珠 安玉兰 翟克清 史加银 甘德芳 刘文
摘 要:新型光伏农业是在满足农作物生长的光照需求下进行光伏发电。为研究不同光学分光膜下生菜叶片的差异基因表达情况,以‘阿迪娜生菜为试验材料,利用转录组测序(RNA-seq)技术分析在覆盖红蓝滤光膜(RBFF)和远红光截止膜(RICF)条件下生菜叶片的基因表达水平。结果表明,RBFF条件下有2685个基因存在差异表达,其中有1380个上调表达基因,1305个下调表达基因。RICF条件下有3264个基因差异表达,其中上调表达基因有881个,下调表达基因2383个。进一步分析发现,1498个差异表达基因在RBFF和RICF条件下均表达,1187个基因在RBFF条件下差异表达,1766个在RICF条件下差异表达。从上述差异表达基因中筛选出10个可能与光胁迫相关的基因,实时荧光定量验证转录组数据的可靠性。结果表明,大部分基因的表达情况与测序结果一致,说明转录组数据是可靠的。光响应相关基因的表达分析结果显示,RBFF覆盖下大部分基因在覆盖15 d时大量表达,达到表达高峰。RICF下的3个基因表达量较高,其余的表达量较低,大部分基因在 15~21 d时达到表达高峰。本研究为进一步挖掘生菜基因组中光响应基因以及揭示生菜对光响应的分子机制提供理论依据和数据支持。
关键词:生菜;光学分光膜;转录组分析;实时荧光定量PCR(qRT-PCR)
中图分类号:Q949.783.5;Q786 文献标识码:A
Abstract: New photovoltaic agriculture can generate photovoltaic power under the light demand of crop growth. To study the differential gene expression in lettuce leaves under different spectrophotometric films, the ‘Adina lettuce variety was used as the experimental material, and the gene expression level of lettuce leaves under the conditions of red and blue filter film (RBFF) and far infrared cut-off film (RICF) was analyzed by the transcriptome sequencing (RNA-seq) technique. The results showed that 2685 genes were differentially expressed in RBFF, including 1380 up-regulated genes and 1305 down-regulated genes; 3264 genes were differentially expressed in RICF, of which 881 were up-regulation and 2383 down-regulation. Further analysis revealed that 1498 differentially expressed genes were expressed in both RBFF and RICF, 1187 genes were differentially expressed in the RBFF, while 1766 were differentially expressed in RICF. Ten genes related to light stress were screened from the differentially expressed genes, and the reliability of transcriptome data was verified by qRT-PCR. The results of expression analysis of light response related genes showed that most of the genes under red-blue filter film were expressed in large quantities, and the expression reached peak at 15 d; under far infrared cut-off film, the expression of three genes was higher, while the expression of others was lower. The expression of most genes reached peak at 1521 d. This study would provide a theoretical basis and data support for further exploring photoresponsive genes in the lettuce genome and revealing the molecular mechanism of the lettuce response to light.
Keywords: lettuce; optical spectrophotometric film; transcriptome analysis; quantitative real-time PCR (qRT-PCR)
生菜(Lactuca sativa L.)又名葉用莴苣,菊科莴苣属莴苣种的叶用莴苣变种,为1、2年生草本植物[1-3]。生菜富含维生素、花青素和矿物质等营养成分,同时具有医疗保健功效[4-7],是目前植物工厂试验和生产的主栽类型和模式植物,适合水培,可在弱光条件下培养[8-10]。随着市场经济的发展、人们生活水平的提高,消费者对蔬菜的品质要求越来越高,培育营养价值高、口味好、无公害的绿色蔬菜逐渐成为消费者和科研人员追逐的目标[11]。目前对生菜的研究大多集中在栽培管理技术[12-14]、提高生菜营养品质[15]等方面,对生菜转录组测序的研究报道较少。
转录组是特定的组织或者细胞在某一发育阶段或功能状态下转录出来的所有RNA的集合[16]。转录组研究是研究基因结构、功能和表达的重要方法,也是表型关联研究的重要手段[17]。转录组测序作为转录组学研究的关键技术,对深入探索植物的分子机制具有重要作用。光在植物生长发育过程中起至关重要的作用,也是生菜生长发育过程中的关键因素之一[18]。在生菜整个生长期进行连续光照,能够显著提高生菜的产量,促进可溶性糖、抗氧化物质的合成[19]。有研究表明,蓝光对生菜花青素的合成具有重要作用[20]。周智等[21]研究表明,4∶1的红蓝光质比有利于拟南芥生长发育,减少蓝光比例对拟南芥的根系生长及叶绿素积累有一定的促进作用。
光伏农业作为一种新型的农业发展方式,在满足作物生长光需求的前提下,将多余的光反射集中于晶硅电池上用于发电,实现植物生长和光伏发电两不误[22]。本研究利用自主研发的新型纳米光学分光膜,分别为红蓝滤光膜(Red and blue filter film, RBFF)和远红光截止膜(Far infrared cut-off film, RICF)。其中,RBFF是将太阳光中适合光合作用的红蓝光光谱分选出来用于植物生长,其余光谱反射用于发电。同时,为探讨远红光对植物生长的影响,研制出了RICF,除远红光外,其余光谱全部透过。前期预实验测定了这2种光学膜覆盖下生菜的生理生化指标、生物酶活性以及营养品质等指标的变化,在此基础上,本研究通过对不同光学膜覆盖下的生菜叶片进行转录组测序,从中挖掘生菜响应光胁迫的相关基因,为更进一步探索生菜对光响应的分子机制研究提供数据支撑。
1 材料与方法
1.1 试验材料及处理
试验在中国科学技术大学先进技术研究院玻璃温室中进行,试验所用生菜品种为‘阿迪娜,种子由瑞克斯旺(中国)种子有限公司提供。种子播于穴盘内,育苗24 d 后,移栽至玻璃温室,2 d后分别采用普通玻璃板(common glass, CG,光强660 μmol/(m·s))、RBFF(由纳米材料制成,粘附于普通玻璃板上,只透过红光和蓝光,光强440 μmol/(m·s),其余光谱收集用于发电。)、RICF(粘附于普通玻璃板上,除了远红光外,其他光全部透过,光强700 μmol/(m·s),目的探讨缺失远红光对蔬菜生长的影响)覆盖培养。盖膜9 d(多云)后,于下午取样,每个处理分别取3株叶片等量混匀,液氮速冻,?80 ℃保存,用于后续的RNA提取、cDNA文库构建和测序。测序由深圳华大基因股份有限公司完成。
1.2 生菜总RNA提取、cDNA文库构建和测序
RNA提取由深圳华大公司完成,用Agilent 2100 Bioanalter(Agilent RNA 6000 Nano Kit)檢测总RNA的浓度、RIN值、28S/18S比值,RNA纯度使用紫外分光光度计NanoDropTM进行。构建
cDNA文库时先用带有Oligo dT的磁珠富集含有poly A尾巴的mRNA,然后用打断buffer把获得的RNA片段化,用随机N6引物进行反转录,再用DNA聚合酶Ⅰ和RNase H合成第二链cDNA。补平双链DNA末端并磷酸化5端,将合成的双链DNA连接到配对的接头上,利用特异性引物进行PCR扩增富集。使用华大基因公司BGISEQ?500平台对cDNA文库进行上机测序。
1.3 差异表达基因的qRT-PCR验证
提取与测序同批的生菜样品总RNA,用PrimeScriptTM RT Reagent Kit gDNA Eraser(TaKa?Ra)试剂盒反转录成cDNA。利用IDT(Integrated DNA Technologies)进行引物设计,Primer?design进行引物校正,引物序列见表1。实时荧光定量PCR体系采用iTaqTM Universal SYBR Green Supermix (BIO-RAD)和CFX96TM Real-Time System检测系统,反应程序如下:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共35个循环。对随机选取10个DEGs进行表达分析,以Lsactin为内参基因[4],以普通玻璃板覆盖的为对照,采用2??CT估算待测差异基因的表达水平。
1.4 光响应相关基因的表达分析
翟克清等[23]通过生菜覆膜20、35 d的生理指标测定,发现盖膜20 d酶活性变化较35 d的大,且与对照组相比,盖膜20 d处理的生菜叶片细胞超微结构和叶绿体结构有显著差异。为检测不同光响应基因对不同光学分光膜覆盖的反应,分别于盖膜后9(多云)、15(多云)和21 d(晴)下午取‘阿迪娜生菜叶片,提取总RNA,经反转录成cDNA。选取光响应相关基因的同源基因LSAT_9X83701(PHYA)、LSAT_6X401(PHYB)、LSAT_8X31220(PIF3)、LSAT_3X58041(PIF4)、LSAT_3X81620(PAP1)、LSAT_2X122581(LHY)及LSAT_2X76880(CHS),以其特异性引物进行qRT-PCR,以普通玻璃板覆盖的为对照,数据处理及分析同上。
1.5 数据处理
通过转录组测序获得原始数据(raw reads)
后,使用华大自主研发的过滤软件SOAPnuke进行过滤,对过滤后的clean reads进行质量统计,以确定所获得的数据能否用于后续分析。用HISAT软件将3个样品经过滤得到的clean reads比对到公布的莴苣参考基因组序列(https:// www. ncbi.nlm.nih.gov/genome/352)。统计reads在参考序列上的分布情况以及覆盖度。使用Bowtie2软件将clean reads比对到参考序列以统计基因比对率,再使用RSEM计算基因和转录本的表达水平,得到FPKM (Fragments Per Kilobase Million)值。根据基因的表达量(FPKM)值计算该基因在不同样本间的差异表达倍数。将FDR(False Discovery Rate)≤0.001且倍数差异在2倍以上的基因默认定义为差异表达基因(Diff?er?en?tially Expression Gene, DEG),采用Poss?ionDis方法进行差异检测。最后在差异表达基因的基础上,进行GO和KEGG功能富集分析。
2 结果与分析
2.1 测序原始数据分析
3个样品(CG、RBFF、RICF)测序得到的raw reads的数量分别为72 160 422、69 726 782和69 726 610,经过滤去除低质量、接头污染以及未知碱基含量过高的reads,分别得到65 699 706(6.57 Gb)、66 180 828(6.62 Gb)和65 498 632(6.55 Gb)个clean reads,Q20的百分比大于97%(表2),低质量(Quality < 20)的碱基比例较低,说明测序质量较好,可用于后续分析。
2.2 生菜样品与参考基因组的比对分析
使用BGISEQ-500平台对3组样品进行测序,每个样品平均产出6.58 Gb数据。将clean reads比对到参考基因组序列,样品比对基因组的平均比对率为91.99%,比对基因集的平均比对率为69.12%(表3)。样品间的相关性比较结果显示,RBFF与CG之间的相关性系数为0.917,RICF与CG之间的相关性系数为0.901(图1)。另外,样品一共检测到11 430个新转录本,其中预测编码的转录本为9060个,非编码转录本为2370个。
2.3 差异基因表达量分析
差异表达基因数目统计可以看出,与对照组(CG)相比,RBFF条件下有2685个基因存在差异表达,其中1380个上调表达基因,1305个下调表达基因。RICF条件下有3264个基因存在差异表达,其中881个上调表达基因,2383个下调表达基因(图2)。
差异基因的维恩图分析表明(图3),1498个差异表达基因在RBFF和RICF条件下均表达,1187个基因在RBFF条件下差异表达,1766个在RICF条件下差异表达。根据试验处理方案及数据结果显示,初步推测1187、1766个基因中可能存在调节远红光和红蓝光响应的相关基因(图3)。
2.4 差异基因的功能注释
为进一步了解生菜对红蓝光及远红光响应的分子机制,对DEGs进行Gene Ontology(GO)富集分析。GO分为分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)3大类。其差异表达基因
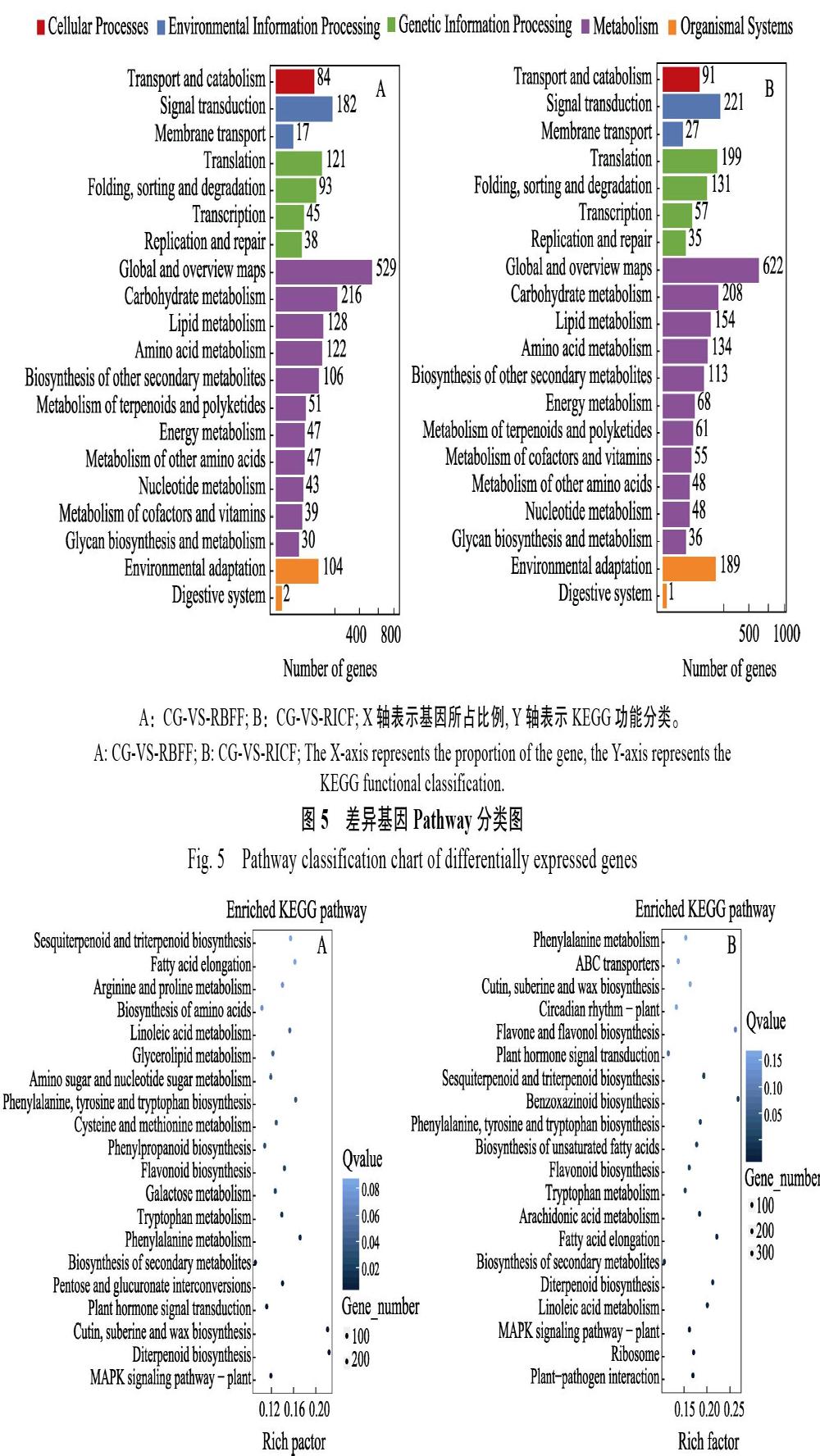
分布在3大类中的45个类别,包括代谢过程、细胞过程、细胞壁、催化活性和结合等。另外,大多数差异基因与细胞组分相关,而参与生物过程的差异基因相对较少。在细胞组分中,以参与膜、膜组分、细胞、细胞组分、细胞器构成的富集最明显。参与生物过程的差异基因主要富集在代谢过程和细胞过程这2个类别。而催化活性和结合是RBFF和RICF条件下分子功能差异基因富集的主要类别(图4)。
2.5 差異表达基因Pathway功能分析
KEGG代谢通路将差异基因映射到5大类一级通路中,其中涉及代谢通路的基因最多。RBFF和RICF下分别是1358和1547个,分别占注释到KEGG中的基因比例68%和62%。其次是遗传信息处理(图5)。另外,与CG相比,RBFF条件下富集结果最明显的通路是角质、木栓和蜡的生物合成以及二萜生物合成。次生代谢产物的生物合成过程DEGs的数目最多,富集因子值很小。RICF条件下,苯并噁嗪类生物合成的富集因子值最大,富集结果最明显。DEGs数目最多的也是次生代谢产物的生物合成这一过程(图6)。
2.6 qRT-PCR验证
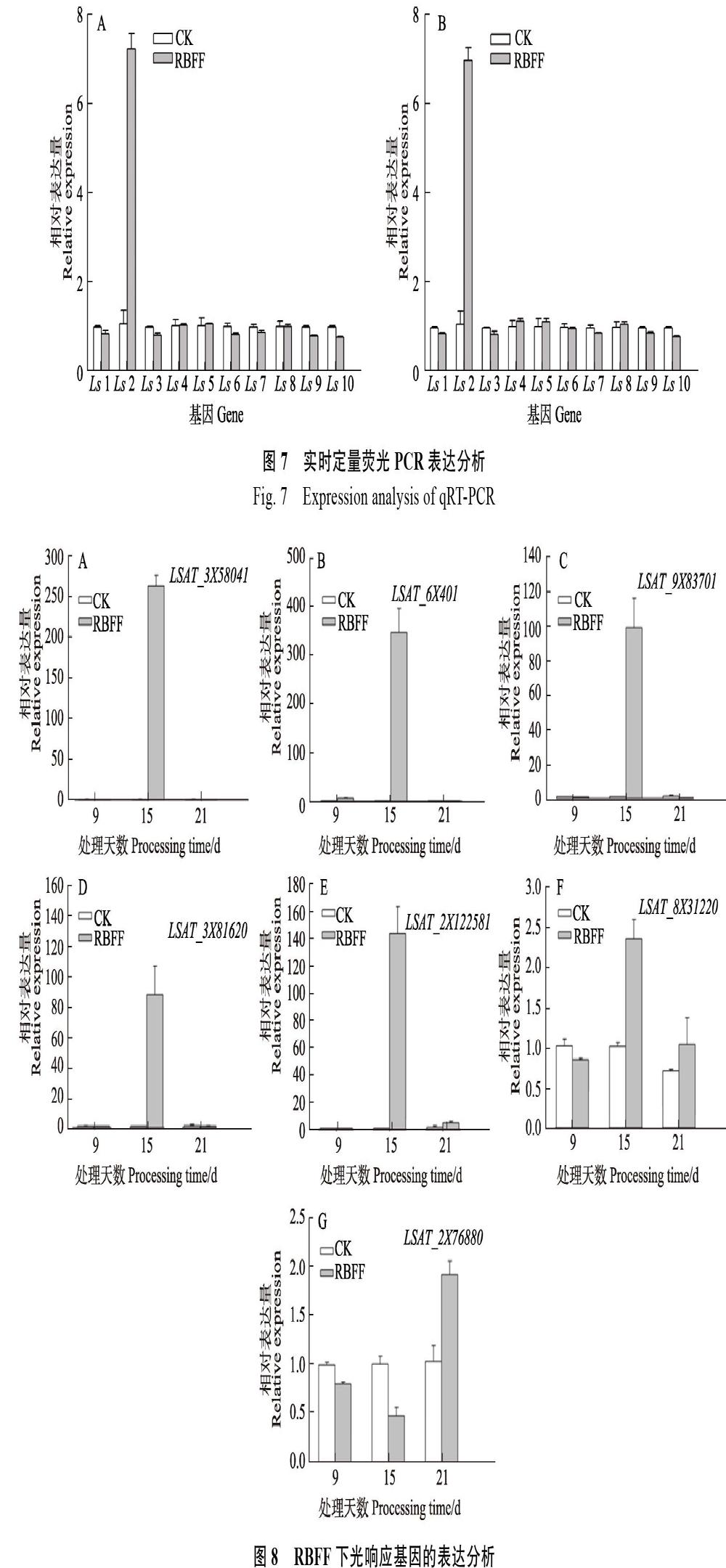
试验选取了10个差异表达基因作为验证测序数据可靠性的候选基因,其中大部分是与光信号途径相关的基因,其中PHYA、PHYB属于光敏色素基因家族,PIF3和PIF4 是与光敏色素A、B 等相互作用的因子。MYB转录因子PAP1及查尔酮合成酶基因CHS参与花青素合成途径,RbcL参与植物光合作用关键基因,LHY是植物生长节律关键基因等。利用IDT(Integrated DNA Technologies)设计特异性引物进行实时荧光定量PCR,结果表明,在RBFF和RICF覆盖下的生菜,10个基因的表达情况近乎一致,即Ls2(PHYB)基因的表达量最高,Ls2、Ls4(PAP1)、Ls5(LHY)、Ls8(PMA)均呈现上调表达,而Ls1(PIF4)、Ls3(PHYA)、Ls6(PIF3)、Ls7(Pme3)、Ls9(CHS)、Ls10(RbcL)均下调表达。大部分基因的表达与测序结果一致,说明转录组数据结果可靠(图7)。
A:CG-VS-RBFF;B:CG-VS-RICF;X轴代表富集因子值(Rich Factor),是注释上某一通路的前景值(差异基因个数)与注释上某一通路的背景值(所有基因个数)之商,数据越大,说明富集结果越明显。Y轴代表通路名称,图中圆点的颜色代表Q-value,颜色越浅值越大,越深值越小,值越小代表富集结果越显著;圆点的大小代表DEGs数目,点越大代表数目越多,越小代表数目越少。
A: CG-VS-RBFF; B: CG-VS-RICF. The X-axis represents the enrichment factor value (Rich Factor), which is the quotient of the foreground value (number of differential genes) of a pathway on the annotation and the background value (number of all genes) of a pathway on the annotation, and the larger the data, the more obvious the enrichment results. The Y-axis represents the path name. The color of the dots in the figure represents the Q-value, and the lighter the color, the greater the value, the deeper the smaller, the latter represents the more significant the enrichment results; the size of the dots represents the number of DEGs, and the larger the number represents, the smaller the number represents.
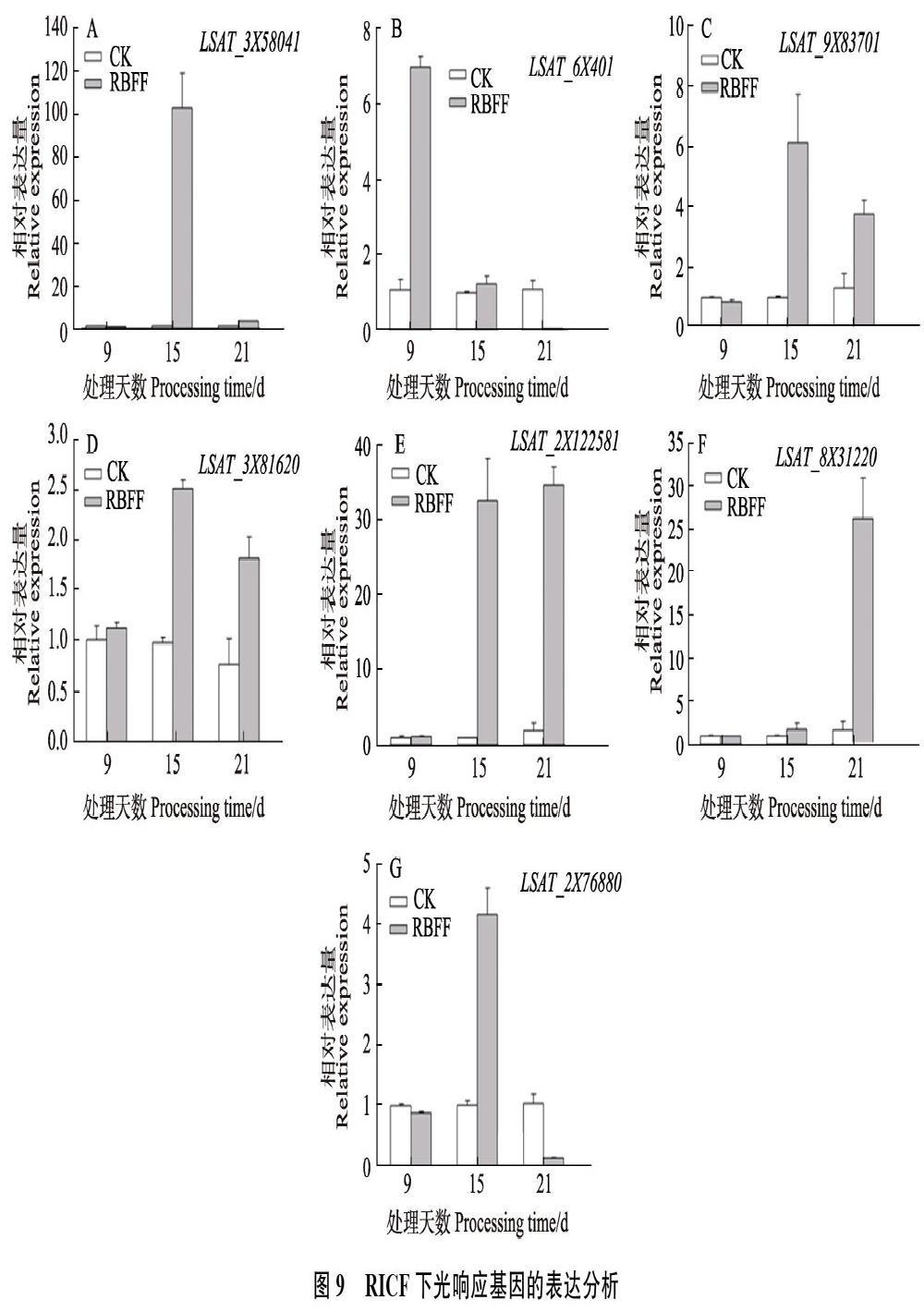
2.7 不同分光膜下光响应相关基因的表达分析
RBFF覆盖9、15和21 d时,不同光响应基因的表达情况不同(图8)。其中,生菜PIF4、PHYB、PHYA、MYB75(同PAP1)、LHY的同源基因(LSAT_3?X?58041、LSAT_6X401、LSAT_ 9X83701、LSAT_3X?81620、LSAT_2X122581)大量表达,在覆盖15 d时表达量最高,其表達量值分别为263.7、311.2、108.6、87.5和144.9。PIF3的同源基因LSAT_8X31220和CHS的同源基因LSAT_2X?7??6880整个过程表达量都比较低,LSAT_2X76880覆盖9和15 d时呈现下调表达。LSAT_9X83701和LSAT_8X31220在覆盖9 d时下调表达,其余情况均为上调表达。
RICF覆盖9、15和21 d时,LSAT_3X58041在覆盖9 d时呈现下调表达,覆盖15 d时大量表达,表达量值达114.7。LSAT_2X122581在覆盖15和21 d时表达量较高,LSAT_8X31220在覆盖21 d时有较高的表达量。LSAT_6X401、LSAT_9X83701、LSAT_3X81620和LSAT_2X76?880表达量都比较低,其中LSAT_6X401覆盖9 d时表达量稍高,其余以覆盖15 d是表达量稍高(图9)。
3 讨论
光照是影响植物生长发育的重要因素之一,红光和蓝光是植物光合作用中叶绿素吸收利用最多的光,能够有效提高光合效率[24]。研究报道,红光有利于植物营养物质的积累,蓝光能够促使植物花期提前,而红蓝光混合比单个红光或蓝光更有利于植物生长,且不同的植物对红蓝光混合比例的要求也不同[25-26]。黄薪历等[27]在研究红光和远红光对番茄生长发育的影响时指出,红光和远红光的相对强度发生变化会影响植物的生长发育。目前,有关红蓝光影响生菜生长发育的研究较多,但生菜对红蓝光响应的机理尚不明确。
光既是植物体进行光合作用必不可少的条件,也是植物体生长发育和代谢调节等生命活动的关键环境因子,植物体接收光信号主要是由光受体完成[28]。研究发现的光受体有:感受蓝光或近紫外UV-A区域光的隐花色素(Cryptoch-o?m?e?s),感受蓝光的向光色素(Phototropins),感受蓝绿光的ZTLS家族(Zeitlupes),感受紫外UV-B区域光的UV-B受体[29]以及感受红光、远红光的光敏色素(phytochrome, PHY)。其中PHYA是远红光感受器,PHYB是红光感受器。这些光受体感知外界的光信号后,通过相关光响应因子及途径来调控植物体的光形态建成等生理过程[30]。本研究中RBFF和RICF两组试验,PHYB都表现为上调表达,说明生菜在红光照射时,PHYB表现为高表达。PHYB是植物体内感受红光和远红光的光受体,主要以红光吸收型(Pr)、远红光吸收型(Pfr)2种形式存在,通过调节红光与远红光可逆转换过程来影响植物体的形态建成以及生理反应,其转换水平与红光、远红光的光强比值有关[27, 31-33]。低红光/远红光比值使PHYB转变为无活性的Pr形式,高红光/远红光比值可使PHYB转化为有活性的Pfr形式[28, 31]。推测本研究中PHYB表达上调可能是在红光照射的条件下,PHYB的转换调节作用引起的。另外,KEGG生物通路分析发现,光敏色素B(PHYB)和光敏色素相关作用因子4(PIF4)可能既存在相互独立的调控途径,又存在相互协作共同参与植物体细胞伸长来响应光信号。研究表明,PHYB还能通过调节幼嫩叶片的气孔发育来响应成熟叶片对光信号的感知,植物体主要是由光敏色素家族中的PHYB和光敏色素相互作用因子4(Phyto?c?h?r?o?m?e?-inte?racting factor 4, PIF4)对光信号进行响应[34-35]。光敏色素作用因子(PIF)在光敏色素介导的光响应过程中起至关重要的作用[30],PIF与PHY的协同作用会影响植物体的光形态建成,还参与植物对抗逆信号的响应过程[28]。Casson等[35]研究指出,除了与PIF4相互作用以响应光信号,PHYB也可能通过与PIF4无关的途径独立地对光信号作出响应,这与本研究中KEGG途径分析结果类似。
研究发现,有2类基因参与调控花青素的生物合成过程,一类是用于编码各种酶的结构基因,一类是用于调控结构基因在特定时间和空间特异性表达的调控基因,称作转录因子[36]。研究较多的是MYB转录因子,且其调控作用已在玉米、矮牵牛、葡萄等植物中得到证实[37]。陈静等[31]研究表明,光敏色素在花青素的合成过程中起关键作用,不同红光/远红光比例会影响花青素合成途径。其中,MYB家族PAP1(Production of anthocyanin pigment 1)是与花青素合成途径相关的基因[38-39]。刘轶等[40]研究表明,AtPAP1是调控花青素合成的关键基因,不需要其他转录因子的辅助,能单独调控花青素的转录表达。本研究KEGG途径分析结果表明,PAP1除了能独立调控花青素的转录表达,还可能与查耳酮合酶(Ch?alcone synthase,CHS)基因共同调节UV-B受体的生物途径。王曼等[41]发现,诱导CHS表达的主要光受体是CRY1。拟南芥PAP1-D突变体中,CHS表达会引起花青素显著积累[36]。目前对PAP1与CHS之间调控关系的研究尚不明确,探究这2个基因的相互作用对光胁迫研究意义重大。
光响应相关基因的表达分析表明,RBFF覆盖的生菜,大部分光响应基因在覆盖15 d呈现大量表达,表明其基因在此阶段对红蓝光的缺乏比较敏感。而RICF覆盖的生菜,PIF4、LHY、PIF3同源基因LSAT_3X58041、LSAT_2X122581和LSAT_8X31220分别在15 和21 d大量表达,可能是对缺失远红光比较敏感的基因。另外,PIF4同源基因LSAT_3X58041和LSAT_2X-122581在2种膜覆盖15 d时的表达量都比较高,说明这2个基因能同时响应红蓝光和远红光胁迫。本研究得到的DEGs以及部分光响应基因的表达模式,可用来分析和挖掘生菜基因组中对红蓝光及远红光响应的相关基因以及它们之间的联系,为揭示生菜对光响应的分子机制提供理论依据和数据支持。
参考文献
孙金才, 陈卉卉, 赵川川. 鲜切生菜的保鲜工艺研究[J]. 食品与生物技术学报, 2015, 34(4): 402-406.
李清光. 鲜切生菜品质控制技术研究进展[J]. 食品工业, 2018, 39(12): 226-229.
陈子敬. 生菜LsFT和LsSOC1基因的克隆及功能分析[D]. 北京: 中国农业大学, 2018.
劉丹丹. 外源硒对紫色生菜生理特性及花青素合成调控的研究[D]. 南京: 南京农业大学, 2016.
王 波, 沈其荣, 赖 涛, 等. 不同铵硝比营养液对生菜生长发育影响的研究[J]. 土壤学报, 2007, 44(3): 561-565.
班兆军, 张晶琳, 袁秋萍, 等. 不同包装膜对生菜贮藏期品质的影响[J]. 食品科技, 2018, 43(5): 31-36.
潘文娟. 生菜成熟度识别及采后品质质量研究[D]. 合肥: 合肥工业大学, 2015.
刘庆鑫, 方 慧, 李宗耕, 等. 自然光植物工厂多层立体栽培补光对生菜产量和品质的影响[J]. 中国农业大学学报, 2019, 24(1): 92-99.
Truco M J, Antonise R, Lavelle D, et al. A high-density integrated genetic linkage map of lettuce (Lactuca spp.)[J]. Theoretical and Applied Genetics, 2007, 115(6): 735-746.
Higashi T, Aoki K, Nagano A J, et al. Circadian oscillation of the lettuce transcriptome under constant light and light- ark conditions[J]. Frontiers in Plant Science, 2016, 7: 1114.
郭新波. 生菜特殊营养品质评价与代谢工程强化研究[D]. 上海: 复旦大学, 2013.
申领艳, 闫凤岐, 康少辉, 等. 张承坝上地区结球生菜1年2茬安全高效栽培模式和标准化田间管理技术[J]. 蔬菜, 2019(3): 45-47.
牛小朋. 生菜栽培技术[J]. 蔬菜, 2012(9): 13-14.
雷喜红, 李 蔚, 孙朝华, 等. 蔬菜工厂化生产(八) 高品质生菜水培生产技术[J]. 中国蔬菜, 2019(2): 87-91.
陈晓丽, 杨其长, 张 馨, 等. LED绿光补光模式对生菜生长及品质的影响[J]. 中国农业科学, 2017, 50(21): 4170-4177.
石文芳. 基于RNA-seq测序的梅花转录组分析[D]. 北京: 北京林业大学, 2012.
王楚彪, 卢万鸿, 林 彦, 等. 转录组测序的发展和应用[J]. 桉树科技, 2018, 35(4): 20-26.
Demotes-Mainard S, Peron T, Corot A, et al. Plant responses to red and far-red lights, applications in horticulture[J]. Environmental and Experimental Botany, 2016, 121: 4-21.
查凌雁, 刘文科. 昼夜连续照射LED红蓝光对不同品种生菜生长和品质的影响[J]. 中国农业气象, 2018, 39(7): 453-461.
Baek G Y, Kim M H, Kim C H, et al. The effect of LED light combination on the anthocyanin expression of lettuce[J]. IFAC Proceedings Volumes, 2013, 46(4): 120-123.
周 智, 张永丽, 王变变, 等. 荧光粉激发型LED光对拟南芥生长发育的影响[J]. 植物学报, 2018, 53(4): 502-508.
张昕昱, 张智深, 张放心, 等. 基于植物光合作用的太阳光谱分离技术进展[J]. 照明工程学报, 2018, 29(4): 17-21.
翟克清, 张昕昱, 周念念, 等. 光学干涉膜下生菜的生理指标变化及品质分析[J]. 浙江农业学报, 2019, 31(9): 1493-1501.
Pfündel E, Baake E. A quantitative description of fluorescence excitation spectra in intact bean leaves greened under intermittent light[J]. Photosynthesis Research, 1990, 26(1): 19-28.
王 君, 仝宇欣, 杨其长. LED光源红蓝光配比对生菜光合作用及能量利用效率的影响[J]. 农业工程学报, 2018, 34(14): 234-240.
闻 婧, 杨其长, 魏灵玲, 等. 不同红蓝LED组合光源对叶用莴苣光合特性和品质的影响及节能评价[J]. 园艺学报, 2011, 38(4): 761-769.
黄薪历, 于 捷, 艾楷棋, 等. 红光和远红光对番茄生长发育的影响[J]. 西北农林科技大学学报(自然科学版), 2018, 46(3): 111-118, 127.
姜 敏, 李 魏, 董 铮, 等. 光敏色素对植物抗逆反应的调控研究进展[J]. 生物技术通报, 2017, 33(7): 15-21.
Wu L, Yang H Q. CRYPTOCHROME 1 is implicated in promoting R protein-mediated plant resistance to Pseudomonas syringae in Arabidopsis[J]. Molecular Plant, 2010, 3(3): 539-548.
岳 晶, 管利萍, 孟思遠, 等. 光敏色素信号通路中磷酸化修饰研究进展[J]. 植物学报, 2015, 50(2): 241-254.
陈 静, 陈启林, 翁 俊, 等. 不同红光/远红光比例(R/FR)的光照影响番茄幼苗叶片中花青素合成的研究[J]. 西北植物学报, 2004, 24(10): 1773-1778.
Smith Harry. Physiological and ecological function within the phytochrome family[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1995, 46(1): 289-315.
Whitelam G C, Smith H. Retention of phytochrome-medi?a?ted shade avoidance responses in phytochrome-deficient mutants of Arabidopsis, cucumber and tomato[J]. Journal of Plant Physiology, 1991, 139(1): 119-125.
Casson S, Hetherington A. Phytochrome B is required for light-mediated systemic control of stomatal development[J]. Current Biology, 2014, 24(11): 1216-1221.
Casson S A, Franklin K A, Gray J E, et al. Phytochrome B and PIF4 regulate stomatal development in response to light quantity[J]. Current Biology, 2009, 19(3): 229-234.
田爱梅, 张恩慧, 许忠民, 等. 白芨MYB类转录因子PAP1基因的克隆与表达分析[J]. 西北农业学报, 2014, 23(3): 123-127.
贾赵东, 马佩勇, 边小峰, 等. 植物花青素合成代谢途径及其分子调控[J]. 西北植物学报, 2014, 34(7): 1496-1506.
Tohge T, Nishiyama Y, Hirai M Y, et al. Functional genomics by integrated analysis of metabolome and transcriptome of Arabidopsis plants over-expressing an MYB transcription factor[J]. Plant Journal, 2005, 42(2): 218-235.
Borevitz JO, Xia Y, Blount J, et al. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J]. The Plant Cell, 2000, 12(12): 2383-2393.
刘 轶, 郑唐春, 代丽娟, 等. 拟南芥AtPAP1基因植物表达载体构建及在烟草中遗传转化分析[J]. 植物生理学报, 2017, 53(7): 1199-1207.
王 曼, 王小菁. 蓝光和蔗糖对拟南芥花色素苷积累和CHS基因表达的影响[J]. 热带亚热带植物学报, 2004, 12(3): 252-256.
