内蒙古乌海地区沙漠葡萄发酵醪液中酿酒酵母菌的筛选与鉴定
2020-03-23赵雪平温雅娇李正英郑海武黄海英李晓娟
赵雪平,温雅娇,李正英,*,郑海武,黄海英,李晓娟
(1.内蒙古农业大学职业技术学院,内蒙古包头014109;2.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
酿酒酵母的分布与地理位置和气候条件有关,目前世界大部分产区的酿酒酵母被广泛研究[1-4],我国葡萄产区的酿酒酵母也被广泛关注,主要集中在宁夏、新疆、云南、山东等地。赵悦等对云南葡萄产区的酿酒酵母多样性进行了研究[5],马文瑞等在新疆产区筛选了高产酸酿酒酵母[6],赵晓宁等对河北产区的酿酒酵母菌进行了分析和鉴定[7],张春芝等对宁夏产区的酿酒酵母菌进行了鉴定[8],而内蒙古地区的酿酒酵母的筛选和分离,尚有大量的工作去做,内蒙古乌海市位于北纬 39°02′~39°54′,东经 106°36′~107°08′地处黄河上游,东临鄂尔多斯高原,库布奇沙漠、毛乌素沙漠和乌兰布和沙漠,三大沙漠环绕乌海,光照充足,昼夜温差大,为葡萄生长提供了很好的地理和环境条件,所产的葡萄的糖度大,故为酵母菌提供了良好的生长繁殖场所,因此期许在此地区能够筛选出优良的酿酒酵母菌。酵母菌在葡萄酒发酵过程中扮演着重要的角色,它分解葡萄汁中的大部分糖并转化为酒精和二氧化碳。但还会生成一些其他的代谢产物,包括甘油、高级醇、酯、醛等,而这些影响了葡萄酒的色泽、香气及口感,这些因素直接决定着葡萄酒的质量[9]。优良酿酒酵母菌的筛选不仅要考察酿酒酵母菌的发酵能力、耐受性,更重要的是产品的品质。因此酵母菌的筛选对于葡萄酒品质的提升具有很重要的意义。
本研究以内蒙古乌海地区农家自酿发酵醪液为筛选来源,对照商业菌株,通过发酵能力、耐受性、产酒精能力、低产硫化氢、产酯能力,分3 级进行筛选,并且进行鉴定及产品感官评价。以期为我国葡萄酒的发展提供依据。
1 材料与方法
1.1 材料与设备
1.1.1 菌种
测试菌种:采集于内蒙古自治区乌海农家自酿发酵醪液。
对照菌种:葡萄酒活性干酵母(编号CECA):安琪酵母股份有限公司;酿酒酵母(编号CSM):法国拉曼公司。
1.1.2 原料
酿酒葡萄采于内蒙古农业大学职业技术学院科技园区。
1.1.3 培养基
孟加拉红琼脂培养基:孟加拉红0.033 g/L,氯霉素0.1 g/L,硫酸镁0.5 g/L,磷酸二氢钾1 g/L,蛋白胨5 g/L,葡萄糖10 g/L,琼脂15 g/L;
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)固体培养基:酵母浸出粉5 g/L,蛋白胨10 g/L,琼脂 14 g/L,葡萄糖 20 g/L。
酵母膏胨葡萄糖(yeast peptone dextrose,YPD)液体培养基:酵母浸出粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。
氯化三苯基四氮唑(2,3,5,-triphenyltetrazolium,TTC)上层培养基[10]:TTC 0.5 g/L,葡萄糖 5 g/L,琼脂15 g/L。
TTC 下层培养基[10]:硫酸镁0.4 g/L,磷酸二氢钾1.0 g/L,酵母浸出粉1.5 g/L,蛋白胨2 g/L,葡萄糖10 g/L,琼脂20 g/L,调节pH 值至5.5。
BIGGY 琼脂培养基:BIGGY 琼脂 45 g/L。
产酯固体培养基[11-12]:溴甲酚紫0.04 g/L,三丁酸甘油脂15 mL/L,酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂 20 g/L。
发酵培养基:硫酸铵1 g/L,硫酸镁1 g/L,磷酸二氢钾1 g/L,酵母浸粉10 g/L,胰蛋白胨20 g/L,葡萄糖200 g/L。
1.1.4 主要试剂
酵母浸粉、胰蛋白胨:北京奥博星生物技术有限责任公司;葡萄糖:天津市风船化学试剂科技有限公司;琼酯粉:天津市科密欧化学试剂有限公司;磷酸二氢钾:天津市标准科技有限公司;硫酸铵:天津市天大化学试剂厂;硫酸镁:北京双环化学试剂厂;氢氧化钠:天津市盛奥化学试剂有限公司;乳酸:天津市化学试剂三厂;乳酸钾:山东优索化工科技有限公司;酒石酸钾钠:国药集团化学试剂有限公司;酵母菌DNA 提取试剂盒:天根生化科技有限公司;以上试剂均为分析纯。
1.1.5 仪器与设备
全功能酶标仪(synergyHIMF+Take3):美国BioTek仪器有限公司;电子天平(TP-214)、酸度计(PHS-3C)、移液器(1 00 μL~1 000 μL):丹佛仪器北京有限公司;可调式封闭电炉(FL-2):天津市泰斯特仪器有限公司;恒温震荡培养箱(THZ-98AB)、生化培养箱(LRH-70)、光学显微镜(CX21)、电热恒温水浴锅(HWS12):上海一恒科学仪器有限公司;立式压力蒸汽灭菌锅(SX-700):北京世贸远东科学仪器有限公司;超净工作台(VD-1320):哈尔滨东联电子技术开发有限公司;高速离心机(HC-2518R):海玉博生物科技有限公司。
1.2 方法
1.2.1 酿酒酵母菌株的分离纯化
以内蒙古乌海地区农家自酿发酵醪液为酵母菌的收集来源。将收集的样品制成菌液,并且稀释,吸取50 μL 稀释后的菌液于孟加拉红固体平板上,用涂布棒涂匀,28 ℃培养1 d~3 d。挑选单个的具有典型酵母菌菌落特征且形态差异较为明显的菌落,划线纯化两到三代,将上述分离纯化得到的酵母菌接入YEPD 斜面培养基,4 ℃保藏。
1.2.2 酿酒酵母菌株一级筛选
采用酵母菌株发酵力试验进行一级筛选。将分离纯化得到的酵母菌株活化,接入放有倒置杜氏管的YPD 液体培养基试管中,28 ℃培养,每隔12 h 观察其产气情况,记录杜氏管内气体体积[10]。去除发酵速度慢,不产气的菌株。将起酵速度快,产气多的菌株筛选出来,并用于二级筛选。
1.2.3 酿酒酵母菌株二级筛选
采用耐受性测定进行二级筛选,包括耐酒精性能试验、耐SO2性能试验、高糖耐受性试验和低pH 值的耐受性试验,将YPD 液体培养基分装到试管中再放入倒置的杜氏管,杜氏管内不含空气。121 ℃灭菌20 min,冷却至室温(25 ℃),按照表1 调节培养基条件梯度,酒精度和SO2浓度先灭菌后调整,糖度和pH 值先调整后灭菌。接种待测酵母菌株接2%,每个处理平行3 次,28 ℃培养1 d~3 d,观察其产气状况判断其耐受性。以商业酿酒酵母CECA 和CSM 及空白试验作为对照。酵母菌株耐受性测定条件梯度设置见表1。

表1 酵母菌株耐受性测定条件梯度Table 1 Conditional gradient for tolerance measurement of yeast strains
1.2.4 酿酒酵母菌株三级筛选
将分离后的酵母菌株利用TTC 培养基显色法测定菌株产酒精能力,BIGGY 琼脂培养基显色法测定菌株产硫化氢性以及产酯培养基显色法测定菌株产酯特性。筛选出产酒精能力强、低产硫化氢且高产酯的优良酵母菌株。
1.2.4.1 高产酒精酵母菌株的筛选
酵母菌株划线接种到TTC 下层培养基上,以商业酿酒酵母CECA 和CSM 及空白试验作为对照,28 ℃培养1 d~3 d 后,在菌落上覆盖一层TTC 上层培养基,28 ℃遮光培养。观察各平皿中菌落的显色情况,菌株与培养基反应,使菌落呈现白色、浅红色、红色和深红色,菌落呈现的颜色越深,表明菌株产酒精能力越强。
1.2.4.2 低产硫化氢酵母菌株的筛选
将1.2.4.1 中筛选出的高产酒精酵母菌株点种到BIGGY 琼酯培养基上,并以商业酿酒酵母CECA 和CSM 及空白试验作为对照,28 ℃培养1 d~3 d,观察各菌株菌落颜色,菌株产生的硫化氢与BIGGY 培养基中的铋发生反应,使菌落呈现白色、黄色、浅棕色和深棕色,颜色越深,代表菌株产硫化氢的量越多。
1.2.4.3 高产酯酵母菌株的筛选
将1.2.4.2 中筛选出的酵母菌株划线接种到产酯培养基上,以商业酿酒酵母CECA 和CSM 及空白试验作为对照。观察其菌落颜色。菌株产酯能力不同所呈现在产酯平板上的菌落颜色也不相同,菌落黄色越浓,表明菌株的产酯量越多[13]。
1.2.5 优良菌株的分子生物学鉴定
酵母菌株KT3 送至生工生物工程(上海)股份有限公司,进行26S rDNA D1/D2 区测序[14-16],酵母菌株序列测定后,将测序结果在NCBI 数据库中进行比对,通过比对测序菌株与数据库中模式菌株的可信值进行鉴定,用Mega 软件构建系统进化树。
1.2.6 优良酵母菌发酵特性的测定
将优良酵母菌株按2%的接种量接入到发酵培养基中,每组试验3 个平行,并以商业酿酒酵母CECA 和CSM 及空白试验作为对照。在130 r/min,28 ℃恒温振荡培养,每隔12 h 称重并记录。计算出菌株的CO2失重量,判断菌株的发酵速率。
将优良菌株接种到YPD 液体培养基中,28 ℃培养。每隔2 h 测定菌液的OD600值,连测16 次,根据OD值绘制其生长曲线,确定其生长对数期。
1.2.7 酵母菌株发酵产品感官评价
将培养至对数生长期的优良菌株接种到YPD 液体培养基中,在10 ℃、12 000 r/min 条件下离心3 min,收集菌泥备用[17]。选用种植于内蒙古农业大学职业技术学院科技园区的葡萄进行发酵试验[葡萄汁理化指标为:23.0 Brix°,还原糖 154.07 g/L,总酸(6.86±0.2)g/L,pH 值3.14]。葡萄汁中按2%的接种量接入优良酵母菌株,同时用法国商业酵母CSM 和国产商业酵母CECA 作对照。在25 ℃下恒温发酵。每24h 测定还原糖、总酸和酒精度,当残糖含量下降至4 g/L 以下时视为发酵结束[18-19],按照 GB/T 15037-2006《葡萄酒》[18]的方法,组织7 位有经验的品评员,进行感官评定。
2 结果与分析
2.1 酿酒酵母菌的分离纯化
将发酵醪液中酵母菌的分离纯化,通过对酵母菌形态观察以及显微镜镜检,初步去除重复菌株,共筛选 出 22 株 酵 母 菌 株 编 号 为 :KC1 ~KC4、KS1 ~KS3、KP1~KP6、KJ1~KJ3、KT1~KT3、KZ1~KZ3。
2.2 酿酒酵母菌的筛选
2.2.1 酿酒酵母菌的一级筛选
将分离纯化的22 株酵母菌进行酵母菌发酵能力测定,测定结果见表2。

表2 酵母菌株发酵力测定结果Table 2 Determination of fermentation ability of yeast strains
由表2 可知,分离纯化的22 株酵母菌株经过杜氏管产气试验,有10 株菌能在12 h 内(包括12 h)发酵产生CO2,并充满杜氏管,说明这部分菌株的发酵能力最强,活力最旺盛;有9 株酵母菌能在24 h 内(包括24 h)起酵并产气充满杜氏管,说明这些菌株的生长速度较快,能够在短时间内开始发酵;有3 株酵母菌未在48 h 内产气,说明其生长繁殖慢,发酵力弱。葡萄酒的生产酿造中,葡萄原汁并不经过消毒杀菌,若持续48 h都无法开始发酵,就会导致葡萄汁变质,影响口感和酒的品质,所以将未在48 h 内产气的菌株淘汰,仅保留余下的19 株菌进行二级筛选试验。
2.2.2 酿酒酵母菌耐受性测定
将一级筛选得到得19 株菌进行耐受性测定,结果见表3。
国标GB 2760-2011《食品添加剂使用标准》[20]要求葡萄酒生产中SO2最大添加量不超过250 mg/L,酿制干红葡萄酒的葡萄含糖量一般大于20%压榨后的冰葡萄汁含糖量能达到35%~45%[21],新鲜葡萄汁的pH 值范围在3~4.5 之间,本研究中的19 株酵母菌均符合酿酒酵母耐受性的要求。
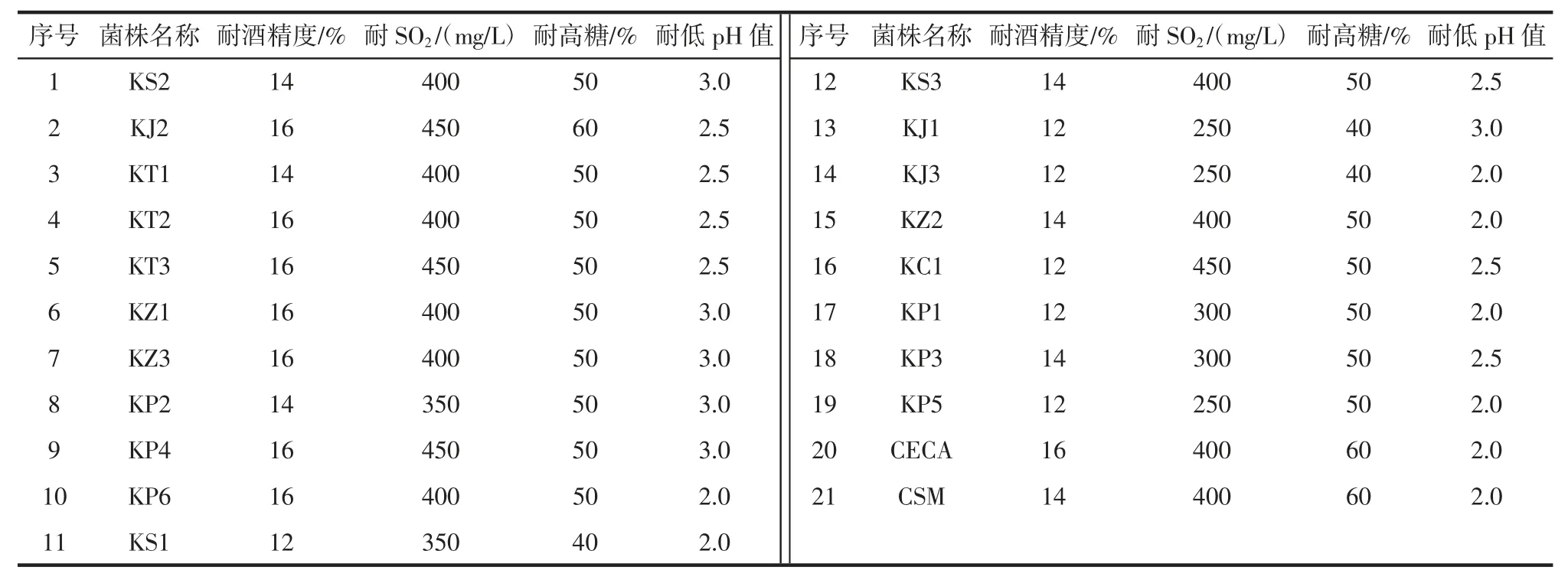
表3 酵母菌株耐受性能测定试验结果Table 3 Screening results of ester-producing characteristics
2.2.3 高产酒精酵母菌的筛选
将分离纯化的19 株酵母菌进行产酒精能力试验,结果见表4。
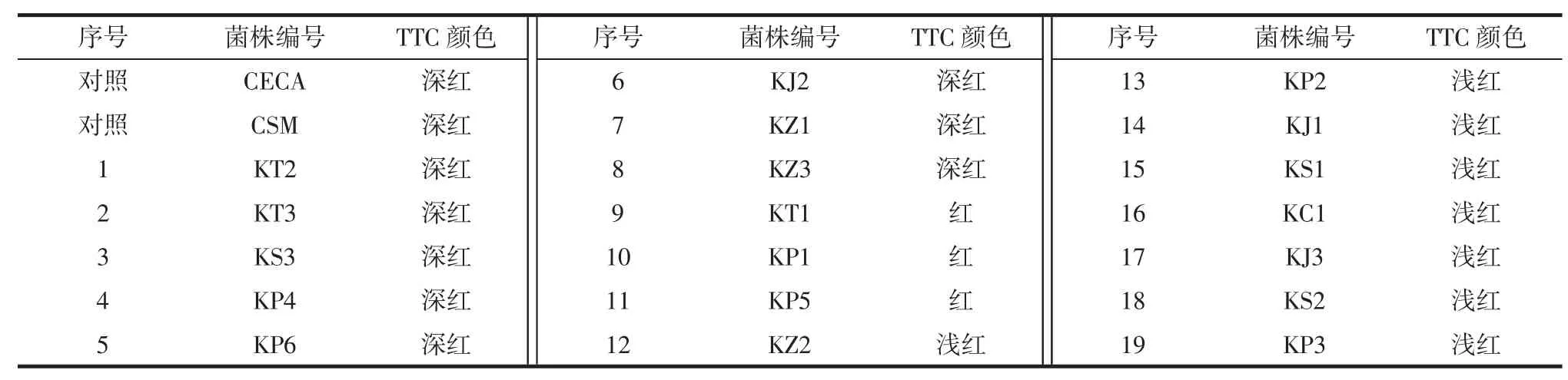
表4 酵母菌在TTC 培养基上的显色结果Table 4 Chromogenic results of yeast on TTC medium
由表4 可知,有 8 株酵母菌(KT2、KT3、KS3、KP4、KP6、KJ2、KZ1、KZ3) 的菌落在 TTC 培养基上呈深红色,其产酒精能力与对照组相当,因此选择这8 株产酒精能力强的酵母菌进行下一步的筛选试验。
2.2.4 低产硫化氢酵母菌株的筛选试验
将高产酒精的8 株酵母菌进行低产硫化氢酵母菌株的筛选试验,结果见表5。
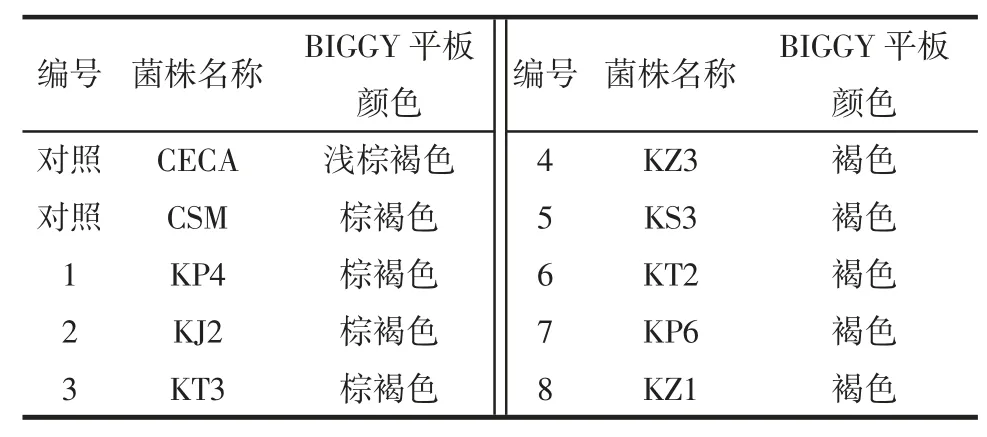
表5 酵母菌在BIGGY 培养基上菌落颜色Table 5 Colony colour of yeast on BIGGY medium
BIGGY 琼脂是一种具有选择性的培养基,使用铋作为指示剂,来测定菌株生长时是否有产生硫化氢,颜色越深,表面菌株产硫化氢越多[22]。由表5 可知,对照菌株CECA 菌落在BIGGY 培养基上呈浅棕褐色,为低产硫化氢酵母,CSM 呈棕褐色,为中产硫化氢酵母。硫化氢产生的不良气味会影响葡萄酒的风味[23],且对人体有毒害作用,基于此,仅保留低产和中产硫化氢的菌株KP3、KJ2 和KT3 作后续研究。
2.2.5 高产酯酵母菌株的筛选试验结果
将3 株低中产硫化氢高产酒精酵母分别接种到产酯培养基上,并以商业菌株CECA 和CSM 作对照,28 ℃恒温培养1 d~3 d。观察菌落附近的颜色并记录,显色结果见表6。
由表6 可知,对照菌株CECA、CSM 及KT3 的菌落在产酯培养基上呈深黄色,即产酯能力较强,选择KT3 酵母菌株进行后续研究。
2.3 优良酵母菌的鉴定
酵母菌株KT3 的聚合酶链式反应(polymerasechainreaction,PCR)扩增电泳图如图1。

表6 产酯特性筛选结果Table 6 Screening results of ester-producing characteristics
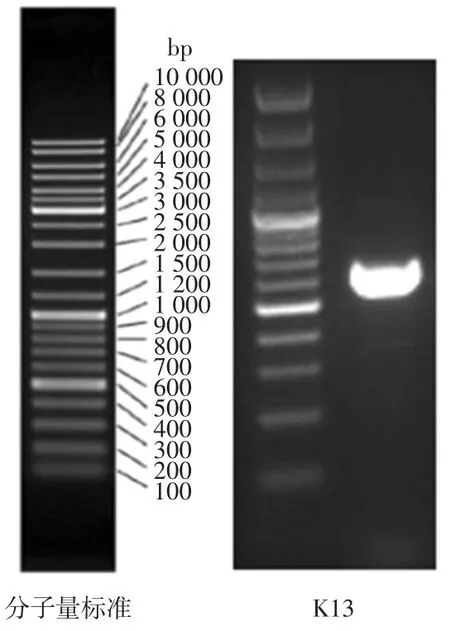
图1 酵母菌株PCR 扩增电泳图Fig.1 PCR amplified electrophoresis map of yeast strains
如图1 所示,通过对酵母菌株DNA 的提取和PCR扩增,可以看出酵母菌株的DNA 片段长度在580 bp~600 bp 左右,符合前人对酵母菌基因序列长度的研究范围[24]。
DNA 测序结果在NCBI 网站上进行序列同源性比对,结果见表7。
通过比较得到酵母菌株KT3 的DNA 片段与酿酒酵母同源性最高,达到99%,与测序结果进行对比,并用MEGA6.0 构建系统进化树,见图2。最终确定酵母菌株KT3 为酿酒酵母。

表7 酵母菌株26S rDNA D1/D2 序列测序结果Table 7 Sequencing results of 26S rDNA D1/D2 sequence of yeast strain
2.4 优良酵母菌发酵特性测定
酿酒酵母菌株KT3 生长曲线如图3 所示。
图3 可以看出,在2 h~4 h 内,菌株处于调整期,菌株繁殖较慢;4 h~12 h,菌株进入对数生长期;培养到12 h~30 h 时,菌株进入稳定期;在 30 h~36 h 时,菌株活力下降逐渐进入衰亡期。综上可知该酿酒酵母菌具有良好的生长特性。
酵母菌株KT3 的发酵速率测定结果见图4。
由图4 可知,菌株KT3 的发酵液CO2失重略小于对照菌株CECA 发酵液的CO2失重,大于对照菌株CSM 发酵液CO2失重,具有良好的发酵速率。
2.5 酵母菌株发酵产品感官评价
优选的酿酒酵母和2 株商业酿酒酵母发酵的葡萄酒的色泽、香气、澄清度、滋味、典型性等方面进行评分[25-26],结果见表8 和图5。
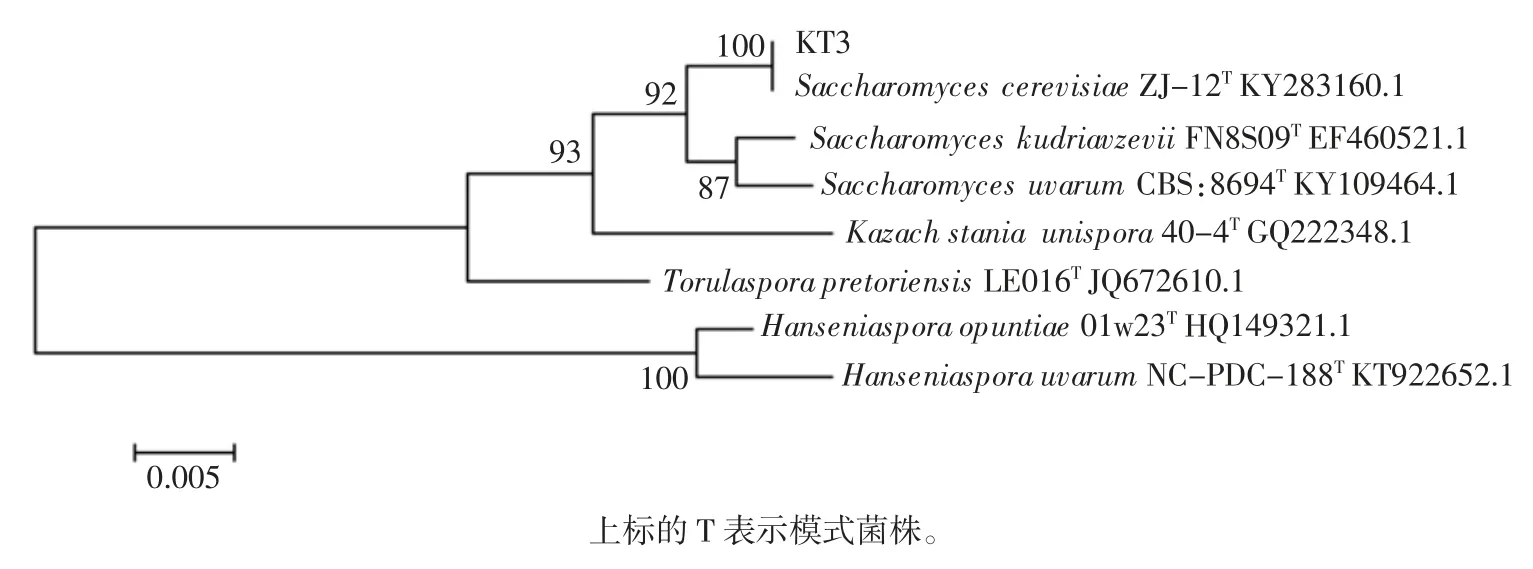
图2 酵母菌株26S rDNA 构建的系统进化树Fig.2 Phylogenetic tree constructed by yeast strain 26S rDNA
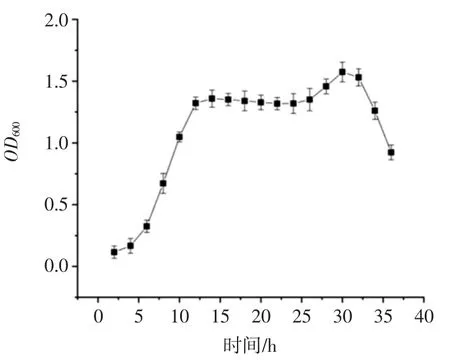
图3 KT3 生长曲线图Fig.3 OD600 value of growth curve of KT3
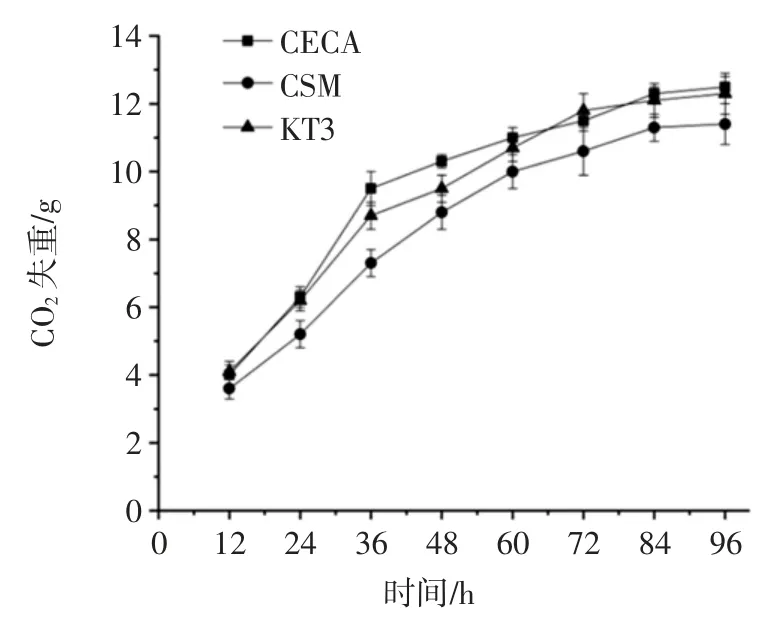
图4 CO2 失重Fig.4 CO2 weight loss

表8 不同酵母菌发酵的干红葡萄酒感官评分表Table 8 Sensory scoring scale for dry red wine fermented by different yeasts
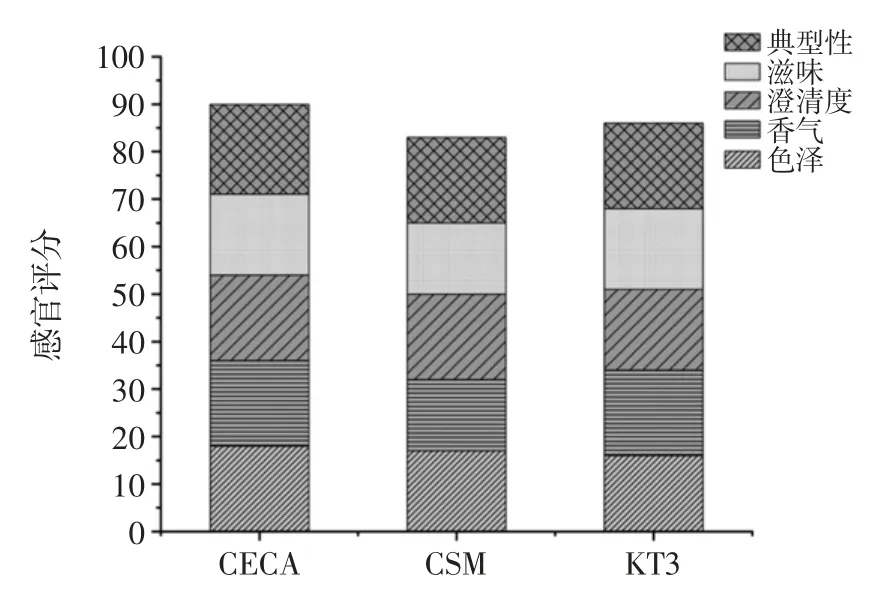
图5 不同酵母菌发酵的干红葡萄酒感官评定Fig.5 Sensory scoring scale for dry red wine fermented by different yeasts
在2 株商业酵母菌和1 株优选酵母菌发酵葡萄酒的感官评分中,评分从高到低依次为CECA、KT3、CSM。筛选出的优良菌株中KT3 酿制的葡萄酒酒体澄清透亮有光泽,呈宝石红色,入口偏酸,口味独特,层次丰富,有典型性。
3 结论
本文以内蒙古乌海地区自然发酵醪液为筛选来源,通过筛选得到1 株酵母菌KT3,经26S rDNA D1/D2 区域测序,确定KT3 为酿酒酵母菌,该酵母菌的耐酒精度为16%,耐SO2浓度为450 mg/L,耐高糖浓度为50%,耐pH 值为2.5,具有良好的耐受性,产品典型性突出,可以用于商业化生产。
