壳聚糖/酸枣仁黄酮复合膜的制备与表征
2020-03-23姜雪段蕾韩墨吴修利殷立颖
姜雪,段蕾,韩墨,吴修利,殷立颖
(长春大学食品科学与工程学院,吉林长春130022)
近年来,大量石化塑料的使用带来了自然资源枯竭、食品安全和环境污染等系列问题,生物降解和生物基包装材料受到了广泛关注[1]。天然高分子聚合物,如淀粉、纤维素、蛋白质和壳聚糖等作为可生物降解和食用的物质,由于具有良好的安全性、生物相容性、可降解和成膜等特性,具有广泛的应用前景[2]。此外,大量的研究也集中于添加天然抗氧化剂和抗菌剂食用包装材料[3]。
壳聚糖是由自然界中存储量仅次于纤维素的天然高聚物甲壳素脱乙酰所得到的产物,结构单元为β-1,4-2-氨基-D-葡萄糖。作为一种优良的成膜材料,壳聚糖与许多中等强度的商用高分子材料相比具有良好的透气性和力学性能,人们普遍认为酵母和霉菌对壳聚糖最敏感,其次是革兰氏阳性细菌和革兰氏阴性细菌[4]。但壳聚糖抑菌谱较窄的缺点限制了其作为食品活性包装的应用范围[5]。相关文献表明,在壳聚糖膜中添加香芹酚、绿茶和葡萄籽提取物等含有多酚类抗氧化生物活性物质有助于食品保鲜和延长保质期[3,6]。
酸枣仁作为药食同源的原料,含有黄酮类、萜类、皂苷及有机酸等多种活性成分,其中黄酮类为主要的有效成分。黄酮类化合物具有抗氧化、抗病毒及非常广泛的抑菌作用[7-9],对于多种细菌具有抑制作用,抑菌效果甚至优于多酚类化合物[10]。因此本文将酸枣仁总黄酮与壳聚糖复合成膜,提高壳聚糖复合膜的抗菌活性和抗氧化性,从而拓宽壳聚糖膜在食品活性包装方面的应用。
1 材料与方法
1.1 材料与试剂
壳聚糖:国药集团化学试剂有限公司(脱乙酰度为84%);甘油:天津市光复科技发展有限公司;氢氧化钠、冰乙酸、氯化钠(分析纯):北京化工厂。
1.2 仪器与设备
AM-3250A 型磁力搅拌机:天津奥特赛恩斯仪器有限公司;DZF-6050 型真空干燥箱:上海博讯实业有限公司医疗设备厂;721-100 型可见分光光度计:上海菁华科技仪器有限公司;KQ-600KDE 型高功率数控超声波清洗机:昆山市超声仪器有限公司;QJ210 型电子万能仪试验机:上海倾技仪器仪表科技有限公司;NICOLETIS5 型傅里叶红外仪:赛默飞世尔科技有限公司;JSM-6510LA 型扫描电子显微镜:日本岛津公司;TD-3000 型X-射线衍射仪:丹东通达仪器有限公司。
1.3 试验方法
1.3.1 酸枣仁总黄酮提取
酸枣仁总黄酮提取依据先前的研究[11],将脱脂后的酸枣仁粉末 1.0 g 按料液比 1 ∶57(g/mL),乙醇体积分数74%,加入聚四氟乙烯内衬的不锈钢反应釜中,密封置于干燥箱中,设定提取温度93 ℃、提取时间4.2 h,在此条件下,提取3 次,然后冷却至室温25 ℃,取出反应釜,抽滤提取液,即得到分析液。采用NaNO2-Al(NO3)3比色法检测酸枣仁总黄酮得率为16.761 mg/g,黄酮浓度为1.085 mg/mL。
1.3.2 壳聚糖/酸枣仁黄酮复合膜的制备
1.0 g 壳聚糖溶于35 mL 2%的乙酸溶液中,搅拌均匀后,加入0.3 g 甘油,50 ℃水浴保温30 min,并持续搅拌制得壳聚糖溶液;而后将制备的黄酮提取液分别按 0、5、10、15 mL 加入到壳聚糖溶液中,50 ℃搅拌30 min,室温25 ℃下,超声20 min,除去壳聚糖复合膜膜液中的气泡;称取22 g 壳聚糖复合膜膜液流延在直径为10.2 cm 的塑料平板上,50 ℃烘干揭膜。
1.3.3 壳聚糖/酸枣仁黄酮复合膜物理性能的测定
1.3.3.1 复合膜的厚度和密度
复合膜厚度使用数显型螺旋测微器进行测量。在膜上任意测量5 个位置,每个样本测量5 次,计算平均值。膜密度由膜重量和体积确定,膜体积由膜面积和厚度进行计算。
1.3.3.2 复合膜透明度
透明度的测定参考Park 等[12]方法,略有改动。选取光滑、平整、洁净且无瑕疵的膜,将试样膜(1 cm×4 cm样条)置于紫外分光光度计中,在600 nm 处测定试样膜的吸光度。未放置膜的单元作为参照样。试样膜的透明度以不透明度表示,计算公式如下:

式中:O 表示不透明度;Abs 为试样在 600 nm 的吸光度;d 为试样的厚度,mm。
1.3.4 壳聚糖/酸枣仁黄酮复合膜机械性能的测定
测试方法参照GB13022-91《塑料、薄膜拉伸性能试验》略有改动,将膜样品裁成长条型的试样(长150 mm×宽10 mm),作出标距50 mm,在相对湿度为75%的干燥器内平衡48 h。测试条件:试验拉伸速率设定为100 mm/min,夹具间距为50 mm,室温25 ℃条件下测定。
1.3.5 壳聚糖/酸枣仁黄酮复合膜结构表征
1.3.5.1 傅里叶变换衰减全反射红外光谱(fourier transform attenuated total reflection infrared spectrometry,ATR-FTIR)[13]
利用红外光谱仪进行扫描,并采用薄膜法,红外扫描范围波长范围为4 000 cm-1~650 cm-1,分辨率为4 cm-1,扫描次数为 16 次。
1.3.5.2 X-射线衍射分析(X-ray diffraction,XRD)[14]
采用X-射线衍射仪对复合膜晶体结构进行分析,铜靶,入射线波长0.154 2 nm,Ni 滤波片,管压40 kV,管流40 mA,扫描角度 2θ 为 5°~40°,扫描速度为 2 °/min。
1.3.5.3 扫描电镜分析(scanning electron microscope,SEM)
将膜样用导电胶固定在铜台,然后喷镀上金箔,采用高倍扫描电子显微镜观察。
1.4 数据处理
采用Origin 8.5 软件绘图,Spss 17.0 统计分析软件进行数据处理。
2 结果与分析
2.1 壳聚糖/酸枣仁黄酮复合膜物理性能分析
酸枣仁黄酮添加量对壳聚糖/酸枣仁黄酮复合膜的膜厚度、密度、透明度的影响见表1。

表1 不同添加量的酸枣仁黄酮/壳聚糖复合膜的特性研究Table 1 Properties of chitosan film incorporated with different jujube flavonoid
从表1 中数据可以看出,随着酸枣仁黄酮提取物添加的增加复合膜厚度及密度呈现增大的趋势。同样的现象也发生在苹果幼果多酚壳聚糖复合膜性质研究中,研究者认为多酚可能在壳聚糖链羟基之间起到架桥的作用,因此壳聚糖分子之间的距离变短,导致膜结构更紧密,增大了膜厚度和膜密度[1]。
随着酸枣仁黄酮提取物的加入使复合膜趋向于黄色,而且较暗,膜不透明度O 值从1.570 增加到1.995,可见复合膜透明度下降。包装材料透明度的降低可以有效的避免包装食品受到可见光和紫外光的作用发生氧化变质及气味流失[15]。
2.2 壳聚糖/酸枣仁黄酮复合膜机械性能
抗拉强度是薄膜抵抗施加的拉伸应力而显示的最大强度,而断裂伸长率则代表薄膜断裂前试样长度的最大变化。酸枣仁黄酮添加量对壳聚糖复合膜力学性能影响见图1。
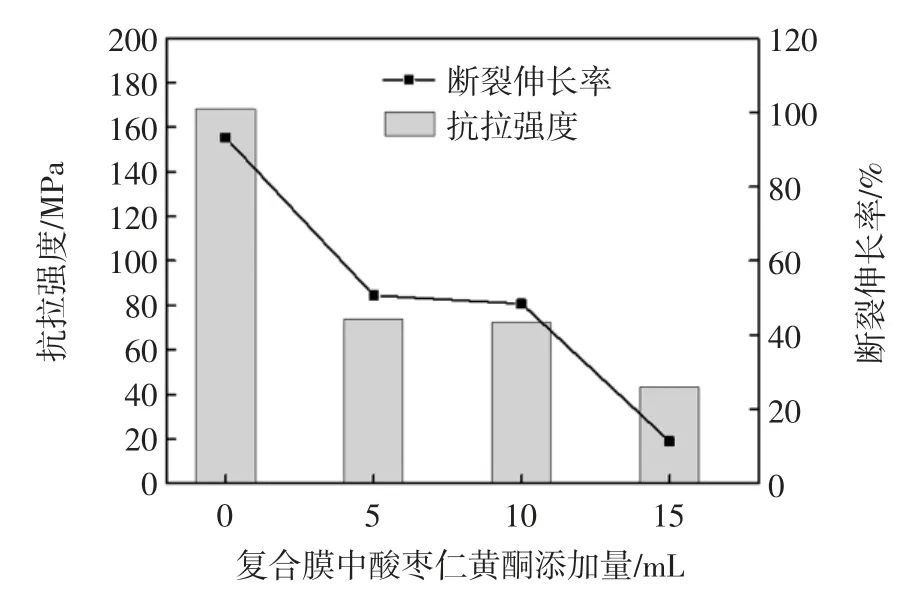
图1 壳聚糖复合膜抗拉强度和断裂伸长率Fig.1 Tensile strength and elongation at break of chitosan composite film
随着酸枣仁黄酮量的增加,拉伸强度和断裂伸长率都呈现明显的下降趋势,其中以壳聚糖空白膜的拉伸强度最大,随着酸枣仁黄酮提取液的加入,拉伸强度逐渐将小,当添加15 mL 时,拉伸强度最低,仅仅是空白膜的1/4 左右,从膜的柔韧性来看,也是壳聚糖空白膜最好。在研究壳聚糖/佛手柑精油膜和壳聚糖/茶提取液膜力学特性的过程也发现了类似的规律[16]。壳聚糖膜的力学特性与壳聚糖的组成、膜微观网络的结构和分子间的作用力有关。酸枣仁黄酮提取液添加到壳聚糖膜中,黄酮分子破坏了壳聚糖分子规整性,减弱了壳聚糖分子间的氢键,阻碍了高分子链间的相互作用,因而壳聚糖复合膜的抗拉强度降低[17]。而另外一个原因也可能是壳聚糖膜溶液加入酸枣仁黄酮后,导致制备的膜发生不连续性,进而膜的柔韧性降低,抗压能力下降[15]。
2.3 壳聚糖/酸枣仁黄酮复合膜红外光谱分析
不同酸枣仁黄酮添加量的壳聚糖复合膜红外光谱如图2 所示。

图2 壳聚糖/酸枣仁黄酮复合膜红外光谱图Fig.2 Infrared spectrum of chitosan/jujube flavonoid composite film
由图2 可知,壳聚糖空白复合膜红外谱图各吸收峰归属如下[18-20],位于波数 3 500 cm-1~3 200 cm-1的宽峰源自壳聚糖膜中氢键缔合的-OH 伸缩振动与氨基基团的N-H 伸缩振动所叠加的多重吸收峰。2 920 cm-1和2 860 cm-1附近的吸收峰归属于C-H 的伸缩振动,而位于波数 1 650、1 556 cm-1和 1 310 cm-1的吸收峰则分别对应于酰胺Ⅰ谱带、酰胺Ⅱ谱带、酰胺Ⅲ谱带。此外,红外谱图上还可观测到位于1 157 cm-1的CO-C 键的伸缩振动,1 017 cm-1位置附近与醇羟基相连的C-OH 伸缩吸收峰以及892 cm-1吡喃糖的特征吸收峰,可见制膜过程壳聚糖基本的化学骨架未发生破坏。
分析加入酸枣仁黄酮后的壳聚糖复合膜红外光谱,没有发现新的吸收峰和明显的波长位移,这表明壳聚糖和酸枣仁黄酮之间并未生成新的化学键。随着酸枣仁黄酮含量的加入,位于3 200 cm-1附近的宽峰变得比较平坦,这意味着加入的酸枣仁黄酮和壳聚糖结合相互作用降低了壳聚糖复合膜体系中-OH 和-NH的伸缩振动,而且基团的相互影响也导致指纹区的某些吸收峰包括C-H 的伸缩振动甚至难以在图上察觉。
2.4 壳聚糖/酸枣仁黄酮复合膜X射线衍射分析
不同酸枣仁黄酮添加量的壳聚糖复合膜X-射线衍射图如图3 所示。
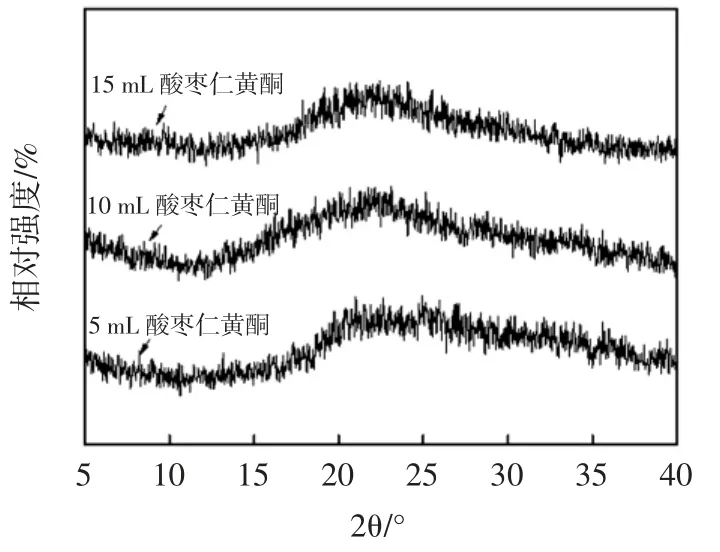
图3 壳聚糖/酸枣仁黄酮复合膜X-射线衍射图Fig.3 X-ray diffraction pattern of chitosan/jujube flavonoid composite film
壳聚糖作为一种易结晶的高分子聚合物,分内部及分子之间存在较强的氢键作用,分子结构致密,存在晶形Ⅰ和晶形Ⅱ两种晶形,通常,从壳聚糖醋酸溶液浇铸而成的膜呈现晶形Ⅰ结构,壳聚糖膜在2θ=10°和20°附近出现两个较强的衍射峰[21]。而添加酸枣仁黄酮的复合膜衍射峰强度明显降低甚至消失,呈现出非晶态弥散峰的特征。说明添加的酸枣仁黄酮与壳聚糖成膜过程形成的相互作用,破坏了壳聚糖自身分子内和分子间原有的氢键,致使膜的无定形区域降低[1]。而膜的机械强度与结晶度密切相关,这与前面膜的力学相关特性数据检测结论相一致。这可能是酸枣仁黄酮某种程度的不溶。
2.5 壳聚糖/酸枣仁黄酮复合膜扫描电镜分析
扫描电镜图可提供膜表面和内部微观结构的信息,图 4 是壳聚糖复合膜的扫描电镜图。图 4(a)~(c)是不同酸枣仁黄酮添加量的复合膜的表面图,图4(d)~(f)为对应的膜层截面图。
由图4 可见,壳聚糖空白对照复合膜表面平整光滑,均匀致密,这说明膜内部较均匀,由于未经过滤处理,空白壳聚糖膜表面有少许不溶物。添加酸枣仁总黄酮的壳聚糖复合膜的表面相对致密、平滑,无孔状或裂纹,显示出现较好的均一性,但事实上与空白壳聚糖膜相比较,没有其致密,这可通过膜层截面看出来,膜抗拉强度和断裂伸长率数据也证实了这一点。当添加量为5 mL 时,膜表面出现类似鳞片的结构,内部较粗糙,推测这是由于酸枣仁总黄酮与壳聚糖膜液组分相容性差所造成的两相分离,当添加量进一步增加,总黄酮浓度增高,加剧了总黄酮之间的疏水作用,诱导形成聚集如箭头所示。

图4 壳聚糖/酸枣仁黄酮复合膜扫描电镜图(2 000×)Fig.4 Scanning electron micrograph of chitosan/jujube flavonoid composite film(2 000×)
3 结论
壳聚糖是天然的高分子线性多糖,无毒、抗菌,具有良好的生物相容性和可降解性。本文采用流延法制备壳聚糖复合膜,在壳聚糖膜液中添加具有抑菌作用和抗氧化作用的酸枣仁黄酮提取液。随着复合膜中酸枣仁黄酮提取液的逐渐增加,致使壳聚糖分子之间作用力减弱,复合膜的拉伸强度、断裂伸长率呈现明显的降低趋势,而膜的厚度和密度则呈现变大的规律,膜透明度逐渐减小有利于作为包装材料避光防止抗氧化。壳聚糖复合膜红外光谱显示壳聚糖分子的基本骨架并未因为膜的制备发生改变,壳聚糖和酸枣仁黄酮之间未生成新的化学键,但彼此相互作用影响导致某些基团吸收峰强度减弱甚至难以察觉,X-射线衍射分析表明壳聚糖复合膜呈现非晶态弥散峰的特征,SEM 分析证实虽然复合膜表面光滑致密,但有酸枣仁总黄酮的聚集现象。
