两种药食同源植物总生物碱的提取及其抗氧化作用
2020-03-23王亚冬李秀梅潘方方张海英杨培龙马文建
王亚冬,李秀梅,潘方方,张海英,杨培龙,马文建,3,*
(1.天津科技大学生物工程学院,天津300457;2.中国农业科学院饲料研究所,北京100081;3.齐鲁理工学院,山东济南250200)
随着现代生活节奏的不断加快,在环境、年龄、心理、生理疲劳等多种因素共同作用下导致人体内产生大量自由基[1-2],研究证实,机体衰老、癌症等重大疾病的产生都与体内产生的过量自由基相关[3]。通过从食物中摄取天然抗氧化物质来巩固机体内的抗氧化水平,清除自由基,有利于人类健康。生物碱是自然界中广泛存在的一类含氮碱性有机化合物,多数具有复杂的含氮杂环,结构多样,种类繁多[4],并且具有广泛的药理活性[5-7],如抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)、抗高血脂、抗血小板聚集、降血压、抗氧化、抗菌、抗肥胖、抗糖尿病以及抑制黑色素生成活性同时毒副作用相对小于化学合成药,因此生物碱类提取物一直是人们竭力于开发新药的重要研究领域[8]。
本文以人们日常的药食同源植物马齿苋和蒲公英为原料,采用超声波破碎法考察两种植物总生物碱提取率,以总抗氧化能力、清除 ABTS+·、DPPH·、超氧阴离子、羟基自由基能力、总还原能力为衡量指标,考察了两种植物总生物碱的抗氧化作用,以期为这两种植物作为天然抗氧化剂在食品中的进一步应用提供参考。
1 材料和方法
1.1 材料与仪器
1.1.1 植物原料
马齿苋:于2017 年8 月采自北京;蒲公英:于2016 年8 月采自黑龙江。植物原料均清洗后于40 ℃低温烘至恒重,粉碎机粉碎后过60 目分析筛于密封袋中保存备用。
1.1.2 试验试剂
无水乙醇、氢氧化钠、盐酸、氨水(均为分析纯):北京北化精细化学品有限责任公司;硫代巴比妥酸(Thiobarbituric,TBA)、ABTS、DPPH:Sigma 公司;30 %过氧化氢、铁氰化钾(K3[Fe(CN)6])、过硫酸钾、氯化铁、三氯乙酸(trichloroacetic acid,TCA)、三羟甲基氨基甲烷盐酸盐(Tris-HCl)、焦性没食子酸、脱氧核糖、抗坏血酸、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA-2Na)、磷酸盐缓冲液(phosphate buffer solution,PBS):国药集团化学试剂有限公司;总抗氧化能力检测试剂盒FRAP 法(ferric reducing ability of plasma):碧云天生物技术研究所;乌头碱对照品:中国药品生物制品检定所提供;无水硫酸钠、邻苯二甲酸氢钾:西陇化工股份有限公司;溴麝香草酚蓝指示液:北京索莱宝科技有限公司;氯仿:北京化工厂。
1.1.3 试验仪器
DGG-9140A 型电热恒温鼓风干燥箱、DK-S26 型电热恒温水浴锅:上海森信实验仪器有限公司;YF114型高速中药粉碎机:江阴市新友机械制造有限公司;SY-1000E 型多用途恒温超声提取机:北京弘祥隆生物技术股份有限公司;Synergy H1 型全功能酶标仪:美国伯腾仪器有限公司;RE-2000 型旋转蒸发器:上海荣亚生化仪器厂;TDZ5-WS 型台式低速离心机:湖南赫西仪器装备有限公司;LGJ-18 型真空冷冻干燥机:北京松源华兴科技发展有限公司;HYQ-3110 涡旋混匀器:上海珂淮仪器有限公司。
1.2 试验方法
1.2.1 总生物碱含量的测定
称取一定质量的植物全草粗粉置于250 mL 的锥形瓶中,以一定的料液比加入一定浓度的乙醇,在一定温度和功率下,调至合适的pH 值,进行一定时间的超声提取,静置10 min,将上层提取液倒入离心管中,5 000 r/min 离心10 min,将离心后的提取液置于250 mL的锥形瓶中,使用相对应的乙醇浓度定容。取0.1 mL的提取液置于1 mL 比色管中,用一定浓度的乙醇定容至刻度,以相对应的乙醇浓度为空白,并在410 nm处测定提取液吸光值,根据标准曲线测植物中生物碱的提取率,提取率/%=(样品中生物碱的质量/药材质量)×100。
1.2.1.1 对照品溶液的配置
取精密称取12.0 mg 乌头碱对照品于50 mL 的容量瓶中,加1 mol/L 盐酸溶液数滴,溶解,加等量1 mol/L NaOH 溶液,用蒸馏水定容至50 mL 的刻度,摇匀,即得浓度为0.24 mg/mL 的对照品溶液。
1.2.1.2 绘制乌头碱标准曲线
精密量取乌头碱对照品液 0、0.35、0.40、0.50、0.80、1.00 mL,分别置于分液漏斗中,各加蒸馏水3.00、2.65、2.60、2.50、2.20、2.00 mL,加溴麝香草酚蓝指示液 2.0 mL,邻苯二甲酸氢钾-氢氧化钠(pH 6)缓冲液5.0 mL,加氯仿10 mL,振摇3 min,静置1 h,分取氯仿液,并加入0.5 g 无水硫酸钠,放置0.5 h,以第一份为空白,于410 nm 处测定吸收度。以吸光值(A)为纵坐标,乌头碱质量浓度(C)为横坐标,绘制标准曲线[9],结果如图1所示。回归方程相关系数R2=0.999 7,表明其具有良好的线性关系,可以作为标准曲线使用。
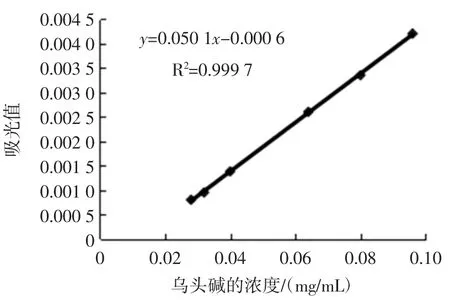
图1 乌头碱标准曲线Fig.1 Standard curve of aconitine
1.2.2 两种植物总生物碱提取条件的确定
以两种植物总生物碱提取率为优化指标,采用超声波破碎提取法考察乙醇浓度、料液比、提取溶剂pH值、超声时间、超声功率、超声温度6 种因素对两种植物总生物碱提取率的影响,确定适宜的两种植物的总生物碱提取条件。
具体操作:在设定好的各因素条件下,于400 mL 体系中超声波破碎提取,之后定容至400 mL,5 000 r/min,离心10 min,取上清液,检测总生物碱提取率。在确定的两种植物总生物碱适宜提取工艺条件下,进行3 次重复性验证试验。
1.3 两种植物总生物碱提取物抗氧化活性
1.3.1 样品的制备
根据适宜的两种植物总生物碱提取条件,获得两种植物总生物碱提取液,4 000 r/min,离心15 min,得到上清液,取上清旋转蒸发浓缩,于-80 ℃冷冻并真空冷冻干燥得到植物总生物碱提取物固态粉末,储存于4 ℃冰箱备用。
1.3.2 总抗氧化能力的检测
称取27.8mg 试剂盒提供的FeSO·47H2O,溶解并定容到1 mL,此时浓度即为100 mmol/L。取适量100 mmol/L FeSO4溶液稀释至 0.15、0.3、0.6、0.9、1.2、1.5 mmol/L。
于96 孔板的每个检测孔中加入180 μL FRAP 工作液(TPTZ 稀释液 150 μL+TPTZ 溶液 15 μL+检测缓冲液 15 μL),之后,空白对照孔中加入 5 μL 蒸馏水;标准曲线检测孔内加入5 μL 各种浓度的FeSO4标准溶液;样品检测孔内加入5 μL 各种样品,轻轻混匀,37 ℃孵育 3min~5 min 后在 593 nm 处测其吸光值,根据标准曲线计算出样品的总抗氧化能力。FeSO4标准曲线见图2。

图2 FeSO4 标准曲线Fig.2 Standard curve of FeSO4
1.3.3 ABTS+自由基清除试验
7 mmol/L ABTS 与 2.45 mmol/L 过硫酸钾以 9 ∶1体积比混合室温(20 ℃左右)下静置16 h,使用前稀释8倍作为ABTS 储备液。一系列质量浓度范围(1.6 μg/mL~1 000 μg/mL,无水乙醇溶解)样品中分别加入2.5 mL ABTS 储备液,混匀后避光反应20 min 并于波长734 nm处测定吸光值。以1 mL 双蒸水加ABTS 待用混合液作为空白对照。ABTS+自由基清除率/%=[(A1-A2)/A1]×100,其中:A1表示空白对照的吸光度;A2表示待测样品 ABTS 吸光度[10]。
1.3.4 DPPH 自由基清除试验
一定质量浓度范围(1.6 μg/mL~1 000 μg/mL,无水乙醇溶解)的样品,各取样品0.3 mL,分别加入2.7 mL,0.2 mmol/L 的DPPH(无水乙醇溶解),涡旋混匀,将配好的样品避光静置1 h 后在517 nm 处测其吸光度。以1 mL 无水乙醇代替提取物作为空白对照。DPPH 自由基清除率/%=[(A1-A2)/A1]×100,其中:A1表示空白对照的吸光度;A2表示待测样品DPPH 吸光度[11]。
1.3.5 超氧阴离子自由基清除试验
200 μg/mL 待测样品 1 mL 加入 Tris-HCl 缓冲液(pH 值 8.2,0.05 mol/L)4.5 mL 在 25 ℃下反应 10 min加入 0.003 mol/L 邻苯三酚(10 mmol/L 盐酸溶解)600 μL,充分反应后立即在波长325 nm 处测定吸光度,每隔30 s 测定一次吸光度,直至吸光值不在发生明显的变化,用10 mmol/L 盐酸代替样品作为空白对照。邻苯三酚的自氧化速率可以根据吸光度-时间曲线计算斜率[12]。
1.3.6 羟基自由基清除试验
反应体系中分别加入10 mmol/L 的2-脱氧核糖400 μL,氯化铁 (10 mmol/L)100 μL,EDTA-2Na(1 mmol/L)100 μL,30% 过氧化氢(10 mmol/L)100 μL,样品质量浓度(1.6 μg/mL~1 000 μg/mL)100 μL,再加入抗坏血酸(1 mmol/L)200 μL 引发反应,在 37 ℃下反应 1 h,加入 0.5%TBA 的氢氧化钠(0.025 mol/L)溶液1 mL 和 30%TCA 水溶液 1 mL,混合物 80 ℃水浴加热30 min,冷却。在532 nm 处测定吸光值,以0.05 mol/L PBS(pH 值7.4)在反应体系中代替样品作为空白对照测得吸光值,计算清除率。羟基自由基清除率/%=[(A1-A2)/A1]×100,其中:A1表示空白对照的吸光度;A2表示待测样品的吸光度[13]。
1.3.7 总还原能力检测
取待测样品20 mg 配制成400 μg/mL 样品溶液,分别取 50、100、150、200、250、300、350、400、450、500 μL样品溶液,加双蒸水至1 mL,分别加0.2 mol/L PBS(pH值 6.6)和 1 % K3[Fe(CN)6]各 2.5 mL,在 50 ℃下反应20 min,再加入 10%TCA 2.5 mL,3 000 r/min(r=3 cm)离心10 min,取上清液2.5 mL 加入双蒸水2.5 mL,加入0.1%氯化铁0.5 mL 混合,10 min 后在700 nm 处测定其吸光值A2,以不加样品的双蒸水同法操作作为空白对照测得其吸光值,增加的吸光值表示还原能力的增加[14]。
2 结果与分析
2.1 两种植物总生物碱提取条件的确定
2.1.1 乙醇浓度对总生物碱提取率的影响
分别考察乙醇浓度(55%、60%、65%、70%、75%、80 %)对两种植物总生物碱提取率的影响,结果见图3。
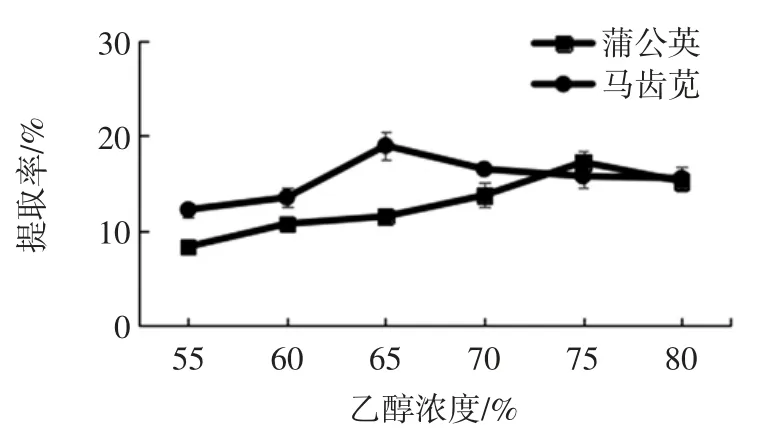
图3 乙醇浓度对两种植物总生物碱提取率的影响Fig.3 Effect of the ratio of volume percentage of ethonal on the extraction ratio of total alkaloids from two kinds of plants
随着乙醇浓度的增加,两种植物总生物碱提取率均呈现先增加后降低的趋势。当乙醇浓度为65%时,马齿苋总生物碱提取率最高,当乙醇浓度大于65%时,马齿苋总生物碱提取率呈现下降趋势;当乙醇浓度为75%时,蒲公英总生物碱提取率最高,当乙醇浓度大于75%时,蒲公英总生物碱提取率呈现下降趋势。其原因可能是增加乙醇量有利于生物碱的溶解。但当加乙醇量达到一定程度时,生物碱已全部溶解,所以继续增加乙醇量生物碱提取率不再增加[15]。因此确定蒲公英和马齿苋总生物碱提取适宜乙醇浓度分别为75%和65%。
2.1.2 料液比对两种植物总生物碱提取率的影响
在两种植物总生物碱提取适宜乙醇浓度下,分别考察料液比 1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)对两种植物总生物碱提取率的影响,结果见图4。
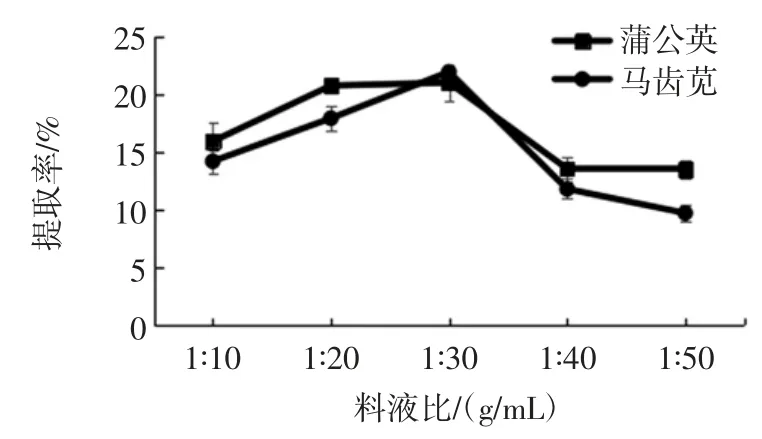
图4 料液比对两种植物总生物碱提取率的影响Fig.4 Effect of the ratio of solid to liquid on the extraction ratio of total alkaloids from two kinds of plants
由图4 中数据可以看出,随着溶剂量增加,两种植物总生物碱提取率增加,而当其料液比超过1 ∶30(g/mL)时,总生物碱提取率反而降低。这可能是因为植物中总生物碱的溶出已经达到饱和状态[16]。因此确定蒲公英和马齿苋适宜料液比均为1 ∶30(g/mL)。
2.1.3 提取溶剂pH 值对总生物碱提取率的影响
在两种植物总生物碱提取的适宜乙醇浓度和料液比条件下,分别考察提取溶剂 pH 值 4、5、6、7、8 对两种植物总生物碱提取率的影响,结果见图5。

图5 提取溶剂pH 值对两种植物总生物碱提取率的影响Fig.5 Effect of the ratio of extraction solvent pH value on the extraction ratio of total alkaloids from two kinds of plants
由图5 可知,当提取溶剂pH 值小于7.0 时,蒲公英、马齿苋总生物碱提取率随提取溶剂pH 值升高而增加,而大于7.0 时,总生物碱提取率反而降低。可以看出,弱酸及中性的pH 环境能提高植物生物碱化合物的提取效果,但碱性过大则起到相反的作用。因此蒲公英和马齿苋总生物碱提取的最佳提取溶剂pH 值均为7。
在两种植物总生物碱提取的适宜乙醇浓度、料液比和提取溶剂pH 值条件下,分别考察超声时间为20、25、30、35、40 min 对两种植物总生物碱提取率的影响,结果见图6。
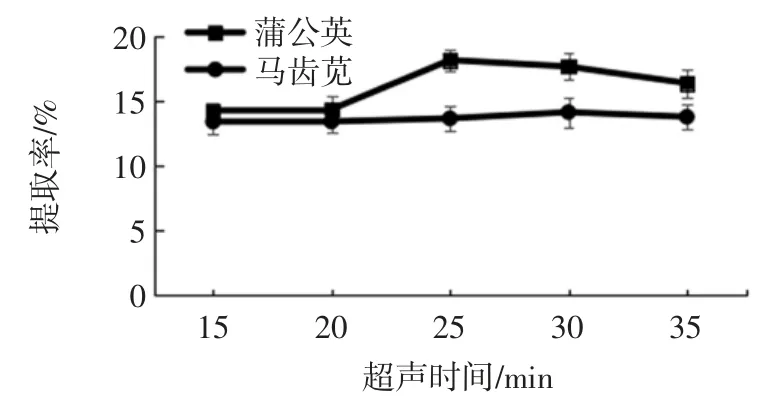
图6 超声时间对两种植物总生物碱提取率的影响Fig.6 Effect of the ratio of ultrasonic time on the extraction ratio of total alkaloids from two kinds of plants
由图6 能够看出蒲公英总生物碱提取率随着提取时间的延长而提高,当超声时间大于25 min 时,总生物碱提取率呈现降低的趋势;马齿苋总生物碱提取率在超声时间为30 min 时,其提取率最高,当超声时间大于30 min 时,马齿苋总生物碱提取率呈现降低的趋势。可能是因为生物碱在超声波的空化作用下,使生物碱的结构被破坏,从而导致生物碱的提取效果下降[16]。因此蒲公英和马齿苋总生物碱适宜提取时间分别为 25 min 和 30 min。
2.1.5 超声功率对两种植物总生物碱提取率的影响
在两种植物总生物碱提取的适宜乙醇浓度、料液比、提取溶剂pH 值和超声时间条件下,考察超声功率(400、500、600、700、800 W)对两种植物总生物碱提取率的影响,结果见图7。

图7 超声功率对两种植物总生物碱提取率的影响Fig.7 Effect of the ratio of ultrasonic power on the extraction ratio of total alkaloids from two kinds of plants
图7 中结果显示随着超声功率的增加,两种植物总生物碱提取率随之升高,至700 W 后,总生物碱提取率随之降低。其原因可能是因为超声波具有较强的机械剪切作用,过高的超声波功率破坏了生物碱的结构,因而降低了生物碱提取得率[17]。因此蒲公英和马齿苋总生物碱提取适宜超声功率均为700 W。
2.1.6 超声温度对两种植物总生物碱提取率的影响
在两种植物总生物碱提取的最适乙醇浓度、料液比、提取溶剂pH 值、超声时间和超声功率条件下,考察超声温度(45、50、55、60、65 ℃)对两种植物总生物碱提取率的影响,结果见图8。
3.学区。2014年,学区为成人教育提供的资金为44.7亿欧元,相当于国家总支出的14%。随着学区管理权限的增强,其在职业培训和教育融资方面的参与程度显著提高。但是,具体的参与程度学区间有所不同,因为不同的学区有权依据当地的社会、经济状况决定教育政策的优先次序。学区的财政资助主要用于年轻人的职业教育和培训,占比达到42%。
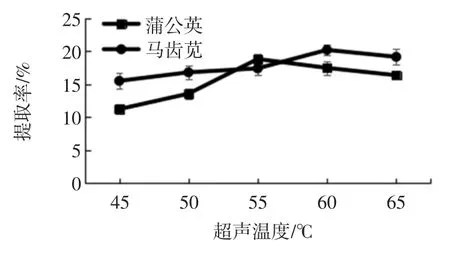
图8 超声温度对两种植物总生物碱提取率的影响Fig.8 Effect of the ratio of ultrasonic temperature on the extraction ratio of total alkaloids from two kinds of plants
由图8 能够看出,两种植物总生物碱提取率随温度的升高呈现先增后减的趋势。当温度为55 ℃时,蒲公英总生物碱提取率最高,当温度大于55 ℃时,蒲公英总生物碱提取率呈现下降趋势。当温度为60 ℃时,马齿苋总生物碱提取率最高,当温度大于60 ℃时,马齿苋总生物碱提取率随着温度的升高而下降。可能是温度太高会使生物碱的结构不稳定,发生分解,且温度太高,乙醇挥发严重,也会影响生物碱的提取[18]。因此蒲公英和马齿苋总生物碱提取适宜超声温度分别为 55 ℃和 60 ℃。
2.1.7 两种植物总生物碱适宜提取条件验证
按照上述两种植物总生物碱提取适宜条件,进行3 次验证试验,两种植物总生物碱提取率差异不显著,结果如表1 所示。
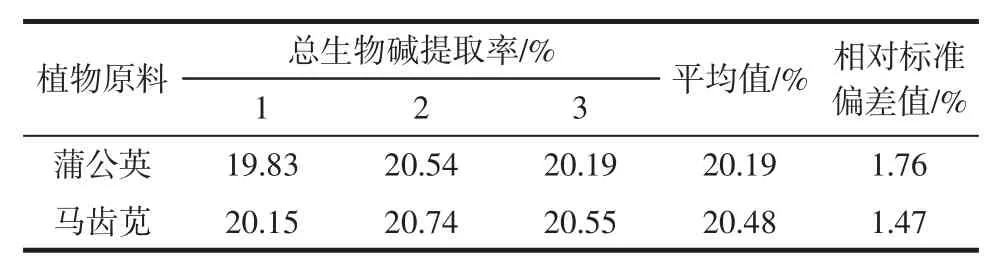
表1 两种植物总生物碱提取适宜条件Table 1 Suitable conditions for extraction of total alkaloids from three plants
2.2 两种植物总生物碱抗氧化活性比较
2.2.1 总抗氧化能力
两种植物总生物碱提取物的总抗氧化能力见图9。
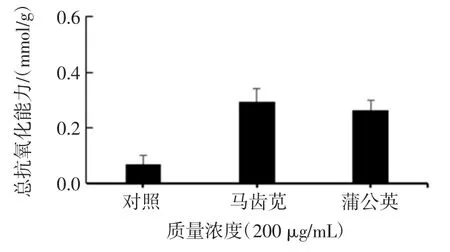
图9 两种植物总生物碱提取物的总抗氧化能力Fig.9 The total antioxidant capacity of total alkaloids extract from two kinds of plants
由图9 可以看出,在相同质量浓度(200 μg/mL)下,两种植物总抗氧化能力为马齿苋总生物碱提取物大于蒲公英总生物碱提取物。
2.2.2 ABTS+自由基清除试验
两种植物总生物碱提取物对ABTS+自由基的清除能力见图10。

图10 两种植物总生物碱提取物对ABTS+自由基的清除能力Fig.10 The scavenging ability of total alkaloids extract from two kinds of plants to ABTS+free radical
由图10 可以看出,两种植物的总生物碱提取物对ABTS+自由基的清除率随着浓度的增加而增强。当质量浓度为1.6 μg/mL 时,两种植物的总生物碱提取物对ABTS+自由基的清除能力没有明显的差异;当质量浓度为 8 μg/mL~1 000 μg/mL 时,对 ABTS+自由基的清除能力为蒲公英总生物碱提取物大于马齿苋总生物碱提取物。
2.2.3 DPPH 自由基清除试验
两种植物总生物碱提取物对DPPH 自由基的清除能力见图11。

图11 两种植物总生物碱提取物对DPPH 自由基的清除能力Fig.11 The scavenging ability of total alkaloids extract from two kinds of plants to DPPH free radical
由图11 可知,两种植物总生物碱提取物随着浓度的增加对DPPH 自由基的清除能力增强;当质量浓度在 1.6 μg/mL~1 000 μg/mL 范围内对 DPPH 自由基的清除能力为蒲公英总生物碱提取物大于马齿苋总生物碱提取物。
2.2.4 超氧阴离子自由基清除试验
两种植物总生物碱提取物对超氧阴离子的清除能力见图12。

图12 两种植物总生物碱提取物对超氧阴离子的清除能力Fig.12 The scavenging ability of total alkaloids extract from two kinds of plants to superoxide anion
本研究采用经典的邻苯三酚自氧化法评价两种植物总生物碱对超氧阴离子自氧化的抑制作用[19]。由图12 可知,蒲公英和马齿苋总生物碱提取物的自氧化速率分别为 2.93×10-2OD/min 和 3.00×10-2OD/min,因此,超氧阴离子自氧化的抑制作用强弱为马齿苋总生物碱提取物大于蒲公英总生物碱提取物。
2.2.5 羟基自由基清除试验
两种植物总生物碱提取物对羟基自由基的清除能力见图13。
由图13 可知,两种植物总生物碱提取物对羟自由基的清除率随着浓度的增加而增强。当两种植物总生物碱提取物质量浓度为1.6 μg/mL~1 000 μg/mL 范围内,对羟基自由基的清除率为蒲公英总生物碱提取物大于马齿苋总生物碱提取物。

图13 两种植物总生物碱提取物对羟基自由基的清除能力Fig.13 The scavenging ability of total alkaloids extract from two kinds of plants to hydroxyl free radical
2.2.6 总还原能力
两种植物总生物碱提取物的总还原能力见图14。

图14 两种植物总生物碱提取物的总还原能力Fig.14 The total reduction capacity of total alkaloids extract from two kinds of plants
由图14 可知,两种植物总生物碱提取物的总还原能力随着浓度的增加而增强。在20 μg/mL~200 μg/mL 浓度范围内,两种植物总生物碱提取物总还原能力为马齿苋总生物碱提取物大于蒲公英总生物碱提取物。
3 结论
本文对两种人们日常喜食的药食同源植物的总生物碱提取率及抗氧化作用进行了比较分析,测定了两种植物总生物碱提取率和抗氧化活性。结果表明,蒲公英和马齿苋总生物碱的提取率分别为20.19%和20.48%,两种植物的总生物碱提取率几乎没有差异。当两种植物总生物碱提取物质量浓度为200 μg/mL时,总抗氧化能力为马齿苋总生物碱提取物大于蒲公英总生物碱提取物;质量浓度为1.6 μg/mL 时,两种植物的总生物碱提取物对ABTS+自由基的清除能力没有明显的差异;质量浓度为 8 μg/mL~1 000 μg/mL 时,对ABTS+自由基的清除能力为蒲公英总生物碱提取物大于马齿苋总生物碱提取物;质量浓度为1.6 μg/mL~1 000 μg/mL 时,对DPPH 自由基的清除能力为蒲公英总生物碱提取物大于马齿苋总生物碱提取物;超氧阴离子自氧化的抑制作用强弱为马齿苋总生物碱提取物大于蒲公英总生物碱提取物;质量浓度为1.6 μg/mL~1 000 μg/mL 时,对羟基自由基的清除率为蒲公英总生物碱提取物大于马齿苋总生物碱提取物;质量浓度为20 μg/mL~200 μg/mL 时,总还原能力为马齿苋总生物碱提取物大于蒲公英总生物碱提取物。本文证明了这两种植物提取物具有良好的抗氧化活性,人们可以经常食用,可作为潜在天然抗氧化剂在食品中的进一步应用提供参考。
