黑质注射LPS构建亚急性帕金森病模型的评价
2020-03-20刘家岐楚世峰陈乃宏张大永
刘家岐,赵 明,楚世峰,陈乃宏,张大永
(1.中国药科大学药物科学研究院,南京 210009;2. 北京医院药学部,北京 100730;3.中国医学科学院神经科学中心,北京 100050)
帕金森病(Parkinson’s disease, PD)是导致中老年人致死致残的主要神经退行性疾病之一。PD患者常伴有震颤和运动迟缓等运动症状[1],并以黑质处多巴胺(dopamine,DA)能神经元进行性变性丢失和黑质致密部残存的神经元内出现路易小体[α-突触核蛋白(α-synuclein,α-Syn)为其主要成分]为主要病理特征[2]。帕金森病的发病机制有很多,其中神经炎症(主要指小胶质细胞的快速激活)和PD发病过程之间存在着重要的联系[3]。
目前公认的研究炎症机制最常用的PD模型是脂多糖(lipopolysaccharide,LPS)动物模型[4]。最初的LPS腹腔注射小鼠模型[5, 6],因外周注射的LPS不能通过血脑屏障,且并不专一性地刺激黑质部位的小胶质细胞,而具有造模周期长,专一性不强等缺点。相比之下,黑质部位定位注射LPS就可以特异性地激活黑质区域的小胶质细胞,排除因其他神经退行性疾病特征脑区的小胶质细胞激活而带来的干扰。再者,Castao等[7]早在1998年建立的LPS经单侧黑质诱导的PD大鼠模型中,只观察了黑质内DA能神经元和小胶质细胞的变化,却缺少对PD标志性病理指标α-Syn的检测。
本研究采用脑内置管微量给药系统在双侧黑质连续5 d注入LPS,建立亚急性PD小鼠模型,发现该PD小鼠模型不仅具备PD样行为,神经炎症反应,而且可模拟PD的病理学特征,显著提升中脑内α-Syn的单体、寡聚体和磷酸化水平,为从神经炎症解析PD病理学改变提供了潜在的动物模型,也为炎症靶点抗PD药物的研发奠定了理论的基础。
1 材料
1.1 动物60只健康的♂ C57/BL小鼠,购自北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2014-0023。体质量(25~30) g,鼠龄9~10周,清洁级。所有动物饲养于明暗交替的中国医学科学院药物研究所动物房,湿度55%±5%,温度(22.0±2.0) ℃,实验过程中自由进食饮水。
1.2 试剂LPS(Sigma-Aldrich公司,批号:028M 4094V)、anti-β-actin(Sigma-Aldrich公司); anti-α-Syn、anti-TH(Santa Cruz 公司); α-Syn 5G4(Millipore 公司);p-α-Syn(Abcam公司);HRP 标记的二抗(KPL公司);DAB显色液(北京中杉金桥);生理盐水(四川科伦,批号:M18062105-2);TRIzol(Invitrogen公司,批号:248201);氯仿、异丙醇(北京市通广精细化工公司,批号:20181015);TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒(北京全式金,批号:N20426)、TransStart Tip Green qPCR Supermix试剂盒(北京全式金,批号:N10710);RIPA裂解液、BCA蛋白定量试剂盒、ECL超敏发光液(北京普利莱)。
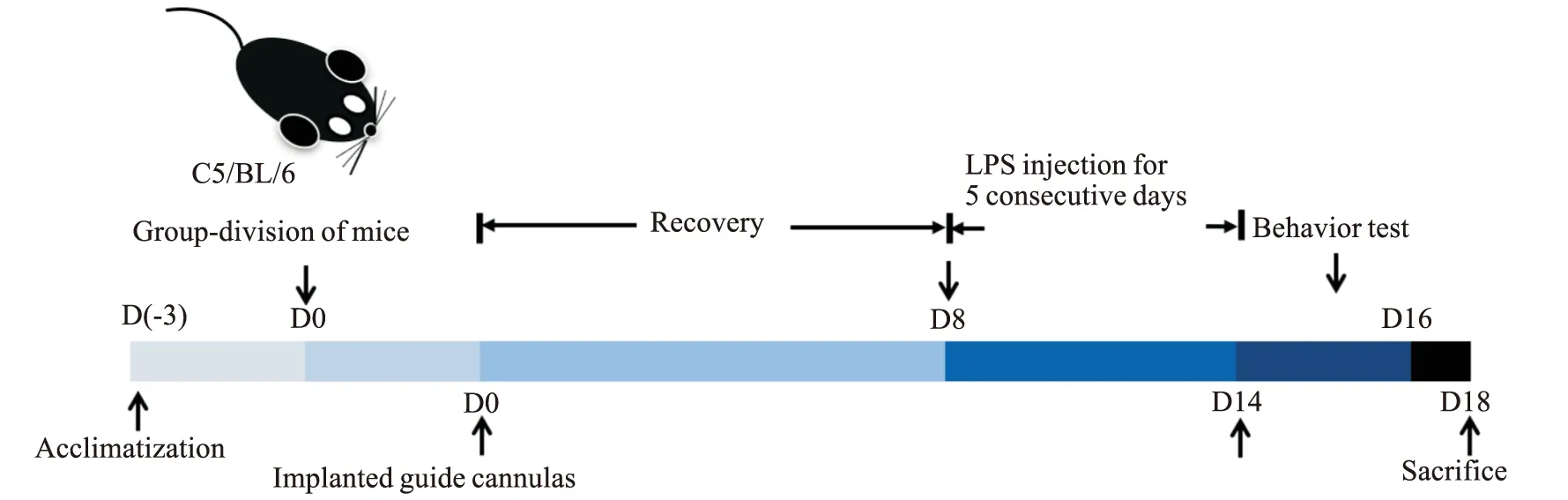
Fig 1 Scheme of experimental procedure
1.3 仪器与设备小动物麻醉机、双管微量给药系统、大小鼠脑立体定位仪(深圳瑞沃德)、微量注射泵(保定雷弗流体公司)、冰冻切片机(Leica公司)、Image Quant LAS 4000 min影像分析仪(GE公司)、台式冷冻离心机(Sigma公司)、酶标仪(Thermo公司)、大小鼠转棒仪(IITC Life Science公司)、YLS-13A大小鼠拉力测定仪(济南益延公司)、LineGene 9600 Plus 荧光定量PCR检测系统(杭州博日公司)。
2 方法
2.1 PD小鼠模型制备及分组60只小鼠适应1周后开展行为学训练,剔除掉四肢运动不协调的小鼠后随机分组。空白组,20只,不给予任何处理。模型组,20只,双侧黑质注入溶于生理盐水的脂多糖溶液(2.5 μg/侧)。溶剂组,20只,在脑内相同的位点处注入无菌生理盐水。对溶剂组和模型组的小鼠进行异氟烷气体麻醉后,在黑质处植入双位点的脑内导管(AP-3.28 mm,ML-1.50 mm,DV-4.60 mm),并用牙托水泥固定在颅骨上。埋管结束休息8 d后,使用5 μL微量注射器通过注射内管向模型组小鼠黑质内注入LPS溶液(每侧2 μL),注射完成后针头继续保持5 min,防止液体溢出而影响模型的建立。LPS溶液连续给予5 d,每天注射的时间一致。溶剂组以同样的方法注入无菌的生理盐水。实验进程如Fig 1所示。
2.2 行为学检测LPS连续注射5 d后,对各组小鼠进行滚轴实验、爬杆实验和抓力实验的行为学检测。所有行为学实验均置于安静的动物实验操作间内进行。
2.2.1滚轴实验 将小鼠置于转棒仪上通过小鼠在转棒上的潜伏时间来评价小鼠的运动协调能力[8]。参数设置为初始速度5 r·min-1,终止速度30 r·min-1,匀加速运行5 min。小鼠按照与转棒相反的运行方向运动,一共测量3次并取平均值来分析,每次间隔30 min以上。
2.2.2爬杆实验 各组小鼠通过测试其在自制爬杆设备上的爬下时间来检测小鼠肢体的协调能力[9]。爬杆装置由缠有纱布的长50 cm直径1 cm的木杆组成,木杆顶端有一小木球。将自制的爬杆装置底部与木杆垂直,并放置于大的饲养笼中,底部用垫料覆盖。记录各组小鼠3次的爬下时间并取平均值,每次测量间隔30 min以上。
2.2.3抓力实验 将小鼠抓力测定仪水平放置于实验操作台,确保抓力板呈水平方向运动。将小鼠轻轻地放在抓力板上,手持小鼠尾部均匀用力后拉,直到小鼠松开前肢,在仪器上记录下小鼠的抓力。每只小鼠测定6次抓力,并取平均值用于后续统计分析。
2.3 组织样本及切片制备取每组的10只小鼠麻醉后固定在灌流操作台上,剪开肋骨,暴露心脏,用灌满0.01 mol·L-1PBS的注射针头经心脏灌流,剪开右心耳,待肝脏变白后,换为4%的多聚甲醛(paraformaldehyde,PFA)溶液进行灌注固定。四肢僵硬后,对小鼠进行断头取脑,小心地将脑组织剥离至装有4% PFA溶液的样本瓶中固定24 h。而后,将小鼠全脑组织用质量分数为10%、20%、30%的蔗糖PFA溶液进行梯度脱水。包埋剂保护后,将脑组织置于冷冻切片机内进行20 μm冠状切片的制备。每只小鼠的平均地从黑质头侧至尾侧选取30张制备冰冻切片,储存于-20 ℃冰箱。剩余每组的10只小鼠取中脑和纹状体组织冷冻于-80 ℃冰箱储存。
2.4 免疫组织化学检测将冰冻切片置于37 ℃烘箱平衡30 min后,浸泡在抗原修复液内热修复10 min。冷却至室温后,用0.01 mol·L-1PBS溶液洗涤3次,每次5 min。接下来,用1% Triton-100 PBS溶液室温浸泡10 min。洗涤3次后,用3%的过氧化氢室温避光孵育10 min。再次洗涤3次,用5%的BSA封闭30 min。封闭液清除后,切片用酪氨酸羟化酶(tyrosine hydroxylase,TH)(1 ∶400),离子钙接头蛋白1(ionized calcium binding adapter molecule-1,IBA-1) (1 ∶200) 的一抗4 ℃孵育过夜。PBST缓冲液洗涤3次后,滴加用辣根过氧化酶标记的二抗室温孵育2 h。再次洗涤3次后,使用DAB显色试剂盒显色。切片梯度酒精脱水后,在二甲苯 Ⅰ(Ⅱ)中各浸泡5 min,在切片上滴加中性树脂封片。在显微镜下观察,拍摄代表性的图片,用Image pro Plus6.0软件进行统计分析。

Fig 2 Behavioral results of three groups of mice
A: Rotarod test:the latent time.B: Pole test: the climbing down time. C:Grip strength test: the grip strength.##P<0.01vsvehicle group
2.5 实时定量PCR分析使用TRIzol从中脑组织中提取总RNA,用Nano核酸定量仪测定RNA的浓度及纯度。使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒将RNA全部逆转录为cDNA。使用TransStart Tip Green qPCR Supermix试剂盒将1 μg RNA合成的cDNA用AB 7900HT快速实时定量PCR系统进行cDNA的扩增。并采用ΔΔCT的相对定量方法进行统计分析。每种目标基因的引物见Tab 1。
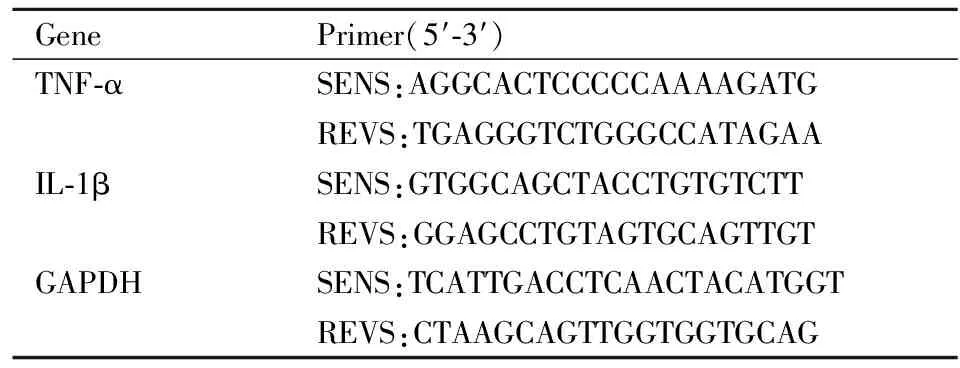
Tab 1 Primers for qPCR analysis
2.6 蛋白免疫印迹分析使用RIPA裂解液从中脑组织中提取出蛋白上清,并用BCA试剂测定浓度。采用SDS-PAGE电泳分离蛋白质(每个30 μg),转移到PVDF膜上。PVDF膜用质量分数为5%的 BSA室温封闭2 h后,孵育一抗4 ℃冰箱中过夜:抗α-synuclein (1 ∶200),抗α-synuclein(5G4)(1 ∶1 000),抗磷酸化α-synuclein(1 ∶500)和内参β-actin(1 ∶1 000)。TBST缓冲液洗涤3次后,室温孵育各自条带对应的二抗2 h。洗涤3次后,室温孵育三抗(1 ∶5 000)1 h。再次洗涤3次后,用ECL发光试剂盒将膜条带化学曝光并用影像分析仪扫描记录图像。用Image J软件进行进一步的条带定量分析。
靶向抗肿瘤单克隆抗体类药物联合常规化疗方案治疗转移性结直肠癌的临床进展 ………………………… 赵源浩(14):2012
3 结果
3.1 双侧黑质注射LPS可诱导小鼠出现PD样行为学障碍静止性震颤是PD典型的运动障碍,在小鼠上表现为运动协调性的降低。如Fig 2所示,在滚轴实验中,与溶剂组相比,模型组小鼠在滚轴上的潜伏时间显著缩短(P<0.01),从爬杆顶端到底端的用时显著延长(P<0.01)和基础抓力明显变小(P<0.01)。与空白组相比,溶剂组小鼠的潜伏时间、爬下时长和基础抓力无显著的变化,表明本实验的造模方法对小鼠不产生行为学的改变。
3.2 双侧黑质注射LPS诱导小鼠黑质DA能神经元受损为了确定小鼠的整个黑质中DA能神经元丢失的程度和模式,对溶剂组和模型组中各一只小鼠的30张黑质切片进行全部免疫组化染色,计数并统计每一张黑质切片中DA能神经元的数目。统计结果如Fig 3所示。因此,在后续的实验中,我们选取30张切片中的第10到第15张黑质切片进行染色分析。
如Fig 4所示,模型组小鼠黑质致密部的DA能神经元的数目对比溶剂组显著减少,并具有统计学差异(P<0.01)。溶剂组黑质处多巴胺能神经元的个数与空白组的数目相近,无统计学差异。
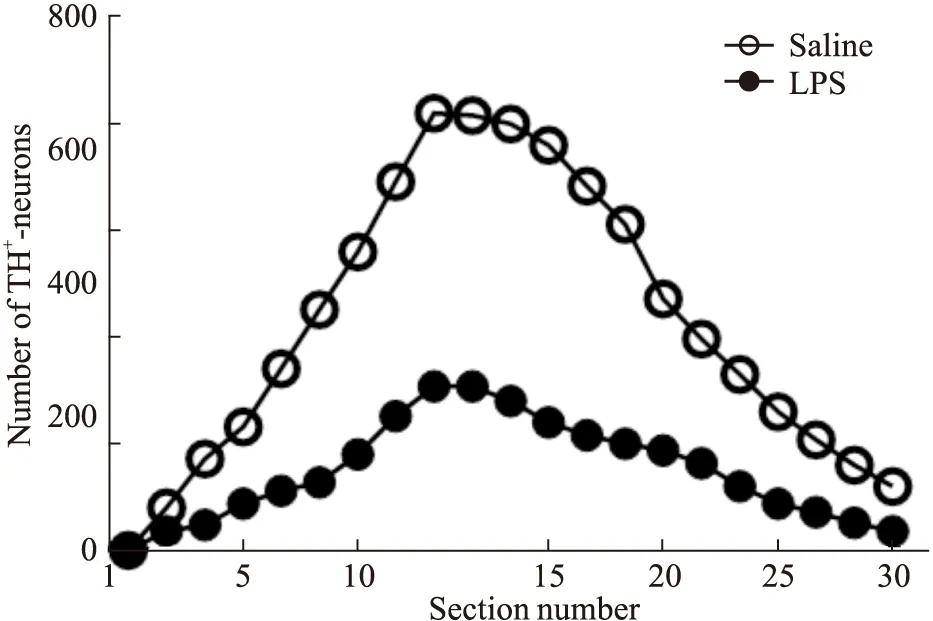
Fig 3 Quantitative analysis of LPS-induced loss
Thirty coronal sections from rostral to caudal were taken from brains injected intranigrally with saline (2 μL) or LPS (2 μL; 5 days) and immunostained with an anti-TH antibody. The number of TH-positive neurons in the SN was visually counted under a microscope. The results shown are from one representative set of sections from one brain, and similar results were obtained with sections from two other brains.

Fig 4 Effect of LPS on TH expression in midbrain
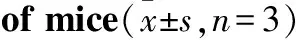
A:Representative photomicrograph of TH-immunoreactive neurons across groups. (scale bar = 400 μm) B: A histogram representing the quantitative analysis of TH-positive cells normalized to control levels is shown.##P<0.01vsvehicle group
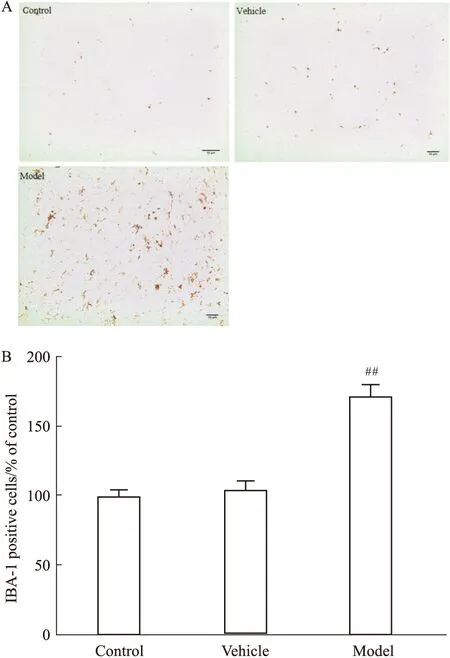
Fig 5 Effect of LPS on activation state of microglia
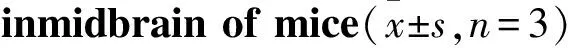
A: Representative photomicrograph of IBA-1-immunoreactive cells across groups. (scale bar=400 μm) B: A histogram representing the quantitative analysis of IBA-1-positive cells normalized to control levels is shown.##P<0.01vsvehicle group
3.3 双侧黑质注射LPS可诱导小鼠黑质内小胶质细胞的激活小胶质细胞是介导神经炎症反应过程中起着非常重要作用的神经胶质细胞。如Fig 5所示,LPS的暴露造成了模型组小鼠黑质部位的小胶质细胞大量激活。与溶剂组相比,模型组小鼠黑质区域IBA-1免疫阳性的小胶质细胞数目显著增加(P<0.01),且具有统计学差异。而溶剂组小鼠黑质IBA-1免疫阳性小胶质细胞的数目对比空白组,无明显的统计学差异。
3.4 双侧黑质注射LPS可诱导小鼠中脑内炎症因子mRNA的表达上调我们运用实时定量PCR技术观察小鼠中脑内促炎性细胞因子mRNA的表达变化。如Fig 6所示,和溶剂组相比,LPS炎症PD模型小鼠中脑内炎症因子TNF-α (P<0.01)和IL-1β (P<0.01)的mRNA表达水平显著上调,且具有统计学差异。同样,溶剂组小鼠中脑内炎症因子的表达水平与空白组无显著的差异。
3.5 双侧黑质注射LPS可诱导小鼠中脑内不同形式的α-Syn表达增加如Fig 7A和7B所示,我们采用Westernblot 方法检测了单体形式的 α-Syn、寡聚体形式的α-Syn(5G4)和磷酸化形式的 α-Syn(Ser129)在小鼠黑质部位的表达。和溶剂组相比,模型组小鼠黑质部位单体形式的α-Syn的蛋白表达显著增加(P<0.01)。同样地,LPS的作用使小鼠黑质部位磷酸化形式的α-Syn表达明显上调(P<0.01)。接下来,我们进一步用α-Syn(5G4)来更全面地检测小鼠黑质部位中的α-Syn。如Fig 7C所示,模型组小鼠黑质部位的聚集化的α-Syn表达增加,与溶剂组相比具有统计学差异(P<0.01)。而溶剂组小鼠中脑内单体形式、寡聚体形式和磷酸化形式的α-Syn的表达水平与空白组相比差异无显著性。
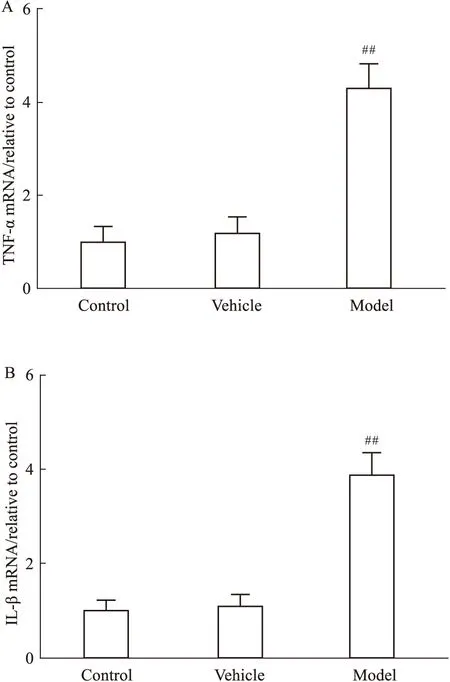
Fig 6 Effect of LPS on mRNA expression of TNF-α and
A: TNF-α; B: IL-1β. The relative mRNA level was normalized to GAPDH mRNA.##P<0.01vsvehicle group
4 讨论
本次研究中,考虑到多次连续定位注射LPS至小鼠的黑质,容易因机械手术损伤而增加死亡率,于是我们引入了双位点脑内置管微量给药系统,对传统的LPS大鼠模型建立方法进行了优化改进[10],大大降低了连续多次黑质处注射造成的死亡率,也减少了连续多次的注射位点误差。
在本次的研究结果中,行为学结果显示,LPS模型组小鼠的滚轴潜伏期显著缩短、爬下时间延长和前肢的抓力显著下降,表明LPS造模后的小鼠运动协调性差、运动变迟缓和肌肉张力下降。同时,模型组小鼠表现出肢体僵硬、姿态不稳及一些震颤的迹象,与PD患者的临床运动症状相符[11]。
本实验的病理学结果同样也表明,模型组小鼠黑质致密部的DA能神经元受损严重、大量小胶质细胞激活和黑质内炎症因子mRNA的水平上调显著。在LPS经黑质注射的大鼠模型的研究中,Castao等[7]已经发现LPS可以造成大鼠黑质部位多巴胺能神经元的不可逆性损毁。大多数PD病人的尸检结果也已经表明[12],患者脑内存在大量的激活态小胶质细胞。小胶质细胞是介导神经炎症反应的胶质细胞中重要的组成部分,对其激活状态的检测有助于判断LPS是否在小鼠黑质处产生炎症[13]。而其分泌的TNF-α和 IL-1β 等致炎性细胞因子可以导致多巴胺能神经元的变性,是神经炎症造成PD样病理表现的重要机制。因此,本亚急性PD小鼠的病理结果与PD患者的尸检结果相符,此炎症PD模型建立成功。
在PD的病因探究过程中,Spillantini等[14]在1997年最先在PD患者脑内观察到α-Syn这种神经元蛋白。并且目前普遍认为 α-Syn是PD的重要病理及诊断特征的重要蛋白标志,它的异常聚集与PD的发生发展密切相关。针对α-Syn三种不同的形式,我们运用相应的抗体对三组小鼠黑质部位的α-Syn进行了检测。蛋白免疫印迹结果表明,LPS经黑质诱导的小鼠中脑内单体形式、寡聚体形式和磷酸化形式的α-Syn的蛋白表达水平增加。且已有文献报道[15],磷酸化α-Syn水平增加可以引起DA能神经元的毒性损伤。因此,本次建立的LPS亚急性PD小鼠模型不仅成功模拟了PD样的行为学障碍和炎症相关的PD病理学改变。更是观察到模型组小鼠在PD典型脑区黑质内出现α-Syn的聚集和异常改变等PD的诊断性指标,使此亚急性PD模型的专一性更强,此炎症PD模型的建立更具意义。
综上所述,LPS经黑质诱导的小鼠可以出现PD样运动障碍,PD样病理表现和PD诊断标志蛋白。此神经炎症的亚急性PD小鼠模型模型持续、稳定且造模时间短,为抗PD新药的临床前筛选提供了新途径,也为PD免疫炎症发病机制的探究过程中转基因小鼠的使用奠定了基础。

Fig 7 Effects of LPS on α-synuclein expression in midbrain of
A: Representative protein bands of α-synuclein detected by α-synuclein and β-actin and a histogram representing the quantitative analysis of α-synuclein levels normalized to β-actin protein levels are shown. B: Representative protein bands of α-synuclein detected by p-α-synuclein and β-actin and a histogram representing the quantitative analysis of p-α-synuclein levels normalized to β-actin protein levels are shown. C: Representative protein bands of α-synuclein detected by α-synuclein(5G4) and β-actin and a histogram representing the quantitative analysis of α-synuclein(5G4) levels normalized to β-actin protein levels are shown.##P<0.01vsvehicle group
