丹参茎叶酚酸组分对溃疡性结肠炎模型小鼠的干预作用
2020-03-20彭珂毓顾俊菲宿树兰郭建明钱大玮段金廒
彭珂毓,顾俊菲,宿树兰,朱 悦,郭建明,钱大玮,段金廒
(南京中医药大学1.江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室、2.基础医学院中药学教研室,江苏 南京 210023)
溃疡性结肠炎(ulcerative colitis,UC)是由宿主胃肠道微生物群落的异常免疫应答引起的慢性特发性疾病,是炎症性肠病(inflammatory bowel disease,IBD)的重要临床亚型,其病因和发病机制不明。近年来,UC的发病率急剧上升且已不再局限于西方国家。在我国,随着人们生活环境与方式的改变,UC的患病率逐年增加[1]。氨基水杨酸类、免疫抑制剂和糖皮质激素等为临床治疗UC的常用药物,长期应用均具有不同程度的副作用[2]。丹参茎叶总酚酸具有保护糖尿病肾病、糖尿病肠病和改善心血管疾病等多种药理活性[3-4],其中丹酚酸类成分具有良好的抗炎活性,能够修复肠屏障损伤,调节肠道微生物紊乱,增加肠道短链脂肪酸含量,达到对结肠炎的保护治疗作用[5-6]。课题组前期研究发现,丹参茎叶中含丰富的酚酸类成分,尤以丹酚酸B和迷迭香酸为主,二者总含量与根中SAB和RA总含量相近,但两者含量比例与根中不同。随着丹参大宗产业不断开发利用,带来极大的经济效益的同时,在生产过程中产生的大量未被利用的丹参茎、叶,也带来了沉重的环境负担和资源浪费,亟待寻找合理的丹参茎叶资源化利用途径。
本研究采用葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的UC小鼠模型,从综合改善症状和降低炎症反应方面研究丹参茎叶总酚酸及其所含丹酚酸B和迷迭香酸对UC模型小鼠的干预作用,以明确丹参茎叶抗UC的生物效应,为丹参茎叶的进一步开发利用提供科学依据。
1 材料及仪器
1.1 实验动物SPF级C57BL/6小鼠130只,♂,体质量(24±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(苏)2016-0003。
1.2 主要试剂柳氮磺吡啶肠溶片(上海信谊天平药业有限公司,批号09170617);丹参根总酚酸(西安小草植物科技有限责任公司,XC20170205);丹酚酸B和迷迭香酸(南京春秋生物工程有限公司,DFSB20170915、MDXS20180521),原儿茶醛和芦丁(中国食品药品检定研究所,110810-201007、100080-201409),丹参素、丹酚酸A、丹酚酸C、异槲皮苷、山奈酚-3-0-芸香糖苷和紫云英苷(北京普天同创生物科技有限公司,MUST-13030108、MUST-13030701、MUST-15011305、MUST-15070211、MUST-16041507、MUST-13092006),纯度均大于98%;DSS(MPBIO公司,批号Q4299);小鼠IL-6(货号H007)、小鼠IL-4(货号H005)、小鼠肿瘤坏死因子-α(TNF-α,货号H052)试剂盒均购自南京建成生物有限公司。RNA逆转录试剂盒(Lot#N10227)和qPCR试剂盒(Lot#M31107)均购自TransGene公司。
1.3 仪器ACQUITY UPLC系统(Waters,美国);ML204及MS-20S型分析天平(METTLER TLEDO,中国);多功能酶标仪(PerkinElmer,美国);ABI 7500实时定量PCR(Applied Biosystems,美国);RM2016病理切片机(Leica,德国);正置光学显微镜(Nikon,日本)。
2 方法
2.1 丹参茎叶总酚酸的制备丹参茎叶样品于2018年7月采集于陕西铜川,60 ℃烘干除杂后,粉碎成粗粉(40目)。称取丹参茎叶样品400 g,参考文献[7]提取方法制备得到丹参茎叶总酚酸,-30 ℃冰箱保存。
2.2 丹参茎叶总酚酸的成分分析
2.2.1色谱条件 采用UPLC对制备所得的丹参茎叶总酚酸和购买所得丹参根总酚酸进行含量测定。色谱柱为ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm),流动相为0.1%甲酸水(A)-乙腈(B),以0.4 mL·min-1的恒定流速进行梯度洗脱,进样体积2 μL,柱温35 ℃。洗脱条件为0~1 min,95%→95% A;1~3 min;95%→90% A;3~7 min,90%→85% A;7~11 min,85%→79% A;11~15 min,79%→67% A;15~17 min,67%→30% A;17~18 min,30%→20% A;18~20 min, 20%→20%;20~21 min,20%→95%)。酚酸类成分检测波长为280 nm;黄酮类成分检测波长为254 nm。
2.2.2对照品溶液的制备 精密称取丹参素、原儿茶醛、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A、丹酚酸C、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷及紫云英苷对照品适量,用90%甲醇配置成丹参素0.169 g·L-1、原儿茶醛0.245 g·L-1、迷迭香酸0.593 g·L-1、紫草酸0.127 g·L-1、丹酚酸B 0.271 g·L-1、丹酚酸A 0.138 g·L-1、丹酚酸C 0.103 g·L-1、芦丁0.331 g·L-1、异槲皮苷0.147 g·L-1、山奈酚-3-O-芸香糖苷0.218 g·L-1及紫云英苷0.217 g·L-1的混合对照品溶液。
2.2.3供试品溶液的制备 精密称取丹参茎叶总酚酸和丹参根总酚酸适量,加入90%甲醇,混匀,离心取上清液过0.22 μm滤膜,即得供试品溶液。
2.2.4线性关系、最低检测限和最低定量限试验 取混合对照品溶液,分别稀释2、10、20、100、200倍进样,以峰面积为纵坐标(Y),对照品的质量浓度为横坐标(X)绘制各对照品标准曲线,线性回归得各化学成分的回归方程、相关系数及线性范围。最低检测限(limit of detection,LOD)和最低定量限(limits of quantification,LOQ)分别在各化合物的信噪比为3和10时测定。
2.2.5精密度、重复性和稳定性考察 精密度试验:精密吸取混合对照品液连续进样6次,计算各成分的峰面积的相对标准偏差(relative standard deviation,RSD)。重复性试验:精密称取丹酚茎叶总酚酸适量,按“2.2.3”项条件平行制备6份供试品溶液进样测定,计算各成分峰面积的RSD。稳定性试验:取供试品溶液分别在0、2、4、6、8、12、24 h进样分析,计算各成分峰面积的RSD。
2.2.6加样回收率考察 精密称取丹酚茎叶总酚酸样品粉末,分别加入一定量的丹参素、原儿茶醛、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A、丹酚酸C、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷及紫云英苷对照品溶液,按“2.2.3”项条件下制备供试品溶液进样测定,记录峰面积,计算加样回收率及RSD。
2.3 药物配制柳氮磺吡啶肠溶片研碎成粉末,以0.5%的羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)混匀成浓度为50 kg·L-1。将丹参茎叶总酚酸、丹参根总酚酸、丹酚酸B及迷迭香酸均充分混匀于0.5%的CMC-Na溶液中,调整丹参茎叶总酚酸和丹参根总酚酸浓度为20 kg·L-1,丹酚酸B和迷迭香酸浓度为6 kg·L-1。
2.4 动物造模及分组小鼠随机分为13组:(1) 正常对照组(Control);(2) 模型组(Model);(3) 柳氮磺吡啶肠溶片组(SASP 500 mg·kg-1);(4、5) 丹参茎叶总酚酸高、低剂量组(DYSAH 200 mg·kg-1、DYSAL100 mg·kg-1);(6、7) 丹参根总酚酸高、低剂量组(DGSAH 200 mg·kg-1、DGSAL 100 mg·kg-1);(8、9) 丹酚酸B高、低剂量组(SABH 60 mg·kg-1、SABL 30 mg·kg-1);(10、11) 迷迭香酸高、低剂量组(RAH 60 mg·kg-1、RAL 30 mg·kg-1);(12、13)丹酚酸B+迷迭香酸高、低剂量组(S+RH 120 mg·kg-1、S+RL 60 mg·kg-1)。除空白组给予不做任何特殊处理正常饮食饮水外,其余各组均饮用当日现配的2% DSS溶液连续7 d,造模成功后,按体质量10 mL·kg-1灌胃给药7 d,共14 d。
2.5 标本采集给药结束后,处死小鼠,迅速剖取结肠测定长度后,截取近直肠端1~2 cm放入4%多聚甲醛中固定过夜用于病理学分析,剩余组织马上投入液氮速冻0.5 h后,放入-80 ℃冰箱保存。
2.6 疾病活动指数评分小鼠造模过程中,通过参考Cooper评分系统方法评定疾病活动指数(disease activity index,DAI)以量化结肠炎。具体评分标准如下:体重减轻的变化(0:0,1:1%~5%,2:5%~10%,3:10%~20%,4:>20%);大便性状(0:正常,1和2:稀便,3和4:腹泻);便血情况(0:阴性,1:+,2:++,3:+++,4:++++);3项所得平均分即为DAI。
2.7 HE染色上述固定好的结肠标本,常规石蜡包埋切片,HE染色,光镜下观察病理损伤情况。
2.8 ELISA法测TNF-α、IL-6、IL-4水平取结肠组织,称定重量,按比加入冰PBS溶液制成10%组织均浆液,离心后取上清液,按相应试剂盒操作说明进行测定。
2.9 实时荧光定量PCR测定IL-6、COX2、IL-17A mRNA表达取结肠组织,加入TRIzol及锆珠冰上研磨提取总RNA,测定RNA纯度。RNA逆转录试剂盒逆转录后,用qPCR试剂盒以20 μL反应体系进行PCR扩增。引物序列见Tab 1。以GAPDH为内参基因,采用相对定量法(2-ΔΔCt)得到目的基因相对表达量。

Tab 1 Primer sequences of genes
3 结果
3.1 丹参茎叶总酚酸和丹参根总酚酸的成分分析结果比较
3.1.1方法学考察结果 各成分的回归方程、线性范围、LOD及LOQ结果如Tab 2所示。精密度试验RSD在1.13%~1.57%,表明仪器精密度良好;重复性试验RSD在2.41%~3.54%,表明方法重复性良好;稳定性试验RSD在2.85%~3.95%,表明供试品溶液在24 h内稳定性良好;加样回收率试验回收率在98.1%~104.4%,RSD均小于2.76%。
3.1.2丹参茎叶总酚酸和丹参根总酚酸的成分结果比较 对丹参茎叶总酚酸和丹参根总酚酸进行成分分析,共确定了其中的11种酚酸黄酮类成分,详见Tab 3。丹参茎叶总酚酸中主要含有水溶性酚酸类成分和少量黄酮类成分,含量分别为653.8 mg·g-1、18.67 mg·g-1;其中水溶性酚酸类以SAB和RA为主,含量比例接近1 ∶1。丹参根总酚酸主要含有水溶性酚酸类成分含量为780.8 mg·g-1,其中以SAB为主。

Tab 2 Linear regression, LOD and LOQ data
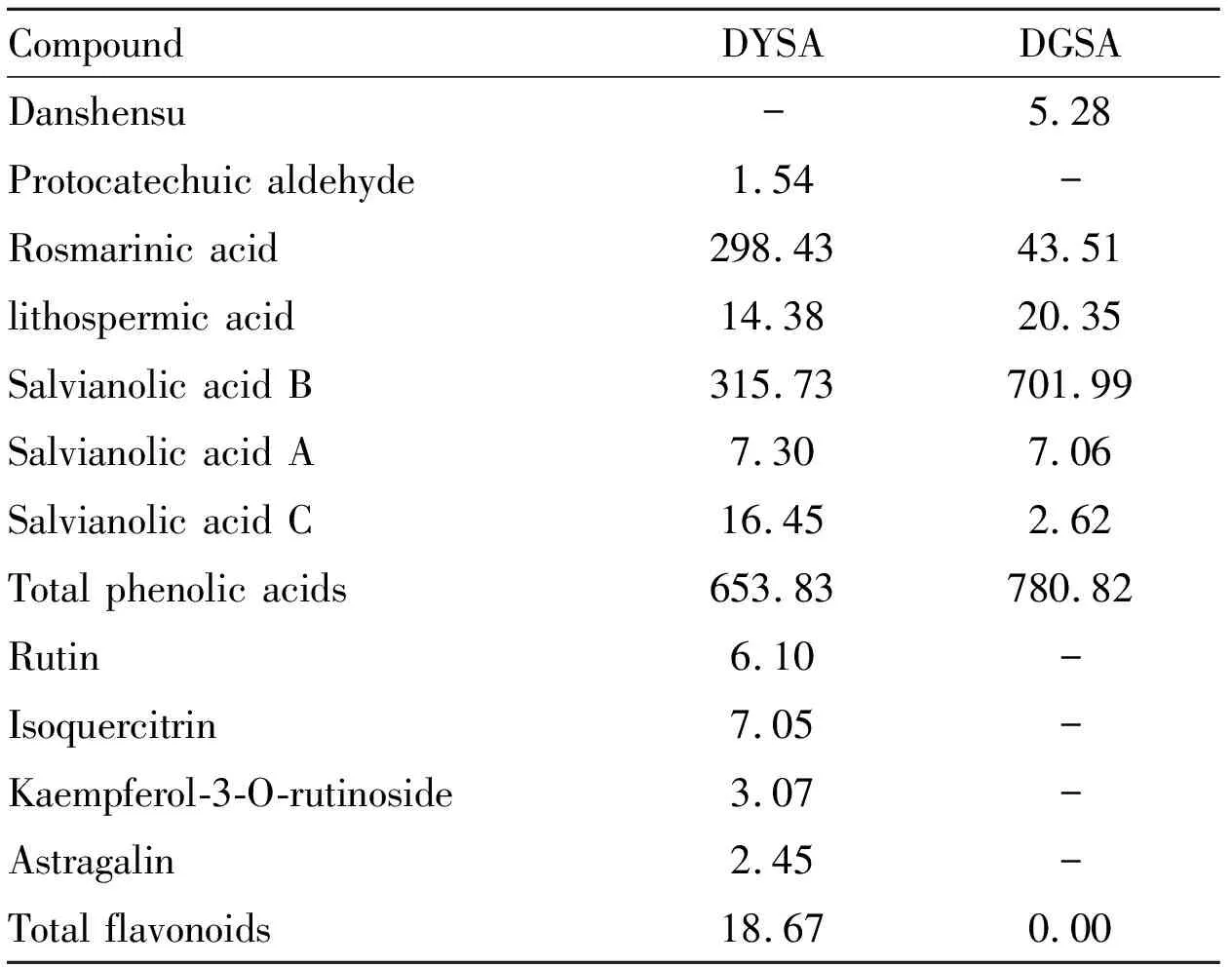
Tab 3 Contents of phenolic acids andflavonoids in DYSA and DGSA(mg·g-1)
3.2 丹参茎叶酚酸组分对DSS诱导的UC模型小鼠体重及DAI评分的影响重复测量方差分析结果显示,正常对照组与模型组小鼠体重在7 d内,两组间(F=75.40,P=0.00)及不同时间点间(F=45.23,P=0.00)差异均存在显著性,并且存在明显交互效应(F=90.56,P=0.00),表明模型组小鼠体重虽受时间影响仍明显低于正常对照组,见Tab 4。与模型组相比,各给药组随给药治疗时间延长小鼠体重缓慢增长,在d 6~d 7恢复明显,各组间比较差异有显著性(F=2.22,P=0.02;F=2.15,P=0.02)。各时间点间差异有显著性(F=165.01,P=0.00),并与组间存在明显的交互效应(F=1.71,P=0.03)。将各给药组与模型组比较得到SASP、DYSAL、SABH、SABL组间差异无显著性,DYSAH、DGSAH、DGSAL、RAH、RAL、S+RH、S+RL组间差异有显著性。对各组间进行简单效应分析得到各组间不同时间点的差异;与模型组相比RAL体重在给药d 2后即开始明显回调(P<0.05),S+RL在给药d 3后即开始明显回调(P<0.05),结合体重均数趋势发现RA与S+R比DYSA更有效,见Tab 5。模型组DAI评分在d 7内均明显高于正常对照组(P<0.01)。给药干预后,各给药组小鼠在d 5~d 7水样及稀便逐渐转变成成形的松散软便,便血症状基本消失,DAI明显低于模型组(P<0.05);其中DYSAH与RAH组DAI降低最为明显(P<0.01),见Tab 6。

Tab 4 Effect of DSS on weight of DSS-induced ulcerative n≥6)
##P<0.01vscontrol
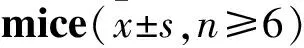
Tab 5 Effect of DYSA, SAB and RA alone and in combination, on weight of UC
*P<0.05,**P<0.01vsmodel
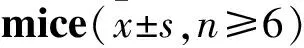
Tab 6 Effect of DYSA, SAB and RA alone and in combination on DAI score of UC
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
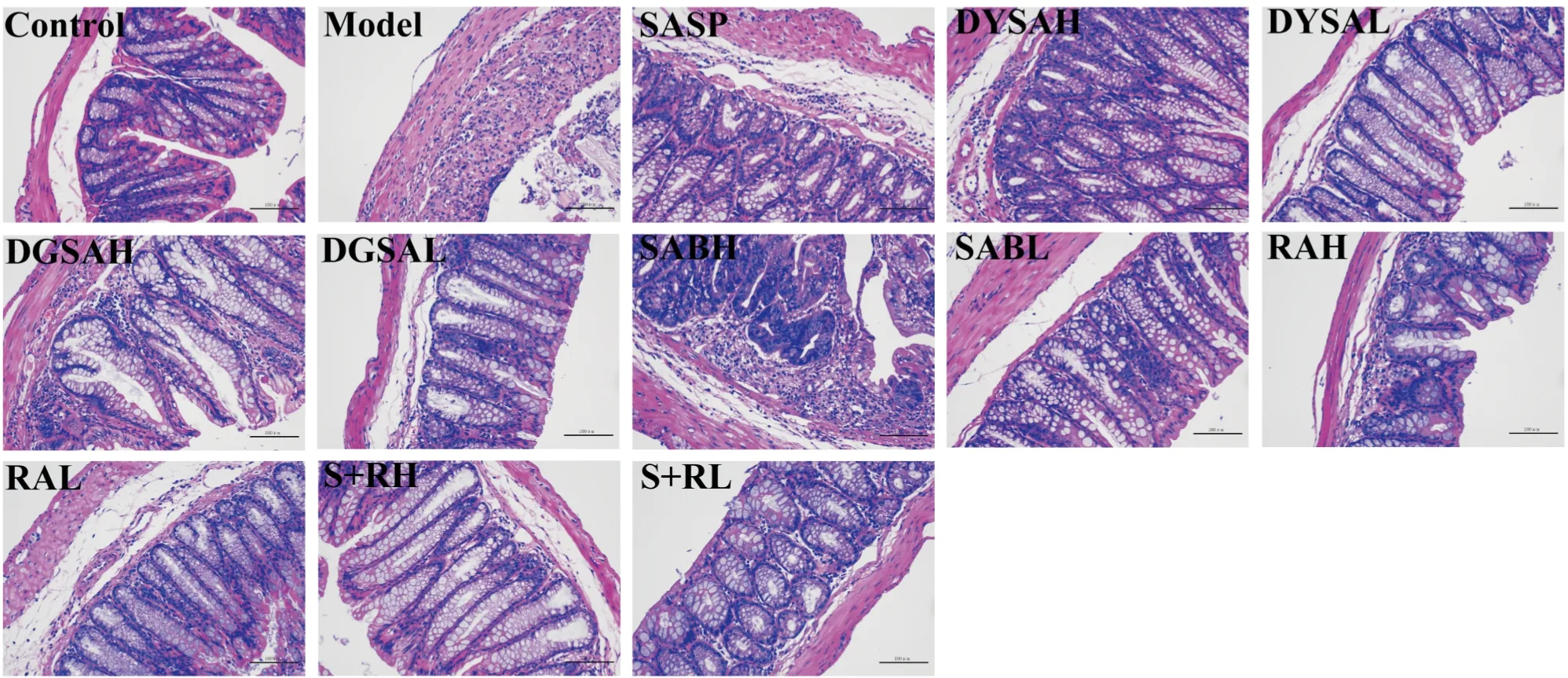
Fig1RepresentativeHE-stainedcolonsections(×200,n=3)
3.3 丹参茎叶酚酸组分对DSS诱导的UC模型小鼠结肠组织病理形态的影响由Fig 1结果可知,与正常对照组相比,模型组小鼠结肠黏膜结构紊乱水肿,肠腺及隐窝大部分被破坏或消失,肠壁多处溃疡或糜烂,伴有大量炎细胞浸润,肠腔内可见许多坏死细胞。丹参茎叶酚酸组分给药干预后肠道病理状态得到不同程度的改善。DYSAH、DYSAL、RAL、S+RH和S+RL组较模型组小鼠结肠黏膜结构完整清楚,水肿及炎症程度得到减轻,表现出明显的保护干预作用。
3.4 丹参茎叶酚酸组分对DSS诱导的UC模型小鼠的结肠长度及TNF-α、IL-6和IL-4水平的影响模型组小鼠肠管长度明显短于正常对照组(P<0.01)且IL-6、IL-4、TNF-α水平明显高于正常对照组(P<0.01,P<0.05)。给药干预后,各给药组不同程度的改善结肠短缩及IL-6水平,对IL-4和TNF-α水平无明显抑制作用。在各给药组中,除DGSAH、DGSAL及SABH外其他给药组结肠长度均明显增长(P<0.05),尤以DYSAL和S+RL组小鼠结肠平均长度最长,明显长于模型组(P<0.01)。SABH组治疗后IL-6水平明显降低(P<0.01),此外SASP、S+RL和RAL组治疗后也明显降低IL-6含量(P<0.05),见Fig 2A~B、Fig 2C~E。
3.5 丹参茎叶酚酸组分对DSS诱导的UC模型小鼠结肠的炎性因子mRNA表达的影响与正常对照组相比,模型组小鼠结肠组织IL-6、COX2、IL-17A mRNA水平明显升高(P<0.01)。给药干预后,各给药组均不同程度的降低COX2和IL-17A mRNA水平,其中DYSAH、SABH、RAL、S+RL组能明显下调IL-6、COX2、IL-17A mRNA表达(P<0.05,P<0.01)。总体上,相比于DYSA,SAB和RA单独或混合表现出对IL-6、COX2和IL-17A mRNA更为明显的抑制作用,见Fig 3。
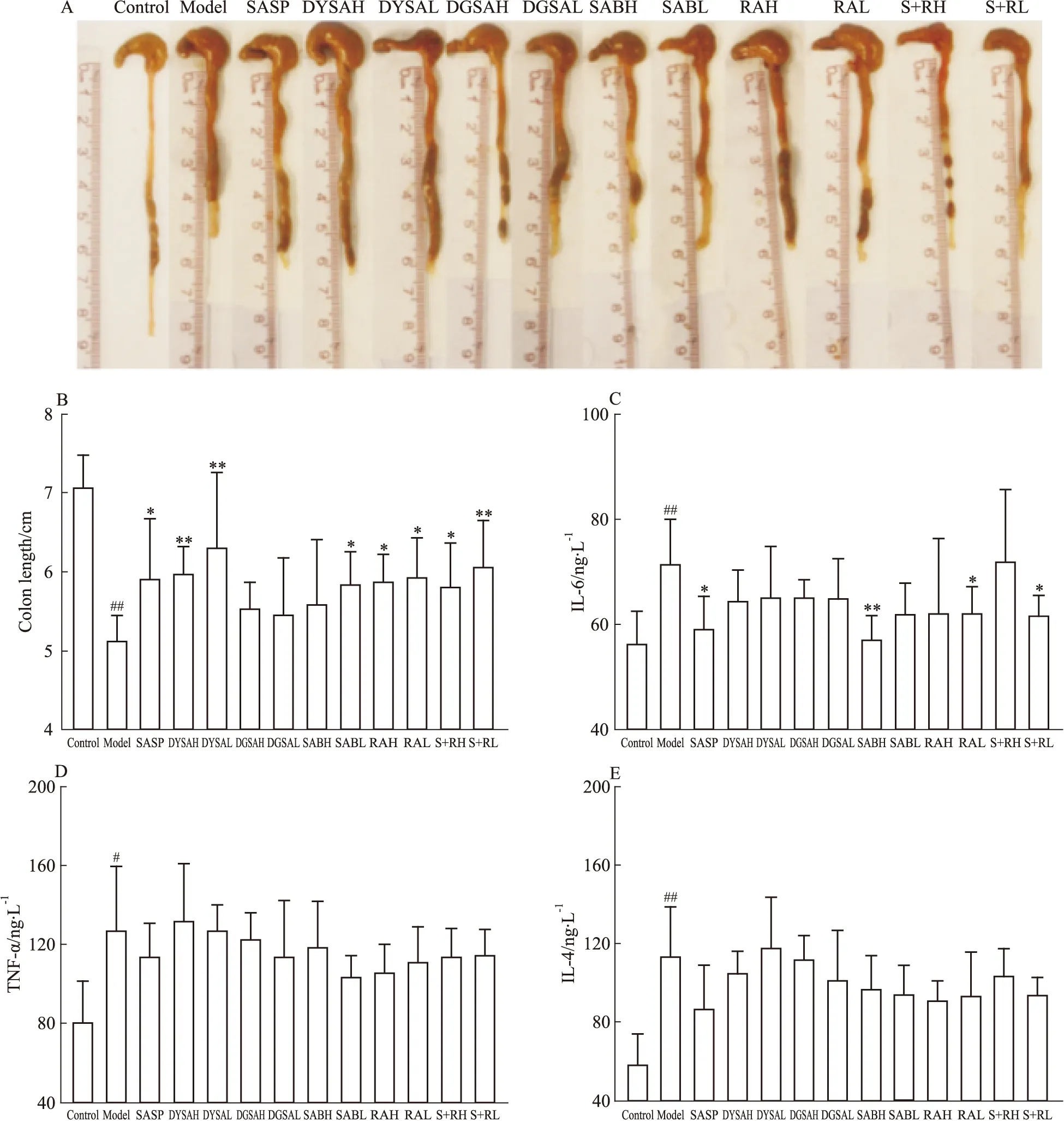
Fig 2 (A~B) Effect on colon length of UC mice;(C~E)Changes of IL-6,TNF-α and IL-4 levels in colon tissues of UC
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
4 讨论
UC的复杂病因尚未完全明确,已知受损的肠上皮组织和活化的免疫细胞参与粘膜和粘膜下层炎症相关细胞因子的持续过度产生及炎症相关蛋白的上调(如COX2)从而导致细胞因子平衡紊乱是UC发病机制的重要原因[8]。COX2为一种常见的诱导酶,在病理状态下诱导组织将花生四烯酸转化为过量前列腺素,促使各种炎症反应。文献研究表明,UC的发病与COX2密切相关,并且病情越严重COX2表达水平越高[9]。对COX2的抑制可降低中性粒细胞浸润,减轻炎症反应,从而缓解UC的发生发展[10]。据报道,迷迭香酸能够有效抑制NF-κB和STAT3的活化,降低促炎因子(TNF-α、IL-6等)及COX2的表达,减轻炎症反应,改善DSS诱导的UC模型小鼠病理表现[5]。本研究发现,丹参茎叶总酚酸及其主要效应成分丹酚酸B和迷迭香酸对DSS诱导的UC模型小鼠结肠组织中COX2 mRNA均表现出抑制作用。

Fig 3 Changes of IL-6, COX2 and IL-17A mRNAin colon tissues of UC
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
Lin等[11]发现,通过对STAT3依赖性的激活COX2转录,产生大量前列腺素可诱导Th17细胞分化。除此之外,IL-6在早期阶段就可以协同TGF-β诱导Th17细胞。已经发现Th17细胞在IBD发展中的关键作用,是研究治疗IBD的新方向[12]。UC患者肠道大量浸润的Th17细胞主要表达IL-17A等,作用于中性粒细胞,刺激炎症介质等分泌,加速中性粒细胞的募集、活化、迁移至病灶,进而加速炎症进程和引起肠黏膜损伤[13-14]。主要含迷迭香酸的紫苏提取物可抑制血清中IL-17A等的表达,达到对UC模型小鼠的保护作用[15]。本研究发现,迷迭香酸、丹酚酸B单独或混合使用可明显降低DSS诱导的UC模型小鼠结肠组织中的IL-6水平和IL-6、IL-17A mRNA表达;丹参茎叶总酚酸能够降低IL-6含量,虽差异无显著性,但能明显抑制IL-6、IL-17A mRNA表达。
本文研究表明,丹参茎叶总酚酸及其主要效应成分丹酚酸B和迷迭香酸单独或混合均不同程度的改善DSS诱导的UC模型小鼠的病理表现可能与下调IL-6蛋白及mRNA水平,抑制COX2、IL-17A mRNA表达,从而直接或间接影响IL-17A的分泌和Th17细胞的分化,缓解UC的发生发展,为丹参茎叶防治UC的进一步深入研究和丹参茎叶的开发利用提供了科学依据。
