基于2-羟丙基-β-环糊精修饰的CdTe荧光探针定量分析结晶紫及机理探讨
2020-03-19严梅敏李丽娜
严梅敏,李丽娜
(宜春学院 生命科学与资源环境学院,江西 宜春 336000)
结晶紫(CV)是一种人工合成的有毒碱性三苯甲烷类染料[1],因其价格低廉、使用方便,被用于治疗水产品因细菌和真菌引起的各种疾病。然而,三苯甲烷类染料会危害人体机能,其降解产物苯胺具有致畸、致癌、致突变作用[2],严重威胁着消费者的身体健康。研究表明,结晶紫在鱼的肌肉组织中的消除过程长,代谢物会残留在鱼体内,并迅速在生物体内富积[3],最后可能通过食用进入人体。目前水产品中CV的检测主要依赖高效液相色谱、气相色谱、质谱等[4-5]大型分析仪器,这些方法在检测中存在样品前处理复杂、成本高、耗时耗力等问题。因此,建立新方法测定水产品中的CV具重要研究意义。
量子点具有优异的光学和电学性能,其合成具有巨大的应用潜力[6]。而进一步对量子点表面进行功能修饰对其结合性能具重要作用,可通过改变量子点表面配体分子以及覆盖功能配体使其表面钝化,以实现量子点的功能化,促进量子点与环境的兼容性[7],如利用冠醚、环糊精、杯芳烃等分子化合物对量子点表面进行修饰,可直接降低量子点表面的缺陷程度,实现量子点功能化,改善其荧光量子效率和稳定性[8]。申晨凡等[9]通过制备高稳定性、高量子产率的 CdSe/ZnS量子点构建了检测多巴胺的荧光方法。
本文采用TGA作稳定剂和2-Hp-β-CD作修饰剂,在水相中合成2-Hp-β-CDCdTe量子点,其结合了CdTe荧光量子点的性能和2-Hp-β-CD的包容能力,提高了量子点的水溶性和增强了荧光能量的稳定性。以2-Hp-β-CDCdTe量子点和CV分别为供体和受体,构建的荧光共振能量转移(FRET)体系可实现对CV的荧光猝灭,从而发展了基于量子点与CV的相互作用实现对水产品中CV快速、廉价、灵敏检测的分子光谱法。
1 实验部分
1.1 仪器与试剂
Hitachi F-4600型荧光分光光度计(日本日立公司),用于记录RRS光谱;F-280型荧光分光光度计(天津港东科技有限公司),用于荧光光谱并进行相应的测量;FE28型PH计(梅特勒-托利多仪器(上海)有限公司)调节溶液酸度;Evolution Model 201紫外-可见分光光度计(UV-Vis,赛默飞世尔科技中国有限公司)用于吸收光谱的扫描;F200透射电镜(日本电子)用于测定量子点的形貌;HJ-5型多功能搅拌器(苏州威尔实验用品有限公司)用于合成量子点过程中搅拌加热。
氯化镉(CdCl2·2.5H2O)、巯基乙酸(TGA)、CV、亚碲酸钠(Na2TeO3)购于山东西亚化学工业有限公司;2-羟丙基-β-环糊精(2-Hp-β-CD)、十六烷基三甲基溴化铵(CTAB)购于国药集团化学试剂有限公司;所有试剂纯度均为分析纯,水为去离子水。
1.2 实验过程
CdTe量子点的合成:以TGA为稳定剂,采用水热法合成CdTe量子点,将0.02 mol/L CdCl2· 2.5H2O溶液置于三口烧瓶中,通过不断搅拌使新加入的0.277 mL TGA全部溶解,用1 .0 mol/L NaoH调至pH 10.5,在N2环境中驱除溶液中的溶解氧[10]。在N2下加入0.1 g NaBH4和0.022 2 g Na2TeO3,并在空气下加热(100 ℃)回流2 h。
再称取1 g 2-Hp-β-CD 溶于50 mL水中,加至已制备的CdTe量子点,继续加热回流2 h,制得2-Hp-β-CDCdTe量子点。
1.3 CV的测定
于5 mL 比色管中依次加入1.6 mL 2.0×10-4mol/L 2-Hp-β-CDCdTe量子点、1.0 mL 1.37×10-4mol/L CTAB、1.0 mL Tris-HCl 缓冲溶液(pH 8.0)和一定量的CV标准溶液,定容混匀,室温下稳定 20 min。以330 nm为激发波长,测定其荧光强度F和空白溶液(未加CV标准溶液)的荧光强度F0,计算相对荧光强度 ΔF=F0-F,以ΔF对CV浓度作图并绘制标准曲线。
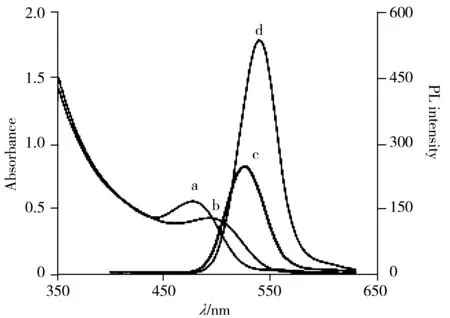
图1 CdTe QDs(a,c)和2-Hp-β-CDCdTe QDs(b,d)的紫外-可见吸收光谱和荧光发射光谱
2 结果与讨论
2.1 2-Hp-β-CDCdTe量子点的紫外吸收光谱和荧光光谱
图1显示了水溶液中CdTe量子点分别与2-Hp-β-CD结合前后的紫外-可见吸收光谱(曲线a、b)和荧光发射光谱(曲线c、d)。从曲线a、b可知,二者结合后,紫外光谱吸收强度下降,最大吸收峰红移,但谱图形状无较大改变,均具有较宽的激发光谱范围;比较曲线c、d,发现结合2-Hp-β-CD后的CdTe量子点荧光强度显著增加,发射峰位轻微红移;选择330 nm 处激发时,其荧光发射最大波长位于550 nm 处,且发射峰峰形对称,半峰宽窄,荧光强度较高。表明CdTe量子点被2-Hp-β-CD修饰后具有良好的荧光性能。究其原因,很可能是由于2-Hp-β-CD的作用钝化了量子点表面,抑制了表面空穴处的非辐射重组[11]。此外,观察c、d的发射峰位置,发现2-Hp-β-CDCdTe量子点与CdTe量子点的光谱宽度基本相同,说明水溶液中的2-Hp-β-CDCdTe量子点保持了量子点的光学特性。与原来的CdTe量子点相比,2-Hp-β-CD可以很好地改善其性能,如增加水溶性,增强荧光能量的稳定性以及调节分子包含体的效果。
2.2 2-Hp-β-CDCdTe量子点的表征
图2为2-Hp-β-CDCdTe量子点(无CTAB),以及CTAB存在下CV与2-Hp-β-CDCdTe QDs体系的高分辨透射电镜(HRTEM)图。从图中可以看出,所制备的2-Hp-β-CDCdTe量子点近似呈球形,粒径约为4 nm,且分布均匀,有很好的分散性(图2A)。当量子点体系中加入1.0 ×10-5mol/L CV时,可观察到产物粒径明显增大,粒径从4 nm左右增至10 nm左右,形态也从较规则的近圆形变化为不规则形状,形成团聚(图2B)。说明在CTAB存在下,溶液中CV和2-Hp-β-CDCdTe QDs随机结合,生长成稳定且大小不同的复合物。


图2 2-Hp-β-CDCdTe QDs(A)及CV与2-Hp-β-CDCdTe QDs体系(B)的TEM图

图3 2-Hp-β-CDCdTe QDs的发射光谱(a)和CV的紫外-可见吸收光谱(b)
2.3 CV与2-Hp-β-CDCdTe量子点的FRET构建
荧光共振能量转移( FRET)是指化合物分子受光激发后,分子内部发生了供体与受体之间的一种能量转移。FRET的发生需满足3个条件:① 供体能发射荧光;② 供体的发射光谱与受体的吸收光谱有一定程度的重叠;③ 供、受体足够接近,且作用距离一般为2~8 nm[12-13]。研究发现2-Hp-β-CDCdTe量子点和CV可分别作为供体和受体,根据2-Hp-β-CDCdTe量子点的发射光谱和结晶紫的吸收谱(图3)可知,2-Hp-β-CDCdTe 量子点的荧光发射光谱(最大发射波长为550 nm)均落在CV的紫外吸收光谱(CV最大吸收波长为 600 nm)图内,可见二者的光谱重叠性较好,达50%以上(大于30%)。因此,可认定二者之间形成了FRET,导致量子点发生荧光猝灭效应[14]。
根据 Stern-Volmer 方程[15],进一步判断CV对2-Hp-β-CDCdTe量子点的荧光猝灭类型,实验设定CV浓度在1.0×10-7~1.0×10-5mol/L范围内。根据公式:F0/F=1+Ksv[Q]=1+Kqτ0[Q],式中的F0和F分别为加入猝灭剂前后荧光物质的荧光强度,Ksv为动态猝灭常数,Kq为动态荧光猝灭速率常数,τ0为未加猝灭剂荧光物质的平均寿命(通常为 10-8s),[Q]表示猝灭剂的浓度。根据公式计算出Kq=1.8×1014L·mol-1·s-1,该值远远大于猝灭剂与荧光分子的最大扩散碰撞猝灭常数(2.0×1010L·mol-1·s-1),可判定CV对2-Hp-β-CDCdTe量子点的猝灭为静态猝灭[16 ]。引起静态猝灭的主要原因为能量转移、电子转移、表面吸附[15],进一步佐证了二者之间建立的FRET引发了2-Hp-β-CDCdTe量子点的静态猝灭。
2.4 CTAB对2-Hp-β-CDCdTe-CV体系FRET的影响
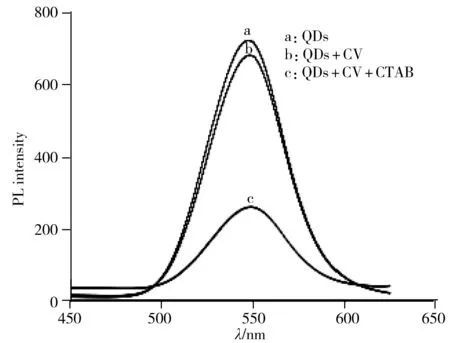
图4 CTAB对体系荧光共振能量转移的影响
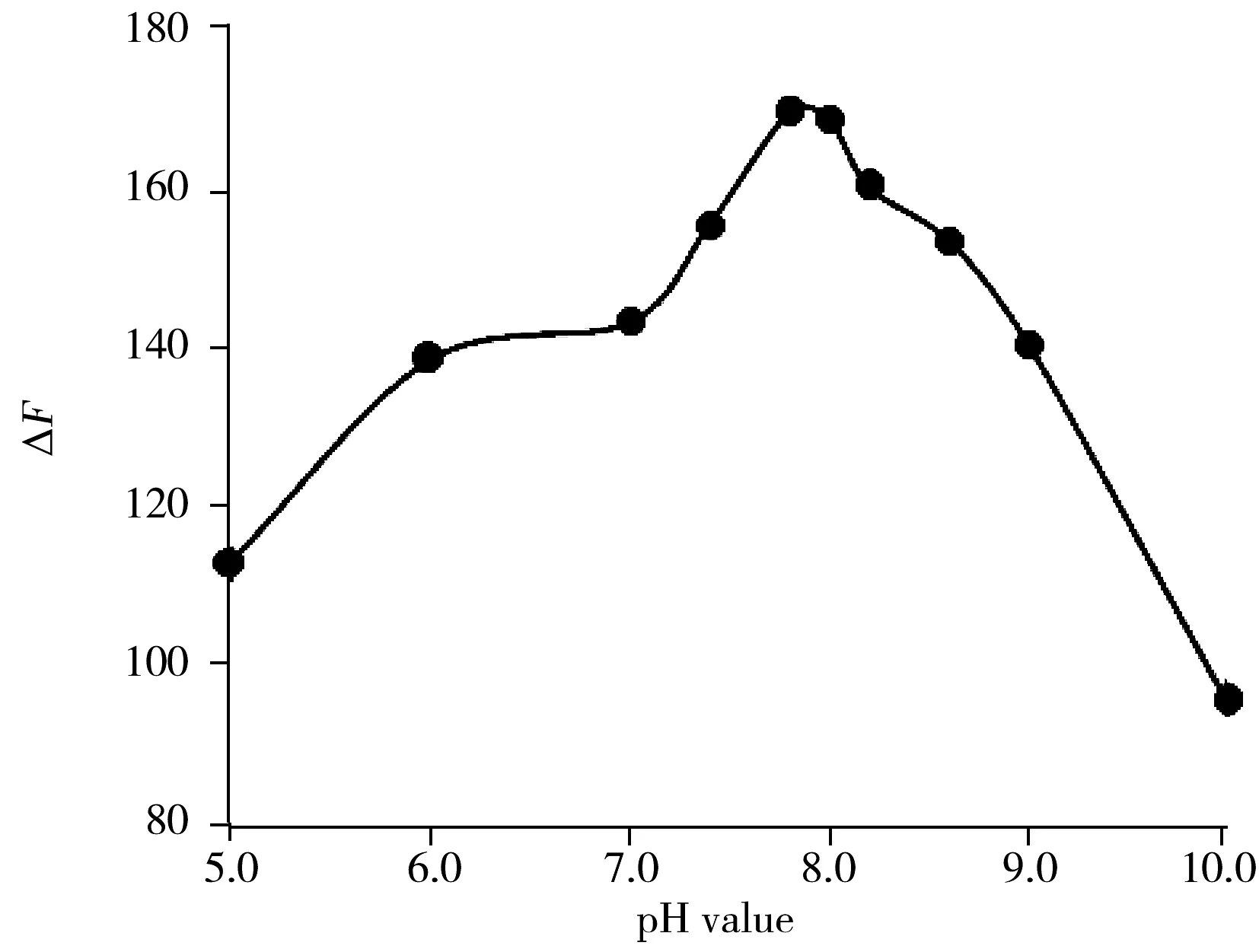
图5 pH 值对2-Hp-β-CDCdTe QDs-CV 体系荧光强度的影响

图6 CTAB浓度对2-Hp-β-CDCdTe QDs-CV 体系荧光强度的影响
考察了加入CV前后2-Hp-β-CDCdTe量子点体系的荧光强度变化(图4曲线a、b),及加入表面活性剂CTAB前后荧光强度的变化(图4曲线b、c)。结果显示,加入CV后2-Hp-β-CDCdTe的荧光强度降低不明显,说明猝灭剂和荧光剂之间虽然发生了反应,但形成的新物质不稳定,当进一步加入CTAB后,荧光强度大幅度降低。原因可能为2-Hp-β-CDCdTe量子点表面带负电荷,可与带正电荷的CTAB阳离子表面活性剂分子通过静电作用结合形成QDs-CTAB复合体[17],也可能因CTAB分子中烃基可与CV 分子通过分子间作用力结合使得CV和量子点的距离缩短,从而加深了能量间的传递,形成了更稳定的化合物。
2.5 实验条件的优化
2.5.1 pH值对体系荧光强度的影响将2-Hp-β-CDCdTe 量子点应用于分子检测时,其荧光强度易受溶液 pH值的影响。实验以Tris-HCl 为缓冲溶液,考察了pH 值在5.0 ~10.0范围内对体系荧光强度的变化情况。图5显示,在较酸或较碱性条件下荧光强度变化不大,当溶液pH值为7.0~9.0时,反应体系的荧光猝灭效应较为明显,且以pH 8.0左右的猝灭效果最强烈。因此,实验选择pH 8.0 Tris-HCl缓冲溶液作为体系最佳反应环境。这是由于2-Hp-β-CDCdTe量子点表面TGA存在着羧基基团,在较强的酸性条件下,羧基电离程度低,使得量子点的亲水性降低[18],导致量子点在较强酸性条件下荧光较低的现象;当pH较碱性时,溶液中存在的大量OH-会与量子点表面配体产生竞争作用,2-Hp-β-CD分子含羟基键,而羟基的吸附和配体的离去会在量子点表面形成新的缺陷,导致非辐射跃迁增大,荧光猝灭强度降低[19]。
2.5.2 CTAB用量对体系荧光强度的影响考察了不同体积(0.1、0.3、0.8、1.0、1.2 mL)CTAB对体系荧光强度的影响。结果显示,当CTAB用量逐渐增大时,荧光猝灭效应逐渐增强,当CTAB用量为0.8 mL时,体系的荧光猝灭最强,此后,继续增加CTAB用量,其荧光猝灭效应反而减弱。因此,实验选取0.8 mL CTAB为实验最佳用量。固定CTAB用量及其他条件,考察了CTAB浓度对体系的影响。根据图6可知,CTAB浓度过低时体系猝灭效应不明显,过高时,溶液易出现白色浑浊,且稳定性降低。因此实验选择CTAB的最佳浓度为1.37×10-4mol/L。
2.5.3 量子点浓度对体系荧光强度的影响量子点浓度的变化会影响体系的相对荧光强度。当量子点的浓度较大、荧光强度高时,加入少量CV时的荧光强度变化不明显,导致分析的灵敏度低;当量子点的浓度较小、荧光强度低时,加入少量CV可使得荧光强度发生明显变化,灵敏度好,但线性范围窄。综合考量灵敏度和线性范围,本实验选择2-Hp-β-CDCdTe量子点溶液为2.0×10-4mol/L(按Cd2+浓度计算)。
2.6 干扰实验

2.7 线性范围与检出限
在最佳实验条件下,考察了不同CV浓度对体系荧光强度的影响,并绘制标准曲线(见图7)。结果表明:CV浓度在1.0×10-7~1.0×10-5mol/L范围内与体系的相对荧光强度呈良好的线性关系,线性方程为ΔF=43.195c+42.377(c:μmol/L),相关系数(r2)为0.995 2,检出限(3δ/k)为1.74×10-8mol/L。

图7 不同浓度CV对2-Hp-β-CDCdTe QDs体系荧光强度的影响
2.8 实际样品的分析
为验证该方法在实际应用中的可行性,本文对湖水中的CV含量进行测定。水样取自岐山村渔业养殖废水排口下游的湖塘,将1 L水样加热浓缩至100 mL,用稀NaOH溶液调节至pH 8.0,转移至100 mL容量瓶中,定容。取上述处理后的水样,按实验方法对其进行检测,均未检出CV。采用标准加入法进行回收率实验,在样品中分别加入0.2、1.0、3.0 μmol/L 3种浓度的CV标准溶液,测得CV的回收率分别为103%、106%、99%,相对标准偏差(RSD)分别为2.0%、4.3%、1.5%。说明该方法具有较好的准确度和精密度,可用于渔业养殖废水中CV的测定。
3 结 论
本研究以TGA作为稳定剂和2-Hp-β-CD作为修饰剂在水相中合成CdTe量子点,利用CV对2-Hp-β-CDCdTe量子点的猝灭效应,建立了CdTe量子点测定水中CV的方法。研究发现2-Hp-β-CD修饰的CdTe量子点的水溶性强、荧光能量的稳定性较好,量子点同CV间产生了能量共振转移作用,导致静态荧光猝灭的发生,加入CTAB后导致猝灭效应大大增强。根据此机理,优化了量子点同CV的反应条件,并对渔业养殖废水中的CV实现了定量检测,结果满意。
致谢:感谢南昌大学唐群教授和付鑫同学在本文完成过程中提供的帮助和指导!
