云南干热河谷退化生态系统光合碳分配特征及其影响因素
2020-03-19樊佳奇牛来春
樊佳奇, 牛来春
(云南师范大学 文理学院, 昆明 650222)
土壤碳库在全球碳平衡中具有关键的作用,对全球碳固持产生至关重要的影响。土壤碳库在植物生长和微生物活动中处于动态变化中[1-3]。一般情况下,经过光合作用,植物吸收了大量的CO2,将其中固定的碳输送至植物各部分,最后经过根系送至土壤中,或者通过有机质的形式保存在土壤中;或者在土壤微生物的作用下,将其转化为CO2或CH4等气体,输入大气中[4-5]。据统计,我国草原植被和土壤中的碳储量分别为3.06,41.03 Pg,总碳储量大约为44.09 Pg,占据世界草原总碳储量的9%~16%[6-7]。由以上数据可知,草地碳循环对全球碳循环的影响非常巨大。国外针对作物地下部碳的转移,使用了同位素示踪技术进行定量研究,并将研究目标确定为小麦、大麦及牧草等[8-9]。而国内,针对农田土壤碳平衡方面的研究,受到技术条件的限制,主要研究内容为影响农田土壤呼吸的环境因素、秸秆分解动态及不同农作措施下土壤有机质含量及组成特征等,但是没有系统研究草地土壤碳素平衡问题。
建植人工草地和草地的退化让土壤的理化性质以及下垫面植被发生了改变,对此草地应做出如何的响应模式,以及草地退化对土壤碳循环有如何的影响,此方面的研究尚不多见[10-12]。当前光合碳在草地—土壤系统中进行分配以及转化的有关影响因素还尚不清晰,这主要是由于以往的研究未能区分新合成的光合碳和土壤原来的有机碳[13-14]。稳定同位素示踪技术(13C)是对植物碳转移、分配和固定进行研究的重要手段,它能够定量植物输入到根部的碳、根际呼吸(进而区分土壤呼吸)以及根际沉积碳。在植物的生育期间进行一系列脉冲标记,可以对植物输入到地下各组分的碳量进行合理的估算,由于13C标记技术自身操作性稳定和安全等优点,在生物地球化学循环的研究中得以广泛使用[15-17]。有鉴于此,在本文针对不同退化草地,运用原位13CO2脉冲标记方法,研究不同退化阶段草地光合碳分配特征及转移规律,能够更好地确定新碳在草地植株—土壤生态系统中的转移以及在土壤、根、茎叶中的分配特征,从而为研究植物—土壤系统中碳的平衡过程提供科学依据。
云南的地貌特征以低纬度、高原山地为主,聚集了大量的干热河谷,并在印度洋西南季风和太平洋东南季风的作用下,呈现出自然环境特异化的状态[18-19]。干热河谷位于高原山地高热多光照干旱的河谷地带,具有不连续、呈散点不规则分布的特点[20-21]。由于环境的自然变化和人类活动的破坏,先是土壤退化,继而引发了土地荒漠化的局面,生态环境受到破坏,异常脆弱。针对这种情况,学者们从干热河谷的成因、植被恢复、土壤水分、土壤变化及形成机制、荒漠化、土壤侵蚀等方面进行研究,但未对退化生态系统光合碳分配特征进行研究。本文针对云南干热河谷,采用13C脉冲标记方法,以不同退化阶段(轻度退化LD、中度退化MD、重度退化HD、极度退化ED、对照CK)的草地为研究对象,研究光合碳在不同退化草地—土壤间的分配及其向地下输入特征,对我国草地生态系统碳平衡的研究提供数据支撑。
1 研究区概况与研究方法
1.1 研究区概况
研究区域的地理坐标为25°41′28″N,101°52′47″E,处于云南省金沙江元谋干热河谷小垮山流域。该地区为典型的金沙江干热河谷,属于南亚热带季风河谷干热气候区,海拔为1 059~1 154 m,极端最低气温为-2℃,极端最高气温为42℃,年平均气温21.9℃,≥12℃的持续天数为349 d,积温为7 796℃,日照率达到62%,年太阳总辐射量为641.8 kJ/cm2,干燥度为4.4。多年来,该地区的平均降雨量为613.8 mm,呈现少而相对集中的情况,降水量远远低于蒸发量,“干”的特征非常突出。该地区的土壤大多为变性土和燥红土,夹杂分布着紫色土和水稻土。植被主要是草本植物,为适应该地区的自然环境和气候状况,干热稀树灌草丛草地是作为顶极植物群落而存在的。
1.2 样地选取
2018年9月上旬,以草地退化程度为主要选择标准,把小垮山流域作为样地进行研究,轻度退化(LD),中度退化(MD),重度退化(HD)和极度退化(ED)4个程度进行标准设置,从样地分布的空间出发,选取了2002年围栏封育、面积为50 m×50 m的3个地形土壤条件相似、退化程度不同、放牧围封情况相似的草地作为对照样地进行研究。
采用剖面法分别在LD,MD,HD,ED和CK样地内选取0—20 cm的土层,将3个重复混合均匀后,置于室内自然风干。土壤粒径的体积百分比时使用MS3500激光粒度分析仪测定;通过60目筛研磨,采用元素分析仪(Elementar Vario MACRO,Germany)测定土壤全氮(Total nitrogen,TN)和有机碳(Soil organic carbon,SOC)含量;采用火焰分光光度计测定全氮和碱解氮;采用高氯酸—硫酸消化,钼锑抗比色法(UV-2450)[22]测定全磷(Total phosphorus,TP)。
1.3 脉冲标记
在不同退化草地上,随机选择3个重复样地,并设置间隔行,避免13CO2这一标记受到污染。在各退化草地开始标记之前,要设立柱状形式的标室,丙烯酸膜和透明的PVC壁是组成标志室的两种材质。标记室需要安装在5 cm深的土壤当中,并且用45 μm的尼龙网眼孔将其周边包住,并且放置于土地深10 cm的地方,目的是防止植被的根系部分生长至标记室,影响植被与外界养分、水分的交换。标记室的内径为1 m(体积0.314 m3合314 L),内高为0.4 m,其内壁上被涂满了雾化剂,目的是防止水汽的出现(凝结的水汽可溶解标记的CO2,也可增大光强),还要在其周围放置细土,防止气体泄漏。自2018年8月1日的11:00开始标记,将高压瓶中放置具有高纯度13C的CO2,并用4 mm的管子连接标计室和CO2瓶。当10 L13CO2,被放入时,标记室中的气体量增加到3.18%,而地表则每平方米增加了12.738 L13CO2。标记室顶膜密封完整时,便可开始进行标记。由于气体流速为0.25 L/min,放入的CO2体积较小,不会影响到标记室中的气压。标记40 min之后,不再放入CO2,继续封闭标计室5 h。封闭期间,可以通过其内的风扇促进室中气体流通。从叶和群落水平植物光合作用的大小出发,对其大小进行初步预估,快速减少标记室中的CO2。标记完成时,可移走标记室。
1.4 样品采集与制备
在标记的第1天和第21天,采集20 cm深的土壤,直径为5 cm,含有根系的5株草系,在每一种土地中,每次收集15株,编号并装入档案,拿回实验室。清洗花、茎叶、草地根等部位后,在70°温度条件下烘干48 h,进行称量的同时计算花、茎叶、草地根等部位的生物含量。将烘干的样本碾碎后,测量其中的δ13C和C的值。用2 mm的土壤筛筛选土壤的样本,并将其放置于4度的条件中,测量其中的δ13C和C的值。针对3种类型草地中1 m×1 m面积的表面上的生物量,采用同一个方法进行测定,重复取样4次。同时采用跟钻采集地下生物量,每个样方重复进行4次。
1.5 样品测定与分析方法
以50 g土壤样本为母本,将20 g土壤样品取出,并放置于一个白色的平板上,挑出其中的细根杂物,将其放入100 ml去离子水中振荡30 min,土壤中具有水溶性的有机碳会得到充分溶解。在等待一段时间后,为防止冲洗HCl的时候,水溶性的有机碳出现流失情况,要把处在上面的清液倒入烧杯中。将HCl溶液滴入盛有清液的烧杯中,使其pH值<3(用于去除可溶性碳酸盐)。然后,将50 ml的3 mol/L的HCl溶液放入泥浆,去除其中的碳酸盐。
反应2 d后,冲洗没有碳酸盐的土壤,直到呈现中性为止,再将烧杯中的清液倒进其中,在60°的温度条件下进行烘干、研磨操作,用0.15 mm的土壤筛筛选后,放置一旁备用。
使用EA-IRMS(元素分析仪—同位素比率质谱分析联用仪,Flash EA1112 HT-DELTA V Advantage,Scientific,Inc.,USA)测定δ13C值。其主要步骤如下:将样品放置于元素分析仪器中,使其高温燃烧后产生CO2,同时使用质谱仪监测CO2的13C与12C比率,与国际标准物(Pee Dee Belemnite,PDB)进行对比后,进一步计算样品的δ13C比率值。δ13C测定精度为±0.1‰。光合固定13C进入茎叶、根、土壤中(不考虑呼吸损失),各组分固定13C量(mg)计算公式为:
13Ci=(F1-F2)/100
式中:各组分13C含量为13Ci;标记组分13C丰度为F1;不标记组分13C丰度为F2。
采用使用SPSS 20.00和Excel 2010进行数据统计和分析。
2 结果与分析
2.1 不同退化阶段草地土壤养分
从图1可以看出,土壤有机碳变化范围为6.15~12.05 g/kg,其含量随着退化程度的增加呈先增加后降低趋势,表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05);土壤全氮变化范围为0.73~1.24 g/kg,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05),LD,CK,HD差异不显著(p>0.05);土壤全磷变化范围为0.81~0.83 g/kg,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中不同退化阶段土壤全磷差异均不显著(p>0.05);土壤全钾变化范围为13.14~20.14 g/kg,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05),LD和HD差异不显著(p>0.05);土壤碱解氮和速效磷变化范围分别为32.14~52.89 mg/kg,23.11~38.92 mg/kg,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05),LD和HD差异不显著(p>0.05)。
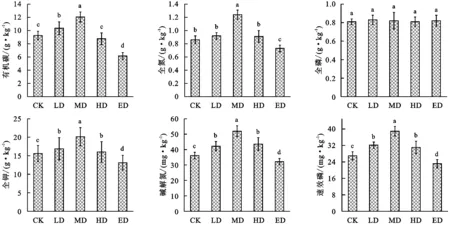
图1 不同退化阶段土壤养分
2.2 不同退化阶段草地地上和地下生物量
如图2所示,不同退化阶段草地茎叶生物量变化范围为16.78~32.57 g/m2,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05);根生物量和地上生物量变化范围分别为10.03~19.54 g/m2,27.03~39.87 g/m2,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中MD显著高于其他处理(p<0.05)。根冠比变化范围为0.31~0.38,随着退化程度的增加呈先增加后降低趋势,大致表现为:MD>LD>CK>HD>ED,其中HD和ED差异不显著(p>0.05)。
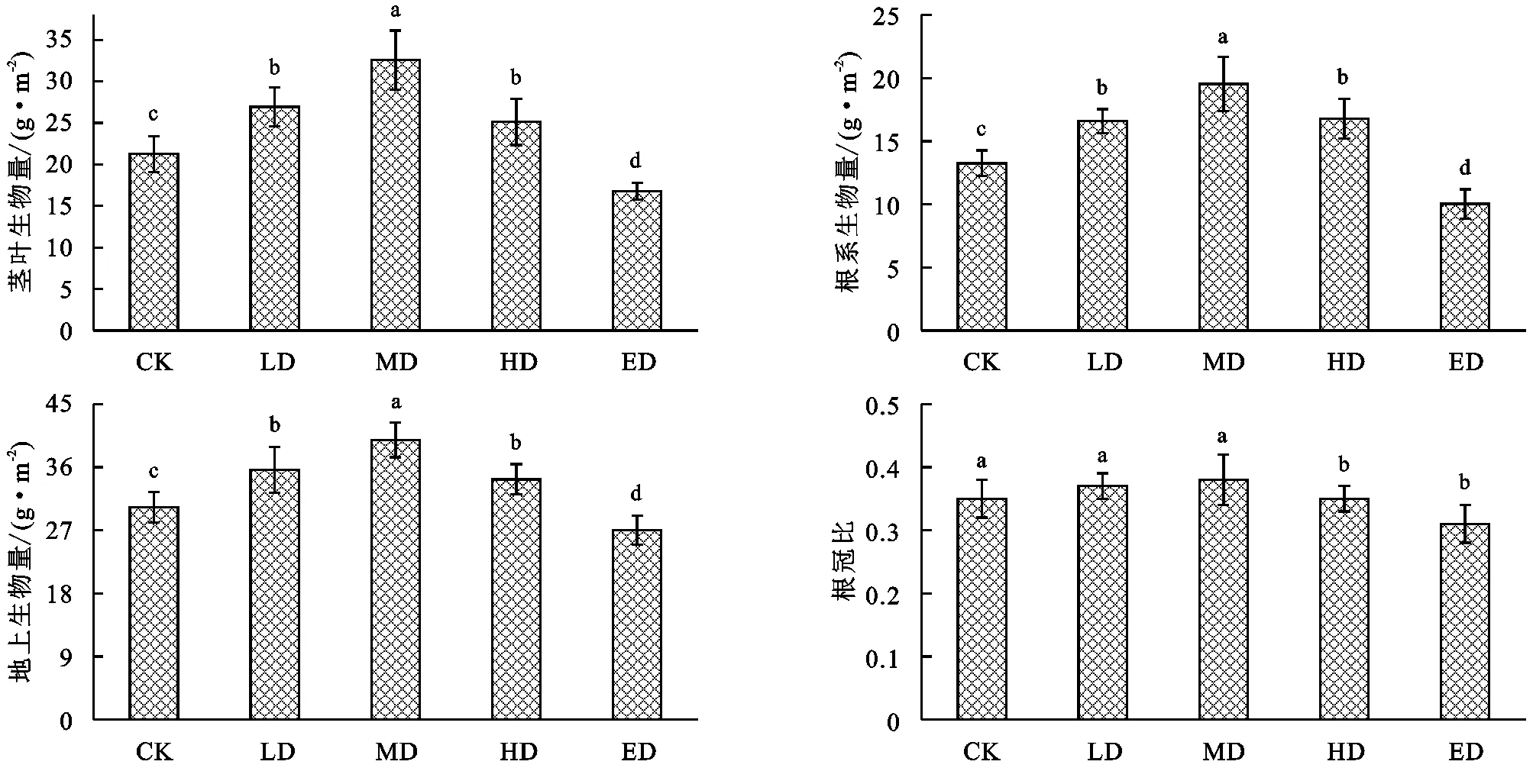
注:不同小写字母表示差异显著(p<0.05),下图同。
图2 不同退化阶段草地地上和地下生物量
2.3 不同退化阶段草地-土壤系统13C丰度动态变化
脉冲标记后光合固定13C在草地—土壤系统中进行转移与分配。由图3可以看出,光合固定碳转移较快,脉冲标记当天不同类型草地δ13C值均表现为茎叶>根>土壤,土壤中差异不大;草地茎叶和根中的δ13C值随着退化程度的增加呈先增加后降低趋势,在MD达到最大,由此可以看出,草地的根部对光合固定新碳的富集程度较大。

图3 标记当天不同退化阶段草地-土壤系统13C丰度动态变化
2.4 不同退化阶段草地-土壤系统13C分配动态变化
由表4可知,标记当天,不同退化阶段草地茎叶13C含量在MD达到最高(48.32%),SD最低(32.01%),同样地,不同退化阶段草地根13C含量变化范围为13.07~28.74,MD达到最高;不同退化阶段草地根土壤13C含量变化范围为5.02~12.85,MD达到最高,随退化阶段的增加呈先增加后降低趋势。标记21 d以后,不同退化阶段草地茎叶、根和土壤13C含量与初始值呈一致的变化规律。
由表5可知,标记当天,不同退化阶段草地—土壤系统光合同化13C主要集中分配在茎叶中,其次是根中、土中;标记21 d,不同退化阶段草地—土壤系统光合同化13C主要集中分配在根中,其次为茎叶和土中,其次是根和土壤中。
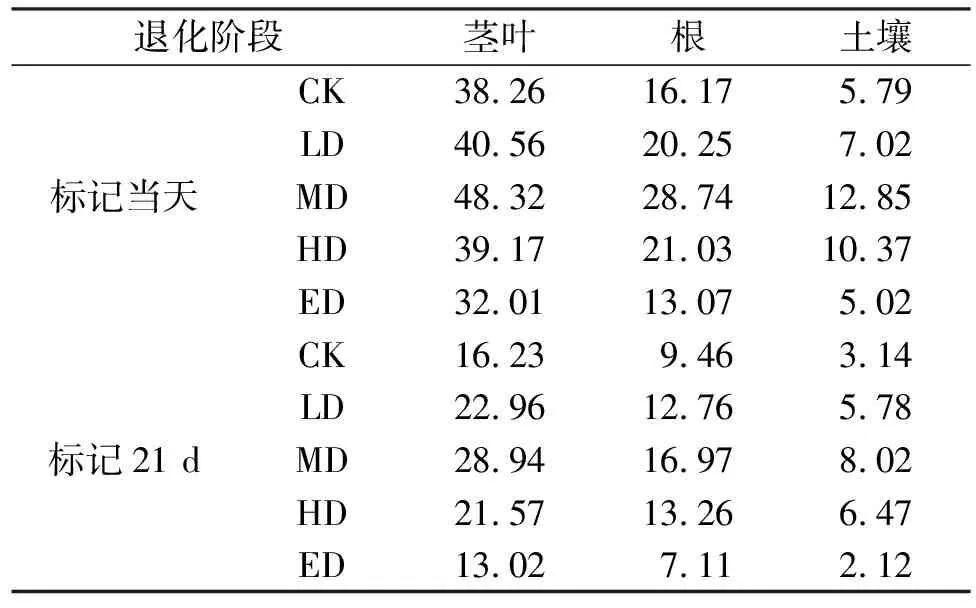
表4 不同退化阶段草地-土壤系统各组分13C含量动态变化 mg/m2
2.5 不同退化阶段草地光合碳对土壤有机碳的贡献
标记结束后,不同退化阶段草地对土壤有机碳的贡献量和累积量见图4。MD对土壤有机碳的贡献量最大,对土壤有机碳的贡献量随退化程度的增加呈先增加后降低趋势;净固定碳的累积输入量由整个时期的贡献量的累加得到,由图4可知,有机碳的累积量随退化程度的增加呈先降低后增加趋势,在MD达到最低值。
2.6 13C-SOC的影响因素
相关性分析表明(表6),土壤养分显著影响了光合同化碳在地上部和土壤中的分布,其中,茎叶13C含量与有机碳、全氮、碱解氮和速效磷含量呈显著的正相关(p<0.05);根13C含量与有机碳、全氮、碱解氮和速效磷含量呈显著的正相关(p<0.05);土壤13C含量与有机碳、全氮呈极显著的正相关(p<0.01),与碱解氮和速效磷含量呈显著的正相关(p<0.05)。

表5 标记后不同退化阶段草地—土壤系统各组分13 C的分配 %

图4 不同退化阶段草地光合碳对土壤有机碳的贡献

表6 13C-SOC的影响因素
注:*代表p<0.05,**代表p<0.01。
3 讨 论
植被对光合作用的分配与生长的时间段处于不断变化中,呈现出不同的状态。试验发现,植被的地上部分保留有很多光合固定的13C,与前人的研究结果一致[22-23]。通过本次试验可知,在差异退化阶段,草地传输到土壤中的碳的估算值大约为2.14~9.78 kg/hm2,产生这种现象的原因与植物类型、生长条件、标记方法、试验技术、采样时间等因素密切相关。研究植被在生育期间内根系淀积的碳量是在标记当天吸收的13C规律基础上展开的,需要采用碳同位素脉冲标记技术进行计算,能够发现在一定的生育期间平均分配植被吸收的光合碳的规律,即光合碳的分配在同一个生育期间会发生较大的变化,而对根系淀积碳量进行脉冲标记定量是一种大致的估算[24-25]。大量的研究表明,植被输入带地下的碳量估计大多采用了碳同位素脉冲标记法的记载,这将有助于估算整个生态系统尺度的碳平衡。
与传统脉冲标记方法相比,本试验在标记的13CO2未从土壤中完全释放时就取样,所以标记的13CO2的减少以及流失,不能够说明物质完全进入了土壤,因为植被微生物和土壤更喜欢标记的有机物。而新固定光合碳的分配是传统脉冲标记方法所提供的。13C脉冲标记可以作为研究碳转移、固定和分配的主要方式,是因为13C同位素具备安全、可靠、稳定、方便等特点,能够对光合碳的去向进行动态监测。与以往试验不同,本次试验采用了原位标记。
标记当天显示,差异草地上13C固定百分比为39%~71%,说明标记效率比较高,能够较合理反映光合碳在土壤—植物系统中的动态分配情况。经研究发现,柳枝稷固定13C比例为42%~79%,蚕豆和玉米固定13C比例为41%~67%,黑麦草固定13C比例不足50%[16-18]。试验显示,茎叶、根、土壤三者固定13C之和是草地光合固定13C量。与其他研究类似,土壤在标记1~2 h之后,已经可以检测到13C。另外还发现,标记当天,差异退化阶段草地土壤碳的分配的平均比重是8.6%,在中退化阶段,16 a上升至13.9%,这说明光合碳在草地植株—土壤系统的转移和分配的速度比较快。
标记脉冲之后,草地植物在叶子的光合作用下,将13C储存起来,并在植物—土壤系统中完成分配。本次研究中,在标记21 d之后,13C被分配至地下的比重大约为11.6%~51.3%。有研究采用脉冲标记实验研究了地上—地下碳的分配过程,经过研究发现,牧草植被被同化的碳元素有30%~50%转移到了地下[15];也有研究发现,标记27 d之后20%~40%的光合碳会转移到地下,这些发现与本研究一致,地下的根系部分借助于光合储存的碳进行生长,或者植物的根和茎叶呼吸的时候释放出13C,或者以根际沉积物的形式消耗13C。随着植物的生长,植物中的生物量不断上升,没有标记的地方同化13C,草地光合固定的13C遭到分解,就让21 d后植株δ13C值出现下降情况[22]。13C的值会受到草地类型、物候期、管理方式、植物种类、示踪期长短等因素的影响。在标记21 d之后,间隔时间较短时,进行再次采样,对δ13C值的细微变化进行实时监测跟踪。对比存在差异的退化阶段草地地上和地下碳库的分配,可以看出,与其他草地相比,标记21 d后MD草地茎叶、根、土壤中的碳存在很大不同,所占的比重较高,这说明,受高的根冠比以及较为良好的土壤理化环境影响,根际由于植物根部所产生的诸多分泌物而产生沉积,是土壤中的有机质的转化率得到提高[24-26]。
标记当日,由于光合碳分配给土地的比重较高,13C在土壤中固定数量和速率得到增强。在标记21 d之后,13C固定百分比达到最大值的时候是MD,与其他退化程度草地相比,MD草地枝叶繁茂,具有明显的优势。通过光合作用,草地茎叶将13C固定在植物—土壤体统中,并通过茎叶运输至根系后,再由根系将其通过根际分泌物的形式送至土壤中并扩散开来。
而在退化阶段草地中,根际微生物呼吸和根际累计物组成的差异有可能会影响13C由草地到土壤的分配。草地分配的碳,大概有5%~27%的碳会被储存在土壤中,而较少的一部分则被转移到地下碳储存库。使MD草地土壤中的碳含量呈现增多状态,这种现象与地下碳储存中输入的多少及地下生物量具有较大的联系。光合固定中的13C借助植物根系沉积物,被转移至土壤中,并被土壤中的微生物所利用和吸收。未来我们研究重点是13C在土地进行固定、分配微生物的作用机制。
4 结 论
CO2浓度是光合作用的主控因子,通过影响光合碳输入直接作用于草地生物量的积累,进而影响草地光合碳在植物—土壤系统的分配与转移。本研究表明13CO2脉冲标记技术是研究草地光合碳分配与转移的有效手段,其中光合碳在不同草地—土壤系统内分配与转化非常迅速,脉冲标记当天不同退化阶段草地δ13C值均表现为茎叶>根>土壤,随着退化程度的增加呈先增加后降低趋势,由此可知,草地的根部对光合固定新碳的富集程度较大;而在标记当天,不同退化阶段草地地上13C固定百分比例较高,说明标记的效率较高且分配差异较大;脉冲标记21 d后,δ13C值下降,固定的光合碳转移到土壤中的含量显著增加。而MD对土壤有机碳的贡献量最大,显著促进了光合碳向土壤的输入。未来我们应该重点关注大气CO2浓度变化对植物—土壤—微生物互作系统的影响,从而揭示全球变化背景下草地碳循环的新机理。
