近江牡蛎膜分离联产制备多糖多肽及其功能特性研究
2020-03-19杨大俏王锦旭李来好杨贤庆马海霞胡晓
杨大俏,王锦旭,李来好,杨贤庆,马海霞,胡晓
(1.中国水产科学研究院南海水产研究所 农业农村部水产品加工重点实验室,广东 广州 510300; 2.上海海洋大学 食品学院,上海 201306;3.韩山师范学院食品工程与生物科技学院,广东 潮州 521041)
牡蛎俗称蚝或海蛎子,是世界第一大养殖贝类,也是中国四大养殖贝类之一[1],因其具有很高的药用价值[2],成为中国卫计委批准的第一批既是食品又是药品的物品。中国拥有丰富的海洋资源,2017年中国牡蛎养殖产量达到487.9万t,在福建、山东、辽宁、江苏、浙江、广东、广西和海南等地均有相应牡蛎养殖[1]。近江牡蛎Crassostrearivularis主要分布于广东、福建等地,为中国南方沿海主要养殖品种。牡蛎营养价值丰富,经蛋白酶酶解后,所得酶解液中含有小分子活性肽[3-4]、低分子量多糖[5]、牛磺酸[6]及多种活性微量元素。
相关研究显示,多肽[7]和多糖[8-10]具有多种药用功能,对牡蛎多糖和多肽的深入研究有利于制药、功能食品及膳食补充剂等行业的发展[5, 11-12]。日本采用高新生物技术及食品加工技术研制了多种牡蛎制品,包括片剂、口服液及胶囊。美国、欧洲、澳洲等也将牡蛎功能食品及保健品推向产业化。随着牡蛎养殖技术的提高,国内也积极研发了多种牡蛎保健品。目前,国内外对近江牡蛎的研究主要集中在牡蛎多肽的活性及其序列研究,以及牡蛎多糖的提取工艺及结构研究,而关于联产制备牡蛎多糖多肽的抗氧化活性及功能特性的研究较少。
分级膜分离技术[13]是以压差为驱动力,不同分子量的超滤膜具有过滤不同分子和形状物质的性质,使用超滤膜在压力差作用下可分离纯化牡蛎酶解液[14]。多糖结构复杂[15],由己糖醛酸、硫酸多糖和氨基己糖构成的糖胺聚糖,具有多种生物活性[16]。本研究中,利用分级膜分离技术分离近江牡蛎酶解液制备多糖和多肽等功能因子,并检测其理化特性、体外抗氧化活性及结构,旨在为近江牡蛎活性多糖和多肽的联产制备提供理论依据,以提高生产效率,实现近江牡蛎资源的高值化利用。
1 材料与方法
1.1 材料
近江牡蛎购自广东省台山市。
试验试剂:Alcalase酶(210 AU/mg)、胰蛋白酶(≥250 U/mg,广州齐云生物技术有限公司);2,6-二叔丁基-4-甲基苯酚(BHT)、还原型谷胱甘肽(GSH)等试剂均为分析纯;三氟乙酸、乙腈、甲醇等均为色谱纯。
标准品:还原型谷胱甘肽(相对分子质量307.3)、L-氧化型谷胱甘肽(相对分子质量612.63)、杆菌肽(相对分子质量1422.69)、[Glu]Flbrinopeptide B Human(相对分子质量1570.57)、Magainin-Ⅱ(相对分子质量2466.9)、抑肽酶(相对分子质量6511.83)、细胞色素C(相对分子质量12 500);平均分子质量为1000、5000、10 000、50 000、150 000、410 000、670 000的葡聚糖;1,9-二甲基亚甲基蓝、Gly-Gly-Tyr-Arg、2,2-联苯基-1-苦基肼基(DPPH)、葡萄糖、D-葡萄糖醛酸、硫酸软骨素、岩藻糖;11种单糖标准品,18种氨基酸标准品等;均购自Sigma公司。
试验仪器:Sunrise-basic Tacan吸光酶标仪(瑞士TECAN);三联高压平板膜设备(厦门福美科技有限公司);LC-20AD高效液相色谱仪(日本岛津SHINADZU);Agilent 1100液相色谱仪(美国Agilent);UPLC-Q-Tof-MS/MS(Agilent 1290/BrukermaXis impact,美国Agilent)。
1.2 方法
1.2.1 近江牡蛎多糖多肽联产酶解制备工艺 取近江牡蛎全脏器→匀浆→均质→热水浸提0.5 h→调pH至8.0→酶解[17](Alcalase∶胰蛋白酶=0.58%∶0.22%)→煮沸灭酶→离心10 min(9000 r/min)→上清液调pH至7.0→0.22 μm滤膜除杂→滤液过相对分子质量为200 000的膜分离[18]→收集截留液→滤液过相对分子质量为8000的膜分离→收集过滤液、截留液→浓缩冻干得各膜分离组分[19],相对分子质量为0~8000的组分记为CRRS-A(多肽组分),相对分子质量为8000~200 000的组分记为CRRS-B(多糖组分),相对分子质量>200 000的组分记为CRRS-C(多糖组分)。
1.2.2 近江牡蛎酶解液膜分离组分含量测定 取CRRS-A、CRRS-B、CRRS-C冻干粉,用水配制成浓度为1 mg/mL的溶液。采用三氯乙酸沉淀法测定多肽含量[20];采用1,9-二甲基亚甲基蓝法测定酸性糖含量[21];将溶液稀释200倍后采用苯酚-硫酸法及DNS法[22]测定多糖含量;采用尹珊珊[23]的方法测定甲基戊糖含量;采用硫酸-咔唑法[24]测定己糖醛酸含量;采用明胶-氯化钡比浊法[25-26]测定硫酸基含量;采用Wanger法[27]测定氨基己糖含量。
称取两份0.05~0.20 g CRRS-A冻干品于密封瓶中,进行酸解(17种氨基酸处理方式相同)、碱解(色氨酸处理方式相同)后参照文献[28]的方法进行氨基酸测定。取CRRS-B、CRRS-C冻干粉经三氟乙酸(TFA)酸解后,反复加甲醇氮气吹净TFA,加入1 mL 0.3 mol/L氢氧化钠溶液,制得多糖水解液,将多糖水解液与11种单糖标准品按照文献[29]的方法进行PMP衍生,测定单糖含量。
1.2.3 近江牡蛎酶解液膜分离组分分子量测定 采用高效体积排阻色谱(HPSEC)法[30]测定近江牡蛎CRRS-A(多肽组分)的分子量分布,使用色谱柱TSK-GEL®G2000SWXL(7.8 mm×300 mm,5 μm),在20∶80(0.1% TFA 乙腈∶0.1%TFA 水)、0.5 mL/min、10 μL、紫外检测器220 nm的条件下洗脱,将标准品及样品配制成0.25 mg/mL溶液,以相对分子质量的对数(logMW)对保留时间(t)作图,得到标准品色谱图及分子量回归方程:logMW=-0.0037t2-0.0821t+5.6697(R2=0.9912)。用峰面积归一法计算CRRS-A多肽组分相对分子质量的分布情况。
采用高效凝胶渗透色谱法(HPGPC)[31]测定近江牡蛎CRRS-B、CRRS-C(多糖组分)的分子质量分布,使用色谱柱Tosoh Biosep®G4000SWXL(7.5 mm×300 mm, 5 μm),在0.2 mol/L硫酸钠、0.7 mL/min、20 μL、示差折光检测器等条件下洗脱,将7种标准品及样品混合配制成0.5 mg/mL的溶液,以相对分子质量的对数(logMW)对保留时间(t)作图,得到标准品色谱图及分子量回归方程:logMW= 8×1021t-13.13(R2=0.9828)。用峰面积归一法计算CRRS-B、CRRS-C多糖组分相对分子质量的分布情况。
1.2.4 近江牡蛎酶解液膜分离组分体外活性测定 参考文献[32]的方法略做改进,各样品及阳性对照物BHT和GSH在相同浓度下测定其体外活性,分别在0.05、1、1 mg/mL浓度下测定DPPH自由基、羟基自由基和超氧阴离子自由基的清除能力。按下式计算DPPH自由基清除率(K1,%)、羟基自由基清除能力(K2,U/mL)和超氧阴离子清除能力(K3,U/g):
其中:AB为空白管吸光度值;A为样品管吸光度值;AD为DPPH自由基反应管吸光度值;AS为标准管吸光度;AC为未损伤管(对照管)吸光度;CS1为H2O2标准品浓度(mmol/L);V为取样量(mL);F为样品测试前稀释倍数;CS2为维生素C标准品浓度(0.15 mg/mL);D为样品浓度(g/L)。
1.2.5 近江牡蛎酶解液膜分离组分基本结构鉴定 采用UPLC-Q-Tof-MS/MS法对CRRS-A多肽组分进行结构鉴定。UPLC色谱参数为:色谱柱Agilent SB-C18 RRHD(50 mm×2.1 mm,1.8 μm);进样量为10 μL;流速为0.2 mL/min;波长为220 nm;流动相A为水,流动相B为甲醇。洗脱程序:0~1 min,15% B;1~4 min,90% B;4~10 min,90% B;10~10.5 min,15% B;10.5~12 min,15% B。MS检测参数为:ESI阳离子模式,相对分子质量扫描范围为50 000~2000 000,单电荷状态[M+H]+检测分子质量,毛细管电压为3500 V,电离电压为2000 V,脱溶剂温度为500 ℃,干燥气温度为180 ℃,干燥气流速为4 L/min。
利用傅立叶变换红外光谱检测CRRS-B、CRRS-C基本结构,方法参照文献[31]。
1.3 数据处理
试验均经过3次重复操作,试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 20.0软件对数据进行统计分析,运用单因素方差分析(One-way ANOVA)检测平均值显著性,显著性水平设为0.05。
2 结果与分析
2.1 近江牡蛎酶解液3种分离组分的成分
以测定指标吸光度值为x轴,以测定指标浓度为y轴,建立标准曲线回归方程。从表1可见,各测定指标的相关系数均在0.99以上,表明回归方程拟合良好。近江牡蛎酶解液膜分离组分CRRS-A、CRRS-B、CRRS-C的成分含量测定结果如图1所示,其中,CRRS-A组分多肽含量最高(P<0.05),为(87.26±1.65)%,除氨基己糖含量以外的其余糖基含量均较低且显著低于CRRS-B、CRRS-C组分(P<0.05);CRRS-B组分中的多糖含量最高(P<0.05),为(75.82±0.28)%,还含有己糖醛酸(5.06±0.60)%、甲基戊糖(31.23±1.29)%、硫酸基(23.47±0.7)%、氨基己糖(2.29±0.04)%,甲基戊糖、硫酸基及己糖醛酸含量均显著高于CRRS-A、CRRS-C组分(P<0.05);CRRS-C组分中的多肽与多糖含量相当,酸性糖含量相对较高(P<0.05)。说明CRRS-A主要为多肽组分,CRRS-B为含有丰富基团的多糖组分,CRRS-C由含多肽链的多糖组成(视为多糖组分),证明8000、200 000超滤膜选取适当。
表1 测定指标标准曲线回归方程及相关系数
Tab.1 Regression equations and correlation coefficients of test indices for southern oysterCrassostrearivularis
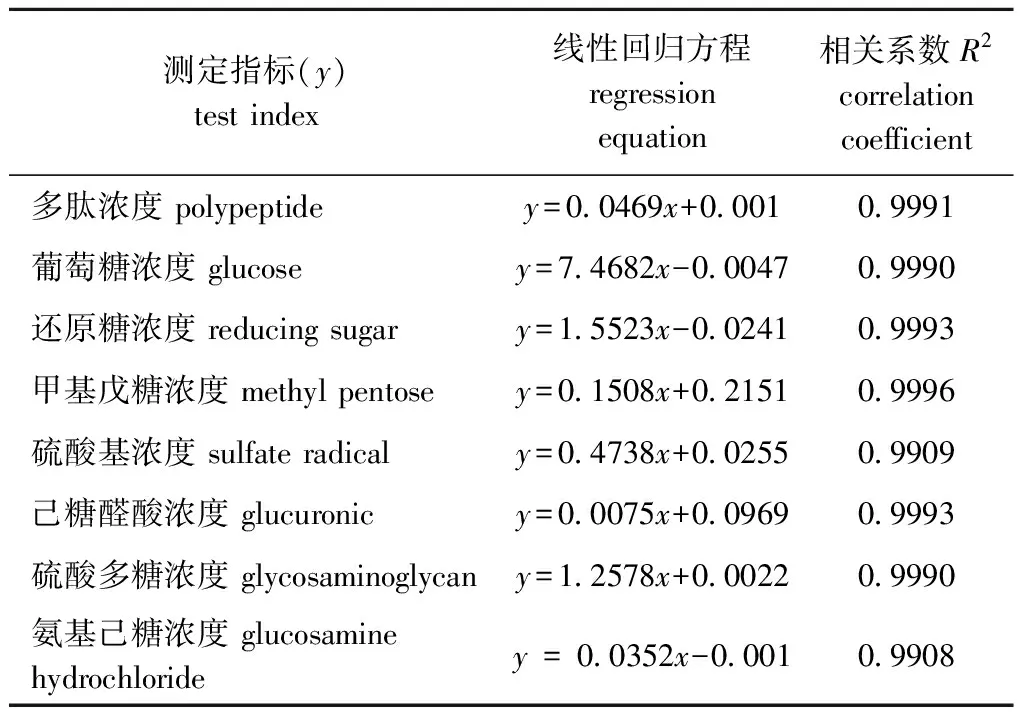
测定指标(y)test index线性回归方程regression equation相关系数R2correlation coefficient多肽浓度 polypeptidey=0.0469x+0.0010.9991葡萄糖浓度 glucosey=7.4682x-0.00470.9990还原糖浓度 reducing sugary=1.5523x-0.02410.9993甲基戊糖浓度 methyl pentosey=0.1508x+0.21510.9996硫酸基浓度 sulfate radicaly=0.4738x+0.02550.9909己糖醛酸浓度 glucuronicy=0.0075x+0.09690.9993硫酸多糖浓度 glycosaminoglycany=1.2578x+0.00220.9990氨基己糖浓度 glucosamine hydrochloridey = 0.0352x-0.0010.9908
从表2可见:近江牡蛎酶解液联产制备多肽组分CRRS-A的氨基酸组成相对完整,其中脯氨酸的相对含量达到(50.61±0.69)%,组氨酸、谷氨酸、天冬氨酸、赖氨酸、精氨酸的相对含量均较高。从表3可见:CRRS-B组分含有葡萄糖最多,为(26.95±0.77)%,还含有氨基葡萄糖、阿拉伯糖、氨基半乳糖、甘露糖、核糖、半乳糖醛酸、葡萄糖醛酸、半乳糖,不含鼠李糖、木糖;CRRS-C组分的单糖相对含量普遍低于CRRS-B组分(CRRS-C杂质含量较高),但相对含量数值趋势一致,为葡萄糖>氨基葡萄糖>阿拉伯糖>氨基半乳糖>甘露糖>核糖>半乳糖醛酸>葡萄糖醛酸>半乳糖,不含鼠李糖、木糖。可见,CRRS-B为氨基含量丰富且多糖纯度较高的多糖链。
表2 近江牡蛎酶解液分级膜分离多肽组分CRRS-A的氨基酸组成
Tab.2 Amino acid composition of CRRS-A from southern oysterCrassostrearivularisby fractional ultrafiltration %
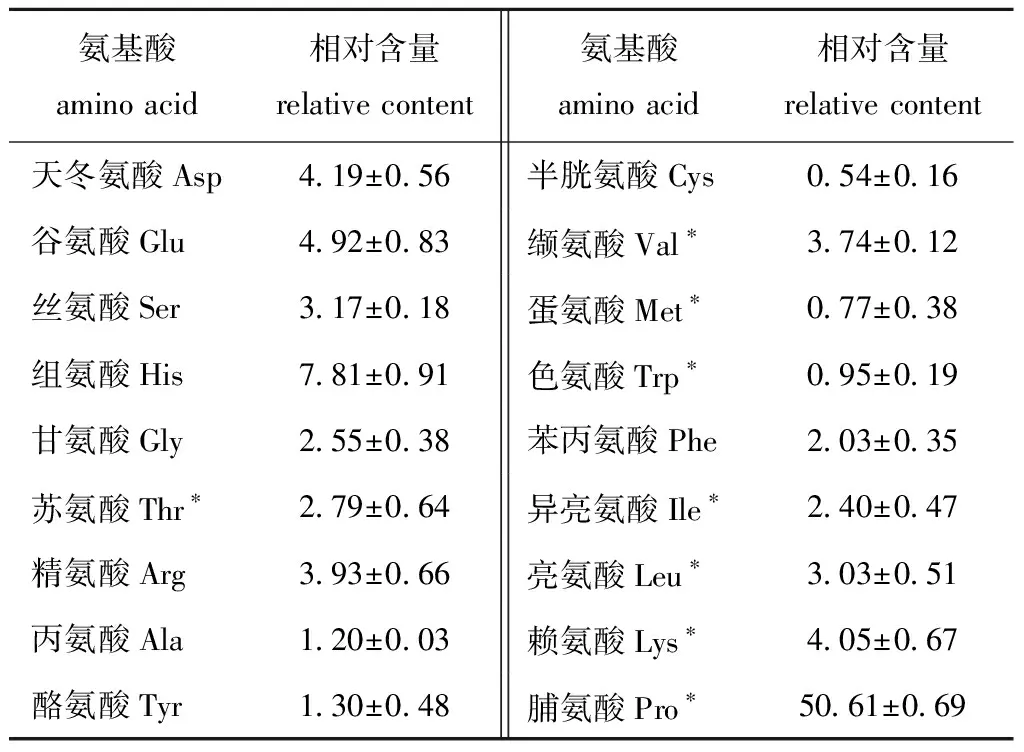
氨基酸amino acid相对含量relative content氨基酸amino acid相对含量relative content天冬氨酸Asp4.19±0.56半胱氨酸Cys0.54±0.16谷氨酸Glu4.92±0.83缬氨酸Val∗3.74±0.12丝氨酸Ser3.17±0.18蛋氨酸Met∗0.77±0.38组氨酸His7.81±0.91色氨酸Trp∗0.95±0.19甘氨酸Gly2.55±0.38苯丙氨酸Phe2.03±0.35苏氨酸Thr∗2.79±0.64异亮氨酸Ile∗2.40±0.47精氨酸Arg3.93±0.66亮氨酸Leu∗3.03±0.51丙氨酸Ala1.20±0.03赖氨酸Lys∗4.05±0.67酪氨酸Tyr1.30±0.48脯氨酸Pro∗50.61±0.69
注:*为必需氨基酸
Note:*,the essential amino acid
2.2 近江牡蛎酶解液膜分离多肽多糖组分的分子质量
从图2可见:由峰面积归一法计算得出,近江牡蛎CRRS-A多肽组分大部分是相对分子质量在2000以下的小分子肽,占86.87%;CRRS-B多糖组分的相对分子质量为8300~150 000,占99.98%;CRRS-C多糖组分的相对分子质量为66 000~7 152 000,占91.33%。
表3 近江牡蛎酶解液分级膜分离多糖组分CRRS-B、CRRS-C的单糖组成及其相对含量
Tab.3 Monosaccharide composition of CRRS-B and CRRS-C from southern oysterCrassostrearivularisby fractional ultrafiltration

单糖monosaccharide相对含量relative content/%CRRS-BCRRS-C甘露糖Man6.10±0.313.89±0.35核糖Rib4.66±0.572.87±0.78鼠李糖Rham——氨基葡萄糖GlcN9.08±0.415.85±0.64葡萄糖醛酸GlcUA2.22±0.221.28±0.15半乳糖醛酸GalUA3.62±0.732.25±0.51葡萄糖Glc26.95±0.7717.75±0.84氨基半乳糖GalN6.91±0.244.40±0.16半乳糖Gal1.50±0.680.80±0.04木糖Xyl——阿拉伯糖Ara8.19±0.475.26±0.31
2.3 近江牡蛎酶解液膜分离组分的基本结构
图3为近江牡蛎酶解液膜分离多肽组分CRRS-A的总离子流图。经分析,近江牡蛎多肽包含10个组分,对10个组分分别进行一级质谱及二级质谱分析,鉴于版面所限,本研究中仅列出化合物1和化合物2的质谱图,其他化合物的质谱图见电子版附录1。其氨基酸分别为:化合物1(m/z286.1982)Ala-Pro-Val;化合物2(m/z272.1981)Pro-Arg;化合物3(m/z753.3862)Phe-Cys-Lys-Val-Pro-Ala-Ser;化合物4(m/z770.4047)Ser-Arg-Met-Tyr-Thr-Leu/Ile;化合物5(m/z960.5304)Leu/Ile-Glu-Lys-Gly-Ser-Gly-Lys-Glu-Leu/Ile;化合物6(m/z731.4652)Phe-Asp-Lys-His-Lys-Gly;化合物7(m/z961.5289)Cys-Trp-Lys-Trp-Pro-Gly-Gly-Gly-Ala;化合物8(m/z962.5292)Pro -Leu/Ile-Ser-Ala-Asp-Cys-Ser-Gly-Gly-Arg; 化合物9(m/z872.5385)Pro-Lys-Ser-Leu/Ile-Lys-Gly-Gly-Trp;化合物10(m/z921.5591)Tyr-Gly-Arg-Ser-Trp-Arg-Pro。
CRRS-B冻干粉末呈淡黄色,CRRS-C冻干粉末颜色稍深。图4为CRRS-B和CRRS-C的红外光谱图。从图4可见:CRRS-B中,3423.35 cm-1处为O-H伸缩振动,2924.09 cm-1处为C-H伸缩振动,这是糖类化合物的典型吸收峰,1548.84 cm-1和1651.07 cm-1处的强吸收峰是酰胺键(肽键)特征吸收峰[33],1600~1650 cm-1处是糖类化合物C=O伸缩振动峰,1080.14 cm-1处有一吸收峰,结合717.52 cm-1处为吡喃环对称伸缩振动,推断CRRS-B为吡喃型,1151.50 cm-1处为-C-O伸缩振动峰,说明CRRS-B含有叔醇,1238.30 cm-1处有吸收峰,推断其含有乙酸酯,1651.07 cm-1处为C=C伸缩振动,2852.72 cm-1处为-CH2对称伸缩振动峰,1400.32 cm-1处为-OH弯曲振动峰;CRRS-C中,在3327.20 cm-1和2933.70 cm-1处有强吸收峰,这是糖类化合物的特征峰,1666.50 cm-1处为C=C伸缩振动,1454.30 cm-1处为-CH3或芳烃的侧面环伸缩振动峰,1400.30 cm-1处为-OH弯曲振动峰,1242.10 cm-1处为-O-C(O)-C伸缩振动峰,1029.90 cm-1处为C-O伸缩振动,931.62 cm-1处为吡喃环的非对称伸缩振动和对称伸缩振动峰,1539.60 cm-1处的强吸收峰是酰胺Ⅱ带的特征吸收峰。红外光谱再次证明了CRRS-B、CRRS-C为结构相似的多糖,糖苷键类型为吡喃型,且由峰型可判断,CRRS-C含多肽链多于CRRS-B(与“2.1”节结果一致)。
2.4 近江牡蛎酶解液膜分离组分体外活性
从图5可见:与抗氧化剂BHT和GSH相比,各组分DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力存在显著性差异(P<0.05),CRRS-A组分具有较高的DPPH自由基、羟基自由基及超氧阴离子清除能力,分别为(93.80±0.87)%、(67.29±5.47)U/mL、(116.67±3.22) U/g,与BHT、GSH 两个抗氧化剂相比,DPPH自由基清除能力与BHT及GSH相当(P>0.05),但其羟基自由基清除能力与超氧阴离子清除能力显著高于BHT和GSH(P<0.05);CRRS-B组分的羟基自由基清除能力、超氧阴离子清除能力显著高于BHT(P<0.05),但显著低于GSH(P<0.05);CRRS-C组分的DPPH自由基、羟基自由基、超氧阴离子清除能力均显著低于GSH(P<0.05)。综上,近江牡蛎酶解液分级膜分离组分具有较高的抗氧化活性,依次为CRRS-A>CRRS-B>CRRS-C,因此,CRRS-A、CRRS-B可作为天然抗氧化剂。
3 讨论
3.1 联产制备牡蛎多糖多肽的优势分析
关于多种物质同时提取或联产的研究,国内主要集中在油料作物和中草药活性成分的提取研究,针对更高效地利用海洋生物资源的工艺研究还较少;国外研究在这一方面几乎还是空白,尤其是对于高蛋白海洋生物而言。近江牡蛎的多糖多肽通常以糖链或肽链的方式连接于蛋白分子或碳水化合物上,形成糖蛋白或糖胺聚糖,本研究中运用酶解工艺将糖复合物分解为糖链或肽链,并将蛋白分解为肽段,得到的多糖多肽具有不同的理化性质。膜分离方法具有提取效率高、设备简单、低能耗、无污染和无相变的优点,故可用于分离分子量差异较大的牡蛎多糖多肽。
3.2 牡蛎多糖多肽的抗氧化活性分析
Hao等[34]发现,组氨酸、脯氨酸、甲硫氨酸、半胱氨酸、酪氨酸、色氨酸和苯丙氨酸等氨基酸对提高牡蛎抗氧化活性起到重要作用。由于本研究中CRRS-A具有较高含量的脯氨酸(50.61%)及组氨酸(7.81%),且脯氨酸参与构成胶原蛋白肽,可初步判断CRRS-A具有抗氧化活性。Seo等[35]酸解太平洋牡蛎Crassostreagigas得到的抗菌肽相对分子质量为5500,Wang等[36]酶解牡蛎Crassostreatalienwhanensis得到两种抗氧化肽,相对分子量分别为518、440,且Ug等[37]指出,当鱼蛋白水解肽分子量低于1000时具有较高的抗氧化活性。天然多肽通常含有较多自由基结合位点,且分子量越小,其抗氧化能力越强(结合位点越多),本研究中CRRS-A的相对分子质量在2000以下,占86.87%。由于CRRS-A的相对分子质量远小于CRRS-B、CRRS-C,因此,CRRS-A的体外抗氧化活性大于CRRS-B及CRRS-C,与体外抗氧化测定结果一致。
Umayaparvathi等[7]试验得出牡蛎Saccostreacucullata的抗氧化肽具有较高DPPH、羟基自由基、超氧阴离子清除能力,分别为(85.70±0.37)%、(79.32±0.65)%、(81.6±0.3)%。徐兆刚等[38]酶解河蚌蛋白,得到DPPH自由基、羟基自由基、超氧阴离子自由基清除能力分别为89.98%、82.29%及51.08%的河蚌肽,得出其具有较好的综合抗氧化活性,河蚌蛋白肽可作为天然抗氧化剂。本研究中得出,CRRS-A具有较高的DPPH自由基、羟基自由基及超氧阴离子清除能力,分别为(93.80±0.87)%、(67.29±5.47)U/mL、(116.67±3.22)U/g,CRRS-B的糖基相对含量高于CRRS-C,多糖纯度较高,且分子质量小于CRRS-C,故其体外抗氧化活性优于CRRS-C,又与同浓度BHT相比,CRRS-B的体外抗氧化活性优于BHT;CRRS-C为杂质含量较多的混合物,具有更为复杂的结构,因而其与自由基作用效果不明显。
本研究成果可为开发利用近江牡蛎活性多肽多糖以制备辅助抗氧化产品提供理论和技术参考,但研究方法多为体外结合化学试验,缺少必要的生物手段,因此,需进行进一步的细胞试验及动物模型活性研究,完善该项膜分离分级分离技术应用。
4 结论
(1)近江牡蛎酶解液分级膜分离相对分子质量为0~8000的组分CRRS-A主要由多肽组成,含量达到(87.26±1.65)%,相对分子量<2000,由10种化合物组成,具有较高的体外抗氧化活性,DPPH自由基清除能力、羟基自由基清除能力较强,超氧阴离子清除能力高于抗氧化剂还原型谷胱甘肽(GSH),达到(116.67±3.22) U/g,可作为天然抗氧化剂。
(2)相对分子质量为8000~200 000的组分CRRS-B含有(75.82±0.28)%的多糖,还含有己糖醛酸(5.06±0.60)%、甲基戊糖(31.23±1.29)%、硫酸基(23.47±0.7)%、氨基己糖(2.29±0.04)%,相对分子量范围8300~150 000,为吡喃型多糖化合物,体外抗氧化能力总体优于抗氧化剂2,6-二叔丁基-4-甲基苯酚(BHT),劣于还原型谷胱甘肽(GSH)。
(3)相对分子质量>200 000的组分CRRS-C为吡喃型糖蛋白,分子量为66 000~7 152 000,体外抗氧化活性较差,利用价值不高。
