RB1基因表达与突变对乳腺癌患者临床预后的影响*
2020-03-18温永琴徐咏强何建芳黄会杰朱莹周婵张丽君
温永琴, 徐咏强, 何建芳, 黄会杰, 朱莹, 周婵, 张丽君
东莞市人民医院病理科(广东东莞 523059)
视网膜母细胞瘤(retinoblastoma,Rb)基因1(RB1)是肿瘤抑制基因。RB1是第1个被克隆的肿瘤抑制基因,RB1对人类视网膜母细胞瘤的发生发展具有重要的作用[1]。既往研究[2]表明,RB1基因在乳腺癌患者中经常发生突变,特别是在三阴性乳腺癌中。Rb蛋白主要作为转录辅因子起作用,它能结合激活E2Fs,E2F1/2/3a的反式激活结构域,并募集染色质修饰因子如组蛋白脱乙酰酶和甲基化酶以沉默基因表达[3]。Rb蛋白也结合多种其他细胞蛋白[4],但它主要通过激活E2F的调节发挥其对细胞增殖和存活的抑制作用。既往研究[5]显示Rb基因缺失可导致细胞增殖的失调从而促进了癌症的生长,且在大多数类型的癌症中,Rb蛋白的失活伴随着诸如p53的失活从而促进肿瘤存活途径的诱导。同时,RB1基因的缺失直接影响了肿瘤患者的药物使用,既往对于RB1基因的研究主要集中在肺癌、卵巢癌以及膀胱癌[6],但RB1基因表达及蛋白的表达水平在乳腺癌中的作用仍未明确。因此,进一步明确RB1基因及其蛋白在乳腺癌中的表达水平对临床特征及预后的影响,对乳腺癌的防治具有重要意义。本研究旨在探讨乳腺癌患者组织中RB1基因及蛋白表达与临床特征的关系,并分析RB1基因表达与突变对临床预后的影响。
1 资料与方法
1.1 一般资料 选择2015年1月至2017年6月于我院行手术治疗的乳腺癌患者共250例,取其保存的病理石蜡切片进行检查,纳入标准:(1)经病理确诊为乳腺癌;(2)术前未行新辅助放化疗;(3)所有患者获得完整随访。排除病历资料不完整或失访的患者,以及合并机体免疫性疾病或长期使用激素治疗的患者。所有标本均取其癌组织和癌旁组织进行后续研究,本研究获得医院伦理委员会审核并批准。250例乳腺癌患者,年龄35~71岁,平均(54.6±7.3)岁。记录所有患者的基本临床资料,包括肿瘤大小、组织分级、淋巴结转移、表皮生长因子受体2(HER2)、雌激素受体(ER)、孕酮受体(PR)以及TNM分期。
1.2 免疫组化检测 将石蜡包埋的乳腺癌组织和癌旁正常组织以5 μm厚度进行组织切片。将组织切片进行脱蜡水化后,采用柠檬酸盐缓冲液中进行抗原修复,应用过氧化氢阻断内源性过氧化物酶活性。采用山羊血清进行封闭后,采用兔Anti-RB-1抗体(ab224426,Abcam)以1∶100稀释后,在4℃条件下进行一抗孵育过夜,随后在室温条件下与HRP标记的山羊二抗孵育。最后采用二氨基联苯胺(DAB)作为底物进行变色反应,然后苏木精复染并封片。所有切片RB1的表达水平由2位有经验的病理师在随机选择5个高倍镜视野(200×)进行评估,具体的评估方法为:染色强度(0为未染色; 1为弱染; 2为中等染; 3为强染),同时记录阳性表达RB1的范围(计分为0:<5%; 1:5%~25%; 2:26%~50%; 3:51%~75%; 4:76%~100%)。将RB1的染色强度计分和阳性表达范相乘以获得复合表达分数(composite expression score,CES)[7],将得到RB1的表达水平的CES,将患者分为两组,RB1低表达(CES <6)和高表达组(CES≥6)。
1.3 RB1表达的生物信息学分析 采用Kaplan-Meier Plotter工具(http://kmplot.com/analysis/)分析RB1基因与乳腺癌患者临床预后的关系。采用cBioPortal工具(http://www.cbioportal.org/)分析RB1基因在乳腺癌病例集中的突变水平,并分析乳腺癌患者RB1基因突变与非突变患者临床预后的关系。

2 结果
2.1 RB1在乳腺癌和癌旁组织的表达水平对比 250例患者的乳腺癌和癌旁组织中,其中乳腺癌组织的RB1表达水平的CES得分平均为4.8±1.6,而癌旁组织为5.2±2.1,其中乳腺癌组织的RB1表达水平显著低于正常癌旁组织,差异有统计学意义(P<0.05),不同表达RB1水平的癌组织和癌旁组织见图1。
2.2 乳腺癌RB1表达水平与乳腺癌临床特征的关系 其中RB1表达水平与乳腺癌的年龄、组织分级、HER2、ER和PR的阳性比例均没有显著的相关性(P>0.05),而RB1低表达的患者其肿瘤最大径≥3 cm、淋巴结转移以及TNM分期为Ⅲ~Ⅳ期的患者比例均显著高于RB1高表达的患者,差异有统计学意义(P<0.05),见表1。
2.3 乳腺癌组织中RB1表达水平与临床预后的关系 250例乳腺癌患者随访时间为6~47个月,中位随访时间为33个月, 其中RB1高表达的患者其总体生存率显著高于RB1低表达的患者,差异有统计学意义(HR=0.56,95%CI:0.32~0.97,P=0.036)。见图2~3。
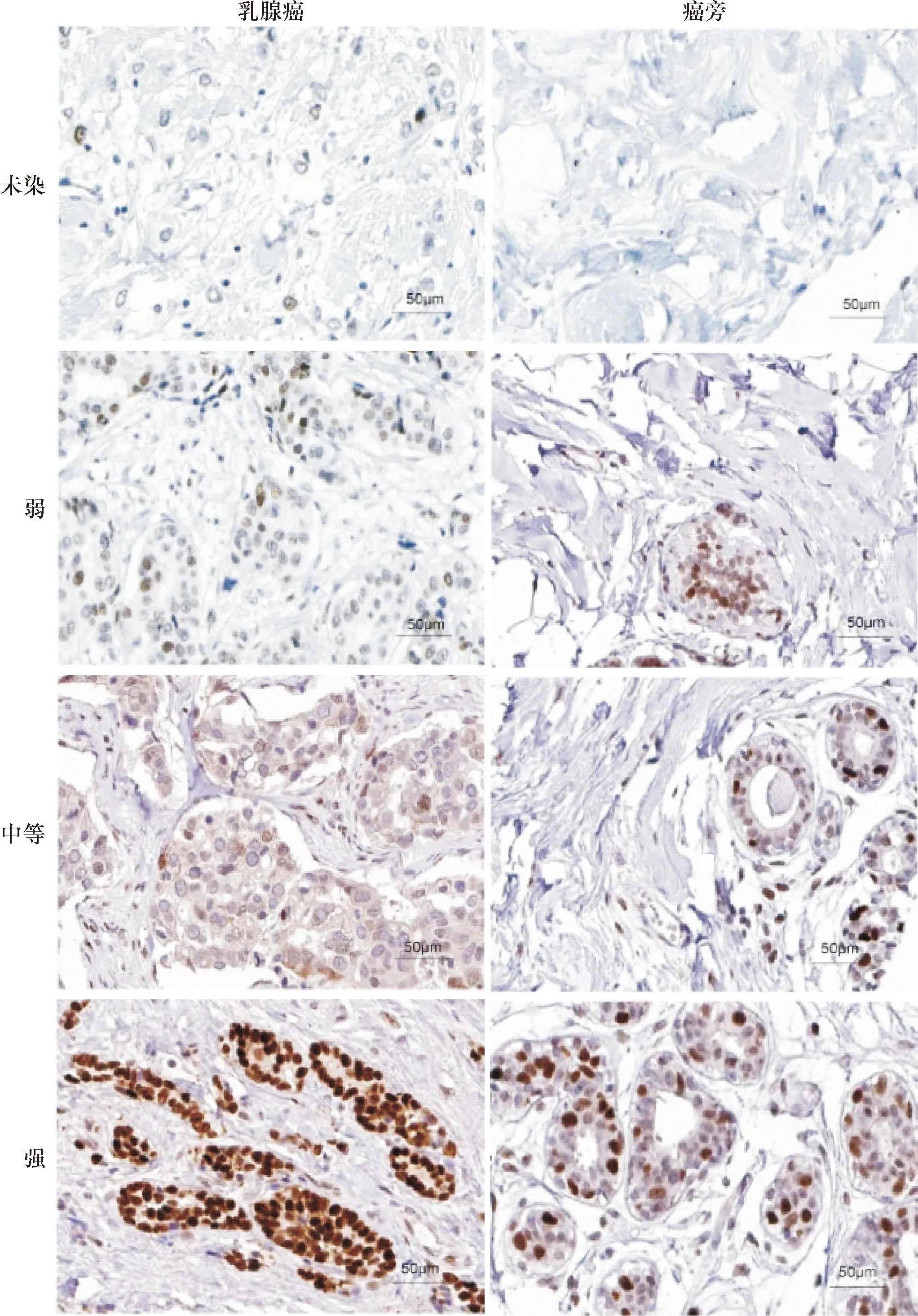
图1 乳腺癌组织和癌旁组织的不同RB1表达水平(免疫组化,×200)
2.4 RB1表达与乳腺癌临床预后的多元Cox回归分析 Cox 多因素模型分析结果显示乳腺癌患者的TNM分期及RB1表达水平显著影响患者的临床预后(P<0.05),见表2。
3 讨论
乳腺癌是一种异质性疾病,其中不同的病理学和基因表现影响患者的临床预后和治疗方案。通常,ER和PR或HER2扩增状态的存在直接影响了治疗的过程[8]。由于乳腺癌中复杂的分子机制,既往研究[9]表明,RB1和Tp53是肿瘤的重要抑癌基因,也参与了乳腺癌在内的许多人类癌症的发生和进展。同时,有研究[10]显示RB1和Tp53在28%~40%的三阴性乳腺癌患者中一起存在失活状态,且通常由纯合缺失引起的RB基因缺失主要发生在三阴性乳腺癌中。然而,在内分泌治疗后的促转移性肿瘤微环境中,RB1表达损失更加明显。既往研究[11]显示RB也可以通过由含有CDK4/6的复合物引发的磷酸化而失活。在乳腺癌中,异常的CDK4/6活性可解除对RB磷酸化的正常控制,活性细胞周期蛋白-CDK复合物对Rb(pRb)的磷酸化导致E2F家族转录因子的释放,以及S期进入所需基因的转录。CDK4/6作为治疗靶标的重要性现已在ER/PR阳性乳腺癌中得到充分证实。但即使这些药物有效,仍难以阻碍疾病的临床进展,这可能与RB1基因表达损失的有关。由于RB1基因与乳腺癌存在密切的关系,但目前对于RB1基因、蛋白表达水平以及其突变对于乳腺癌患者临床预后的影响仍未明确。本研究拟通过临床样本以及生物信息学初步明确了RB1基因和蛋白高表达是乳腺癌预后良好的标记物,但RB1基因突变的乳腺癌患者预后不良。RB1基因表达水平与肿瘤大小、淋巴结转移以及TNM分期密切相关,表明了抑癌基因RB1基因发生突变是影响乳腺癌预后不良的重要风险因素。
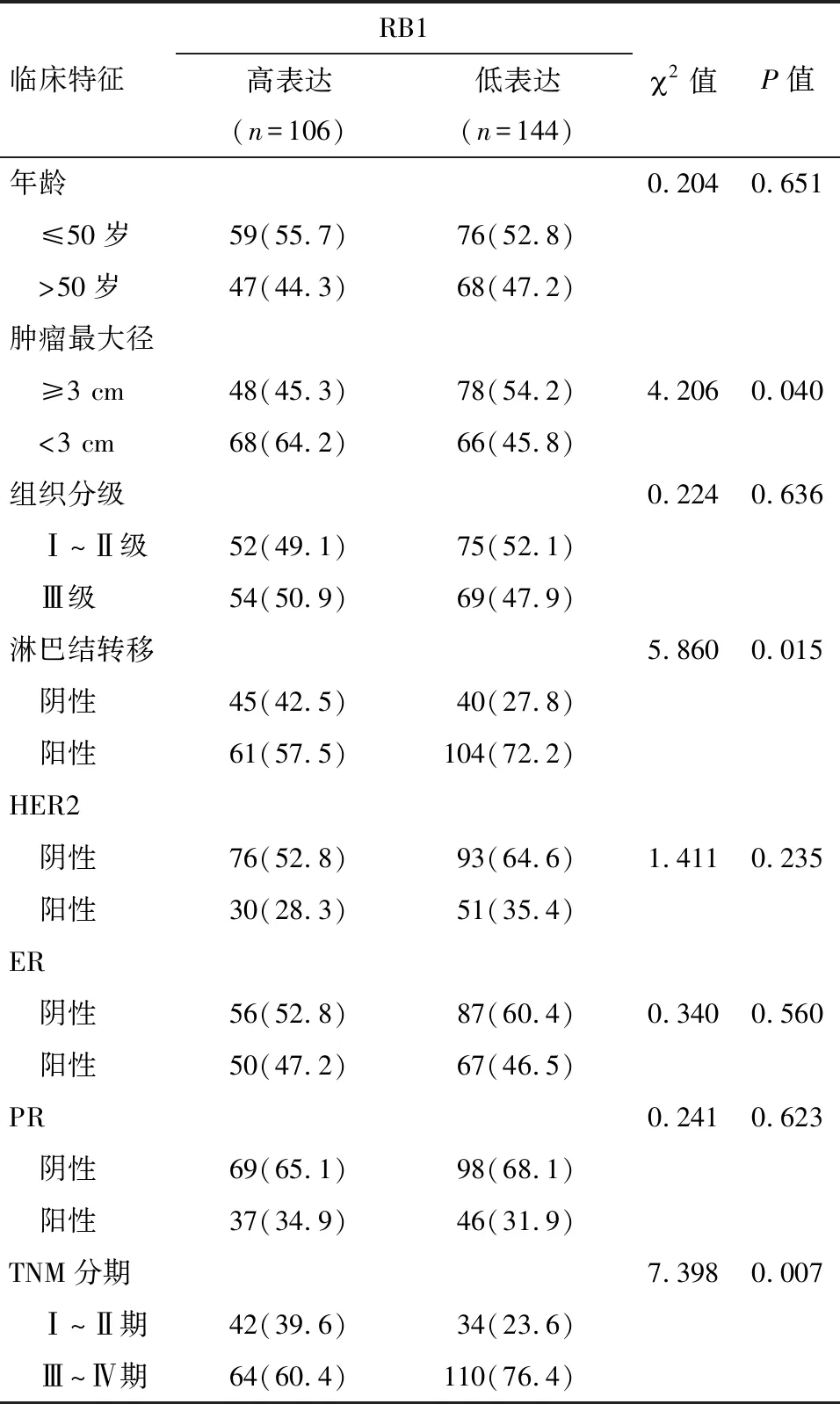
表1 乳腺癌组织中RB1表达水平与临床特征的关系 例(%)
肿瘤抑制基因RB1基因调节细胞周期导致细胞分裂的过程,并且CDK4和CDK6酶阻断RB1活性,这可导致不受控制的细胞增殖和生长[12]。因此,本研究结果显示,RB1蛋白在乳腺癌中的表达水平显著下降,且RB1蛋白在乳腺癌中的表达水平与肿瘤大小和淋巴结转移密切相关,本研究结果与既往研究[13]结果表明RB1基因在肿瘤细胞周期调控的重要作用相一致。虽然乳腺癌的CDK 4/6抑制剂可以抑制肿瘤的增殖,但容易在治疗反应数月后出现耐药性。有研究[14]表明,RB1基因的突变导致RB1基因功能丧失并因此导致促进了肿瘤对CDK4/6抑制剂的抗性。本研究中采用Kaplan-Meier Plotter数据库的结果显示了虽然RB1基因高表达其乳腺癌患者预后更优,但进一步分析RB1基因突变的患者其预后显著差于非突变的患者,表明了RB1基因突变严重影响了RB1基因的抑癌功能。
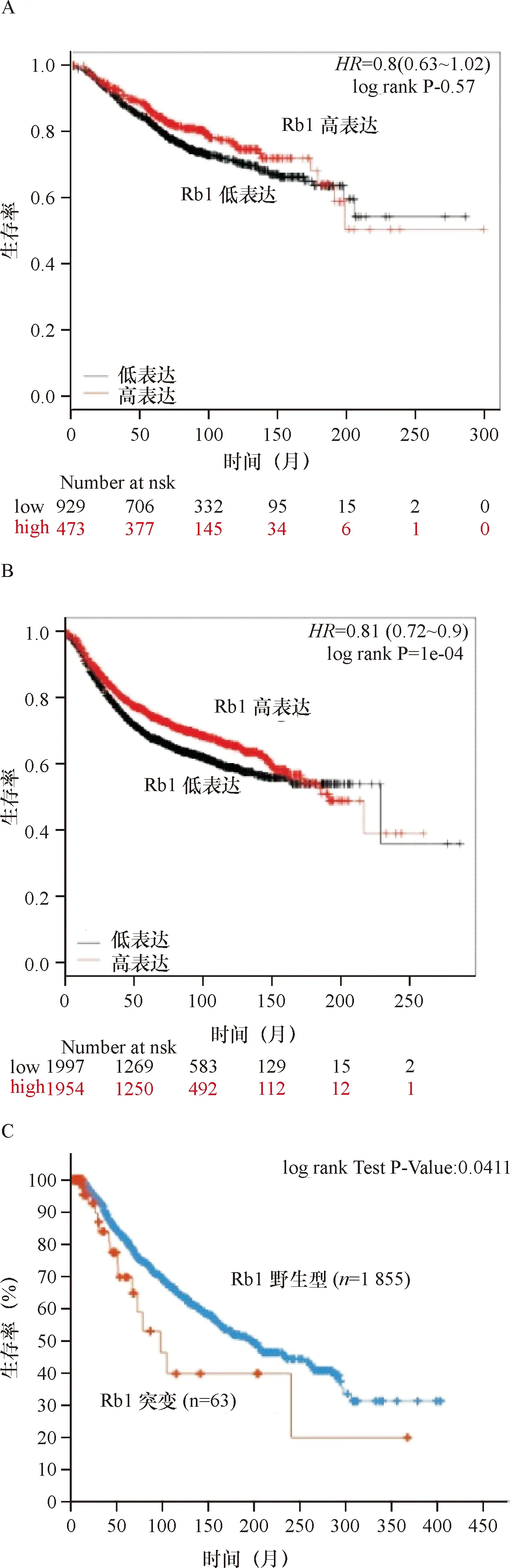
注:A:不同RB1表达水平对乳腺癌总体存活率的影响(n=1 420);B:不同RB1表达水平对乳腺癌无复发生存率的影响(n=3 951);C:RB1突变与非突变对患者的总体存活率的影响(n=1 918)
图2乳腺癌RB1基因表达及突变对临床预后的影响
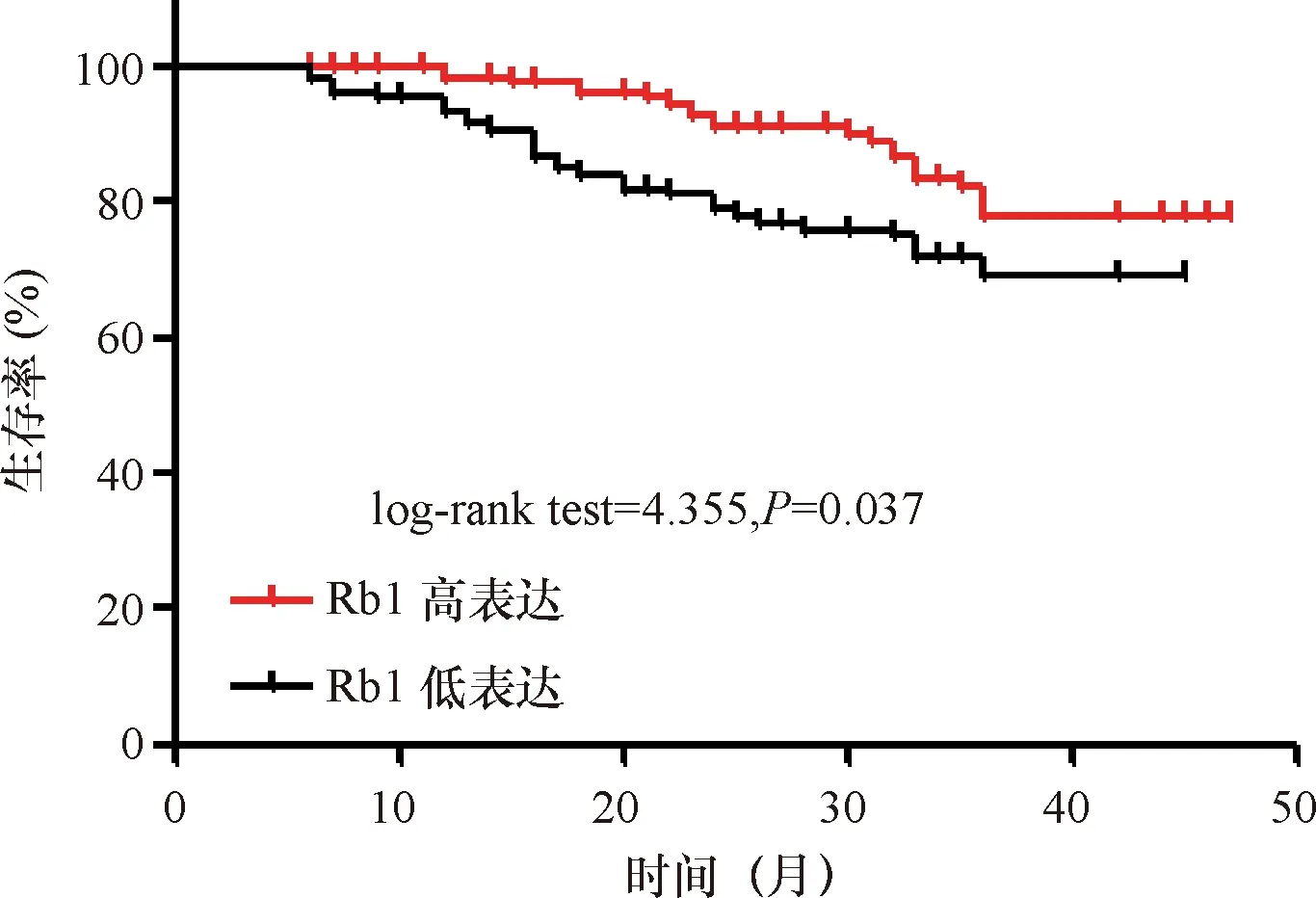
图3 乳腺癌RB1表达水平与临床预后的关系
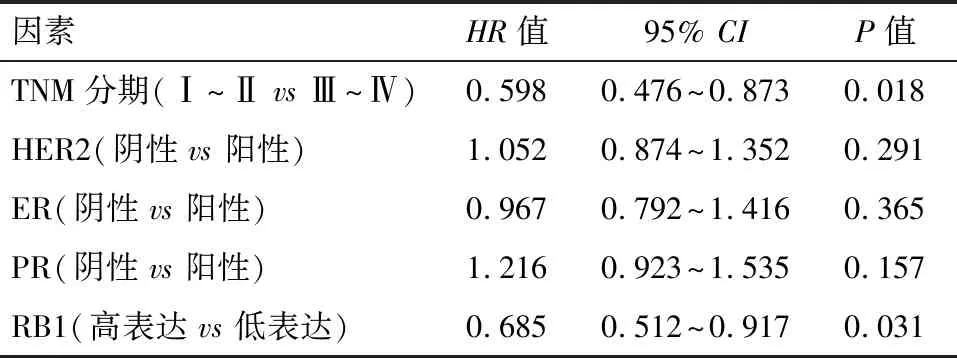
表2 乳腺癌患者Cox多因素生存分析
本研究结果也进一步显示,乳腺癌组织样本中,RB1高表达患者的总体生存率更优。既往有研究[15]表明RB1基因富集的卵巢癌患者其预后更好,联合PD0332991 与卡铂或紫杉醇共同治疗时能显著提高RB1基因富集卵巢癌患者的临床疗效。同时,在肺癌中,抑制RB1后可导致p16 表达上调,p16 保护RB1 缺乏的细胞免受DNA损伤,也导致了基因的不稳定,增加了细胞的增殖功能[16]。RB1 的表达水平也是膀胱癌患者膀胱灌注化疗治疗效果以及肿瘤复发的预测因子[17]。而本研究结果也显示RB1高表达水平是乳腺癌患者预后良好的重要因素。虽然本研究对纳入的样本进行了蛋白水平的评估,但本研究并未对所纳入的标本进行RB1基因突变检测,对于RB1基因突变其对蛋白功能的影响以及对乳腺癌患者预后的影响仍需要进一步加大样本量进行评估。
综上所述,乳腺癌RB1表达水平与肿瘤的大小、淋巴结转移及临床预后密切相关,RB1基因高表达显著改善乳腺癌患者的临床预后,合并RB1基因突变的乳腺癌患者预后较差。
