蝴蝶形单分子配合物的合成、晶体结构及其对水溶液中有害离子的检测
2020-03-18单贵谦王新悦王舒桐王举棋梁丽丽陈明功
汤 泉 单贵谦 王新悦 王舒桐 王举棋 陈 斌 梁丽丽 陈明功
(蚌埠医学院制药工程教研室,蚌埠 233030)
近几十年来,金属有机配位聚合物材料因其多样化的结构及在光、电、磁、手性拆分、催化和荧光传感等方面显示出重要的应用而备受研究者青睐[1-6]。其中具有良好荧光性质的配合物在重金属离子、挥发性有机小分子、硝基芳香族配合物的荧光识别与传感中表现出了很大的潜在应用价值[6-14]。但是大部分配合物不溶于水,有的甚至在水溶液中不稳定,已报道的很多检测体系仅仅局限于N,N-二甲基甲酰胺等有机溶剂的悬浊液中,这严重限制了其在实际检测中的应用[12-14]。如果能够设计合成具有一定溶解度且能够在水体系中检测的荧光材料将会有很大的实际应用价值。
重金属离子,特别是有毒的重金属离子Hg2+,含量超标会对环境造成严重的污染,一旦进入人体可能会引起急性中毒、流鼻血、头痛、神经紊乱、胃穿孔、甚至急性肾衰竭等症状[15-17],因此水溶液中低浓度重金属离子的定量检测极为重要。重铬酸根离子在工业生产中被广泛使用,含量超标会对环境产生严重危害,若通过食物链进入人体中也可能对身体产生严重危害,其氧化性能对DNA产生损伤,并损伤细胞骨架,能致癌,因此高效检测低浓度的Cr2O72-对人类健康具有重要意义[18-19]。含未配位活性基团(如羟基、氨基、巯基、咪唑氮、吡啶氮等)的配合物通常能够有效识别金属离子[20-23],为此我们设计合成了一种半刚性苯并咪唑基配体5,5′-二(2-苯并咪唑基)-2,2′-联吡啶(H2L),并成功合成出微溶于水且水溶液中稳定的2种含未配位活性基团单分子配合物。研究了水溶液中低浓度的金属离子及阴离子对配合物2荧光强度的影响,结果显示配合物2能够在水溶液中高选择性、高灵敏度检测低浓度的有害重金属离子Hg2+及氧化性阴离子Cr2O72-。
1 实验部分
1.1 试剂与仪器
Ni(NO3)2·6H2O、Zn(NO3)2·6H2O、6,6′-二羧基-2,2′-联吡啶和邻苯二胺等购自试剂公司,所用试剂均为分析纯。
配体的1H NMR使用AVANCEⅢHD-500型500 MHz超导核磁共振波谱仪测量;配合物1~3的X射线粉末衍射 (PXRD)室温下使用Bruker D8 Advance型X射线粉末衍射仪测量,收集 5°~50°范围内数据(λ=0.1.541 78 nm,40 kV,40 mA)。热重分析(TGA)使用STA 449-F5同步热分析仪氮气氛围下室温到700℃测量;C、H、N元素分析使用Perkin-Elmer 240C型元素分析仪测量;红外光谱使用Nicolet iS50 FTIR傅里叶变换红外光谱仪溴化钾压片在4 000~400 cm-1范围内测量;紫外可见吸收光谱使用Thermo Evolution 220紫外-可见分光光度计260~600 nm范围内测量;固体及液体荧光光谱使用Perkin-Elmer LS55型荧光光谱仪测量。
1.2 实验过程
1.2.1 配体H2L的合成及表征
配体 H2L 参考文献合成[24]。将 6,6′-二羧基-2,2′-联吡啶(10 mmol)和邻苯二胺(22 mmol)混合于圆底烧瓶中,加入多聚磷酸40 mL,加热至180℃反应6 h后冷却至室温。得到的产物用碳酸钠溶液、水分别洗3次,用N,N-二甲基甲酰胺和无水乙醇重结晶,得到白色粉末,产率40%。1H NMR(500 MHz,DMSO-d6):δ 9.22(d,2H),8.60(d,2H),8.42(t,2H),7.85(q,4H),7.49(q,4H)。
1.2.2 配合物[Ni(HL)(HCOO)(H2O)](1)的合成及表征
将配体 H2L(19.4 mg,0.05 mmol) 和 Ni(NO3)2·6H2O(15 mg,0.05 mmol)加入3 mL的N,N-二甲基甲酰胺/水(2∶1,V/V)溶剂中,于 30 mL 反应釜中加热到90℃反应3 d后缓慢降至室温,得到绿色棒状晶体,产率:72%。配合物1的元素分析按C25H18N6NiO3计算的理论值(%):C 58.98,H 3.56,N,16.50;实测值(%):C 58.93,H 3.60,N 16.45。主要红外光谱数据(KBr,cm-1):3 592(w),3 076(w),2 657(w),2 568(w),2 071(w),1 953(w),1 882(w),1 689(s),1 598(m),1 535(m),1 454(m),1 390(m),1 290(w),1 249(w),1 118(s),1 035(s),943(m),873(m),817(m),767(s),680(s),615(w),569(m),501(w),428(w)。
1.2.3 配合物[Zn(H2L)(H2O)2](NO3)2(2)的合成及表征
将配体H2L(19.4 mg,0.05 mmol)和 Zn(NO3)2·6H2O(15 mg,0.05 mmol),加入4mL的N,N-二甲基甲酰胺/水(2∶2,V/V)溶剂中,于 30 mL 反应釜中加热到80℃反应3 d后缓慢降至室温,得到无色块状晶体,产率:64%。配合物2的元素分析按C24H20N8O8Zn计算的理论值(%):C 46.96,H 3.28,N 18.25;实测值(%):C 46.92,H 3.31,N 18.21。主要红外光谱数据(KBr,cm-1):3 436(w),3 068(w),1 914(w),1 620(w),1 571(s),1 534(m),1 447(s),1 414(s),1 380(m),1 316(s),1 279(s),1 228(m),1 146(w),1 158(s),1 134(s),1 116(w),1 095(w),1 079(m),1 012(m),992(s),972(s),920(w),901(w),814(s),737(s),712(s),634(w),618(w),565(w),518(m),421(m)。
1.3 晶体结构的测定
选取大小适当的晶体,用Bruker Smart Apex CCD单晶衍射仪测量结构。用Mo Kα(λ=0.071 073 nm)射线作为激发波长,以φ-ω扫描方式收集衍射数据并进行吸收校正,采用SHELXS-97[25]程序直接法解出结构,用SHELXL-97程序进行最小二乘法精修。氢原子位置通过理论加氢和密度峰加氢确定。配合物的晶体数据及一些键长键角值分别列于表1和表2中。
CCDC:1877741,1;1877742,2。

表1 配合物1~2的晶体数据和结构精修参数Table 1 Crystal data and refinement parameters for complexes 1 and 2

表2 配合物1和2的主要键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)of 1 and 2
1.4 配合物2的荧光传感测试
用去离子水配置浓度为1 mol·L-1不同金属离子硝酸盐 M(NO3)n(M=Li+、Na+、K+、Ca2+、Mg2+、Al3+、Cd2+、Ag+、Cr3+、Pb2+、Mn2+、Hg2+)及不同阴离子(Cl-、Br-、I-、HCO3-、CO32-、SO42-、H2PO4-、HPO42-、PO43-、Cr2O72-)的钠盐或钾盐水溶液作为储备液。将配合物2(4 mg)研细,分散到20 mL水中超声,配置成澄清透明的水溶液,浓度约为0.3 mol·L-1。在配合物2的水溶液中(3 mL比色皿)依次加入不同量的金属离子或阴离子,充分混匀后,相同实验参数下,分别测定其荧光强度。
2 结果与讨论
2.1 配合物1~2的晶体结构
配合物1属于三斜晶系P1空间群,最小不对称单元含1个配体 (其中一个咪唑氮原子去质子化),1个镍(Ⅱ)离子,1个配位的甲酸根和1个水分子。镍(Ⅱ)离子配位构型为6配位的变形八面体,连接了来自2个配体的2个吡啶氮原子、2个咪唑氮原子、2个氧原子(来自水分子和甲酸根)。Ni-O键长为0.207 80(14)和 0.208 10(14)nm,Ni-N键长在0.206 91(16)~0.222 81(16)nm范围内。4个配位的氮原子几乎处于同一个平面内,2个氧原子分布在平面的两侧。联吡啶环之间的夹角为2.235(58)°,2个吡啶环与苯并咪唑环之间的夹角分别为2.07(6)°和7.29(5)°,呈现稍微扭曲的蝴蝶形构型(图1A)。配合物1中配位的水分子与另一个分子的N咪唑原子和O羧基原子分别形成2种类型的分子间氢键;咪唑氮原子与O羧基原子也形成分子间氢键;苯环上的碳原子与N咪唑原子和O羧基原子分别形成2种类型分子间氢键。配合物1的单分子通过O水-H…O羧基、O水-H…N咪唑、N咪唑-H…O羧基、C苯-H…N咪唑和 C苯-H…O羧基共5种类型分子间氢键(见表3)连接起来,并沿着a轴和c轴方向无限延伸,而沿着b轴方向没有无限延伸(图2A)。整个骨架由分子间氢键连接成了二维层状结构(图2B)。

图1 配合物1(A)和2(B)的配位结构图Fig.1 Coordination environments of complexes 1(A)and 2(B)

图2 配合物1通过分子间氢键(虚线)连接成2D层状结构:分别沿着a轴 (A)和b轴 (B)观察Fig.2 Two dimensional network of 1 formed through intermolecular hydrogen bonds(dotted line):viewing along a axis(A)and b axis(B)

表3 配合物1和2的氢键键长和键角Table 3 Parameters of hydrogen bonding interactions in 1 and 2
配合物2属于单斜晶系P21/c空间群,其最小不对称单元含1个配体,1个锌(Ⅱ)离子,2个配位的水分子和2个游离的硝酸根离子。锌(Ⅱ)离子配位构型为六配位的变形八面体,连接了来自2个配体的2个吡啶氮原子和2个咪唑氮原子及2个水分子的氧原子。Zn-O键长为0.211 9(3)和0.215 7(3)nm,Zn-N键长在0.214 6(4)~0.218 9(3)nm范围内。配位的4个氮原子几乎在一个平面内,2个氧原子在平面的两侧。配体的4个氮原子都与中心金属原子配位,左右结构几乎对称,使得配位后的整个分子也呈现蝴蝶形构型。联吡啶环之间的夹角为9.4(1)°,吡啶与苯并咪唑环之间的2个夹角分别为1.47(9)°和13.0(1)°,使得蝴蝶形结构扭曲,且扭曲程度比配合物1的大(图1B)。配合物2的整个骨架为阳离子型,带2个单位的正电荷,2个游离的硝酸根阴离子与之平衡电荷。配合物2的分子间也存在丰富的分子间氢键。每个分子中2个配位水分子的氧原子与硝酸根中的氧原子分别分子间氢键。每个单分子中2个咪唑氮原子也与硝酸根中的氧原子形成分子间氢键。每个分子的4个苯环上有8个碳原子也分别和硝酸根中的氧原子及咪唑氮原子形成分子间氢键。每个单分子与周围的硝酸根及单分子通过O水-H…O硝酸根、N咪唑-H…O硝酸根、C苯环-H…O硝酸根和 C苯环-H…N咪唑四种类型的分子间氢键相连。2个硝酸根中的氧原子都与周围的分子通过分子间氢键相连。整个骨架由单分子之间大量的分子间氢键连接成了3D网络结构(图3)。

图3 配合物2通过分子间氢键(虚线)连接成3D结构Fig.3 Three-dimensional network of 2 formed through intermolecular hydrogen bonds(dotted line)
2.2 热重分析与X射线粉末衍射

图4 配合物1和2的热重曲线Fig.4 TGA curves of complexes 1 and 2
热稳定性是衡量金属有机配合物性能的重要参数。在氮气氛围下测量了配合物1~2从室温到700℃的TGA曲线,结果如图4所示。对1,其热重曲线在25~140℃内没有失重。在160~270℃范围内有12.6%的急剧失重,应该归因于配位的甲酸根和水分子的失去(理论值12.4%)。在500℃又有约4%的失重,之后整个骨架缓慢坍塌。对配合物2,在100~160℃约有6.0%的失重应该归因于2个配位水分子的失去(理论值5.8%)。在330℃左右有共约20.1%的急剧失重应该归属于2个游离硝酸根离子的失去(理论值20.2%),之后伴随着整个骨架的塌陷。
配合物1和2的粉末X射线衍射如图5,测量的衍射峰的位置与其单晶结构拟合的衍射峰的位置一致,表明配合物1~2具有较高的纯度。配合物1~2不但在空气中很稳定,在有机溶剂及水溶液中也很稳定,配合物1~2都能溶解在DMF溶剂中,并能够重新析出晶体。配合物1和2虽然主体骨架相似,但是其粉末衍射峰的位置并不一致,证明了配位环境及构型的微小差异对其粉末衍射峰的位置有很大影响。
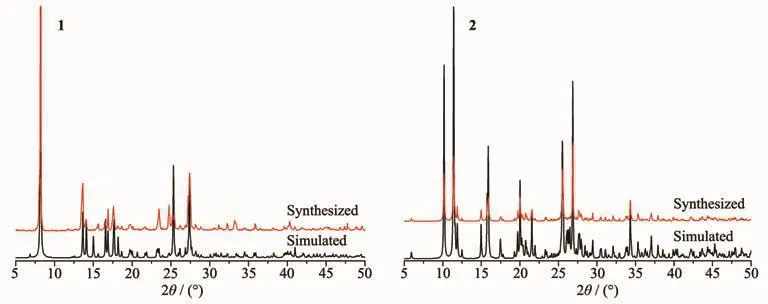
图5 配合物1和2的X射线粉末衍射图Fig.5 PXRD patterns of complexes 1 and 2
2.3 紫外可见吸收光谱
配合物1和2能够溶解在DMF和DMSO溶剂中。室温下,在260~600 nm范围内测量了配体H2L及配合物1和2在DMSO溶液中(0.5 g·L-1)的紫外吸收。如图6A所示,配体在320及335nm处有2个吸收峰,配合物1在328 nm有很强的吸收带,与配体相比吸收更强,应归属于分子内芳香环C=N键中电子n-π*的跃迁吸收。配合物2与配体相比吸收较弱,有相近的吸收波长。

图6 (A)配体H2L和配合物1~2的紫外吸收光谱;(B)配体H2L和配合物2的荧光光谱Fig.6 (A)UV-Vis absorption spectra of the free ligand H2L and complexes 1~2 in DMSO;(B)Fluorescent emission spectra of the free ligand H2L and complex 2
2.4 荧光光谱
室温下,测量了配合物2及配体H2L的固体荧光光谱。当以330 nm波长的光源激发时,配体的最大发射光谱为455nm,配合物2的最大发射波长为460 nm,如图6B。配合物2对于配体最大发射峰相比配体有5 nm的红移,强度也增加了,因此配合物2的荧光光谱可归因于配体之间的π*-π或π*-n电子转移。在配位过程中,配体的构型发生变化,共轭程度增大,导致其荧光强度增强[7]。配合物1和2在水溶液有良好的稳定性,室温下,测量了配合物2水溶液中的荧光光谱。测试结果显示,在相同激发波长条件下(λex=330 nm),配合物2的水溶液仍有很高的荧光强度,最大发射波长为460 nm,与固体的最大发射波长基本上一样。
2.5 水溶液中金属离子及阴离子的荧光传感
基于配合物2在水中的良好稳定性及很高的荧光强度,考虑用来检测水溶液中的金属离子及无机离子。相同实验参数条件下,研究了在配合物2的水溶液中加入不同金属的硝酸盐 (浓度约为1 mmol·L-1)后荧光光谱的变化情况。实验结果表明,金属离子 Li+、Na+、K+、Ca2+、Mg2+、Al3+、Cd2+、Ag+对配合物2的荧光强度影响不大,金属离子Cr3+、Pb2+、Mn2+对配合物2的荧光强度有一定猝灭作用 (加入Mn2+后荧光强度为加入前的45%),而Hg2+离子却能使配合物2的荧光几乎完全淬灭 (加入Hg2+后荧光强度为加入前的2%),表现出很好的选择性(图7)。相同实验条件下,研究了不同阴离子对配合物2水溶液的荧光强度影响情况。实验结果表明,SO42-、HCO3-、CO32-、Cl-、Br-、I-、H2PO4-、HPO42-、PO43-等大部分阴离子对配合物2的荧光强度影响不大,只有氧化性离子Cr2O72-几乎完全猝灭了配合物2的荧光(加入Cr2O72-后荧光强度为加入前的1.5%)(图8)。
为了进一步探究重金属离子Hg2+及阴离子Cr2O72-对配合物2的荧光响应情况,在配合物2的水溶液中加入不同浓度的上述2种离子后再次检测荧光强度。实验结果发现,配合物2的荧光强度随着Hg2+及Cr2O72-浓度的增加都有规律地降低(图9)。为了进一步研究Hg2+及Cr2O72-的浓度与配合物2荧光强度的定量关系,采用Stern-Volmer方程I0/I-1=Ksvc来考察2种离子对配合物2荧光的猝灭程度,其中I0为配合物2在水中的荧光强度,I为加入检测离子之后的荧光强度,c为加入检测离子的浓度(mol·L-1),Ksv为根据公式所得线性关系中的斜率[17]。结果显示,在低浓度下,配合物2的荧光强度对Hg2+和 Cr2O72-的离子浓度表现出了良好的线性响应关系(图10)。由线性拟合结果计算出,配合物2对 Hg2+和 Cr2O72-的 Ksv分别为5.38×104和 4.208×104L·mol-1,R2值分别为0.998 3 和 0.994 55。Ksv越大代表离子浓度对荧光强度影响越大,检测灵敏度越高。配合物2对Hg2+和Cr2O72-的检测达到了比较高的灵敏度[16-17,26-27]。配合物2在水溶液中对重金属离子Hg2+和无机离子Cr2O72-高灵敏的荧光响应行为,应该归因于配合物2中能与金属离子发生相互作用的未配位咪唑氮活性基团以及配合物与Hg2+及Cr2O72-离子之间的电子转移过程的存在[11,28]。配合物2的低浓度水溶液对Hg2+及Cr2O72-离子高选择性、高灵敏度的荧光检测体系可能具有一定的实际应用价值。
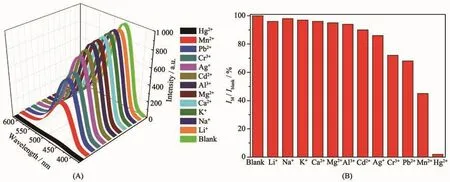
图7 (A)配合物2在含不同金属离子水溶液中的荧光光谱;(B)不同金属离子存在时的相对荧光强度柱状图Fig.7 (A)Fluorescence spectra of 2 in different metal ions solutions;(B)Relative fluorescence intensities(460 nm)of 2 in aqueous solutions of different metal ions

图8 (A)配合物2在含不同阴离子水溶液中的荧光光谱;(B)不同阴离子存在时的相对荧光强度柱状图Fig.8 (A)Fluorescence spectra of 2 in aqueous solutions of different anions;(B)Relative fluorescence intensities(460 nm)of 2 in aqueous solutions of different anions

图9 配合物2的水溶液在加入不同量Hg2+(A)和Cr2O72-(B)后的荧光强度Fig.9 Fluorescence spectra of 2 upon the incremental addition of Hg2+(A)and Cr2O72-(B)solution

图10 配合物2对Hg2+(A)和Cr2O72-(B)水溶液的Stern-Volmer线性关系Fig.10 Stern-Volmer linear fitting of 2 with different concentrations of Hg2+(A)and Cr2O72-(B)in water
3 结 论
利用半刚性的配体 5,5′-2(2-苯并咪唑基)-2,2′-联吡啶(H2L)与金属离子反应,生成了单分子配合物[Ni(HL)(HCOO)(H2O)](1)和[Zn(H2L)(H2O)2](NO3)2(2)。2个配合物具有相似的主体骨架,但金属中心又有着不同的配位小分子,配体的构型也不完全相同。配合物1和2的单体通过分子间氢键连接在一起,分别形成了二维层状结构和三维超分子结构。配合物1和2在水溶液中稳定,能够微溶于水。荧光测试表明配合物2在水溶液中具有很强的荧光性质,且能够在水溶液中高选择性、高灵敏度检测低浓度的有害离子Hg2+和Cr2O72-。
