纳米MoS2的制备及其催化降解有机废水的研究
2020-03-17艾桃桃罗清威李文虎邹祥宇
焦 菲,艾桃桃,2,罗清威,2,李文虎,2,邹祥宇,2
(1.陕西理工大学 材料科学与工程学院,陕西 汉中,723000;2.陕西理工大学 矿渣综合利用环保技术国家地方联合工程实验室,陕西 汉中,723000)
0 引 言
光催化技术在解决能源与环境问题方面表现出了广阔的应用前景和巨大的经济效益,已被美国环保局列入最具有产业化前景的环保高新技术行列,半导体光催化材料也随之得到了快速发展和应用。近些年,利用半导体纳米材料光催化降解有机污染物的技术更加得到重视。该技术与传统的污水处理技术相比,能够对多种污染物进行去除,不存在二次污染,而且在常规条件下即可实现,具有能耗低、反应快、操作简单、处理效率高等优点[1]。近些年,人们研究出多种可降解有机污染物的半导体光催化剂,其中研究最为深入、应用最为广泛的就是纳米ZnO和TiO2,这两种材料的能带间隙分别为3.37和3.2 eV,只能响应紫外光,对可见光的利用率非常低,极大地影响了对太阳光能量的有效利用。随着生活实践的需求以及学科技术的突飞猛进,人们对材料的性能提出了更高的要求。新型光催化材料更看重的是能量的转化效率以及对光的选择范围。纳米二硫化钼(MoS2)作为一种新型的可见光光催化剂,因其独特的电子能带结构、高的反应活性和大的比表面积等优点,较ZnO和TiO2优势明显,迅速成为了催化领域的研究热点[2-3]。理论和实验已经证实,纳米尺度的MoS2由于样品尺度的减小而产生量子限域效应,其禁带宽度可以在1.2~1.8 eV范围内进行调节,1.2和1.8 eV能量的光子对应的光谱截止波长分别为1 050 nm和688 nm,因此可以有效地吸收可见光[4]。
纳米MoS2的常用制备方法有很多种,包括化学气相沉积法[5]、微机械剥离法[6]、水热溶剂法[7-8]、磁控溅射法[9]、液相超声法[10-11]等。在众多制备方法中,因水热溶剂法操作简单、能耗小、效率高、产品结晶度高,制备过程对环境污染较小等优点,是目前制备纳米MoS2最常用的方法之一。作者前期采用水热法制备了纳米MoS2,探讨了制备工艺对MoS2物相及形貌的影响,并采用RhB作为有机污染物,简单分析了MoS2的光催化效果[12]。前期研究中污染物比较单一,与实际生产过程排放的工业废水区别较大。鉴于此,本文以RhB-MO、MB-MO二元混合物为探针分子,探讨污染物初始浓度和溶液的初始pH对MoS2粉末催化效果的影响,这样更接近工业有机废水的实际情况,更加真实反映实验所制备的MoS2纳米粉体的光催化性能。
1 实验方法
1.1 实验原料
实验用主要原料有二水钼酸钠(Na2MoO4·2H2O)、硫脲(CS(NH2)2)、盐酸(HCl)、氢氧化钠(NaOH)、无水乙醇、十六烷基三甲基溴化铵(CTAB)、罗丹明B(RhB)、甲基橙(MO)、亚甲基蓝(MB),上述试剂均为分析纯,未经二次纯化处理。
1.2 纳米MoS2的制备
称取适量的钼酸钠和硫脲,分别装入烧杯,并加入去离子水磁力搅拌使之充分溶解,然后将两种溶液混合并采用磁力搅拌使之均匀,并用HCl调节溶液的pH;将混合液装入带有聚四氟乙烯内衬的不锈钢反应釜中,放入烘箱中,调控温度为220 ℃反应24 h;反应结束后自然冷却至室温,分别用无水乙醇和去离子水清洗数次,通过离心机分离收集产物,最后将产物放置在真空箱内,最终得到黑色粉末,封装备用。
1.3 样品表征
利用X射线衍射仪(XRD)对样品进行物相分析,以Cu-Kα为辐射源,工作电压为40 kV,电流为40 mA,扫描速度为5°/min。利用扫描电镜(SEM,JSM-7610FPlus)表征样品形貌。利用全自动比表面积及孔隙度吸附分析仪(Quadrasorb SI,美国康塔仪器公司)测试样品的比表面积。利用紫外可见分光光度计(UV-5600PC)测试有机废水的吸光度,以此了解催化实验前后溶液中有机污染物的浓度变化,扫描范围为200 nm~800 nm。
1.4 催化反应
以RhB、MB、MO所组成的二元混合物来模拟污染物(RhB和MB为阳离子染料,MO为阴离子染料),利用光化学反应仪进行光催化实验。光催化实验具体过程如下:配置50 mL不同浓度的有机污染物于烧杯中,加入一定量的MoS2粉末,在暗室下磁力搅拌20 min,以建立吸附-脱附平衡。接通电源后开始光催化实验。光源采用250 W的氙灯,溶液距离光源约25 cm,为防止光源热量影响降解速率,反应过程中持续磁力搅拌。以18 min为步长,光照时间为90 min,间隔取样,取样的时候取上层液,将上层液进行离心,把离心后的上层澄清液装入试管中避光保存待测。用紫外可见分光光度计于最大吸收峰处的吸光度来表征MoS2对污染物的催化降解率。降解率计算公式为:
η=(C1-Ct)/C1×100%=(A1-At)/A1×100%
(1)
式中,C1为溶液中有机物的初始浓度,Ct反应t时间后溶液中剩余有机物的浓度,A1和At分别为溶液中有机物浓度为C1和Ct时的吸光度值。
2 结果与讨论
2.1 纳米MoS2结构及形貌表征
图1为220 ℃下反应24 h所合成的MoS2粉末XRD图。从图1中可以看出样品在2θ为14.37、32.67、39.53和58.33°处出现了衍射峰,与2H型MoS2(空间点群为P63/mmc(194))的标准卡片(JCPDS37-1492)基本一致,分别对应其(002)、(100)、(103)、(110)晶面,其中(002)晶面对应的峰强最为显著且尖锐,说明样品的结晶度较好。图中只有MoS2衍射峰,无其它杂峰出现,分析认为所制备的样品纯度较高,为纯相的六方晶系MoS2。

图1 MoS2粉末的XRD图
图2是MoS2的SEM照片。从图2可以看出制备的纳米MoS2颗粒大小比较均匀,而且分散性也较好。从图2可以清晰看出花瓣球形状纳米MoS2的表面是由MoS2纳米片组成,且纳米片自动弯曲卷缩成花球状。这些褶皱弯曲的片层结构提供了更大的比表面积,对于材料的催化性能有着重要影响[13-15]。

图2 MoS2粉末的SEM图像
在77K的条件下,采用N2吸附的方法,在全自动比表面积及孔隙度吸附分析仪上对MoS2纳米颗粒的比表面积进行了测试。测试前,将样品在200 ℃干燥的N2气流中处理3 h。根据Brunauer-Emmett-Teller(BET)气体等温吸附公式的拟合结果,计算BET表面积为89.72 m2/g,表明该催化剂有较大的比表面积,有利于提高催化活性。
2.2 多因素对MoS2光催化降解有机污染物的影响
2.2.1 污染物初始浓度对催化效果的影响
图3反映了混合污染物初始浓度对降解率的影响。混合污染物(RhB-MO、MB-MO)体积比为1∶1,催化剂MoS2投放量为0.05 g,溶液初始浓度分别为10、20、30、40 mg/L。从图3(a)、(b)和表1可以看出,两种混合液的降解率分别在初始浓度10 mg/L和20 mg/L时达到最高;在RhB-MO混合液中,当溶液的初始浓度为10 mg/L时,RhB和MO的降解率分别为71.30%和84.68%;在MB-MO混合液中,当溶液的初始浓度为20 mg/L时,MB和MO的降解率分别为80.79%和76.80%。一般而言,在其他条件不变的情况下,溶液的初始浓度越低降解速度越快,降解率也越高;初始浓度越高需要的降解时间越长,降解率降低。这是因为当溶液的初始浓度不断增加时,催化剂表面的活性位点逐渐被有机分子占满,其余的有机分子逐渐吸附在催化剂表面将其包裹住,从而影响催化效率,使得降解率下降。另外,高浓度对光的屏蔽作用大,使得光难以进入溶液内部,减少了催化剂与光的接触,降低了光的利用率;浓度过低尽管降解率较高但无法充分发挥催化剂的催化性能。因此,在实际应用中,应该从经济的角度出发,选取适合的初始浓度。

图3 (a) RhB-MO在不同初始浓度下的降解率;(b) MB-MO在不同初始浓度下的降解率
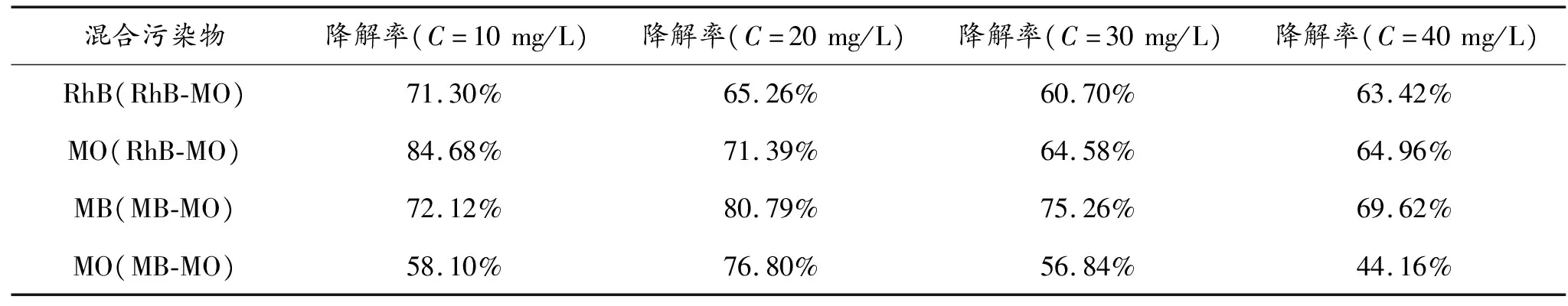
表1 MoS2对不同浓度RhB-MO和MB-MO混合污染物的降解率
2.2.2 不同pH值对催化效果的影响
为了研究溶液不同pH值对催化效果的影响,选定MoS2的投放量为0.05 g,混合污染物(RhB-MO、MB-MO)体积比为1∶1,最佳初始浓度均为20 mg/L,用盐酸和氢氧化钠调节溶液的pH为3、5、7、9,从图4(a)、(b)和表2可以看出,在酸性和中性环境下,混合溶液中的有机物降解率较高;在碱性条件下,混合溶液中的有机物污染物降解率较低。在RhB-MO混合液中,当溶液的pH=7时,RhB和MO的降解率达到最高,分别为71.30%和84.68%;在MB-MO混合液中,当溶液的pH=5和7时,MB和MO的降解率达到最高,分别为84.13%和76.80%。 这是因为MO在酸性和碱性条件下分别呈现出醌式结构和偶氮式结构,在酸性条件下有利于醌式结构的产生,而醌式结构比偶氮式结构更易被还原[16];MB在酸性条件下的酮式结构比中性碱性条件下的偶氮结构易降解[17]。酸性条件下更有利于RhB的降解,分析认为改变溶液的pH使MoS2界面电荷性质及颗粒表面的电荷分布发生变化,从而影响RhB的降解率[18-19]。

图4 (a) RhB-MO在不同pH值下的降解率;(b) MB-MO在不同pH值下的降解率

表2 MoS2对不同pH值RhB-MO和MB-MO混合污染物的降解率
2.3 光催化机理分析
光催化是一个及其复杂的物理化学过程,包括表面吸附、光生电子空穴对的产生、分离、复合以及表面捕获等过程。当MoS2吸收足够的光子能量之后,电子从价带激发到导带上,在导带上产生带负电的高活性电子(e-),在价带上留下带正电的空穴(h+),在库伦作用下形成电子-空穴对,同时为克服彼此的静电引力而互相分离,在分离的过程中通过扩散迁移到表面捕获位置。此时,被半导体颗粒表面的氧分子、水分子以及OH-诱捕产生H2O2和羟基自由基(·OH),与污染物发生氧化还原反应,最终将污染物降解为CO2、H2O、无害盐类及无机酸等小分子。在整个反应中,·OH自由基对反应物选择性几乎为零,被认为是光催化反应中起决定性作用的物种。
MoS2+hv→MoS2(e-+ h+)
(2)
h++H2O→H++·OH
(3)
O2+e-→·O2-
(4)
O2-·+H+→HO2·
(5)
2HO2·→O2+ H2O2
(6)
H2O2+·O2-→·OH+OH-+O2
(7)
H2O2+·OH→H2O+HO2·
(8)
·OH +dye→CO2+ H2O
(9)
3 结 论
(1)采用水热法于220 ℃反应24 h合成了花状微球结构纳米MoS2粉末,粉末表面由许多纳米片组成,纳米片自动弯曲卷缩成花球状。
(2)以RhB、MB、MO二元混合物配制模拟有机废水,通过纳米MoS2粉末的光催化实验发现:纳米MoS2粉末在较低初始浓度(10 mg/L)和弱酸环境(pH=5~7)下表现出较高的催化效率。在RhB-MO混合液中,当溶液的初始浓度为10 mg/L、pH=7时 ,RhB和MO的降解率达到最高,分别为71.30%和84.68%;在MB-MO混合液中,当溶液的初始浓度为20 mg/L时,MB和MO的降解率在pH=5~7时达到最高,分别为84.13%和76.80%。
